第七章 福州大学 有机化学
- 格式:ppt
- 大小:1.83 MB
- 文档页数:35

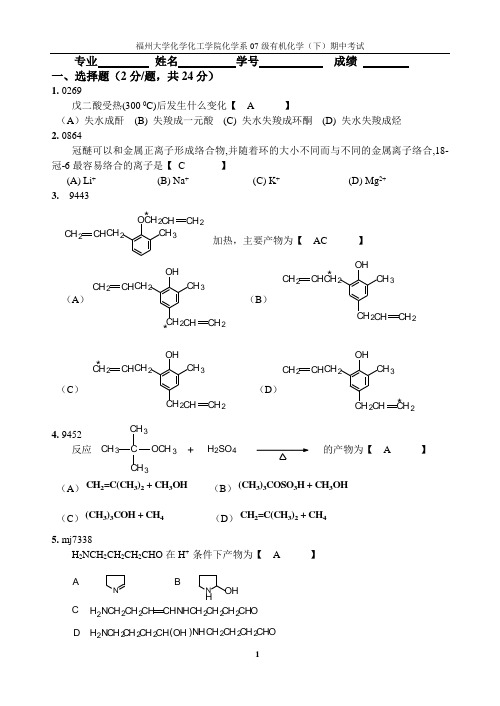
专业 姓名 学号 成绩 一、选择题(2分/题,共24分)1. 0269戊二酸受热(300 0C)后发生什么变化【 A 】(A )失水成酐 (B) 失羧成一元酸 (C) 失水失羧成环酮 (D) 失水失羧成烃 2. 0864冠醚可以和金属正离子形成络合物,并随着环的大小不同而与不同的金属离子络合,18-冠-6最容易络合的离子是【 C 】 (A) Li + (B) Na + (C) K + (D) Mg 2+ 3. 9443加热,主要产物为【 AC 】(A ) (B )(C ) (D )4. 9452反应的产物为【 A 】 (A )CH 2=C(CH 3)2 + CH 3OH (B )(CH 3)3COSO 3H + CH 3OH (C )(CH 3)3COH + CH 4 (D )CH 2=C(CH 3)2 + CH 4 5. mj7338 H 2NCH 2CH 2CH 2CHO 在H + 条件下产物为【 A 】NN HOHA BCH 2NCH 2CH 2CH CHNH CH 2CH 2CH 2CHOD H 2N CH 2CH 2CH NHCH 2CH 2CH 2()OH CHO CH 2CH 2CH CH 2CH 3CH 2CH CH 2O *CH 2CH CH 2CH 3OHCH 2CH CH 2*CH 2CH CH 2CH 3OH CH 2CH CH 2*CH 2CH CH 2CH 3OH CH2CH 2*CH 2CH CH 2CH 3OHCH 2CH CH 2*H 2SO 4C CH 3CH3CH 3OCH 3+6. mj7361在浓硫酸处理时发生Beckmann 重排,产物为【 A 】(A )HN CH 3OC 6H 5 (B )CH 3NHC 6H 5O(C )CH 36H 5CO 2H (D )CH 3CHNH 2C 6H 57. 4109下列四个试剂,不跟CH 3CH 2COCH 2CH 3反应的是【 B 】 (A) RMgX (B) NaHSO 3饱和水溶液 (C) (C 6H 5NH 2NH 2 (D) LiAlH 4 8. 9526在碱存在下, 与1mol 溴反应时,卤化发生的位置【 B 】(A )羰基碳上 (B )亚甲基上 (C )甲基上 (D )羰基氧上 9. kxb8下列化合物水解速度最快的是【 A 】(A)(B)(C)(D)CH 3COCl H 3CCOCl H 3CCH 2COClCH 2COCl10. Lxb4最容易发生外消旋化的化合物是【 D 】(A ). (B ).(C ). (D ).11.0262HCOOH(I),CH 3COOH(II),(CH 3)2CHCOOH(III),(CH 3)3CCOOH(IV)的酸性大小【 B 】(A) IV>III>II>I (B) I>II>III>IV (C) II>III>IV>I (D) I>IV>III>II 12. jL7660通过Michael 加成反应可以合成如下哪类化合物【 A 】(A) 1,5- 二羰基化合物 (B) 1,3- 二羰基化合物 (C) 1,6- 二羰基化合物 (D) 1,4- 二羰基化合物CH 3CN C 6H 5OHCH 2C OCH 3Cl CO 2CH 3CO 2CH 3Br HO二、命名:(2分/题,共4分)1. 2.3-羟基-4,5-二甲氧基苯甲醛 N -乙基对甲苯基乙酰胺三、完成下列反应:(2分/题,共32分)1.fi5569CH 3OCH 3 + C 2H 5OH2. 5555O3. 5571PhCOCH 3 + CH 3OH4. jt3b 115. fj55886. Lt3b1CH 32COOHO42( )CH 32COOHOH?H 2,Pd/CCH 2OEtCH 3O?-OH,H 2OPhC OCH 3CH 2H 3O +?(2)Zn Hg/ HCl ŨCHOOCH 33HO CH 3H 2C ONHC 2H 5OCH 3 1. (CH 3)2CuLi/Et 2O2. H 3O ?O CH 3CH 37. 5591 PhCH=CHCHO8. 5599CHO9. 5623OO 10. 6159CHOCH 2OH11. kt3b14?HOCH 2(CH 2)4CH 2BrHOCH 2(CH 2)4CH 2COOH △(1)NaCN (2)H 3O +12. 5682OO13. 5688PhCH 2COOPh 14. 5723CH 3COO - + PhCOCH 315. 5793CH 2N(CH 3)216. kL5737+PhCHO CH 3CHO OH -?OHC(CH)4CHO?_CHO CH 2CHO+HCN( mol)?1PhCOOHO ?PhOH?PhCH C OCH 3CH 2O Ph?OH -, H 2O((21) H 2O) L iAlH 4,Et 2O ?CON(CH 3)2-COOEt四、机理题(5分/题,共10分) 写出下述反应合理的、分步的反应机理。


高校有机化学排名排名学校名称等级排名学校名称等级排名学校名称等级
1 兰州大学A+ 8 吉林大学 A 15 徐州师范大学 A
2 南开大学A+ 9 山东大学 A 16 华中师范大学 A
3 北京大学A+ 10 南京大学 A 17 天津大学 A
4 浙江大学A+ 11 中山大学 A 18 郑州大学 A
5 四川大学A+ 12 复旦大学 A 19 苏州大学 A
6 中国科学技术大学 A 13 武汉大学 A 20 湖南师范大学 A
7 清华大学 A 14 厦门大学 A 21 云南大学 A
B+ 等(32 个) :华东理工大学、安徽师范大学、聊城大学、北京师范大学、华东师范大学、湖南大学、西北大学、同济大学、福州大学、湘潭大学、延边大学、东北师范大学、北京化工大学、河北大学、西北师范大学、华中科技大学、河北师范大学、东华大学、大连理工大学、中国农业大学、上海交通大学、南昌大学、西南大学、浙江工业大学、黑龙江大学、江西师范大学、陕西师范大学、江苏工业学院、广西大学、贵州大学、广西师范大学、辽宁师范大学
B 等(31 个) :新疆大学、浙江师范大学、河南大学、华南师范大学、首都师范大学、上海大学、辽宁大学、河南师范大学、温州大学、南京理工大学、杭州师范大学、山东师范大学、烟台大学、上海师范大学、山西大学、扬州大学、大连大学、长
春工业大学、青岛科技大学、西华师范大学、中南大学、南京工业大学、陕西科技大学、广州大学、湖南科技大学、内蒙古民族大学、曲阜师范大学、沈阳药科大学、内蒙古大学、云南师范大学、福建师范大学。

第七章 醛酮醌思考与练习7-1 写出分子式为C 5H 10O 的醛、酮的所有异构体。
7-2 命名下列化合物。
⑴ 2,4-二甲基己醛 ⑵ 5-甲基-4-己烯-3-酮 ⑶ 1-环己基-2-丙酮 ⑷ 4-苯基-2-戊烯醛 ⑸ 3-氯-2,5-己二酮 ⑹β-萘甲醛 7-3 写出下列化合物的构造式。
⑴ ⑵ ⑶⑷ ⑸ ⑹7-4 试用合适的原料合成下列化合物。
可用相应醇氧化或用付—克酰基化反应制得。
7-5 将下列化合物的沸点按由高到低的顺序排列,并说明理由。
丙醇>丙酮>甲乙醚>丙烷 主要考虑:有无氢键形成和分子极性的大小。
7-6 乙醛能与水混溶,而正戊醛则微溶于水,为什么?低级醛和酮在水中有相当大的溶解度,这是因为醛和酮分子中羰基上的氧原子可以与水分子中的氢原子形成氢键。
但随着分子中碳原子数的增加,羰基在分子中所占的比例减小,形成氢键难度加大,醛和酮在水中溶解度也逐渐减小。
7-7 羰基化合物和哪些试剂容易发生加成反应?遵循什么规律?羰基化合物与HCN 、NaHSO 3、ROH 、RMgX 、H 2N-Y 等试剂易发生加成反应。
遵循亲核加成反应规律,即羰基中的碳原子形成反应的正电中心,受到亲核试剂的进攻。
7-8在与氢氰酸加成反应中,丙酮和乙醛哪一个反应比较快?为什么?乙醛快;比较醛和酮羰基加成反应的难易,通常考虑两个方面:①由于烷基的给电性,羰基上连接的烷基越多,给电性越强,羰基碳原子正电性越小,越不利于亲核试剂的进攻,使得加成反应速度减慢。
②羰基上连接的烃基越大,则位阻效应越大,亲核试剂就越不容易接近,反应也不易进行。
所以在许多亲核加成反应中,酮一般不如醛活泼。
7-9 醛和酮与格氏试剂加成反应主要适用于哪些物质的合成?醛和酮与格氏试剂(RMgX )加成,可生成比原来醛或酮增加了碳原子的伯、仲、叔醇。
7-10 下列化合物哪些能和HCN 发生加成反应?并写出其反应产物。
⑴、⑵、⑶、⑸; ⑴CH 3CH 2CH 2CH 2CHOCH 3CH 2CHCHOCH 3CH 3CHCH 2CHOCH 3CH 3C CH 3CH 3CHOCH 3C O CH 2CH 2CH 3CH 3C O CHCH 3CH 3CH 3CHCH 2CHO 3CH CHCHOOC 2H 5CH 3CH 3CH 3CH CHCHBr C OCH 3CHO OHCH 2C O OHCH 2CHCH 2CHO CH 2CHCH 2CHCN CH 3CH 2CCH 2CH 3O⑵ ⑶⑸7-11 丙酮中混有少量丙醛,如何提纯丙酮。

福州大学化学考研真题福州大学化学考研真题福州大学是福建省内知名的综合性大学之一,其化学专业一直以来备受考生的关注。
对于有志于攻读化学研究生的考生来说,了解福州大学化学考研真题是非常重要的。
本文将从历年的真题中选取几道典型题目,以供考生参考和学习。
一、有机化学题目1. 下列反应中,哪一个是酯水解反应?A. 酯+醇→酯醇B. 酯+酸→酯酸C. 酯+碱→酯碱D. 酯+醛→酯醛这道题目考察的是对酯水解反应的理解。
正确答案是B,酯与酸反应生成酯酸。
2. 以下哪一个化合物是具有手性的?A. 甲基乙酮B. 丙烯酸C. 乙醇D. 丙酮这道题目考察的是对手性的判断。
正确答案是C,乙醇是手性分子,因为它含有一个手性碳原子。
二、物理化学题目1. 下列哪一个物理量可以用来描述溶液的浓度?A. 质量分数B. 摩尔浓度C. 溶解度D. 电导率这道题目考察的是对溶液浓度的理解。
正确答案是B,摩尔浓度是描述溶液中溶质的摩尔数量与溶液体积之比。
2. 在常温下,以下哪一个物质是固体?A. 氨气B. 水蒸气C. 氧气D. 二氧化碳这道题目考察的是对物质状态的判断。
正确答案是D,二氧化碳在常温下是固体。
三、无机化学题目1. 以下哪一个元素在自然界中属于稀有气体?A. 氮B. 氧C. 氖D. 氢这道题目考察的是对稀有气体的理解。
正确答案是C,氖是自然界中的稀有气体之一。
2. 以下哪一个化合物是无机酸?A. HClB. CH3COOHC. H2SO4D. H2O这道题目考察的是对无机酸的判断。
正确答案是C,H2SO4是无机酸,其他选项是有机酸或无机物。
以上只是选取了几道典型的福州大学化学考研真题进行了解析,实际考试中还有更多不同类型的题目。
考生在备考过程中,应该注重对基础知识的掌握和理解,同时也要进行大量的练习和模拟考试,以提高解题能力和应试水平。
总之,福州大学化学考研真题是考生备考的重要参考资料,通过对真题的研究和分析,考生可以更好地了解考试的难度和出题方向,从而有针对性地进行备考。
福大化学考研题库答案解析福大化学考研题库答案解析近年来,考研已经成为许多大学毕业生进一步深造的首选。
而对于化学专业的考研生来说,福大化学考研题库无疑是备考的重要资料之一。
本文将对福大化学考研题库中的一些典型题目进行解析,帮助考生更好地理解和掌握相关知识。
一、有机化学题目解析题目:下列化合物中,哪个不是脂肪酸?A. 乙酸B. 丙酸C. 戊酸D. 辛酸解析:脂肪酸是指由长链碳氢化合物骨架和一个羧基组成的有机化合物。
乙酸、丙酸、戊酸都是脂肪酸,而辛酸则是一种脂肪酸的同分异构体。
因此,选项D是正确答案。
二、物理化学题目解析题目:在下列物质中,哪个具有最高的沸点?A. 乙醇B. 甲醇C. 乙醚D. 甲醚解析:沸点是指物质在标准大气压下从液态转变为气态的温度。
乙醇和甲醇都是醇类物质,由于分子量较大,分子间的相互作用力较强,因此具有较高的沸点。
而乙醚和甲醚则是醚类物质,由于分子间的相互作用力较弱,因此具有较低的沸点。
因此,选项A是正确答案。
三、无机化学题目解析题目:下列元素中,哪个元素的电子亲和能最大?A. 氧B. 氮C. 硫D. 硒解析:电子亲和能是指一个原子从气态变为负离子时释放出的能量。
根据元素周期表的位置,氧的电子亲和能最大,氮次之,硫再次之,硒最小。
因此,选项A是正确答案。
四、分析化学题目解析题目:下列哪个方法不能用于测定溶液中的铁离子含量?A. 毛细管电泳B. 原子吸收光谱法C. 滴定法D. 离子色谱法解析:毛细管电泳、原子吸收光谱法、滴定法和离子色谱法都是常用的测定溶液中铁离子含量的方法。
但其中,毛细管电泳主要用于分离和测定离子和分子,而不适用于测定金属离子含量。
因此,选项A是正确答案。
五、有机合成题目解析题目:下列反应中,哪个是醛的氧化反应?A. 乙醛与氧气反应生成乙酸B. 乙醇与氧气反应生成乙醛C. 乙酸与氧气反应生成乙酸酐D. 乙醇与氯化氢反应生成乙醚解析:醛的氧化反应是指醛与氧气反应生成相应的酸。
《有机化学》章节目录绪论1.有机化合物的定义2有机化合物的特性2.1有机化合物组成单元的特点-----有机化合物种类繁多2.2 有机化合物结构上的特点-----同分异构现象2.3 有机化合物性质上的特点-----易燃难溶反应慢3 有机化合物中的共价键4 有机化合物的结构4.1分子的结构4.2 分子间作用力5有机化合物的分类5.1 碳架分类5.1.1开链化合物5.1.2碳环化合物5.2官能团分类6 有机化学中的酸碱概念6.1酸碱的电离理论6.2酸碱质子理论6.3酸碱电子理论7 现代有机合成手段7.1有机热反应7.2有机光反应7.3有机电合成7.4有机声化学7.5有机微波化学反应8现代光谱技术8.1 红外光谱8.2 紫外光谱8.3 核磁共振谱8.4 质谱阅读材料-文献与有机化学学习参考第一章烷烃和环烷烃1.1烷烃和环烷烃的通式和构造异构1.1.1 烷烃和环烷烃的通式1.1.2 烷烃和环烷烃的构造异构1.1.3 分子式、构造式和构造简式1.2烷烃和环烷烃的命名1.2.1伯、仲、叔、季碳原子与伯、仲、叔氢原子1.2.2 烷基的概念1.2.3 烷烃的命名1.2.4 环烷烃的命名1.3 烷烃和环烷烃的结构1.3.1 烷烃的结构1.3.2 环烷烃的结构与环的稳定性1. 4 烷烃和环烷烃的构象1.4.1 乙烷的构象1.4.2 丁烷的构象1.4.3 环己烷的构象1.4.4 取代环己烷的构象1.5烷烃和环烷烃的物理性质1.5.1 沸点1.5.2 熔点1.5.3相对密度1.5.4溶解度1.5.5折射率1.6烷烃和环烷经的化学性质1.6.1自由基取代反应1.6.2氧化反应1.6.3异构化反应1.6.4裂化反应1.6.5小环环烷烃的加成反应1.7 烷烃和环烷烃的主要来源和制法1.7.1烷烃和环烷烃的来源——石油和天然气1.7.2烷烃和环烷烃的制法第二章烯烃和二烯烃2.1 烯烃的分类异构和命名2.1.1 烯烃的分类2.1.2 烯烃的结构2.1.3 烯烃的命名(2.2 烯烃的物理性质2.3烯烃的来源和制法2.3.1烯烃的来源2.3.2 烯烃的制法2.4 烯烃的反应2.4.1烯烃的催化加氢2.4.2 烯烃的亲电加成2.4.3 烯烃的自由基加成反应2.4.4烯烃的氧化反应2.4.5 烯烃的硼氢化反应2.4.6 烯烃α-氢取代反应2.4.7烯烃的聚合反应2.5 共轭二烯烃2.5.1共轭二烯烃的结构2.5.2共轭二烯烃的共轭现象2.5.3共轭二烯烃的反应2.5.4共轭体系与共轭二烯烃加成反应历程2.6 异戊二烯和橡胶阅读材料:烯烃的复分解反应第三章炔烃3.1 炔烃的结构3.2 炔烃的异构和命名3.3 炔烃的物理性质3.4 炔烃的化学性质3.4.1 叁键碳上氢原子的活泼性(弱酸性) 3.4.2 加成反应3.4.3 氧化反应3.4.4 聚合反应3.5 重要的炔烃-乙炔阅读材料:导电聚合物——聚乙炔第四章芳烃及非苯芳烃4.1 苯的结构4.1.1 苯的凯库勒式4.1.2苯分子结构的近代概念4.1.3苯的结构的表示方法4.2苯的异构现象和命名4.2.1 苯的异构现象4.2.2 命名4.3 芳烃的来源和制法4.4芳烃的物理性质4.5芳烃的化学性质4.5.1 亲电取代反应4.5.2 苯的加成和氧化反应4.5.3芳烃侧链反应4.6 苯环上亲电取代反应的规律4.6.1 定位效应4.6.2定位规律的理论解释4.6.3苯的二元取代产物的定位规律4.6.4 定位规律在合成中的应用4.7 多环芳烃4.8非苯芳烃4.9 重要的化合物阅读材料:苯的发现和苯分子结构学说第五章立体化学5.1 手性和对映体5.2 分子的对称因素5.3 旋光性和比旋光度5.3.1 旋光性5.3.2 旋光仪与比旋光度5.4 含一个手性碳原子的化合物5.4.1 手性碳原子5.4.2 外消旋体5.5 构型的表示方法、构型的确定和构型的标记5.5.1 构型的表示方法5.5.2 构型的标记5.6 含有多个手性碳原子化合物的立体异构5.7 含假不对称碳原子的分子5.8 外消旋体的拆分5.9 不对称合成(手性合成)5.10含手性碳原子的化合物的对映异构阅读材料:诺贝尔化学奖与手性化合物第六章卤代烃6.1 卤代烃的分类、命名6.2 卤代烃的制法6.3卤代烃的物理性质6.4 卤代烃的化学性质6.4.1亲核取代反应6.4.2消除反应6.4.3与金属作用6.4.4 还原反应6.5 卤代烃的亲核取代反应机理6.5.1双分子亲核取代反应机理6.5.2 单分子亲核取代反应机理6.5.3影响亲核取代反应的因素6.6卤代烃的消除反应机理6.7 卤代烯烃和卤代芳烃6.8重要的卤代烃阅读材料:饮水中卤代烃第七章醇和醚7.1 醇的结构、分类和命名7.1.1醇的结构7.1.2醇的分类和命名7.2 醇的来源与制备7.2.1醇的工业来源与制备7.3醇的物理性质7.4醇的化学性质7.4.1 羟基中氢的反应7.4.2 醇的氧化与脱氢反应7.4.3醇羟基的亲核取代反应7.4.4 醇的脱水反应7.4.5成酯反应7.4.6多元醇的特殊性质7.5 重要的醇7.6醚的结构、分类与命名7.6.1醚的结构、分类7.6.2 醚的命名7.7醚的来源与制备7.7.1由醇脱水7.7.2威廉姆逊(Williamson)合成法7.7.3乙烯基醚的制取7.8醚的物理性质7.9醚的化学性质7.9.1形成8.1.2酚的命名8.2酚的来源与制备8.2.1酚的天然来源8.2.2人工合成法8.2.3 卤代芳烃水解法8.2.4 重氮盐水解法8.3酚的物理性质8. 4酚的化学性质8.4.1酚羟基的反应8.4.2、与三氯化铁的反应8.4.3、芳环上的反应8.4.4、氧化反应8.4.5、还原反应8.4.6、酚的其它反应8. 5重要的酚8.6醌的结构和命名8.7醌的来源与制备8.8醌的化学性质9.8.1加成反应8.8.2.还原反应8.9重要的醌阅读材料:超分子化学第三代主体----杯芳烃第九章醛、酮9.1 醛和酮的结构9.2醛和酮的分类和命名9.2.1 醛酮的分类9.2.2 醛酮的命名9.3.醛酮的制备方法9.3.1由烯烃和炔烃制备9.3.2 由同碳二卤代物水解制备9.3.3 由醇氧化或脱氢反应制备9.3.4 由芳烃制备9.3.5 由酰氯制备9.3.6 由腈制备9.4醛酮的物理性质9.5化学性质9.5.1 亲核加成反应9.5.2 羰基α-H的反应9.5.3 醛酮的氧化和还原9.6重要的醛、酮第十章羧酸及其衍生物10.1 羧酸的结构、分类和命名10.1.1 羧酸的结构10.1.2 羧酸的分类和命名10.2 羧酸的制法10.2.1 氧化法10.2.2 水解法10.2.3 Grignard试剂与CO2作用10.3 羧酸的物理性质10.4 羧酸的化学性质10.4.1羧酸的酸性和电子效应10.4.2 羰基的还原反应10.4.3 脱羧反应10.4.4羧酸衍生物的生成10.4.5 a-氢原子的反应10.5 取代酸10.5.1 卤代酸10.5.2 羟基酸10.6 重要的羧酸10.7 羧酸衍生物的命名10.8 羧酸衍生物的制法10.8.1 酰氯的制法10.8.2 酸酐的制法10.8.3 羧酸酯的制法10.8.4 酰胺的制法10.8.5 腈的制法10.9 羧酸衍生物的物理性质10.10 羧酸衍生物的化学性质10.10.1 酰基碳上的亲核取代(加成-消除)反应10.10.2 水解10.10.3 醇解10.10.4 氨解10.10.5 酸解10.10.6 与Grignard试剂的反应10.10.7 还原10.10.8 氧化10.10.9霍夫曼(Hofmann)降解10.11 重要的羧酸衍生物10.12 油脂和蜡(Oil and Wax)10.12.1 油脂的组成和结构10.12.2 油脂的性质10.12.3 蜡10.13碳酸衍生物10.13.1 碳酰氯10.13.2 碳酰胺10.13.3胍10.14 腈及其衍生物10.14.1腈10.14.2 异腈10.14.3 异氰酸酯阅读材料:共轭二油酸第十一章b-二羰基化合物11.1 烯醇式和酮式的互变异构11.1.1 酸和碱对烯醇式和酮式的互变异构的影响11.1.2 化合物结构对烯醇式和酮式的互变异构的影响11.1.3 b-二羰基化合物的酸性和烯醇负离子的稳定性11.2 乙酰乙酸乙酯的合成及其应用11.2.1 克莱森(酯)缩合反应(Claisen condensation) 11.2.2 乙酰乙酸乙酯在有机合成上的应用11.3 丙二酸酯的合成及在有机合成中的应用11.4碳负离子的亲核加成反应及在有机合成上的应用11.4.1麦克尔反应(Michael reaction)11.4.2瑞佛马斯基反应11.4.3克脑文盖尔反应11.4.4达尔森反应11.4.5普尔金反应阅读材料:β-二羰基化合物的应用第十二章含氮化合物12.1 硝基化合物的分类、结构和命名12. 2硝基化合物的制备12.3 物理性质12.4 化学性质12.4.1 酸性12.4.2 缩合反应12.4.3 还原反应12.4.4 硝基对苯环邻、对位基团的影响12.5 胺的结构、分类和命名12.5.1的结构12.5.2 胺的分类和命名12.6 胺的制法12.6.1 氨或胺的烃基化12.6.2 硝基化合物的部分还原12.6.3 腈和酰胺的还原12.6.4 霍夫曼(Hofmann)降解反应12.6.5 盖布瑞尔(Gabriel)合成法12.6.6 醛或酮的氨化还原12.7 胺的物理性质12.8 胺的化学性质12.8.1 胺的碱性12.8.2烷基化反应12.8.3 酰基化反应12.8.4 磺酰化反应12.8.5 与亚硝酸反应12.8.6 氧化反应12.8.7 芳胺芳环上的反应12.9 季铵盐与季铵碱12.9.1 季铵盐12.9.2 季铵碱12.10 重氮盐的制备及其结构12.11 重氮盐的反应及其应用12.11.1 放氮反应12.11.2 留氮反应12.12 偶氮化合物和偶氮染料12.13 重氮甲烷12.14 叠氮化合物第十三章杂环化合物13.1 杂环化合物的分类和命名13.2 五元杂环化合物13.2.1 含有一个杂原子的五元杂环体系13.2.2 含有两个杂原子的五元杂环体系13.2.3 五元稠杂环体系13.3 六元杂环化合物13.3.1 含有一个杂原子的六元杂环体系13.3.2 含有两个杂原子的六元杂环体系13.3.3六元稠杂环体系阅读材料:生物碱第十四章天然化合物----糖,氨基酸,萜及甾族化合物14.1 糖14.1.1 单糖14.1.2 双糖14.1.3多糖14.2 氨基酸14.2.1氨基酸的结构、命名和分类14.2.2 氨基酸的制法14.2.3氨基酸的性质14.3 萜类14.3.1萜的涵义和异戊二烯规律14.3.2 萜的分类和命名14.4 甾族化合物14.4.1甾的基本结构和命名14.4.2甾族化合物的结构14.4.3甾族的种类阅读材料:米勒人工合成氨基酸。