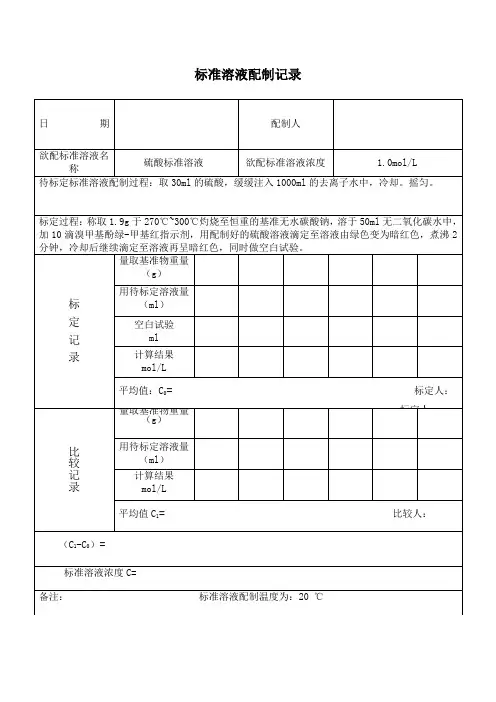
标准溶液配制记录
- 格式:doc
- 大小:81.50 KB
- 文档页数:2
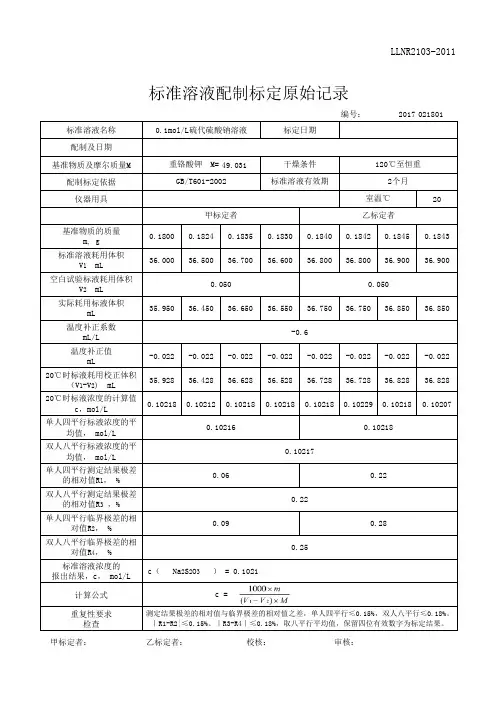

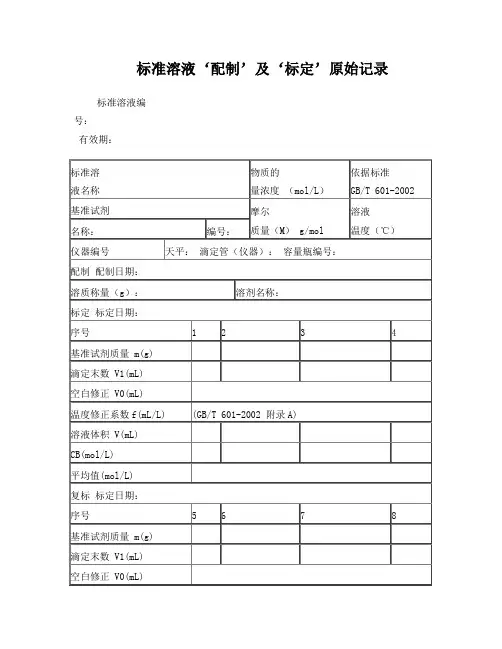
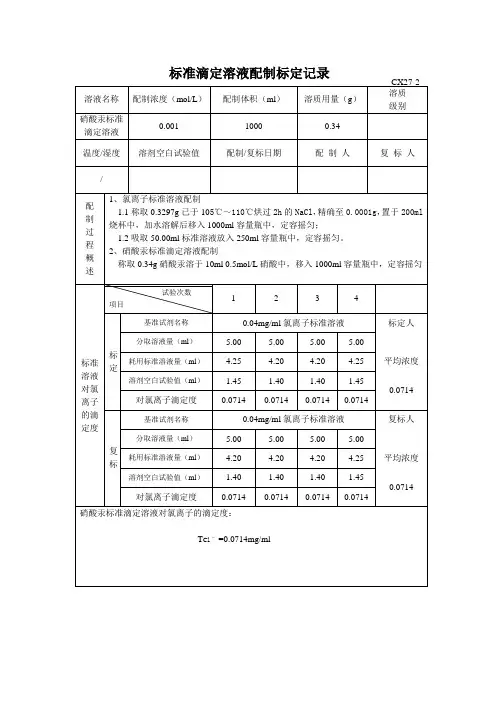
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:温度修正系数f(mL/L) (GB/T 601-2002 附录A)溶液体积 V(mL)CB(mol/L)平均值(mol/L)计算式:V=(V1-V0)×(1+f/1000)CB=1000m/(M×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度 %RH配制:取定溶 mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃ 、湿度: %RH 标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009.1-2003二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定。
2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0.0530]0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g2、数据配制人:复核人:配制日期:复核日期:稀释记录表标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理。
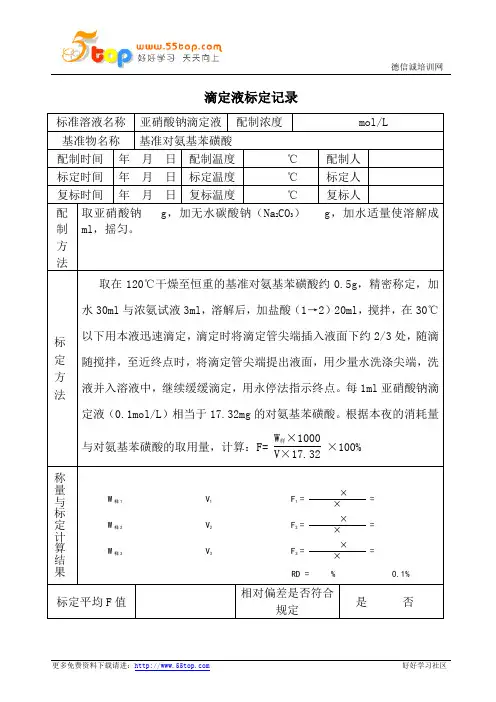
滴定液标定记录标准溶液名称亚硝酸钠滴定液配制浓度 mol/L 基准物名称基准对氨基苯磺酸配制时间年月日配制温度℃配制人标定时间年月日标定温度℃标定人复标时间年月日复标温度℃复标人配制方法取亚硝酸钠 g,加无水碳酸钠(Na2CO3) g,加水适量使溶解成ml,摇匀。
标定方法取在120℃干燥至恒重的基准对氨基苯磺酸约0.5g,精密称定,加水30ml与浓氨试液3ml,溶解后,加盐酸(1→2)20ml,搅拌,在30℃以下用本液迅速滴定,滴定时将滴定管尖端插入液面下约2/3处,随滴随搅拌,至近终点时,将滴定管尖端提出液面,用少量水洗涤尖端,洗液并入溶液中,继续缓缓滴定,用永停法指示终点。
每1ml亚硝酸钠滴定液(0.1mol/L)相当于17.32mg的对氨基苯磺酸。
根据本夜的消耗量与对氨基苯磺酸的取用量,计算:F=W样×1000V×17.32×100%称量与标定计算结果 W样1 V1 F1 =××=W样2 V2 F2 =××=W样3 V3 F3 =××=RD = % 0.1%标定平均F值相对偏差是否符合规定是否称量与标定计算结果W样1 V1 F1 =××=W样2 V2 F2 =××=W样3 V3 F3 =××=RD = % 0.1%复标平均F值相对偏差是否符合规定是否二次相对偏差是否符合规定是否标准溶液F值有效期至年月日。
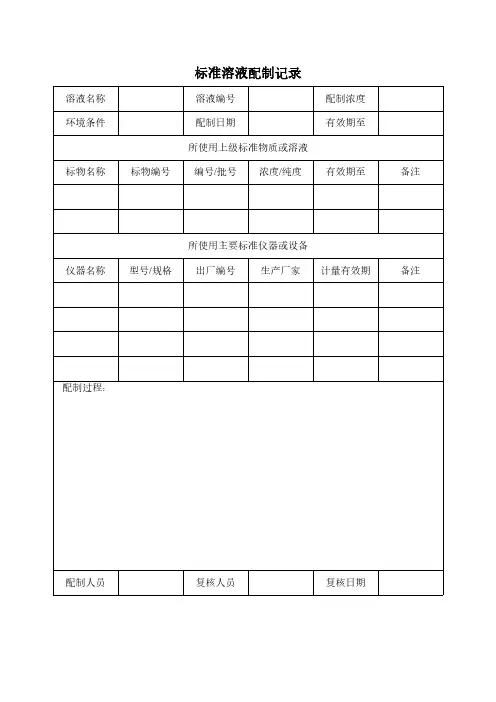
溶液名称溶液编号配制浓度
环境条件配制日期有效期至
所使用上级标准物质或溶液
标物名称标物编号编号/批号浓度/纯度有效期至备注
所使用主要标准仪器或设备
仪器名称型号/规格出厂编号生产厂家计量有效期备注配制过程:
配制人员复核人员复核日期
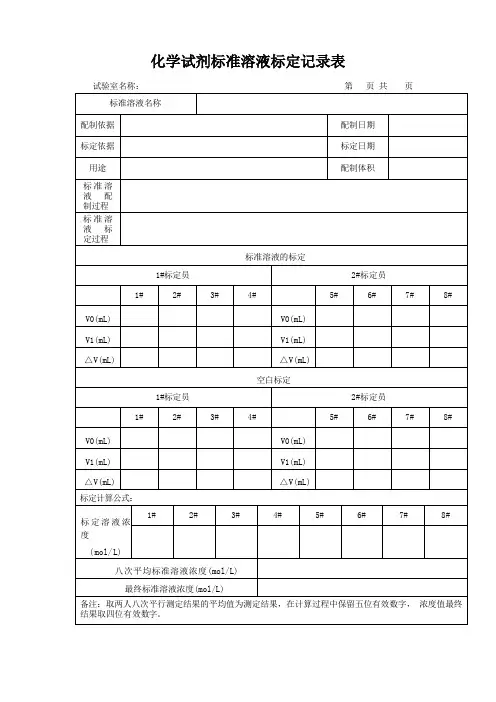
待标溶液名称待标溶液编号
名义浓度
所使用基准物质
标物名称标物编号编号/批号浓度/纯度
有效期至备注C S =
所使用主要标准仪器或设备
仪器名称型号/规格出厂编号生产厂家计量有效期备注标定过程
标定人员
标定人员A 标定人员B :标定次数
A1A2A3A4B1B2B3B4
空白体积V 0/ml
起始读数V 1/ml
终点读数V 2/ml
取待标溶液
体积V/ml
待标溶液
浓度C /(mol/L)
单人四平行结果
相对极差
八平行结果
相对极差
标定浓度mol/L 备注:单人四平行结果相对极差应≤0.15%;八平行结果相对极差应≤0.18%;标定过程中待标溶液及标准滴定液温度应控制在20℃,否则体积应进行补正。
标定人员A 签名及日期标定人员B 签名及日期V V V V C C S )(012--⨯=。

标准溶液配制记录一、实验目的。
本实验旨在记录标准溶液的配制过程,确保实验数据的准确性和可靠性。
二、实验原理。
标准溶液是指其溶液浓度已知并且稳定的溶液,通常用于分析化学中作为定量分析的基准。
配制标准溶液需要根据溶质的质量和溶剂的体积按一定的比例进行配制,配制过程中需要严格控制各个步骤和条件,以确保标准溶液的准确性和稳定性。
三、实验步骤。
1. 根据实验要求选择合适的溶剂和溶质,准备称量瓶、容量瓶、移液管等实验仪器。
2. 使用天平准确称量所需质量的溶质,注意避免溶质的挥发和吸湿。
3. 将称量好的溶质转移至容量瓶中,加入适量的溶剂,用移液管充分混合溶质和溶剂。
4. 摇匀溶液,使溶质充分溶解,然后用溶剂补足至刻度线,摇匀。
5. 用移液管取出一定体积的标准溶液,转移至烧杯中,用试剂瓶盖盖好。
6. 将标准溶液标注清楚,并在标签上注明浓度、配制日期和配制人员。
四、实验记录。
1. 铜离子标准溶液配制记录。
配制人员,张三日期,2022年3月15日。
溶质,CuSO4·5H2O 质量,2.34g。
溶剂,蒸馏水体积,1000mL。
实验过程,按照上述步骤依次进行,摇匀后,得到铜离子标准溶液。
浓度,0.01mol/L。
2. 硫酸标准溶液配制记录。
配制人员,李四日期,2022年3月16日。
溶质,H2SO4 质量,4.80g。
溶剂,蒸馏水体积,1000mL。
实验过程,按照上述步骤依次进行,摇匀后,得到硫酸标准溶液。
浓度,0.1mol/L。
3. 氢氧化钠标准溶液配制记录。
配制人员,王五日期,2022年3月17日。
溶质,NaOH 质量,4.00g。
溶剂,蒸馏水体积,1000mL。
实验过程,按照上述步骤依次进行,摇匀后,得到氢氧化钠标准溶液。
浓度,0.1mol/L。
五、实验总结。
通过本次实验,我们成功配制了铜离子、硫酸和氢氧化钠的标准溶液,每一步都严格按照操作规程进行,确保了标准溶液的准确性和稳定性。
在今后的实验中,我们将继续严格按照标准操作流程进行标准溶液的配制,以确保实验数据的准确性和可靠性。

标准溶液配制记录一、实验目的。
本实验旨在掌握标准溶液的配制方法,提高实验操作技能,确保实验结果的准确性和可靠性。
二、实验原理。
标准溶液是已知浓度的溶液,用于测定未知物质的浓度或进行定量分析。
标准溶液的配制需要根据溶质的摩尔质量、所需溶液的体积和浓度来计算所需的溶质量或溶液体积。
三、实验步骤。
1. 根据实验要求和所需标准溶液的浓度,计算所需溶质的质量或所需溶液的体积;2. 取适量溶剂加入容器中,如水或其他溶剂;3. 将溶质逐渐加入溶剂中,并充分搅拌,直至溶解完全;4. 用稀释瓶加入适量溶剂,将溶液稀释至最终体积;5. 用PH试纸或PH计检测溶液的PH值,确保溶液的酸碱度符合实验要求;6. 用天平称取少量标准溶液,装入干燥洁净的烧杯中,放入干燥器中干燥至恒定质量;7. 记录标准溶液的配制过程和实验数据,如溶质的质量、溶剂的体积、稀释倍数等。
四、实验注意事项。
1. 实验操作过程中要注意安全,避免溶液溅出或溶剂挥发造成伤害;2. 溶质的加入要逐渐,充分搅拌,确保溶解完全;3. 稀释时要准确控制溶剂的加入量,避免误差;4. 配制标准溶液的容器和工具要干燥洁净,避免杂质污染;5. 实验数据要准确记录,确保实验结果的可靠性。
五、实验结果分析。
根据实验数据计算标准溶液的浓度,与理论值进行比较,分析实验误差的原因,提出改进意见,确保实验结果的准确性和可靠性。
六、实验总结。
通过本次实验,掌握了标准溶液的配制方法,提高了实验操作技能,加深了对标准溶液配制原理的理解,为今后的实验工作打下了良好的基础。
七、参考文献。
[1] 《化学实验指导书》。
[2] 《标准溶液的配制与使用》。
以上是本次标准溶液配制记录,如有不当之处,欢迎批评指正。
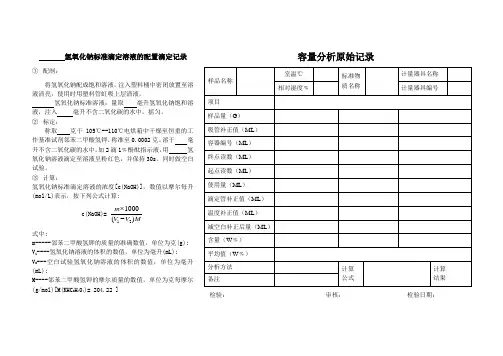
氢氧化钠标准滴定溶液的配置滴定记录 ① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取 毫升氢氧化钠饱和溶液,注入 毫升不含二氧化碳的水中,摇匀。
② 标定:称取 克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于 毫升不含二氧化碳的水中,加2滴1﹪酚酞指示液,用 氢氧化钠溶液滴定至溶液呈粉红色,并保持30s 。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=121000()m V V M⨯-式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V 1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V 2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(KHC 8H 404)= 204.22 ]容量分析原始记录检验: 审核: 检验日期:盐酸标准滴定溶液的配置滴定记录① 配制:盐酸标准溶液,量取 毫升盐酸,注入 毫升水中。
② 标定:称取 克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL 水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min ,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=121000()m V V M⨯-式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V 1---盐酸溶液的体积的数值,单位为毫升(mL)V 2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12Na 2CO 3)=52.994]容量分析原始记录检验: 审核: 检验日期:硫酸标准滴定溶液的配置滴定记录①配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。
标准溶液配制记录一、实验目的。
本实验旨在掌握标准溶液的配制方法,了解标准溶液的应用范围和重要性,提高实验操作技能。
二、实验原理。
标准溶液是已知浓度的溶液,通常用于测定其他溶液中某种物质的浓度或纯度。
其配制需要精确的称量和溶解,以确保浓度的准确性。
三、实验仪器与试剂。
1. 电子天平。
2. 烧杯、量筒、移液管。
3. 蒸馏水。
4. 氢氧化钠固体。
5. 硫酸钠固体。
6. 硫酸氢钠固体。
7. 碳酸钠固体。
8. 硝酸钠固体。
四、实验步骤。
1. 以电子天平称取所需固体试剂,精确至0.01g。
2. 将称取的固体试剂加入烧杯中,并加入适量蒸馏水溶解,转移至量筒中。
3. 用蒸馏水定容至刻度线,摇匀,得到所需浓度的标准溶液。
4. 标签标明标准溶液的名称、浓度、配制日期等信息,保存在阴凉干燥处。
五、实验数据记录。
| 试剂 | 质量/g | 体积/mL | 浓度/mol/L |。
|------------|--------|---------|------------|。
| NaOH | 4.56 | 1000 | 0.1 |。
| Na2SO4 | 3.78 | 1000 | 0.05 |。
| NaHSO4 | 2.34 | 1000 | 0.02 |。
| Na2CO3 | 5.67 | 1000 | 0.1 |。
| NaNO3 | 6.89 | 1000 | 0.1 |。
六、实验结果与分析。
通过本次实验,成功配制了不同浓度的标准溶液,并记录了相应的数据。
在实验过程中,严格按照步骤操作,避免了误差的产生。
标准溶液的配制对于化学分析和实验室日常工作具有重要意义,能够确保实验数据的准确性和可重复性。
七、实验注意事项。
1. 配制标准溶液时,需严格按照配方比例和操作步骤进行,避免误差的产生。
2. 在配制过程中,应注意试剂的溶解和混合均匀,以确保溶液浓度的准确性。
3. 配制完成后,标签标明标准溶液的名称、浓度、配制日期等信息,保存在阴凉干燥处。
标准溶液配制记录一、实验目的。
本实验旨在记录标准溶液的配制过程,以及相关实验数据,为后续实验提供准确可靠的参考依据。
二、实验原理。
标准溶液是已知浓度的溶液,通常用于分析化学中的定量分析。
在配制标准溶液时,需要根据溶质的化学性质和实验要求,选择适当的溶剂和溶质的质量,按照一定的比例配制而成。
三、实验步骤。
1. 准备实验所需的试剂和仪器设备,包括天平、容量瓶、移液管等。
2. 根据实验要求,选择合适的溶剂和溶质,并按照所需的浓度比例进行称量。
3. 将称量好的溶质溶解于适量的溶剂中,摇匀使其充分溶解。
4. 用容量瓶将溶液定容至刻度线,摇匀混合。
5. 将配制好的标准溶液转移至干净的密封瓶中,标注好溶液的名称、浓度、配制日期等信息。
四、实验数据记录。
| 溶质 | 质量/g | 溶剂 | 体积/mL | 浓度/mol/L | 配制日期 |。
|------|--------|------|---------|------------|----------|。
| NaCl | 5.85 | 水 | 1000 | 0.1 |2022/03/15|。
| KCl | 7.20 | 水 | 1000 | 0.2 |2022/03/16|。
五、实验结果分析。
通过本次实验的记录数据,我们成功配制出了两种浓度不同的标准溶液,分别为0.1mol/L的NaCl溶液和0.2mol/L的KCl溶液。
在实验过程中,我们严格按照配制步骤进行操作,确保了实验结果的准确性和可靠性。
六、实验总结。
本次实验记录了标准溶液的配制过程和相关数据,为后续实验提供了重要的参考依据。
在实验中,我们需要严格按照配制步骤进行操作,确保实验结果的准确性和可靠性。
同时,对于配制好的标准溶液,我们也需要做好标注和保存工作,以便后续实验的使用。
七、实验注意事项。
1. 在配制标准溶液时,需要准确称量溶质和溶剂,严格按照比例进行配制。
2. 配制好的标准溶液需要标注清楚名称、浓度、配制日期等信息,并保存在干净的密封瓶中。
标准溶液配制标定记录一、实验目的。
本实验旨在记录标准溶液的配制和标定过程,确保实验数据的准确性和可靠性。
二、实验原理。
1. 标准溶液,是已知浓度的溶液,用于分析化学中的定量分析和质量分析。
2. 配制标准溶液的步骤:a. 确定所需配制的标准溶液的浓度和体积。
b. 准备所需的溶质和溶剂。
c. 按照一定的比例将溶质溶解于溶剂中,配制出标准溶液。
3. 标定标准溶液的步骤:a. 使用已知浓度的标准溶液进行定量分析,得到实验数据。
b. 根据实验数据计算出待标定标准溶液的浓度。
三、实验仪器和试剂。
1. 电子天平。
2. 称量瓶、烧杯。
3. 蒸馏水。
4. 已知浓度的标准溶液。
5. 待标定的溶质。
四、实验步骤。
1. 配制标准溶液:a. 根据所需配制的标准溶液的浓度和体积,准备好溶质和溶剂。
b. 使用电子天平称量所需的溶质,转移至称量瓶中。
c. 加入适量的溶剂,摇匀使溶质完全溶解,配制出标准溶液。
d. 使用称量瓶和烧杯进行操作,注意操作规范,避免溶液的挥发和外界杂质的污染。
2. 标定标准溶液:a. 取一定体积的待标定标准溶液,转移至烧杯中。
b. 使用已知浓度的标准溶液进行定量分析,记录实验数据。
c. 根据实验数据计算出待标定标准溶液的浓度。
五、实验数据记录。
1. 配制标准溶液的记录:a. 配制日期,XXXX年XX月XX日。
b. 配制人,XXX。
c. 标准溶液的浓度,XXXXmol/L。
d. 配制过程中所用的溶质和溶剂的质量和体积。
e. 配制后的标准溶液的外观和溶解情况。
2. 标定标准溶液的记录:a. 标定日期,XXXX年XX月XX日。
b. 标定人,XXX。
c. 待标定标准溶液的浓度,XXXXmol/L。
d. 使用已知浓度的标准溶液进行定量分析的实验数据。
e. 计算出的待标定标准溶液的浓度。
六、实验结果分析。
根据实验数据记录和计算结果,验证标准溶液的浓度是否符合预期要求,评估实验数据的准确性和可靠性。
七、实验结论。
总结实验过程中的操作规范和注意事项,总结实验结果并得出结论,指出实验中存在的问题和改进的方向。