标准溶液配制记录
- 格式:doc
- 大小:44.50 KB
- 文档页数:2

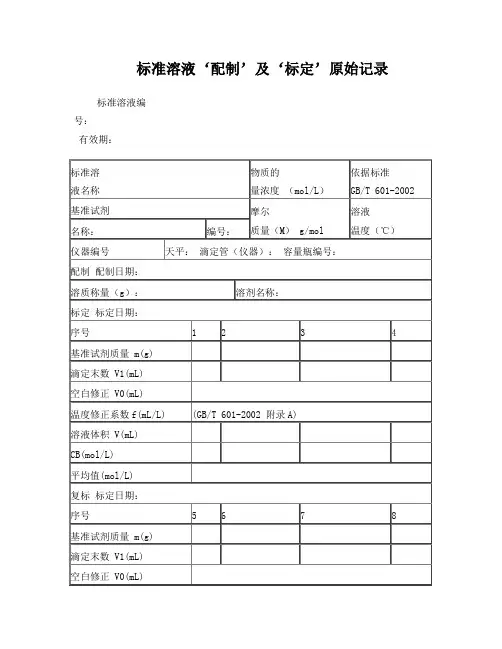
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:温度修正系数f(mL/L) (GB/T 601-2002 附录A)溶液体积 V(mL)CB(mol/L)平均值(mol/L)计算式:V=(V1-V0)×(1+f/1000)CB=1000m/(M×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度 %RH配制:取定溶 mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃ 、湿度: %RH 标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009.1-2003二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定。
2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0.0530]0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g2、数据配制人:复核人:配制日期:复核日期:稀释记录表标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理。
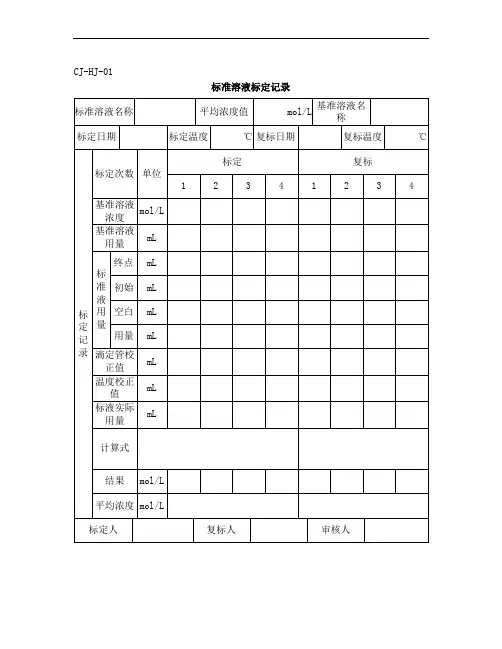

标准溶液配制记录一、实验目的。
本实验旨在记录标准溶液的配制过程,确保实验数据的准确性和可靠性。
二、实验原理。
标准溶液是指其溶液浓度已知并且稳定的溶液,通常用于分析化学中作为定量分析的基准。
配制标准溶液需要根据溶质的质量和溶剂的体积按一定的比例进行配制,配制过程中需要严格控制各个步骤和条件,以确保标准溶液的准确性和稳定性。
三、实验步骤。
1. 根据实验要求选择合适的溶剂和溶质,准备称量瓶、容量瓶、移液管等实验仪器。
2. 使用天平准确称量所需质量的溶质,注意避免溶质的挥发和吸湿。
3. 将称量好的溶质转移至容量瓶中,加入适量的溶剂,用移液管充分混合溶质和溶剂。
4. 摇匀溶液,使溶质充分溶解,然后用溶剂补足至刻度线,摇匀。
5. 用移液管取出一定体积的标准溶液,转移至烧杯中,用试剂瓶盖盖好。
6. 将标准溶液标注清楚,并在标签上注明浓度、配制日期和配制人员。
四、实验记录。
1. 铜离子标准溶液配制记录。
配制人员,张三日期,2022年3月15日。
溶质,CuSO4·5H2O 质量,2.34g。
溶剂,蒸馏水体积,1000mL。
实验过程,按照上述步骤依次进行,摇匀后,得到铜离子标准溶液。
浓度,0.01mol/L。
2. 硫酸标准溶液配制记录。
配制人员,李四日期,2022年3月16日。
溶质,H2SO4 质量,4.80g。
溶剂,蒸馏水体积,1000mL。
实验过程,按照上述步骤依次进行,摇匀后,得到硫酸标准溶液。
浓度,0.1mol/L。
3. 氢氧化钠标准溶液配制记录。
配制人员,王五日期,2022年3月17日。
溶质,NaOH 质量,4.00g。
溶剂,蒸馏水体积,1000mL。
实验过程,按照上述步骤依次进行,摇匀后,得到氢氧化钠标准溶液。
浓度,0.1mol/L。
五、实验总结。
通过本次实验,我们成功配制了铜离子、硫酸和氢氧化钠的标准溶液,每一步都严格按照操作规程进行,确保了标准溶液的准确性和稳定性。
在今后的实验中,我们将继续严格按照标准操作流程进行标准溶液的配制,以确保实验数据的准确性和可靠性。
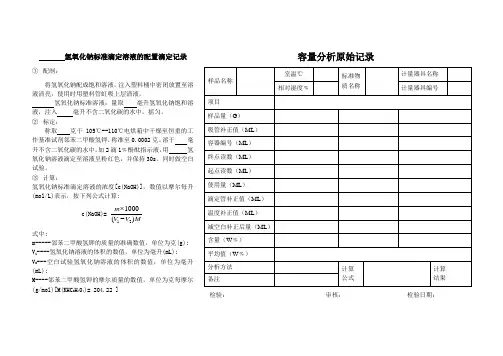
氢氧化钠标准滴定溶液的配置滴定记录 ① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取 毫升氢氧化钠饱和溶液,注入 毫升不含二氧化碳的水中,摇匀。
② 标定:称取 克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于 毫升不含二氧化碳的水中,加2滴1﹪酚酞指示液,用 氢氧化钠溶液滴定至溶液呈粉红色,并保持30s 。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=121000()m V V M⨯-式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V 1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V 2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(KHC 8H 404)= 204.22 ]容量分析原始记录检验: 审核: 检验日期:盐酸标准滴定溶液的配置滴定记录① 配制:盐酸标准溶液,量取 毫升盐酸,注入 毫升水中。
② 标定:称取 克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL 水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min ,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=121000()m V V M⨯-式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V 1---盐酸溶液的体积的数值,单位为毫升(mL)V 2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12Na 2CO 3)=52.994]容量分析原始记录检验: 审核: 检验日期:硫酸标准滴定溶液的配置滴定记录①配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。

标准溶液配制记录一、实验目的。
本实验旨在掌握标准溶液的配制方法,了解标准溶液的应用范围和重要性,提高实验操作技能。
二、实验原理。
标准溶液是已知浓度的溶液,通常用于测定其他溶液中某种物质的浓度或纯度。
其配制需要精确的称量和溶解,以确保浓度的准确性。
三、实验仪器与试剂。
1. 电子天平。
2. 烧杯、量筒、移液管。
3. 蒸馏水。
4. 氢氧化钠固体。
5. 硫酸钠固体。
6. 硫酸氢钠固体。
7. 碳酸钠固体。
8. 硝酸钠固体。
四、实验步骤。
1. 以电子天平称取所需固体试剂,精确至0.01g。
2. 将称取的固体试剂加入烧杯中,并加入适量蒸馏水溶解,转移至量筒中。
3. 用蒸馏水定容至刻度线,摇匀,得到所需浓度的标准溶液。
4. 标签标明标准溶液的名称、浓度、配制日期等信息,保存在阴凉干燥处。
五、实验数据记录。
| 试剂 | 质量/g | 体积/mL | 浓度/mol/L |。
|------------|--------|---------|------------|。
| NaOH | 4.56 | 1000 | 0.1 |。
| Na2SO4 | 3.78 | 1000 | 0.05 |。
| NaHSO4 | 2.34 | 1000 | 0.02 |。
| Na2CO3 | 5.67 | 1000 | 0.1 |。
| NaNO3 | 6.89 | 1000 | 0.1 |。
六、实验结果与分析。
通过本次实验,成功配制了不同浓度的标准溶液,并记录了相应的数据。
在实验过程中,严格按照步骤操作,避免了误差的产生。
标准溶液的配制对于化学分析和实验室日常工作具有重要意义,能够确保实验数据的准确性和可重复性。
七、实验注意事项。
1. 配制标准溶液时,需严格按照配方比例和操作步骤进行,避免误差的产生。
2. 在配制过程中,应注意试剂的溶解和混合均匀,以确保溶液浓度的准确性。
3. 配制完成后,标签标明标准溶液的名称、浓度、配制日期等信息,保存在阴凉干燥处。


edta标准溶液的配制和标定数据记录 EDTA(乙二胺四乙酸)是一种常用的配位试剂,广泛应用于化学分析和环境监测等领域。
为了准确测定目标物质的含量,必须配制和标定EDTA标准溶液。
本文将详细描述EDTA标准溶液的配制过程和标定数据记录方法,以期为读者提供准确、可靠的实验结果。
一、EDTA标准溶液的配制1. 根据实验需求确定所需浓度和体积。
2. 准备清洁、干燥的容器,精确称量所需质量的EDTA固体。
注:应使用分析纯的EDTA以确保溶液的纯度和精确度。
3. 将EDTA固体加入容器中,加入适量的去离子水溶解,定容至所需体积。
注:在溶解过程中应充分搅拌,确保EDTA充分溶解并均匀分布。
二、EDTA标准溶液的标定1. 标定前的准备工作:a. 清洁、干燥容器,准备所需量的标定溶液。
b. 根据实验需求,选择相应的指示剂和溶剂。
c. 准备一定浓度的化学指示剂溶液(例如:钙碳酸盐指示剂等)。
d. 准备一定浓度的酸溶液(例如:0.1 mol/L盐酸溶液)用于调节溶液的pH值。
e. 清洁、干燥滴定管和滴定管架。
2. 标定过程: a. 取一定体积的待测样品(例如:10 mL)加入滴定瓶中。
b. 加入适量的酸溶液调节待测样品的pH值。
确保待测样品中没有其他影响滴定反应的离子。
c. 加入一定体积的化学指示剂溶液,使其与待测样品反应产生可观察的颜色变化。
d. 使用滴定管分次向待测样品中滴定EDTA标准溶液,直至颜色变化,记录滴定所用的EDTA标准溶液的体积(V1)。
e. 等颜色变化稳定后,再缓慢滴定,直到颜色消失,记录滴定所需的EDTA标准溶液的体积(V2)。
f. 重复上述滴定步骤2-3次,计算平均用量,提高测量结果的准确性。
三、标定数据记录 1. 记录待测样品用量、酸溶液浓度、化学指示剂体积以及EDTA 标准溶液滴定数据。
例如:待测样品用量:10 mL,酸溶液浓度:0.1 mol/L,化学指示剂体积:2 mL,EDTA标准溶液滴定体积:V1 = 8.5 mL,V2 = 12.3 mL。
标准溶液配制记录
《标准溶液配制记录》
嘿!你知道吗?在我们的科学课上,老师带着我们一起配制标准溶液,那可真是一次超级有趣又有点小挑战的经历!
那天,一上课老师就神秘兮兮地说:“同学们,今天我们要像小科学家一样配制标准溶液!”大家一听,眼睛都亮了,叽叽喳喳地讨论起来。
“这会很难吗?”“是不是像做魔法药水?”
老师笑着让我们安静下来,开始给我们讲配制的步骤。
第一步,要准备好各种各样的仪器和药品。
那一堆瓶瓶罐罐,就像一个神秘的宝库。
量杯、量筒、玻璃棒,还有那些叫不上名字的化学药品,难道不像一个等待我们去探索的神秘世界吗?
我和同桌小明互相看了一眼,都从对方的眼神里看到了兴奋和紧张。
“这能行吗?”我小声问他。
“试试呗,怕啥!”小明倒是很勇敢。
然后,我们按照老师说的,小心翼翼地开始测量药品的质量。
这可真是个精细活儿,多一点少一点都不行。
我拿着天平,手都有点抖,心里直嘀咕:“这要是称错了可咋办?”
好不容易称好了药品,接下来就是溶解啦。
把药品倒进水里,用玻璃棒搅拌。
我搅拌得可卖力了,感觉自己就像在搅拌一锅魔法汤。
“哎呀,我这怎么还没溶解完?”旁边的小红着急地叫起来。
“别着急,慢慢搅,会好的。
”老师安慰她。
终于,溶液配制好了,看着那一瓶清澈的液体,我们心里充满了成就感。
这一次配制标准溶液的经历,让我明白了做科学实验可不能马虎,要细心、耐心。
这不就像我们的人生一样吗?每一步都要走稳,才能走向成功的彼岸。
我觉得呀,这样的科学实验课太有意思啦,真希望以后能有更多这样的机会,让我们探索更多的科学奥秘!。
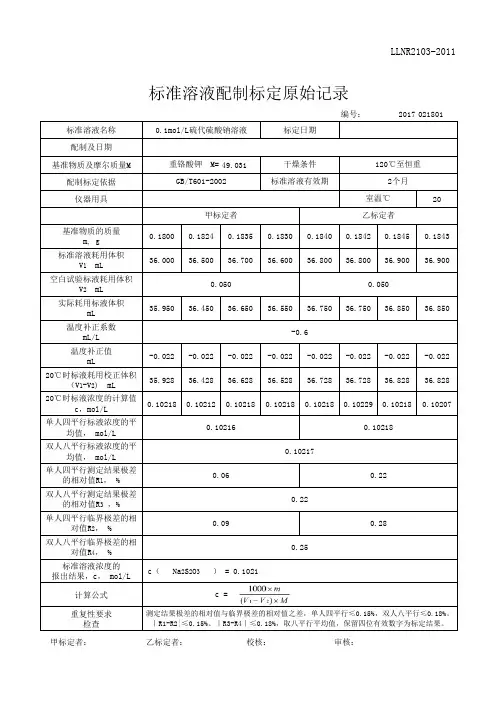
编号:标准溶液名称配制及日期基准物质及摩尔质量M52.994配制标定依据仪器用具20基准物质的质量m, g 0.20910.20590.21110.20530.20410.21570.20840.2005标准溶液耗用体积V 1 mL 36.95036.38037.30036.25036.05038.10036.78035.430空白试验标液耗用体积V 2 mL 实际耗用标液体积mL 36.92936.38037.30036.25036.02738.07736.75735.407温度补正系数mL/L 温度补正值mL20℃时标液耗用校正体积(V 1-V 2) mL 36.92936.38037.30036.25036.02738.07736.75735.40720℃时标液浓度的计算值c,mol/L 0.106850.106800.106800.106870.106900.106900.106990.10686单人四平行标液浓度的平均值, mol/L 双人八平行标液浓度的平均值, mol/L 单人四平行测定结果极差的相对值R 1, %双人八平行测定结果极差的相对值R 3 ,%单人四平行临界极差的相对值R 2, %双人八平行临界极差的相对值R 4, %标准溶液浓度的报出结果,c, mol/L计算公式重复性要求检查无水碳酸钠 M=2014/4/160.070.12甲标定者滴定管、分析天平室温℃270℃至恒重JY-510/QB/T2739-2005标准溶液有效期标准溶液配制标定原始记录0.1mol/LHCl异丙醇乙二醇溶液标定日期2个月2014/4/17干燥条件测定结果极差的相对值与临界极差的相对值之差,单人四平行≤0.15%,双人八平行≤0.18%。
|R1-R2|≤0.15%、|R3-R4|≤0.18%,取八平行平均值,保留四位有效数字为标定结果。
c =0.11c( HCl ) = 0.1069乙标定者0.0210.023 甲标定者: 乙标定者: 审核:0.180.160.230.106830.106910.10687。