(完整版)硝酸盐氮复习题及参考答案
- 格式:doc
- 大小:42.51 KB
- 文档页数:9
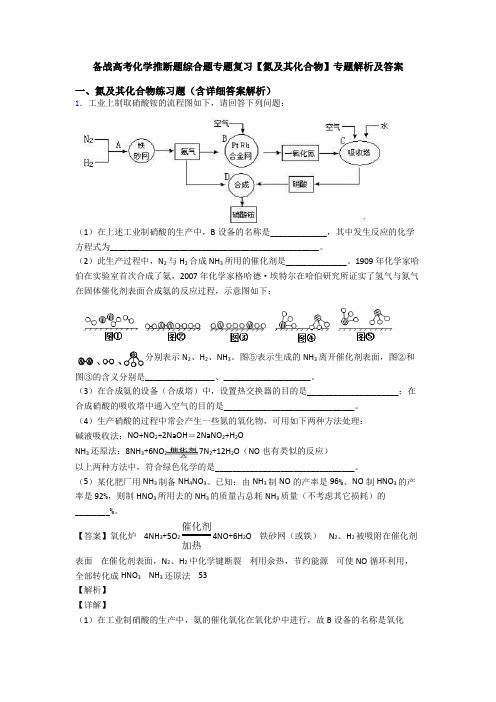
备战高考化学推断题综合题专题复习【氮及其化合物】专题解析及答案一、氮及其化合物练习题(含详细答案解析)1.工业上制取硝酸铵的流程图如下,请回答下列问题:(1)在上述工业制硝酸的生产中,B设备的名称是_____________,其中发生反应的化学方程式为________________________________________________。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是______________。
1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:分别表示N2、H2、NH3。
图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是_____________________;在合成硝酸的吸收塔中通入空气的目的是______________________________。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2ONH3还原法:8NH3+6NO27N2+12H2O(NO也有类似的反应)以上两种方法中,符合绿色化学的是________________________________。
(5)某化肥厂用NH3制备NH4NO3。
已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的________%。
【答案】氧化炉 4NH3+5O2催化剂加热4NO+6H2O 铁砂网(或铁) N2、H2被吸附在催化剂表面在催化剂表面,N2、H2中化学键断裂利用余热,节约能源可使NO循环利用,全部转化成HNO3 NH3还原法 53【解析】【详解】(1)在工业制硝酸的生产中,氨的催化氧化在氧化炉中进行,故B设备的名称是氧化炉,发生反应的化学方程式为4NH3+5O2催化剂加热4NO+6H2O。

高考化学与氮及其化合物有关的压轴题及答案一、氮及其化合物练习题(含详细答案解析)1.硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。
硝酸盐多用于焰火、试剂、图像处理行业。
−−→2M+2NO2↑+O2↑,加热(1)某金属M的硝酸盐受热时按下式分解:2MNO3∆3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。
由此可以计算出M的相对原子质量为__。
(2)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L。
其中NO的体积为__。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6molHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(S.T.P.)。
则产物中硝酸铜的物质的量为_。
如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为__。
(4)有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,HNO3被还原成NO,待反应结束后,可产生标准状况下的气体多少升___?(5)加热某一硝酸铜的结晶水合物和硝酸银的混合物110.2g,使之完全分解,得到固体残渣48.4g。
将反应后产生的气体通过水充分吸收后,剩余气体1.68L(S.T.P.)。
求原混合物中硝酸铜结晶水合物的化学式___。
【答案】108 5.824L 0.025 9:5 0.448L Cu(NO3)2·6H2O【解析】【分析】(1)根据硝酸盐和气体体积的关系式计算金属的相对原子质量;(2)根据氧化还原反应中得失电子数相等计算生成的一氧化氮的体积;(3)根据氮原子守恒确定未反应硝酸根的物质的量,根据硝酸根的物质的量和硝酸铜的关系式计算硝酸铜的物质的量;根据硝酸铜的物质的量计算溶液中铜离子的物质的量,根据氧化还原反应中得失电子守恒计算氧化亚铜的质量,根据铜原子守恒计算氧化铜的质量,从而计算出氧化亚铜和氧化铜的质量之比;(4)根据n=cV计算氢离子和硝酸根的物质的量,由于铁过量,根据反应进行过量计算,以不足量的物质计算一氧化氮的物质的量,进而计算体积;(5)根据原子守恒,气体体积列方程计算硝酸铜和硝酸银的物质的量,根据铜原子守恒计算结晶水系数,从而确定化学式。

第五节 硝酸硝酸盐一、选择题1.物质的量之比为25∶的锌与稀硝酸反应,若硝酸被还原的产物为2N O ,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )。
A .14∶B .15∶C .23∶D .25∶ 解答:本题考查锌与稀硝酸反应产物的判断。
解:设2molZn 参与反应,因Zn 无剩余,则最终生成了()322molZn NO ,显然生成的()322molZn NO 中含有34molNO -,这部分3NO -没有参与氧化还原反应,根据得失电子守恒有:32(Zn)(HNO )4n n ⨯=⨯,则被还原的3(HNO )1mol n =,所以被还原的硝酸与未被还原的硝酸的物质的量之比14=∶。
本题答案为选项A 。
2.在下列变化①大气固氮、②硝酸银分解、③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是( )。
A .①②③ B .②①③ C .③②① D .③①② 解答:本题考查氧化还原反应知识。
解:氧化还原反应中,元素化合价升高是被氧化,化合价降低是被还原。
①大气固氮,元素化合价升高,被氧化; ②硝酸银分解,氮元素化合价降低被还原;③实验室制取氨气中氮元素化合价不变,既不被氧化又不被还原。
本题答案为选项A 。
3.将相同质量的铜片分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )。
A .反应速率,两者相同B .消耗硝酸的物质的量:前者多,后者少C .反应生成气体的颜色:前者浅,后者深D .反应中转移的电子总数:前者多,后者少 解答:本题考查硝酸的性质。
解:铜片与浓、稀3HNO 反应的化学方程式分别为3Cu 4HNO +(浓)32Cu(NO )−−→+ 222NO 2H O ↑+,33Cu 8HNO +(稀)3223Cu(NO )2NO 4H O −−→+↑+。
因浓度越大反应速率越大,所以选项A 错;又因2NO 为红棕色,NO 为无色,所以选项C 错;因两种酸都过量,铜完全溶解,所以转移电子数相等,选项D 错;由化学方程式不难看出,同质量的铜消耗浓3HNO 多,故选项B 正确。

完整版高考化学氮及其化合物知识点及练习题及答案一、选择题1.硝酸钾是一种无氯氮钾复合肥,宜在种植水果、蔬菜、花卉时使用。
关于KNO3的说法中,不正确的是()A.从其阳离子看,属于钾盐B.从其阴离子看,属于硝酸盐C.它属于纯净物中的无机化合物D.因为含有氧元素,故它属于氧化物【答案】D【详解】A.硝酸钾含有的阳离子为钾离子,则硝酸钾属于钾盐,故A正确;B.硝酸钾含有的阴离子为硝酸根离子,则硝酸钾属于硝酸盐,故B正确;C.硝酸钾是由三种元素组成的盐,是纯净的无机化合物,故C正确;D.氧化物是由两种元素组成,并且一种元素为氧元素的纯净物,硝酸钾是由三种元素组成的盐,不属于氧化物,故D错误;故选D。
2.有关铵盐性质的叙述正确的是A.都是晶体,都能溶于水B.受热时分解,都有NH3产生C.与碱共热时不一定产生氨气D.都能与酸反应【答案】A【详解】A.铵盐都是易溶于水的白色晶体,A项正确;B.铵盐不稳定都能加热分解,但不一定有氨气产生,如:NH4NO3N2O↑+2H2O,B项错误;C.铵盐都能与碱反应生成氨气,C项错误;D.铵盐不都能与酸反应,例如硝酸铵不能与酸反应,D项错误;答案选A。
3.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-【答案】A【详解】A. 加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B. 原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO 32-,B 项错误;C. 产生不溶于盐酸的白色沉淀也可能是AgCl ,则原溶液中不一定有SO 42-,C 项错误;D. 加入盐酸酸化的AgNO 3溶液时,则引入了Cl - ,故不能证明是原溶液中是否含有Cl -,D 项错误; 答案选A 。

[国考]硝酸盐氮复习题及参考答案(25题)硝酸盐氮复习题及参考答案(25题)一、填空题1、水中硝酸盐是在有环境下,各种形态的含氮化合物中最化合物,亦是含氮有机物经作用的分解产物。
人摄入硝酸盐后对人体有害,国家《生活饮用水卫生标准》中硝酸盐(以氮计)的含量限制在以下。
答:氧稳定的氮无机化最终阶段 20mg/L2、废水、废水、的出水和可含大量的硝酸盐。
答:制革酸洗某些生化处理设施农田排水3、我国环境监测中推荐测定水中硝酸盐氮的方法有:测量范围较宽的法、适于测定水中低含量的法、适于严重污染并带深色的方法是法,还有法、法和法。
国家标准分析方法是法。
答:酚二磺酸分光光度镉柱还原戴氏合金还原离子色谱紫外电极酚二磺酸光度法4、水样采集后应测定。
必要时,应加使pH ,保存在℃以下,在内进行测定。
答:及时进行硫酸<2 4 24h5、酚二磺酸光度法测定水中硝酸盐氮,当水样中亚硝酸盐氮含量超过0.2mg/L时,可取水样,加入,混匀后,滴加至淡红色,保持15分钟不褪为止,使亚硝酸盐氧化为硝酸盐,最后从硝酸盐氮测定结果中减去亚硝酸盐氮量。
答:100ml 1ml 0.5mol/L的硫酸溶液高锰酸钾溶液6、若水样中含有氯离子较多(10mg/L),用酚二磺酸法测定硝酸盐氮,会使测定结果,可以加入使生成后过滤除去。
答:偏低等当量的硫酸银溶液AgCl7、酚二磺酸光度法测定NO3-—N时,常见的干扰有、、、和。
答:氯化物亚硝酸盐铵盐有机物碳酸盐8、镉柱还原法测定NO3-—N的常见干扰有、,消除办法是,。
答:悬浮物较高含量的铜、铁等金属离子前者采取过滤法后者加入乙二胺四乙酸二钠予以消除9、为使硝酸盐标准贮备液有一定的稳定时间,需在溶液中加入作保存剂,至少可稳定。
答:2ml氯仿(三氯甲烷)6个月10、酚二磺酸法测定水中硝酸盐氮,须注意水样置于上蒸干,为使反应完全必须。
去除Cl -干扰时,严禁过量。
答:水浴充分研磨 Ag2SO411、制备酚二磺酸试剂时,如果用发烟硫酸则在沸水浴中加热小时,如用浓硫酸应加热小时。

高考化学专题复习—硝酸盐A组1.中国古代四大发明之一的黑火药,其主要成分中作氧化剂的是A 硝酸钾B 木炭C 硫黄D 氧气2.Cu(NO3)2 受热分解的方程式为2Cu(NO3)2=2CuO+4NO2↑+O2↑,将所得气体充满一干燥烧瓶(标准状况),再将烧瓶倒置于水中,过较长时间后,烧瓶中溶液的物质的量浓度可能为(假设烧瓶中的溶质不扩散到外面)A 1/28mol/LB 1/14mol/LC 0mol/LD 1/22.4mol/L3.某常见二价金属的硝酸盐R(NO3)2 受热分解后,将所得气体充满一干燥烧瓶(标准状况),再将烧瓶倒置于水中,过较长时间后,烧瓶中溶液的物质的量浓度可能为(假设烧瓶中的溶质不扩散到外面)A 1/28mol/LB 1/14mol/LC 0mol/LD 0.8mol/L4.AgNO3与NaHCO3的混合物5.08g,在500℃加热到不再放出气体为止,冷却,再加足量稀硝酸,然后把溶液蒸干,得无水盐5.1g,原混合物中AgNO3的质量是A 1.84gB 1.68gC 1.7gD 3.4g5.为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。
(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。
(如图)回答下面问题:(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是。
(2)液体X可能是;气体Y可能是。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意,理由是。
(4)用简单的实验证实(2)中的判断①对X的判断②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)6.把Cu(NO3)2固体受热分解所产生的气体在标准状况下充满一只烧瓶,把烧瓶倒置水中,瓶内液面逐渐上升。
假设烧瓶内溶质不扩散到外面的水中,最终烧瓶内溶液的物质的量浓度是。
水和废水(电化学法氯化物、硝酸盐氮)环境监测上岗证考核习题一、填空题1.离子选择电极-流动注射法测定水中氯化物和硝酸盐氮的工作原理是:试液与分别由蠕动泵引入系统,经过一个三通管混合后进入流通池,由流通池喷嘴口喷出,与固定在流通池内的电极接触,该电极与固定在流通池内的参比电极即产生电动势,该电动势随试液中氯离子或硝酸盐氮浓度的变化而变化。
答案:离子强度调节剂离子选择性2.离子选择电极-流动注射法测定水中氯化物时,硫化物的干扰可加入少量的消除。
答案:硝酸铅NO的干扰可加入少量消3.离子选择电极-流动注射法测定水中硝酸盐氮时, 2除。
答案:氨基磺酸4.离子选择电极-流动注射法测定水中氯化物时,应用1%HN03或1%NaOH控制水样pH值在之间。
答案:4.0~8.55.离子选择电极-流动注射法测定水中硝酸盐氮时,应用1%H2S04或1%NaOH控制水样pH值在之间。
答案:2~8二、判断题1.离子选择电极—流动注射法测定水中氯化物时,钾离子、钠离子干扰测定。
()答案:错误正确答案为:离子选择电极—流动注射法测定水中氯化物时,钾离子、钠离子不干扰测定。
2.离子选择电极-流动注射法测定水中硝酸盐氮时,钙离子、镁离子干扰测定。
()答案:错误正确答案为:离子选择电极-流动注射法测定水中硝酸盐氮时,钙离子、镁离子不干扰测定。
3.离子选择电极—流动注射法测定水中氯化物和硝酸盐氮的过程中,如遇气泡聚积在电极表面,应去除,否则影响测定。
()答案:正确4.离子选择电极-流动注射法测定氯化物时,若发现敏感膜表面磨损或沾污,应在细金相砂纸上抛光。
()答案:正确三、选择题1.离子选择电极—流动注射法测定水中氯化物的检出限为mg/L。
() A.0.2B.0.5C.0.7D.0.9答案:D2.离子选择电极—流动注射法测定水中硝酸盐氮的检出限为mg/L。
() A.0.2B.0.5C.0.7D.0.9答案:A3.离子选择电极—流动注射法测定水中氯化物,电极在使用前必须先活化。
亚硝酸盐氮复习题及参考答案(21题)参考资料1、《水环境分析方法标准工作手册》(上册)P175水质亚硝酸盐氮的测定分光光度法GB7493—872、《水和废水监测分析方法指南》上册3、《水和废水监测分析方法》第三版一、填空题1.亚硝酸盐是循环的中间产物,亚硝酸盐在水系中很不稳定,在作用下,可氧化成硝酸盐,在也被还原为氨。
答:氮含氧和微生物缺氧或无氧条件下。
《水和废水监测分析方法指南》上册,P1682.水中亚硝酸盐的主要来源为生活污水中。
此外、等工业废水和,亦可有亚硝酸盐带入水系。
答:含氮有机物的分解化肥酸洗农田排水《水和废水监测分析方法指南》上册,P1683.测定亚硝酸盐的水样应用或瓶采集。
采集后要尽快分析,不要超过小时,若需短期保存,可以在每升水样中加入并保存于。
答:玻璃瓶塑料瓶24小时40mg氯化汞2-5℃《水环境分析方法标准工作手册》(上册)P1784.水中亚硝酸盐很不稳定,采样后应尽快分析,必要时以冷藏抑制的影响。
答:微生物《水和废水监测分析方法》第三版,P2605.测定亚硝酸盐氮的水样中有悬浮物和颜色,需加和消除。
若仍有颜色,则应进行校正。
答:氢氧化铝悬浮液过滤色度《水环境分析方法标准工作手册》(上册)P175、1786.用重氮偶联反应测定水中亚硝酸盐的干扰物质为。
答:氯胺、氯、硫代硫酸盐、聚磷酸钠和高铁离子《水环境分析方法标准工作手册》(上册)P1757.N-(1-萘基)-乙二胺光度法测定亚硝酸盐氮,采用光程长为10mm,测试体积为550ml,以吸光度0.01单位所对应的浓度值为最低检出浓度。
此值为mg/L,测定上限为mg/L。
答:0.003 0.20《水环境分析方法标准工作手册》(上册)P1758.如若摄入亚硝酸盐后,经肠道中微生物作用转变成,出现毒性作用,国家生活饮用水卫生标准中NO3-N含量限制在mg/L以内。
答:亚硝酸盐20《水和废水监测分析方法》第三版P266、5759.分光光度法测定水中亚硝酸盐氮,通常是基于重氮–偶联反应,生成色染料。
总氮复习题及参考答案(5题)(过硫酸钾氧化—紫外分光光度法)参考资料《水和废水监测分析方法》第三版一、填空题总氮测定方法,通常采取分别测定和(、和)后,办法。
或以,使有机氮和无机氮化物转变为后,再以或还原为后,用,以及进行测定。
答:有机氮无机氮化合物氨氮亚硝酸盐氮硝酸盐氮加和的过硫酸钾氧化硝酸盐紫外法亚硝酸盐偶氮比色法离子色谱法《水和废水监测分析方法》第三版,P2782、紫外分光光度法测定总氮用的玻璃器皿可用浸洗,用冲洗后,再用冲洗。
测定较多的水样,在过硫酸钾氧化后可能出现,遇此情况,进行紫外分光光度法测定。
测定时参考吸光度的比值应小于,否则应予。
答:10%盐酸蒸馏水无氨水悬浮物沉淀可吸取氧化后的上清液A220/A275×100% 20% 鉴别《水和废水监测分析方法》第三版,P280二、问答题3、试述过硫酸钾氧化—紫外分光光度法测定水中总氮的原理。
答:在120℃—124℃的碱性介质条件下,用过硫酸钾作氧化剂,不仅可将水样中的氨氮和亚硝酸盐氮氧化为硝酸盐,同时将水样中大部分有机氮化合物氧化为硝酸盐。
而后,用紫外分光光度法分别于波长220nm与275nm处测定其吸光度,按下式计算硝酸盐氮的吸光度:A= A220-2A275从而计算总氮的含量。
其摩尔吸光系数为1.47×103。
《水和废水监测分析方法》第三版,P2784、过硫酸钾氧化—紫外分光光度法测定水中总氮的主要干扰物有哪些?如何消除?答:(1)水样中含有六价铬离子及三价铁离子时,可加入5%盐酸羟胺溶液1-2ml,以消除其对测定的影响。
(2)碘离子及溴离子对测定有干扰。
测定20μg硝酸盐氮时,碘离子含量相对于总氮含量的0.2倍时无干扰。
溴离子含量相对于总氮含量的3.4倍时无干扰。
(3)碳酸盐及碳酸氢盐对测定的影响,在加入一定量的盐酸后可消除。
《水和废水监测分析方法》第三版,P2785、过硫酸钾氧化—紫外分光光度法测定水中总氮,为什么要在两个波长测定吸光度?答:因为过硫酸钾将水样中的氨氮、亚硝酸盐氮及大部分有机氮化合物氧化为硝酸盐。
高考化学易错题专题复习-氮及其化合物练习题附答案一、氮及其化合物练习题(含详细答案解析)1.硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。
试回答下列问题:(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。
上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672【解析】【详解】(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×12=0.25mol,质量为40g;(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为0.3mol10×22.4L·mol-1=0.672L=672mL。
硝酸盐氮复习题及参考答案(25题)参考资料1、《水环境分析方法标准工作手册》(上册)P91水质硝酸盐氮的测定酚二磺酸分光光度法GB7480-87紫外分光光度法《水和废水监测分析方法》第四版2、《环境监测机构计量认证和创建优质实验室指南》3、《水和废水监测分析方法》第三版4、《水和废水监测分析方法指南》(上册)一、填空题1、水中硝酸盐是在有环境下,各种形态的含氮化合物中最化合物,亦是含氮有机物经作用的分解产物。
人摄入硝酸盐后对人体有害,国家《生活饮用水卫生标准》中硝酸盐(以氮计)的含量限制在以下。
答:氧稳定的氮无机化最终阶段20mg/L《水和废水监测分析方法》第三版,P266、5752、废水、废水、的出水和可含大量的硝酸盐。
答:制革酸洗某些生化处理设施农田排水《水和废水监测分析方法》第三版,P2663、我国环境监测中推荐测定水中硝酸盐氮的方法有:测量范围较宽的法、适于测定水中低含量的法、适于严重污染并带深色的方法是法,还有法、法和法。
国家标准分析方法是法。
答:酚二磺酸分光光度镉柱还原戴氏合金还原离子色谱紫外电极酚二磺酸光度法《水和废水监测分析方法》第三版,P266《水环境分析方法标准工作手册》(上册),P914、水样采集后应测定。
必要时,应加使pH ,保存在℃以下,在内进行测定。
答:及时进行硫酸<2 4 24h《水和废水监测分析方法》第三版,P2665、酚二磺酸光度法测定水中硝酸盐氮,当水样中亚硝酸盐氮含量超过0.2mg/L时,可取水样,加入,混匀后,滴加至淡红色,保持15分钟不褪为止,使亚硝酸盐氧化为硝酸盐,最后从硝酸盐氮测定结果中减去亚硝酸盐氮量。
答:100ml 1ml 0.5mol/L的硫酸溶液高锰酸钾溶液《水环境分析方法标准工作手册》(上册)P936、若水样中含有氯离子较多(10mg/L),用酚二磺酸法测定硝酸盐氮,会使测定结果,可以加入使生成后过滤除去。
答:偏低等当量的硫酸银溶液AgCl《水和废水监测分析方法指南》(上册)P165-1667、酚二磺酸光度法测定NO3-—N时,常见的干扰有、、、和。
答:氯化物亚硝酸盐铵盐有机物碳酸盐《水环境分析方法标准工作手册》(上册)P918、镉柱还原法测定NO3-—N的常见干扰有、,消除办法是,。
答:悬浮物较高含量的铜、铁等金属离子前者采取过滤法后者加入乙二胺四乙酸二钠予以消除《水和废水监测分析方法》第三版,P2699、为使硝酸盐标准贮备液有一定的稳定时间,需在溶液中加入作保存剂,至少可稳定。
答:2ml氯仿(三氯甲烷)6个月《水和废水监测分析方法》第三版,P26710、酚二磺酸法测定水中硝酸盐氮,须注意水样置于上蒸干,为使反应完全必须。
去除Cl-干扰时,严禁过量。
答:水浴充分研磨Ag2SO4《环境监测机构计量认证和创建优质实验室指南》P320、321(9)11、制备酚二磺酸试剂时,如果用发烟硫酸则在沸水浴中加热小时,如用浓硫酸应加热小时。
制备好的酚二磺酸应贮存于瓶中,保存时注意否则使测定结果偏低。
答:2 6 密塞棕色防止吸收空气中的水分《环境监测机构计量认证和创建优质实验室指南》P319、321(8)二、判断题(正确的打√,错误的打×)12、酚二磺酸法测定NO3-—N,测定过程中,蒸发的操作是吸取50.0ml经预处理的水样于蒸发皿中,置于水浴上蒸干。
()答:√《水和废水监测分析方法》第三版P26813、水样蒸干后,加入酚二磺酸试剂,充分研磨使反应完全。
()答:√《水和废水监测分析方法》第三版P26814、用酚二磺酸法测定水样中NO3-—N时,可加3-5ml氨水显色。
()答:×(加氨水至有明显的氨味,黄色稳定,一般不应超过3ml。
)《环境监测机构计量认证和创建优质实验室指南》P319、320(5-1)15、用酚二磺酸法测定含Cl-58mg/L的中等硬度地面水中的硝酸盐含量,需加AgNO3全部除去Cl-。
()答:×(用Ag2SO4,保留小于1mg/L的Cl-浓度,过量的Ag+干扰测定。
)《环境监测机构计量认证和创建优质实验室指南》P319、321(5-3)16、紫外法测定水中硝酸盐氮,需在250nm波长和300nm波长处测定吸光度,以校正硝酸盐氮值。
()答:×(220nm处、275nm处)《水和废水监测分析方法》第三版P27217、制备标准曲线时,将一定量标准溶液预先一次统一处理(蒸干、加酚二磺酸充分研磨,转入容量瓶内定容)备用。
()答:√《水和废水监测分析方法》第三版P267三、问答题18、简述酚二磺酸分光光度法测定NO3-—N的原理。
答:硝酸盐在无水情况下与酚二磺酸反应,生成硝基二磺酸酚,在碱性溶液中,生成黄色化合物,于410nm波长处进行分光光度测定。
《水环境分析方法标准工作手册》(上册)P91《水和废水监测分析方法》第三版P26619、简述镉柱还原法测定NO3-—N的原理。
答:在一定条件下,水样通过镉还原柱,使硝酸盐还原为亚硝酸盐,然后以重氮—偶联反应进行测定。
存在于水样中的亚硝酸盐,由测定不经镉柱还原的水样来作校正。
《水和废水监测分析方法》第三版P26920、简述戴氏合金还原法测定NO3-—N的原理。
答:水样在碱性介质中,硝酸盐可被还原剂(戴氏合金)在加热情况下定量还原为氨,经蒸馏出后被吸收于硼酸溶液中,用纳氏试剂光度法或酸滴定法测定。
《水和废水监测分析方法》第三版P27121、简述紫外分光光度法测定NO3-—N的原理。
答:利用硝酸根离子在220nm波长处的吸收而定量测定NO3-—N。
溶液的有机物等干扰物质在220nm处也会有吸收,而硝酸根离子在275nm处没有吸收。
因此,在275nm 处作另一次测量,以校正硝酸盐氮值。
《水和废水监测分析方法》第三版P27222、酚二磺酸法测定NO3-—N,水样色度应如何处理?答:每100ml水样中加入2ml氢氧化铝悬浮液,密塞充分振摇,静置数分钟澄清后,过滤,弃去最初滤液的液的20ml。
《水环境分析方法标准工作手册》(上册)P9323、酚二磺酸法测定NO3-—N,其标准使用液的配制与一般标准使用液的配制有何不同?答:不同点在于:一般标准使用液采用直接法配制,而酚二磺酸法测定硝酸盐氮的标准使用液需将NO3-—N标准贮备液与酚二磺酸在蒸干的条件下反应,生成硝基二磺酸酚后,经稀释而得到。
《水和废水监测分析方法》第三版P26724、酚二磺酸光度法测定NO3-—N,在制备硝酸盐标准溶液时,应同时制备两份,为什么?答:标准溶液同时制备两份,用以检查硝化是否完全。
如发现两份浓度有差异时,应重新吸取标准贮备液进行制备。
《水和废水监测分析方法》第三版P267四、计算题25、用酚二磺酸法测定水中硝酸盐氮时,取10.0ml水样,测得吸光度为0.176。
校准曲线的回归方程为y=0.0149x+0.004(x 为50ml水中NO3-—N微克数),求水样中NO3-—N和NO-3的浓度。
答:NO3-—N浓度为1.15mg/L;NO-3浓度为5.09 mg/L。
《环境监测机构计量认证和创建优质实验室指南》P320、321(13)硝酸盐氮复习题及参考答案(20题)参考资料1、《水环境分析方法标准工作手册》(上册)P91水质硝酸盐氮的测定酚二磺酸分光光度法GB7480-87紫外分光光度法《水和废水监测分析方法》第四版2、《环境监测机构计量认证和创建优质实验室指南》3、《水和废水监测分析方法》第三版4、《水和废水监测分析方法指南》(上册)一、填空题1、水中硝酸盐是在有环境下,各种形态的含氮化合物中最化合物,亦是含氮有机物经作用的分解产物。
人摄入硝酸盐后对人体有害,国家《生活饮用水卫生标准》中硝酸盐(以氮计)的含量限制在以下。
答:氧稳定的氮无机化最终阶段20mg/L《水和废水监测分析方法》第三版,P266、5752、废水、废水、的出水和可含大量的硝酸盐。
答:制革酸洗某些生化处理设施农田排水《水和废水监测分析方法》第三版,P2663、我国环境监测中推荐测定水中硝酸盐氮的方法有:测量范围较宽的法、适于测定水中低含量的法、适于严重污染并带深色的方法是法,还有法、法和法。
国家标准分析方法是法。
答:酚二磺酸分光光度镉柱还原戴氏合金还原离子色谱紫外电极酚二磺酸光度法《水和废水监测分析方法》第三版,P266《水环境分析方法标准工作手册》(上册),P914、水样采集后应测定。
必要时,应加使pH ,保存在℃以下,在内进行测定。
答:及时进行硫酸<2 4 24h《水和废水监测分析方法》第三版,P2665、若水样中含有氯离子较多(10mg/L),用酚二磺酸法测定硝酸盐氮,会使测定结果,可以加入使生成后过滤除去。
答:偏低等当量的硫酸银溶液AgCl《水和废水监测分析方法指南》(上册)P165-1666、酚二磺酸光度法测定NO3-—N时,常见的干扰有、、、和。
答:氯化物亚硝酸盐铵盐有机物碳酸盐《水环境分析方法标准工作手册》(上册)P917、镉柱还原法测定NO3-—N的常见干扰有、,消除办法是,。
答:悬浮物较高含量的铜、铁等金属离子前者采取过滤法后者加入乙二胺四乙酸二钠予以消除《水和废水监测分析方法》第三版,P2698、为使硝酸盐标准贮备液有一定的稳定时间,需在溶液中加入作保存剂,至少可稳定。
答:2ml氯仿(三氯甲烷)6个月《水和废水监测分析方法》第三版,P2679、酚二磺酸法测定水中硝酸盐氮,须注意水样置于上蒸干,为使反应完全必须。
去除Cl-干扰时,严禁过量。
答:水浴充分研磨Ag2SO4《环境监测机构计量认证和创建优质实验室指南》P320、321(9)10、制备酚二磺酸试剂时,如果用发烟硫酸则在沸水浴中加热小时,如用浓硫酸应加热小时。
制备好的酚二磺酸应贮存于瓶中,保存时注意否则使测定结果偏低。
答:2 6 密塞棕色防止吸收空气中的水分《环境监测机构计量认证和创建优质实验室指南》P319、321(8)二、判断题(正确的打√,错误的打×)11、酚二磺酸法测定NO3-—N,测定过程中,蒸发的操作是吸取50.0ml经预处理的水样于蒸发皿中,置于水浴上蒸干。
()答:√《水和废水监测分析方法》第三版P26812、水样蒸干后,加入酚二磺酸试剂,充分研磨使反应完全。
()答:√《水和废水监测分析方法》第三版P26813、用酚二磺酸法测定水样中NO3-—N时,可加3-5ml氨水显色。
()答:×(加氨水至有明显的氨味,黄色稳定,一般不应超过3ml。
)《环境监测机构计量认证和创建优质实验室指南》P319、320(5-1)14、紫外法测定水中硝酸盐氮,需在250nm波长和300nm波长处测定吸光度,以校正硝酸盐氮值。
()答:×(220nm处、275nm处)《水和废水监测分析方法》第三版P27215、制备标准曲线时,将一定量标准溶液预先一次统一处理(蒸干、加酚二磺酸充分研磨,转入容量瓶内定容)备用。