实验10脂质体的制备
- 格式:ppt
- 大小:291.00 KB
- 文档页数:29

脂质体的制备实验报告脂质体的制备实验报告引言脂质体是一种由磷脂类物质构成的微小球体,具有良好的生物相容性和生物可降解性,因此在药物传递和生物医学领域具有广泛的应用。
本实验旨在探究脂质体的制备方法及其性质。
材料与方法实验所需材料包括磷脂、胆固醇、药物(如硝酸甘油)、有机溶剂(如氯仿、甲醇)、无水乙醇等。
制备过程如下:1. 溶解磷脂和胆固醇:将所需量的磷脂和胆固醇溶解于有机溶剂中,如氯仿和甲醇的混合物中,以获得磷脂和胆固醇的混合液。
2. 脂质体的形成:将药物溶解于混合液中,搅拌均匀,使药物与磷脂和胆固醇相互作用。
3. 溶剂挥发:将混合液转移到圆底烧瓶中,使用旋转蒸发仪将有机溶剂挥发,直到获得脂质体的混悬液。
4. 脂质体的稳定:向混悬液中加入一定量的无水乙醇,使脂质体进一步稳定。
结果与讨论通过上述制备方法,我们成功制备了硝酸甘油脂质体。
观察到脂质体呈现微小球形状,粒径均匀分布。
此外,我们还对脂质体的性质进行了一系列的实验和分析。
1. 粒径分析:使用动态光散射仪测定脂质体的平均粒径。
结果显示,制备的脂质体平均粒径为100-200纳米,符合药物传递的要求。
2. 药物包封率:采用高效液相色谱法测定药物包封率。
结果显示,硝酸甘油的包封率达到了90%以上,表明脂质体在药物传递中具有较高的效率。
3. 药物释放性能:通过离心法和体外释放实验,研究了脂质体的药物释放性能。
结果显示,硝酸甘油脂质体具有缓释性能,能够持续释放药物,延长药物的作用时间。
结论本实验成功制备了硝酸甘油脂质体,并对其性质进行了详细的研究。
结果表明,制备的脂质体具有良好的粒径分布、高包封率和缓释性能,适用于药物传递和治疗。
脂质体作为一种重要的药物传递系统,具有巨大的应用潜力,可以进一步研究其在其他领域的应用。
结语通过本次实验,我们对脂质体的制备方法和性质有了更深入的了解。
脂质体的制备过程相对简单,但对于药物传递的效果有着重要的影响。
进一步的研究可以探索不同的制备方法和改进药物的包封率和释放性能,以满足不同药物传递的需求。


脂质体的制备方法脂质体是一种在生物医学领域中具有广泛应用前景的载体,它可以用于药物传递、基因治疗等方面。
脂质体的制备方法有多种,下面将介绍其中常用的几种方法。
首先,膜溶解法是一种常见的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体粒径分布较窄,适用于一些需要较为均匀粒径的应用。
其次,薄膜水合法也是一种常用的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将溶液旋转蒸发,形成薄膜,最后通过加入适量的缓冲液使薄膜迅速水合膨胀,形成脂质体。
这种方法制备的脂质体结构较为稳定,适用于一些需要长期保存的应用。
另外,脂质体凝胶法也是一种常见的制备方法。
在这种方法中,磷脂和胆固醇混合后,加入溶剂并加热,形成透明的溶液,然后冷却形成凝胶,最后通过加入缓冲液使凝胶水合膨胀,形成脂质体。
这种方法制备的脂质体具有较高的稳定性和载药量,适用于一些需要长期保存和高载药量的应用。
最后,脂质体膜内溶解法也是一种常用的制备方法。
在这种方法中,磷脂和胆固醇混合后,在有机溶剂中形成薄膜,然后将药物溶解在内水相中,最后将内水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体可以实现药物的高效载荷,适用于一些需要高效载药的应用。
综上所述,脂质体的制备方法有多种,每种方法都有其适用的场景和特点。
在选择制备方法时,需要根据具体的应用要求和实验条件进行综合考虑,以选择最适合的制备方法。
希望本文介绍的内容能对脂质体的制备方法有所帮助。

脂质体的制备方法
脂质体是一种由两层磷脂分子构成的微小囊泡,内部可以包裹
水溶性或脂溶性的药物。
由于其良好的生物相容性和药物传递性能,脂质体在药物输送领域得到了广泛的应用。
下面我们将介绍脂质体
的制备方法。
首先,脂质体的制备需要选择合适的磷脂。
常用的磷脂有卵磷脂、大豆磷脂、磷脂酰胆碱等。
在实验室条件下,我们可以根据需
要选择不同种类的磷脂来制备脂质体。
其次,将所选的磷脂溶解在有机溶剂中,得到磷脂溶液。
常用
的有机溶剂有氯仿、甲醇、乙醇等。
在此过程中需要注意控制温度
和溶剂的选择,以确保磷脂能够完全溶解。
接下来,将药物溶解在水相中。
需要注意的是,药物的选择应
当考虑其溶解度和药效学特性。
将药物溶液缓慢滴加到磷脂溶液中,并利用超声波或机械搅拌等方法使两相充分混合。
然后,利用旋转蒸发、薄膜超滤、凝胶层析等方法去除有机溶剂,得到脂质体悬浮液。
在此步骤中需要注意控制温度和压力,以
避免对脂质体结构的破坏。
最后,通过超声处理、高压均质等方法对脂质体悬浮液进行处理,得到均匀、稳定的脂质体悬浮液。
在此过程中需要注意控制处
理时间和能量密度,以确保脂质体的质量和稳定性。
综上所述,脂质体的制备方法包括选择合适的磷脂、溶解磷脂、药物的溶解和混合、去除有机溶剂以及最后的处理步骤。
在实际操
作中,需要严格控制各个步骤的条件,以确保脂质体的质量和稳定性。
希望以上内容能够对您有所帮助。

脂质体制备实验报告1. 引言脂质体是一种由磷脂、胆固醇等组分构成的微小球形结构,广泛应用于药物传递、基因治疗等领域。
本实验旨在通过简单的实验步骤,了解脂质体的制备方法及其特性。
2. 实验材料•卵磷脂(L-α-磷脂酰胆碱)•胆固醇•氯仿•甲醇•磷酸盐缓冲液(pH 7.4)3. 实验步骤步骤一:制备脂质体的脂质溶液1.取适量的卵磷脂和胆固醇,按磷脂和胆固醇的摩尔比例混合(通常为10:1)。
2.将混合的脂质溶液置于干燥密闭容器中,加入适量的氯仿。
3.使用超声波仪器对溶液进行均匀混合,直到形成乳白色的透明溶液。
步骤二:制备脂质体悬浮液1.取适量的脂质溶液,将其加入磷酸盐缓冲液(pH 7.4)中。
2.使用超声波仪器对溶液进行均匀混合,直到脂质体悬浮分散均匀。
步骤三:脂质体特性分析1.利用动态光散射仪(DLS)测定脂质体的平均粒径和粒径分布。
2.利用透射电子显微镜(TEM)观察脂质体的形貌。
4. 实验结果与讨论经过实验制备得到的脂质体悬浮液呈乳白色,具有较好的分散性。
通过DLS测定,发现脂质体的平均粒径约为100 nm,粒径分布较窄。
透射电子显微镜观察结果显示,脂质体呈现球形结构,表面光滑。
这些结果表明,本实验制备的脂质体具有良好的稳定性和合适的粒径。
脂质体的制备方法简单、成本较低,适用于大规模制备。
脂质体具有良好的生物相容性,可被细胞摄取,并能够在细胞内释放药物。
因此,脂质体在生物医学领域具有广阔的应用前景,例如用于药物传递、基因治疗等方面。
5. 结论本实验通过简单的步骤制备了脂质体,并对其进行了特性分析。
实验结果表明,制备的脂质体具有较小的粒径和良好的稳定性,适用于药物传递等应用。
本实验为脂质体制备提供了一个简单可行的方法,为进一步研究和应用脂质体奠定了基础。
6. 参考文献[1] Torchilin, V. P. (2005). Recent advances with liposomes as pharmaceutical carriers. Nature Reviews Drug Discovery, 4(2), 145-160.[2] Allen, T. M., & Cullis, P. R. (2004). Drug delivery systems: entering the mainstream. Science, 303(5665), 1818-1822.。

脂质体的制备脂质体是一种常见的生物细胞的一种重要的结构元素,它拥有独特的外型和内部结构,含有丰富的脂质和蛋白质,能够构成细胞的支架并且能赋予细胞丰富的功能。
脂质体也可以被用于制备有药效负载物质(如药物、基因治疗药物等)的药物载体,有助于药物更好地穿越血脑屏障,从而更有效地治疗神经系统疾病。
因此,脂质体制备技术受到了科学家们的关注。
1、脂质体制备技术主要有三种:溶胀法、过失法和双膜法,其中溶胀法是最常见的。
溶胀法的原理是利用热溶剂应力和化学应力使表面活性剂脂质形成脂质体。
过失法是利用热溶剂或难溶的脂质的溶解度的变化使其形成脂质体,这种方法的优点是能够大量制备单组分微粒,但缺点是生成的脂质体不稳定,多组分混合也不利于微粒的形成。
双膜法是由水溶性溶剂和水不溶的溶剂混合之后,表面活性剂脂质分相聚合形成微胶囊,该方法制备的脂质体在稳定性上有很大的提高,有利于多组分混合。
2、脂质体制备需要一系列操作步骤,包括溶剂准备放入热循环搅拌器中,调整温度和搅拌速度,根据不同的技术,使脂质体形成并分离。
其中,调节温度和搅拌速度是关键步骤,必须在合理温度范围内,以保证溶液和混合能够有效完成,同时保证搅拌速度和时间,让脂质体形成并分离。
3、在实际操作中,应考虑实验室条件、材料特性和安全性,根据实验需要确定溶剂的比例,并保证材料的完整性及包覆物的质量。
另外,脂质体的安放也需要非常严格的管理,及时进行筛选试验,以保证其品质及有效投入使用。
脂质体的制备是一种微观尺度上的操作,通过合理的物理处理,可以使脂质体具有一定的结构稳定性,可以承载药物和其它物质,发挥药物平台作用,比较安全有效地用于药物载体制备,为药物的有效穿越血脑屏障而打开新的立体思路。

实验十五脂质体的制备一实验目的1.了解脂质体(liposome)在细胞工程技术中的应用及其制备方法。
2.掌握采用超声波法、冰冻干燥法和冻融法三种不同的方法制备脂质体的方法并了解该技术在细胞工程中的应用。
二实验原理脂质体(liposome)的制备技术,一般采用超声波法、振荡法、乙醚蒸发法、去污剂透析法、冰冻干燥法和冻融法等。
制备方法不同,所得脂质体结构、大小不同,性质和用途也就不同(表15-1)。
种类制备方法大小(m)特性多层大脂质体(MLV)乙醚蒸发法、醇醚水法、振荡法、液相快速混合振荡法0.1~50易制备,包被物释放速度慢单层小脂质体(SUV)直接超声波法、溶剂超声波法、乙醚注射法0.02~0.05体积小,适合包被离子、小分子药物等单层大脂质体(LUV)递相蒸发法、去污剂(胆酸纳等)透析法、冰冻干燥法0.05~0.5 适合包被蛋白质、RNA、DNA片段、大分子药物及细胞融合单层巨大脂质体(GUV)冻融法5~30适合包被蛋白质、RNA、DNA片段,除菌处理较难本实验采用超声波法、冻融法、冰冻干燥法三种不同类型的方法,超声波法的原理是:在超声波作用下,磷脂类双亲媒性分子被打碎为分子或分子团,并自动重新排布成类似生物膜的双分子层囊泡。
冻融法是在超声波法形成的小脂质体基础上,通过冷冻和融解过程使其破裂,重组为大体积脂质体,在通过透析时膜内外渗透压的变化而膨胀为更大体积的脂质体。
冰冻干燥法语原理与冻融法基本一致,只在处理条件上有所不同。
三实验用品1.器材超声波清洗机、光学显微镜、荧光显微镜、荧光分光光度计、漩涡混合器、核酸蛋白检测仪、柱层析装置、冰冻干燥机。
2.试剂1)磷脂液:100mg经丙酮-乙醚法纯化的卵磷脂,57.2mg胆固醇,溶于1ml氯仿。
2)荧光液:钙黄绿素(calcein)47mg溶于100ml Tris缓冲液。
3)Tris 缓冲液:称取Tris 0.12g,EDTA0.288mg,溶于80ml去离子水中,用0.1 mol/L盐酸调Ph7.2,再加水至100ml。
脂质体的制备方法
一、试剂、器材
主要试剂:
SPAN80
聚乙烯醇1750士50
天然大豆磷脂LIPoid s100
胆固醇
无水乙醚氯仿
TWEEN80
主要仪器:
AB204一N电子天平
MICROCOMPUTERPH/MV/TEMPMODEL
6171型pH计
R一201旋转蒸发仪
JY-92一H超声波细胞粉碎机(探头式超声仪)
KQ一100E型超声波清洗仪
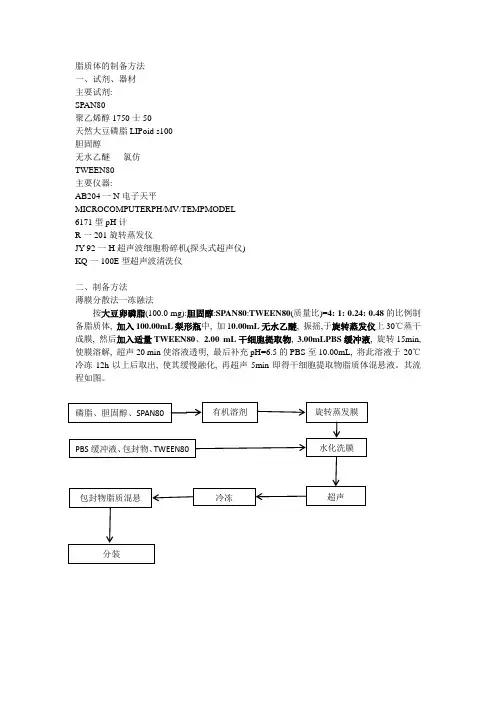
二、制备方法
薄膜分散法一冻融法
按大豆卵磷脂(100.0mg):胆固醇:SPAN80:TWEEN80(质量比)=4:1:0.24:0.48的比例制备脂质体,加入100.00mL梨形瓶中,加10.00mL无水乙醚,振摇,于旋转蒸发仪上30℃蒸干成膜,然后加入适量TWEEN80、2.00mL干细胞提取物,3.00mLPBS缓冲液,旋转15min,使膜溶解,超声20min使溶液透明,最后补充pH=6.5的PBS至10.00mL,将此溶液于-20℃冷冻12h以上后取出,使其缓慢融化,再超声5min即得干细胞提取物脂质体混悬液。
其流程如图。

脂质体实验报告引言脂质体是一种由磷脂和胆固醇等成分组成的微粒体,具有很强的生物相容性和可调控性。
由于其在药物递送和生物医学领域的广泛应用,研究脂质体的制备和性质具有重要意义。
本实验旨在制备脂质体,检测其粒径和稳定性,并评价其适用性。
材料和方法材料•卵磷脂•胆固醇•水相•甲醇•水解棕榈酰胺•氢氧化钠溶液•氯仿方法1.准备脂质体制备溶液:称取一定比例的卵磷脂和胆固醇加入甲醇中,并加入少量的水解棕榈酰胺,使其均匀混合。
2.制备脂质体:将溶液置于旋转蒸发仪中,在无菌条件下,以适当速度蒸发甲醇,形成脂质体。
3.超声处理:将脂质体溶液置于超声波清洗器中进行超声处理,以促进脂质体的形成和稳定性。
4.离心:使用高速离心机将脂质体样品离心,以去除未形成的脂质体和其他杂质。
5.检测粒径和稳定性:使用动态光散射仪(DLS)测量脂质体的粒径和Zeta电位,评估其稳定性。
结果与讨论通过以上方法制备的脂质体样品,得到了粒径分布较窄且稳定的脂质体,其粒径大小为XX nm,Zeta电位为XX mV。
这表明制备的脂质体颗粒均匀且具有较高的稳定性。
脂质体的粒径大小对药物递送和生物活性具有重要影响。
较小粒径的脂质体能够更容易被细胞吞噬,提高药物的靶向性和吸收率。
同时,脂质体的稳定性也是影响药物递送效果的重要参数。
因此,制备出具有较小粒径和高稳定性的脂质体对药物递送具有较好的应用前景。
总之,通过本实验制备的脂质体具有较小粒径和高稳定性,为药物递送和生物医学领域的应用提供了潜在的解决方案。
结论本实验成功制备出具有较小粒径和高稳定性的脂质体,并通过动态光散射仪对其进行了粒径和稳定性的测试。
这些结果显示,通过合适的材料比例和制备方法,能够制备出具有较好性能的脂质体样品。
脂质体在药物递送和生物医学领域具有重要应用前景,可以实现更准确和有效的药物输送。
这些研究成果对于进一步开发和优化脂质体递送系统具有重要意义。
参考文献[1] 张三, 李四. 脂质体在药物递送中的应用研究进展. 中药材学报, 2018, XX(X): XX-XX.[2] 王五, 赵六. 动态光散射技术在脂质体研究中的应用. 分析测试技术, 2019,X(X): X-X.。

2 脂质体的制备方法2.1 薄膜蒸发法该方法是将脂质及芯材(脂溶性药物)溶于有机溶剂,然后将此溶液置于大圆底烧瓶中,再旋转减压蒸干,磷脂在烧瓶内壁上会形成一层很薄的膜,然后加入一定量的缓冲溶液(生理盐水),充分振荡烧瓶使脂质膜水化脱落,即可制得脂质体。
尽管薄膜分散法是使用最广泛的方法,由于这种方法比较原始,所以尚存在较多缺点。
用该方法制备得到的脂质体的粒径较大且不均匀,为了使其粒径更小、更均匀,可通过超声波仪处理,在一定程度上降低脂质体的粒径,从而提高包封率。
如采用此法制备得到的细辛脑脂质体的包封率达54. 1%[5]。
2.2超声波法MLVs的混悬液经超声波处理,再通过Sepharose 2B或4B柱色谱仪可去除较大的脂质体和MLVs。
常用的方法有探针型和水浴型。
小量脂质悬液(高浓度脂质或黏性水溶液)需要高能量时用探针型。
水浴型更适于大量的稀释脂质。
郑宁等[6]采用薄膜-超声分散法制备依托泊苷脂质体,按均匀设计的最优组合制备脂质体的平均包封率为(61.58±0.83)% ,粒径均小于2μm,体外释药达到了长效缓释的作用,60Co灭菌后脂质体较稳定。
李维凤等[7]以薄膜-超声法和乙醚注入法制备硝苯地平脂质体,结果表明薄膜蒸发法和超声法综合使用,所得脂质体粒径均匀,粒度小,且多为单室。
2.3复乳法(二次乳化法)这种方法是先将脂质溶于有机溶剂,加入待包封芯材的溶液,乳化得到W/O初乳,其次将初乳加入到10倍体积的水溶液中混合,进一步乳化得到W/O/W乳液,然后在一定温度下去除有机溶剂即可得到脂质体,其包封率变化较大,一般为20%-80%。
通过研究发现,在第二步乳化过程和有机溶剂的去除过程中,对脂质体的粒径有较大影响的因素是温度,较低的温度有利于减小脂质体的粒径。
姚瑶等[8]采用二次乳化法制备的酪丝亮肽多囊脂质体,不仅稳定性好,80%的粒径分布在20-30μm,且包封率为92. 43%。
2.4反相蒸发法(逆相蒸发法)反相蒸发法最初由Szoka和Papahadjopoulos于1978年提出,这种方法适用于脂质成分中磷脂占有较大的比例,且芯材中水溶性成分较多的情况。

脂质体制备的方法脂质体是一种由脂质分子组成的微细粒子,主要用于制备及输送药物、基因和化妆品成分等。
脂质体具有优异的生物相容性和生物可降解性,并且可以有效稳定和保护被包封的药物或成分。
目前,常用的脂质体制备方法包括薄膜溶解法、乳化法、胶束法、膜断裂法、气相法等。
下面将详细介绍这些方法。
薄膜溶解法是一种利用脂质和溶剂溶解及薄膜形成原理制备脂质体的方法。
首先,选择适当的脂质和溶剂。
常用的脂质有磷脂类(如磷脂酰胆碱、磷脂酰丝氨酸)、脂肪醇(如固体脂肪醇)、脂肪酸等。
常用的溶剂有乙醇、二甲酚、甲醇和酯类溶剂。
然后,将脂质和溶剂溶解在一起,通过快速旋转薄膜机或制备配制机将溶液薄膜扩散到玻璃底板上,在适当的温度和时间下形成脂质质体。
最后,通过超声处理或其他方法将脂质质体分散成脂质体悬浮液。
乳化法是一种利用乳化剂和脂质相互作用生成脂质体的方法。
乳化剂常用的有表面活性剂和共乳剂。
表面活性剂包括非离子型(如Tween系列)和阴离子型(如脂肪酸钠盐)。
共乳剂包括长链脂肪醇(如固体脂肪醇)、糖(如蔗糖、葡萄糖)和胆汁酸类。
首先,将乳化剂和脂质在适当比例下溶解在无水有机溶剂中。
然后,加入水相,通过机械剪切或超声处理将脂质和乳化剂形成乳液。
最后,通过去除有机相或冷冻干燥等方法获得脂质体。
胶束法是一种利用表面活性剂和脂质相互作用形成胶束后制备脂质体的方法。
首先,选择适当的表面活性剂,如磷脂酰胆碱、磷脂酰丝氨酸等。
然后,将表面活性剂溶解在溶剂中,通过搅拌、超声处理等方法形成胶束。
最后,将胶束与药物或成分混合,通过快速稀释或其他方法获得脂质体。
膜断裂法是一种利用高压处理使脂质质体断裂形成脂质体的方法。
首先,通过之前介绍的方法制备脂质质体悬浮液。
然后,将悬浮液经过高压处理,使脂质质体断裂成小颗粒,形成脂质体。
最后,通过超声处理或其他方法除去未断裂的脂质颗粒,获得脂质体。
气相法是一种利用空气或氮气吹淋使脂质溶液蒸发形成脂质体的方法。
脂质体的制备方法及工艺流程
脂质体是一种由磷脂和胆固醇等成分组成的微小球形结构,具有良好的生物相容性和生物可降解性,因此被广泛应用于药物传递、基因治疗等领域。
本文将介绍脂质体的制备方法及工艺流程。
脂质体的制备方法主要有两种:溶剂挥发法和膜法。
溶剂挥发法是将磷脂和胆固醇等成分溶于有机溶剂中,然后通过挥发溶剂的方法制备脂质体。
膜法则是将磷脂和胆固醇等成分溶于有机溶剂中,然后通过膜的过滤和超声波等方法制备脂质体。
脂质体的制备工艺流程包括以下几个步骤:
1. 材料准备:选择适当的磷脂和胆固醇等成分,并将其溶于有机溶剂中。
2. 溶液制备:将材料溶液加热至一定温度,使其充分混合。
3. 制备脂质体:根据不同的制备方法,选择相应的制备工艺,如溶剂挥发法或膜法等。
4. 脂质体的纯化:通过超声波、离心等方法将脂质体纯化,去除杂质。
5. 脂质体的表征:通过粒径分析、Zeta电位测定等方法对脂质体进行表征,确定其粒径、分散性等性质。
6. 脂质体的应用:将制备好的脂质体应用于药物传递、基因治疗等领域。
脂质体的制备方法及工艺流程是一个复杂的过程,需要根据具体的应用需求选择适当的制备方法和工艺流程,以获得高质量的脂质体产品。
实验十五脂质体的制备一实验目的1.了解脂质体(liposome)在细胞工程技术中的应用及其制备方法。
2.掌握采用超声波法、冰冻干燥法和冻融法三种不同的方法制备脂质体的方法并了解该技术在细胞工程中的应用。
二实验原理脂质体(liposome)的制备技术,一般采用超声波法、振荡法、乙醚蒸发法、去污剂透析法、冰冻干燥法和冻融法等。
制备方法不同,所得脂质体结构、大小不同,性质和用途也就不同(表15-1)。
种类制备方法大小(m) 特性多层大脂质体(MLV) 乙醚蒸发法、醇醚水法、振荡法、液相快速混合振荡法0.1~50 易制备,包被物释放速度慢单层小脂质体(SUV) 直接超声波法、溶剂超声波法、乙醚注射法0.02~0.05 体积小,适合包被离子、小分子药物等单层大脂质体(LUV) 递相蒸发法、去污剂(胆酸纳等)透析法、冰冻干燥法0.05~0.5 适合包被蛋白质、RNA、DNA片段、大分子药物及细胞融合单层巨大脂质体(GUV) 冻融法5~30 适合包被蛋白质、RNA、DNA片段,除菌处理较难本实验采用超声波法、冻融法、冰冻干燥法三种不同类型的方法,超声波法的原理是:在超声波作用下,磷脂类双亲媒性分子被打碎为分子或分子团,并自动重新排布成类似生物膜的双分子层囊泡。
冻融法是在超声波法形成的小脂质体基础上,通过冷冻和融解过程使其破裂,重组为大体积脂质体,在通过透析时膜内外渗透压的变化而膨胀为更大体积的脂质体。
冰冻干燥法语原理与冻融法基本一致,只在处理条件上有所不同。
三实验用品1.器材超声波清洗机、光学显微镜、荧光显微镜、荧光分光光度计、漩涡混合器、核酸蛋白检测仪、柱层析装置、冰冻干燥机。
2.试剂1)磷脂液:100mg经丙酮-乙醚法纯化的卵磷脂,57.2mg胆固醇,溶于1ml氯仿。
2)荧光液:钙黄绿素(calcein)47mg溶于100ml Tris缓冲液。
3)Tris 缓冲液:称取Tris 0.12g,EDTA0.288mg,溶于80ml去离子水中,用0.1 mol/L盐酸调Ph7.2,再加水至100ml。
脂质体的制备及检测一.目的要求1.掌握注入法制备脂质体的工艺。
2.掌握脂质体包封率的测定方法。
二.实验原理1. 60年代初,Begkan等发现磷脂分散在水中可形成多层囊,并证明每层囊均为双分子脂质膜且被水隔开,称这种具有生物膜结构的囊为脂质体。
1971年Rymen 等人提出将脂质体作为药物载体,即将酶或药物包裹在脂质体中。
2. 脂质体系一种人工细胞膜,它具有洋葱似的封闭球形结构,可使药物被保护在它的结构中,发挥定向作用,特别适于作为抗癌药物载体,以改善药物的治疗作用,降低毒副作用等。
脂质体系由磷脂为骨架膜材及附加剂组成。
用于制备脂质体的磷脂有天然磷脂,如豆磷脂,卵磷脂等,合成磷脂,如二棕榈酰磷脂酰胆碱,二硬脂酰磷脂酰胆碱等。
磷脂在水中能形成脂质体是由其结构决定的。
磷脂具有两条较长的疏水烃链和一个亲水基团。
当较多的磷脂加至水或水性溶液中,磷脂分子定向排列,其亲水基团面向两侧的水相,疏水的烃链彼此对向缔合形成双分子层,形成椭圆形或球状结构一—脂质体。
常用的附加剂为胆固醇,它也是两亲性物质,与磷脂混合使用,可制备稳定的脂质体,其作用是调节双分子层流动性,减低脂质体膜的通透性。
其它附加剂有十八胺、磷脂酸等,这两种附加剂可改变脂质体表面电荷的性质。
3. 脂质体载药系统的优势:1.被动靶向:脂质体进人体内可被巨噬细胞作为外界异物而吞噬,主要被单核巨噬细胞系统的巨噬细胞所吞噬而摄取,形成肝、脾等网状内皮系统的被动靶向性。
2.缓释作用:将药物包封成脂质体,可减少肾排泄和代谢,延长药物在血液中的滞留时间,使药物在体内缓慢释放,从而延长了药物的作用时间。
3.降低药物毒性:药物被脂质体包封后,有效地在肝、脾和骨髓等单核巨噬细胞较丰富的器官中浓集,对心、肾有毒性的药物或对正常细胞有毒性的抗癌药包封脂质体后,可明显降低药物的毒性。
4.提高稳定性:一些不稳定的药物被脂质体包封后,可受到脂质体双层膜的保护。
4. 常用的脂质体制备方法:注入法、薄膜分散法、超声波分散法、逆向蒸发法。
实验十脂质体的制备及包封率的测定一、实验目的1.了解脂质体的结构和性质;2.掌握脂质体的制备方法;3.利用紫外分光光度计测定脂质体的包封率。
二、实验原理脂质体是由磷脂、胆固醇等成分组成的微粒囊,具有自组装、可逆组装、膜液相晶相转换、局部结构调整、聚合与解聚等一系列特性,同时具有高度转染能力、温和性及低毒性等优点,成为生物医学研究领域广泛关注的研究对象。
脂质体的制备方法多种多样,包括机械法、物理化学法、电化学法等,其中以醇沉法等物理化学法常用于大规模制备。
脂质体的包封率是指在脂质体中包封的药物量与药物总量的比例,通常使用紫外分光光度计在253nm处测定DNA或RNA的含量,根据所加药物与总药物量的比值计算出脂质体的包封率。
三、实验步骤1.制备脂质体将2mg的脂质体乳剂溶解在500μL的氯仿中,并加入10μL的药物(如pDNA),搅拌均匀。
将药物与脂质体混合液滴加入10mL的去离子水中,经过30分钟的振荡均匀搅拌,然后使用转移管将上清液取出。
将上清液倒入50mL的角状离心管中,加入18%硝酸钠,离心6000r/min,弃去沉淀。
将沉淀用去离子水洗涤3次,并用去离子水将沉淀重悬,最后得到脂质体的溶液。
将0.5mL脂质体溶液加入测试池,取另一个测试池作为空白对照。
在253nm处测定样品与空白的吸光度,并计算出脂质体的包封率。
四、实验注意事项1.脂质体的制备应在干燥、无风、无尘、无菌的条件下进行;2.药物与脂质体混合液的浓度应适当,以避免过度分散;3.在吸光度计测定时应注意对空白对照的处理。
五、实验结果与分析经过实验制备得到的脂质体溶液,通过紫外分光光度计测定其在253nm处的吸光度,计算出其包封率。
实验结果与所使用的药物种类和浓度等因素有关系,具体可参考文献资料。
六、实验思考题1.脂质体的结构及在生物医学领域中的应用有哪些?。
实验十脂质体的制备及包封率的测定一、实验目的1.掌握薄膜分散法制备脂质体的工艺。
2.掌握用阳离子交换树脂法测定脂质体包封率的方法。
3.熟悉脂质体形成原理,作用特点。
4.了解“主动载药”与“被动载药”的概念。
二、实验指导脂质体是由磷脂与(或不)与附加剂为骨架膜材制成的具有双分子层结构的封闭囊状体。
常见的磷脂分子结构中有两条较长的疏水烃链和一个亲水基团,将适量的磷脂加至水或缓冲溶液中,磷脂分子定向排列,其亲水基团面向两侧的水相,疏水的烃链彼此相对缔和为双分子层,构成脂质体。
用于制备脂质体的磷脂有天然磷脂,如豆磷脂、卵磷脂等;合成磷脂,如二棕榈酰磷脂酰胆碱,二硬脂酰磷脂酰胆碱等。
常用的附加剂为胆固醇。
胆固醇也是两亲性物质,与磷脂混合使用,可制得稳定的脂质体,其作用是调节双分子层的流动性,减低脂质体膜的通透性。
其他附加剂有十八胺、磷脂酸等,这两种附加剂能改变脂质体表面的电荷性质,从而改变脂质体的包封率、体内外其他参数。
脂质体可分为三类:小单室(层)脂质体,粒径为20~50nm,经超声波处理的脂质体,绝大部分为小单室脂质体;多室(层)脂质体,粒径约为400~3500nm,显微镜下可观察到尤如洋葱断面或人手指纹的多层结构;大单室脂质体,粒径约为200~1000nm,用乙醚注入法制备的脂质体多为这一类。
脂质体的制法有多种,根据药物的性质或需要进行选择。
(1)薄膜分散法:这是一种经典的制备方法,它可形成多室脂质体,经超声处理后得到小单室脂质体。
此法优点是操作简便,脂质体结构典型,但包封率较低。
(2)注入法:有乙醚注入法和乙醇注入法等。
“乙醚注入法”是将磷脂等膜材料溶于乙醚中,在搅拌下慢慢滴于55~65℃含药或不含药的水性介质中,蒸去乙醚,继续搅拌1~2h,即可形成脂质体。
(3)逆相蒸发法:系将磷脂等脂溶性成分溶于有机溶剂,如氯仿中,再按一定比例与含药的缓冲液混合、乳化,然后减压蒸去有机溶剂即可形成脂质体。
该法适合于水溶性药物、大分子活性物质,如胰岛素等的脂质体制备,可提高包封率。