分析化学hf络合滴定法
- 格式:ppt
- 大小:2.13 MB
- 文档页数:100

络合滴定法学习要点1、络合滴定ABC2、络合滴定的条件是什么?3、络合滴定曲线是怎样绘制的?4、络合滴定曲线有什么意义和用途?5、络合滴定突跃如何计算?6、络合滴定误差如何计算?1、络合滴定ABC络合滴定法又叫配位滴定法,是以生成金属络合物为滴定反应基础的容量分析,通常教材中介绍的络合滴定是指以EDTA滴定M(或M滴定EDTA)的反应体系。
络合滴定受到pH值(EDTA酸效应和M的水解效应)、共存的其他络合剂L(M的络合效应)、共存的其他金属离子N(争夺EDTA,对EDTA 的共存离子效应)的四重影响。
分析化学中将各种影响用副反应系数α来表示,计算出各自的α值,再与绝对稳定常数K合并,构成条件稳定常数K’MY,或lgK’MY。
引入条件稳定常数后,原来简单溶液的EDTA-M络合平衡的平衡定律表达式就可替换成用M总浓度M’和EDTA总浓度Y’及MY总浓度MY’(一般情况下忽略MY的副反应)表示的化学平衡定律。
各项副反应系数的定义式和计算式如下:(1)酸效应系数(影响EDTA,使EDTA质子化,降低[Y]浓度):6Y(H)1[Y']1[H ][Y]H ii i αβ+===+∑其中:6EDTA [Y']=[Y]+[HY]+......[H Y]=c(M ’中不含MY 项,络合滴定中必须考虑,可以查表)(2)络合效应系数(影响M ,L 与M 络合,降低[M]浓度):M(L)1[M']1[L][M]n ii i αβ===+∑ 其中:n [M']=[M]+[ML]+......[M L](Y ’中不含MY 项,络合滴定中比较常见的影响,重点)(3)水解效应系数(影响M ,生成羟基络离子,降低[M]浓度):M(OH)1[M']1[OH][M]n ii i αβ===+∑ 其中:n [M']=[M]+[MOH]+......[M OH](不含MY 项,该效应相当于OH 对M 的络合效应,滴定条件下一般可以忽略)(4)共存离子效应系数(对EDTA ):''Y(H)NY NY [Y']1[N]1[N ][Y]K K α==+=+ 其中:[Y']=[Y]+[NY](Y ’中不含MY 项,络合滴定中考虑共存金属离子干扰及消除时要用到,通过加入一种掩蔽剂进去,使干扰的N 生成稳定络离子,就不再干扰M 的滴定了。








分析化学实验课后思考题答案(华大使用教材)实验一分析天平称量练习思考题: 1.加减砝码、圈码和称量物时,为什么必须关闭天平?答:天平的灵敏度在很大程度上取决于三个玛瑙刀口的质量。
若刀口不锋利或缺损,将会影响称量的灵敏度,因此,在加减砝码、取放物体时,必须关闭天平,使玛瑙刀和刀承分开,以保护玛瑙刀口。
2.分析天平的灵敏度越高,是否称量的准确度就越高?答:分析天平的灵敏度越高,并非称量的准确度就越高。
因为太灵敏,则达到平衡较为困难,不便于称量。
3.递减称量法称量过程中能否用小勺取样,为什么?答:递减称量法称量过程中不能用小勺取样,因为称量物有部分要沾在小勺上,影响称量的准确度。
4.在称量过程中,从投影屏上观察到标线已移至100分度的右边,此时说明左盘重还是右盘重?答:在称量过程中,从投影屏上观察到标线已移至100分度的右边,此时说明右盘重。
实验二滴定分析基本操作练习思考题:1.HCl和NaOH标准溶液能否用直接配制法配制?为什么?答:由于NaOH固体易吸收空气中的CO2和水分,浓HCl的浓度不确定,固配制HCl和NaOH 标准溶液时不能用直接法。
2.配制酸碱标准溶液时,为什么用量筒量取HCl,用台秤称取NaOH(S)、而不用吸量管和分析天平?答:因吸量管用于标准量取需不同体积的量器,分析天平是用于准确称取一定量的精密衡量仪器。
而HCl的浓度不定, NaOH易吸收CO2和水分,所以只需要用量筒量取,用台秤称取NaOH即可。
3.标准溶液装入滴定管之前,为什么要用该溶液润洗滴定管2~3次?而锥形瓶是否也需用该溶液润洗或烘干,为什么?答:为了避免装入后的标准溶液被稀释,所以应用该标准溶液润洗滴管2~3次。
而锥形瓶中有水也不会影响被测物质量的变化,所以锥形瓶不需先用标准溶液润洗或烘干。
4.滴定至临近终点时加入半滴的操作是怎样进行的?答:加入半滴的操作是:将酸式滴定管的旋塞稍稍转动或碱式滴定管的乳胶管稍微松动,使半滴溶液悬于管口,将锥形瓶内壁与管口接触,使液滴流出,并用洗瓶以纯水冲下。

络合滴定法原理络合滴定法是一种常用的分析化学方法,它通过络合剂和金属离子之间的化学反应来确定金属离子的浓度。
络合滴定法的原理是基于络合剂和金属离子形成络合物的化学平衡反应,通过滴定确定金属离子的浓度。
络合滴定法广泛应用于环境监测、食品安全、药物分析等领域,具有操作简便、准确度高的特点。
在络合滴定法中,络合剂通常是一种具有多个配位基团的有机分子,它可以与金属离子形成稳定的络合物。
络合剂和金属离子之间的络合反应是一个动态的化学平衡过程,滴定过程中,当络合剂的摩尔浓度略大于金属离子的摩尔浓度时,络合剂会与金属离子形成络合物,从而使反应达到化学平衡。
通过滴定时加入的络合剂的体积和金属离子的摩尔浓度之间的关系,可以确定金属离子的浓度。
络合滴定法的原理基于化学平衡反应的定量分析,它要求络合剂和金属离子之间的络合反应是可逆的,并且在一定条件下达到化学平衡。
在实际应用中,选择合适的络合剂对于络合滴定法的准确性和灵敏度至关重要。
另外,滴定过程中的指示剂的选择也会影响络合滴定法的准确性,指示剂的变色点应与络合滴定终点相一致。
络合滴定法的优点在于操作简便、准确度高、适用范围广,因此在分析化学中得到了广泛的应用。
它可以用于测定水样中的金属离子浓度,如铁离子、铜离子、镍离子等。
此外,络合滴定法还可以用于药物分析、环境监测、食品安全等领域。
在实际应用中,需要根据不同的分析对象和需要确定的金属离子种类选择合适的络合剂和指示剂,并严格控制滴定条件,以确保测定结果的准确性和可靠性。
总之,络合滴定法是一种重要的分析化学方法,它通过络合剂和金属离子之间的化学反应来确定金属离子的浓度。
络合滴定法的原理是基于化学平衡反应的定量分析,它具有操作简便、准确度高的特点,广泛应用于环境监测、食品安全、药物分析等领域。
在实际应用中,需要选择合适的络合剂和指示剂,并严格控制滴定条件,以确保测定结果的准确性和可靠性。
通过对络合滴定法原理的深入理解和实践操作,可以更好地应用于实际分析工作中,为科学研究和生产实践提供有力的支持。
络合滴定钙电极
络合滴定是一种常用的分析化学方法,用于测定溶液中金属离子的含量。
在络合滴定中,常用的电极之一就是钙电极。
钙电极是一种特殊的电极,它由一个银丝电极和一个钙离子选择性膜组成。
当钙离子与选择性膜接触时,会发生一系列的化学反应。
这些反应会导致电极表面的电位发生变化,从而可以通过测量电位的变化来确定溶液中钙离子的浓度。
在络合滴定中,钙电极起到了至关重要的作用。
通过将待测溶液和滴定试剂一起加入滴定池中,滴定池中的pH值会发生变化。
当滴定剂中的配体与溶液中的金属离子形成络合物时,溶液的pH值会发生突变。
这个突变会引起钙电极电位的变化,从而可以确定滴定终点。
由于络合滴定钙电极的工作原理比较复杂,因此在实际操作中需要注意一些细节。
首先,为了保证测量的准确性,钙电极需要经常校准。
其次,应该注意滴定剂和待测溶液的配比,以确保滴定过程中的反应能够充分进行。
最后,在进行滴定时,应该控制滴定液的滴入速度,以免溶液的pH值变化过快,影响测量的准确性。
总的来说,络合滴定钙电极是一种非常重要的分析仪器,它在测定溶液中金属离子含量方面发挥着重要作用。
通过精确测量溶液的电位变化,可以确定溶液中金属离子的浓度,为科学研究和工业生产
提供了有力的支持。
第六章 络合滴定法络合滴定法是以络合反应为基础的滴定分析方法。
从路易斯酸碱理论来说,络合反应也是路斯酸碱反应,所以络合滴定与酸碱滴定法有许多相似之处,学习时可对照比较,但络合滴定中也有自身的特点,内容更复杂。
络合反应在分析化学中应用广泛,有关理论和实践知识是分析化学重要的内容之一。
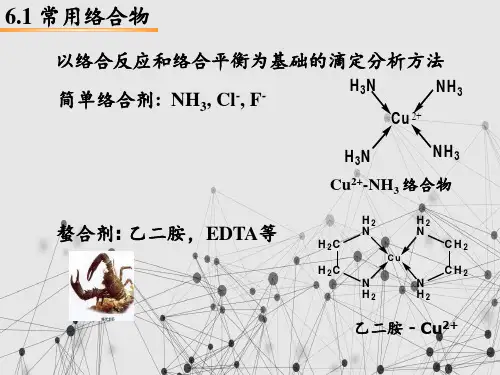
6.1 络合滴定分析中常用的络合剂和络合平衡 6.1.1 常用的络合剂络合反应中常用的络合剂很多,如测定金属离子的络合滴定剂、掩蔽剂、指示剂和金属缓冲溶液等等。
络合剂的分类方式也很多,按络合剂中的键合原子分类,可分为:(1)氧配位螯合剂:如磺基水扬酸、酒石酸、柠檬酸、乙酰丙酮等;2.氮配位络合剂:如氨、乙二胺、联吡啶、邻二氮菲等;(3)氧、氮配位络合剂:8-羟基喹啉、氨三乙酸及EDTA 氨羧络合剂等;(4)硫配位螯合剂:如铜试剂、2-巯基苯并噻唑等。
1. 氨羧络合剂络合滴定中重要的滴定剂是具有-N(CH 2COOH)2基团氨羧络合剂,常见的氨羧络合剂见下表。
2. 乙二胺四乙酸的性质:(1) 乙二胺四乙酸结构:(ethylenediaminetetreacetic acid )简称EDTA ,具有结构如图所示。
一个分子中含有二个-N(CH 2CO OH)2基团,与金属离子结合时有六个配位原子,可形成五个五元螯合环,具有很强的络合性能,是常用的络合滴定剂和掩蔽剂。
(2) EDTA 性质:EDTA 在水中的溶解度不大,EDTA 的二钠盐溶解度较大,EDTA 是六元酸,可用H 6Y 2+表示,有六级离解常数。
各级解离常数与对应的质子化常数如后。
,,,++++=Y H H Y H 5269.0a H69.02Y 6H Y 5H H a 101,10)()()(11====-+++K K c c c K Y H H Y H 45+=++6.1a H56.1Y 5H Y 4H H a 101,10)()()(22====-++K K c c c K -++=Y H H Y H 340.2H40.2Y 4(H )Y 3(H )(H a 10 ,10)3===--+K c c cK,,,各组分的分布分数如上图所示。