5-核苷酸酶检测试剂盒(钼蓝微板法)
- 格式:pdf
- 大小:319.65 KB
- 文档页数:3

试剂R1溶液应呈淡黄色、无颗粒、无杂质、无沉淀和悬浮物;R2溶液无色、无颗粒、无杂质、无沉淀和悬浮物;质控品为白色冻干粉末。
2. 2净含量
试剂盒各试剂装量应不小于标示值。
2. 3试剂空白
2. 3.1试剂空白吸光度
用蒸馅水作为样品加入试剂测试,试剂空白吸光度A54finm WO. 200o
2. 3. 2试剂空白吸光度变化率
用蒸馅水作为样品加入试剂测试,试剂空白吸光度变化率应W0. 02o
2. 4分析灵敏度
测试25 U/L被测物时,吸光度变化率(△A/min)范围为0. 005〜0. 040。
2. 5线性范围
应在(0-100) U/L内满足线性相关系数rN 0. 990,浓度N12U/L时,相对偏差
W20%;浓度V12 U/L时,绝对偏差W2 U/L。
2. 6测量精密度
2. 6. 1重复性
变异系数CV应W6. 0%。
2. 6. 2批间差
变异系数CV应W 10. 0%0
2. 7准确度
用产品配套的2个浓度的定值校准品作为样本进行检测,其相对偏差应W
10. 0%o
2. 8分析特异性
当样品中甘油三酯浓度W10g/L,胆红素浓度W200 MW1/L,血红蛋白浓度W5 g/L,抗坏血酸^260 mg/L浓度时,测试结果的干扰偏差应在± 10%范围内。
第1页共1页。

5’-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清中5’-核苷酸酶的活性。
试剂1:1×30ml;试剂2:1×10ml试剂1:2×30ml;试剂2:1×20ml试剂1:1×60ml;试剂2:1×20ml试剂1:3×80ml;试剂2:4×20ml试剂1:4×60ml;试剂2:4×20ml试剂1:2×60ml;试剂2:2×20ml试剂1:2×30ml;试剂2:2×10ml试剂1:6×60ml;试剂2:2×60ml2.1 外观试剂1为无色至浅褐色液体,无可见异物,试剂2为无色至浅褐色液体,无可见异物。
2.2 净含量试剂净含量不少于标称装量。
2.3 试剂空白2.3.1 试剂空白吸光度用生理盐水作为样本加入试剂测试时,试剂空白吸光度应<0.200A。
2.3.2 试剂空白吸光度变化率用生理盐水作为样本加入试剂测试时,试剂空白吸光度变化率的绝对值应<0.020△A/min。
2.4 分析灵敏度5’-NT含量为50U/L时,测定吸光度变化率的绝对值应>0.005△A/min。
2.5 线性区间试剂(盒)线性在[5,100]U/L区间内:2.5.1 线性相关系数(r)应不小于0.990;2.5.2 [5,20]U/L区间内,线性绝对偏差不超过±4U/L;(20,100]U/L区间内,线性相对偏差不超过±10%。
2.6 精密度2.6.1 重复性用相同批号试剂盒测试两个水平的样本,所得结果的变异系数(CV)应不大于10%。
2.6.2 批间差用3个不同批号试剂盒测试两个水平的样本,试剂(盒)批间相对极差应不大于10%。
2.7 准确度与已上市的同类产品比对,用40个在[5,100]U/L区间内不同浓度的人源样本,用线性回归方法计算两组结果的相关系数(r)不小于0.990;[5,20]U/L区间内,线性绝对偏差不超过±4U/L;(20,100]U/L区间内,线性相对偏差不超过±10%。
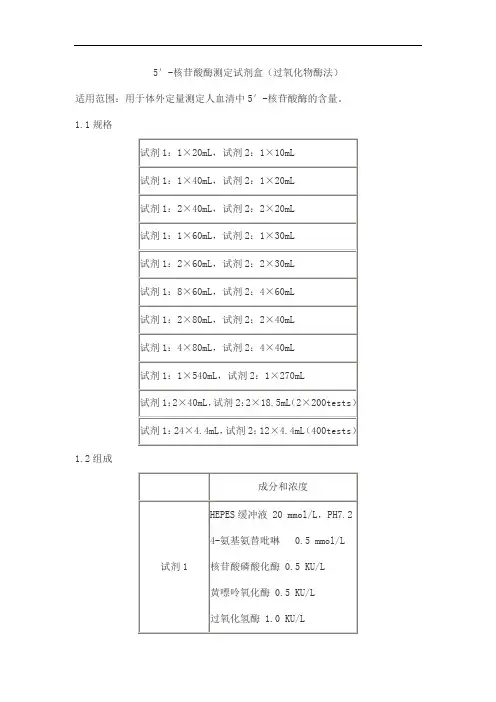
5′-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中5′-核苷酸酶的含量。
1.1规格
1.2组成
2.1 外观
2.1.1试剂1:无色至淡红色液体,无浑浊,无不溶物;
2.1.2试剂2:无色至淡红色液体。
2.1.3包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量
液体试剂的净含量不低于标示体积。
2.3 试剂空白
2.3.1试剂吸光度
试剂空白吸光度≤0.5。
2.3.2试剂白吸光度变化率
试剂空白吸光度变化率(ΔA/分)≤0.005。
2.4 分析灵敏度
样本浓度为100 U/L时,ΔA/分≥0.015。
2.5 线性区间
在[5,300] U/L范围内,线性相关系数r≥0.990;测试浓度在[5,40] U/L 时,绝对偏差不超过±4 U/L,测试浓度在(40,300] U/L时,相对偏差不超过±10%。
2.6 精密度
2.6.1 批內精密度
用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度
回收率在85%-115%范围内。
2.8 稳定性
原包装试剂盒在2℃~8℃避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1和2.7的要求。

5'-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:本产品用于体外定量测定人血清中5’-核苷酸酶的活性。
1.1 规格具体产品规格见下表:1.2 组成成分1.2.1 试剂的组成试剂1:GOOD’S缓冲液 100mmol/L 4-氨基安替比林 2mmol/L核苷酸磷酸化酶 0.1U/ml黄嘌呤氧化酶 0.2U/ml过氧化物酶 0.6U/mlBSA 1g/L试剂2:GOOD’S缓冲液 100mmol/L5’-次黄嘌呤核苷酸 10mmol/LTOOS 0.15g/L1.2.2 校准品的组成(选配)5’-核苷酸酶(5.0~100.0)U/L该校准品为血清基质冻干校准品1.2.3 质控品的组成(选配)5’-核苷酸酶(5.0~100.0)U/L该质控品为血清基质冻干质控品校准品、质控品有批特异性,具体靶值见靶值表。
2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色或淡黄色澄清透明无杂质的液体;2.1.3 试剂2:无色或黄色澄清无杂质的液体;2.1.4 校准品:白色或浅黄色冻干粉,复溶后为浅黄色溶液,无不溶物;2.1.5 质控品:白色或浅黄色冻干粉,复溶后为浅黄色溶液,无不溶物。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在主波长546nm、副波长800nm、37℃条件下,试剂空白吸光度小于0.4;2.3.2 试剂空白吸光度变化率在主波长546nm、副波长800nm、37℃条件下,试剂空白吸光度变化率不大于0.01。
2.4 线性2.4.1 线性范围[5.0,100.0]U/L,相关系数r>0.990。
2.4.2 线性偏差(20.0,100.0]U/L线性范围内,相对偏差不超过±10%;[5.0,20.0]U/L线性范围内,绝对偏差不超过±2.0U/L。
2.5 分析灵敏度检测浓度为67.8U/L的样本时, 吸光度变化率不小于0.01。
2.6 重复性2.6.1 试剂重复性测试高、低浓度的血清样本或质控品,重复测试10次,CV≤10%;2.6.2 校准品重复性用试剂测定1瓶校准品,重复测定10次,CV≤10%;2.6.3 质控品重复性用试剂测定1瓶质控品,重复测定10次,CV≤10%。

5′-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:该产品用于体外定量测定人血清中5′-核苷酸的酶活力。
1. 产品型号/规格及其划分说明1.1 产品型号:试剂1(R1):1×40ml 试剂2(R2):1×20ml;试剂1(R1):2×40ml 试剂2(R2):2×20ml;试剂1(R1):2×60ml 试剂2(R2):2×30ml ;2.1外观试剂盒文字符号清晰;试剂1为淡黄色液体;试剂2为无色清澈液体。
2.2净含量试剂净含量不低于标示值。
2.3试剂空白2.3.1试剂空白吸光度用蒸馏水作为样品进行检测,其空白吸光度≤1.0。
2.3.2试剂空白吸光度变化率用蒸馏水作为样品进行检测,其空白吸光度≤0.01△A/min。
2.4分析灵敏度测定指定浓度为62.0U/L时,其吸光度差值的绝对值应≥0.0001△A/min。
2.5线性范围本试剂盒线性(0,300)U/L区间内,其相关系数r≥0.9900;在(0,20]U/L区间内,绝对偏差不超过±3U/L,在(20,300)U/L区间内,相对偏差不超过±15%。
2.6精密度2.6.1重复性用高低两个浓度的血清样本测试同一批号试剂盒,其变异系数(CV)应≤10%。
2.6.2批间差用高低两个浓度的血清样本测试三个不同批号试剂盒,其批间差应≤10%。
2.7准确度比对试验:在线性范围(0,300)U/L内,线性相关系数r不低于0.975,其中(0,20]U/L范围内,绝对偏差不超过±3U/L,(20,300)U/L范围内,相对偏差不超过±15%。
2.8稳定性试剂盒在2-8℃条件可保存12个月,取效期末的试剂盒,检测其试剂空白吸光度,试剂空白吸光度变化率,分析灵敏度,准确度,线性和重复性等,其质量指标应符合2.1,2.2,2.3,2.4,2.5,2.6.1,2.7的要求。

5′-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清或血浆中5′-核苷酸酶 (5′-NT)的活性。
1.1 包装规格1)试剂1:5×40mL,试剂2:5×20mL;2)试剂1:4×40mL,试剂2:4×20mL;3)试剂1:2×40mL,试剂2:2×20mL。
1.2 主要组成成分试剂1:Good’s缓冲液(100mmol/L),4-氨基安替比林(2mmol/L),PNP(0.1KU/L),XOD(0.2KU/L),POD(0.6KU/L)。
试剂2:Good’s缓冲液(100mmol/L),5′-IMP(10mmol/L),EHSPT(2mmol/L)。
2.1 外观2.1.1 试剂1应为无色至淡粉红色溶液,无混浊,无未溶解物;2.1.2 试剂2应为无色至淡粉红色溶液,无混浊,无未溶解物。
2.2 净含量液体试剂的净含量应不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度5′-NT试剂盒在波长546nm处测定试剂的吸光度应小于0.5000。
2.3.2 试剂空白吸光度变化率5′-NT试剂盒在波长546nm处测定试剂的空白吸光度变化率应小于0.0100。
2.4 分析灵敏度5′-NT试剂盒测试50U/L 5′-NT时,吸光度变化率应大于0.0100。
2.5 准确度用本公司5′-NT试剂盒和已上市其他公司5′-NT试剂盒同时测定40个临床样本,相关系数(r2)应不小于0.95,在[2,20]U/L区间内,绝对偏差应不超过±2U/L;在(20,120]U/L区间内,相对偏差应不超过±15%。
2.6 精密度2.6.1 重复性重复测试(7±3)U/L和(30±5)U/L的样本,所得结果的变异系数CV应不大于5%。
2.6.2 批间差测试(30±5)U/L的样本,所得结果的批间相对极差应不大于10%。
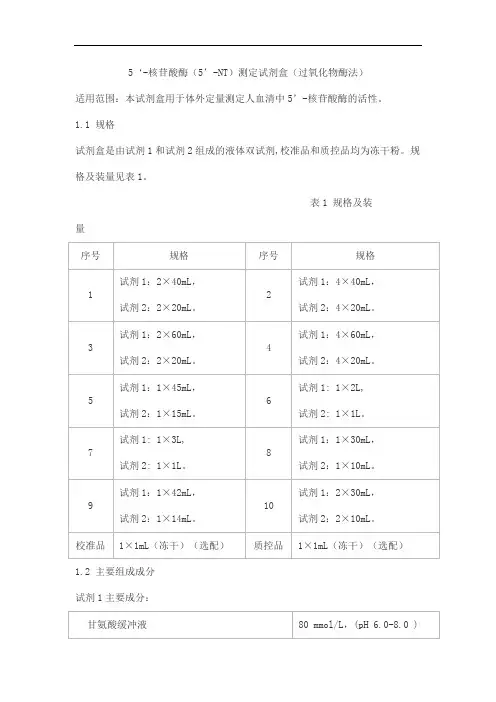
5‘-核苷酸酶(5’-NT)测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清中5’-核苷酸酶的活性。
1.1 规格试剂盒是由试剂1和试剂2组成的液体双试剂,校准品和质控品均为冻干粉。
规格及装量见表1。
表1 规格及装量1.2 主要组成成分试剂1主要成分:试剂2主要成分:校准品主要组分:质控品主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液,试剂2:无色或淡黄色透明溶液 ,校准品:白色至浅黄色冻干粉,复溶后为无色至浅黄色透明液体,质控品:白色至浅黄色冻干粉,复溶后为无色至浅黄色透明液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度在546nm(546nm-550nm)处测定试剂空白吸光度,应<0.6。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.15。
2.4 分析灵敏度测试80U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.004。
2.5 准确度参照EP9-A2的方法,用比对试剂盒同时测试40例线性区间内的不同浓度的血清样本。
其相关系数(r)不小于0.990。
每个浓度点在(1,15)U/L区间内绝对偏差不超过±2.25U/L;[15,95]U/L区间内相对偏差不超过±15%。
2.6 重复性变异系数(CV)应不超过10%。
2.7 线性2.7.1在(1,95]U/L区间内,线性回归的相关系数r应不低于0.990;2.7.2(1,15)U/L区间内绝对偏差不超过±2.25U/L;[15,95]U/L区间内相对偏差不超过±15%。
2.8 批间差对同一份样品进行重复测定,相对极差<15%。
2.9校准品批内瓶间差变异系数(CV)应≤10%。
2.10 质控品批内瓶间差变异系数(CV)应≤10%。
2.11溯源性根据GB/T 21415-2008的规定,本试剂盒内校准品溯源至企业工作校准品,与已上市公司试剂盒进行比对赋值。
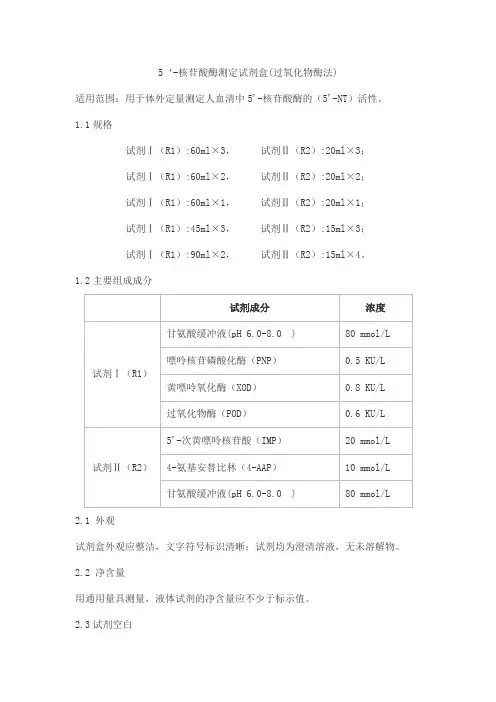
5‘-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中5'-核苷酸酶的(5'-NT)活性。
1.1规格试剂Ⅰ(R1):60ml×3,试剂Ⅱ(R2):20ml×3;试剂Ⅰ(R1):60ml×2,试剂Ⅱ(R2):20ml×2;试剂Ⅰ(R1):60ml×1,试剂Ⅱ(R2):20ml×1;试剂Ⅰ(R1):45ml×3,试剂Ⅱ(R2):15ml×3;试剂Ⅰ(R1):90ml×2,试剂Ⅱ(R2):15ml×4。
1.2主要组成成分2.1 外观试剂盒外观应整洁,文字符号标识清晰;试剂均为澄清溶液,无未溶解物。
2.2 净含量用通用量具测量,液体试剂的净含量应不少于标示值。
2.3试剂空白2.3.1试剂空白吸光度用纯化水作样本,在波长A550nm,比色光径1cm,反应温度37℃下,试剂空白吸光度测定值,应≤0.80A。
2.3.2试剂空白吸光度变化率在波长A550nm,比色光径1cm,反应温度37℃下,试剂空白吸光度变化率(│A/min │)应≤0.100。
2.4分析灵敏度测试浓度80U/L的样本时,吸光度变化值不低于0.002。
2.5 线性在[0.01,200]U/L范围内,线性相关系数r应≥0.990。
在[0.01,50)U/L范围内,线性绝对偏差应不超过±5.0U/L;在[50,200]U/L范围内,线性相对偏差不超过±10%。
2.6 重复性用低、高二个水平的样本检测,检测结果批内变异系数(CV)应不超过10%。
2.7 批间差用三个批号的试剂盒测定同一质控血清,试剂盒批间相对极差≤15%。
2.8 准确度使用美国sigma公司的纯品,进行回收试验,计算回收率,应介于85%-115%之间。
2.9 稳定性试剂在未开瓶状态下,于2℃~8℃可保存12个月。
有效后两个月内进行测定,检测结果应符合2.3、2.4、2.5、2.6、2.8的要求。
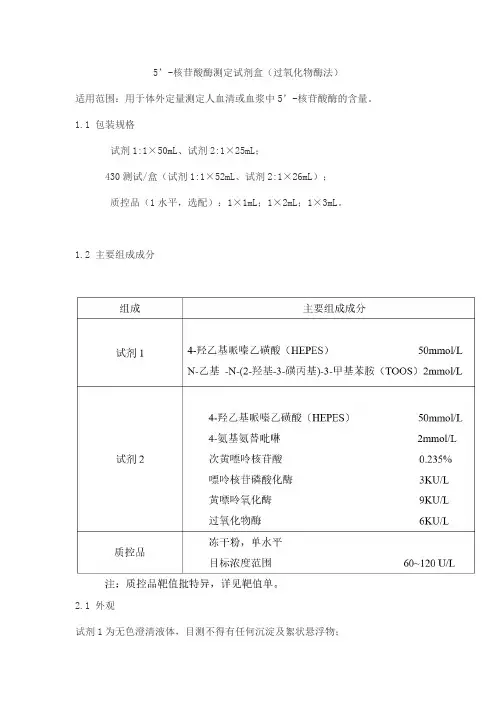
5’-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清或血浆中5’-核苷酸酶的含量。
1.1 包装规格试剂1:1×50mL、试剂2:1×25mL;430测试/盒(试剂1:1×52mL、试剂2:1×26mL);质控品(1水平,选配):1×1mL;1×2mL;1×3mL。
1.2 主要组成成分2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为浅褐色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色至淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1 试剂空白吸光度A下测定的空白吸光度应≤0.0800。
546nm2.3.2 试剂空白吸光度变化率下测定的空白吸光度变化率(ΔA/min)应≤ 0.0050。
A546nm2.4 准确度与已上市的产品进行比对试验:在[5.0,300.0] U/L区间内,相关系数r≥0.975,在[5.0,40.0]U/L区间内测定的偏差应不超过±4U/L,在(40.0,300.0]U/L区间内测定的偏差应不超过±10%。
2.5 分析灵敏度样本浓度为80U/L时,其吸光度变化率应不小于0.0100。
2.6 线性在[5.0,300.0] U/L区间内,线性相关系数r≥0.990,在[5.0,40.0]U/L区间内测定的偏差应不超过±4U/L,在(40.0,300.0]U/L区间内测定的偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性使用高、低不同浓度的样本重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
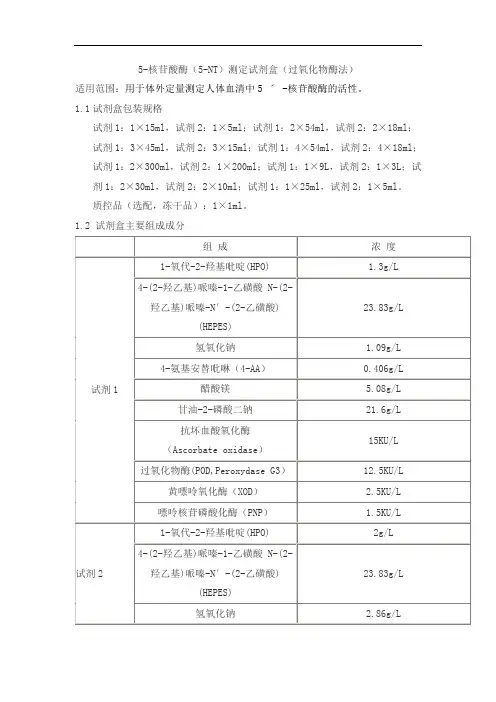
5-核苷酸酶(5-NT)测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人体血清中5 ˊ -核苷酸酶的活性。
1.1试剂盒包装规格试剂1:1×15ml,试剂2:1×5ml;试剂1:2×54ml,试剂2:2×18ml;试剂1:3×45ml,试剂2:3×15ml;试剂1:4×54ml,试剂2:4×18ml;试剂1:2×300ml,试剂2:1×200ml;试剂1:1×9L,试剂2:1×3L;试剂1:2×30ml,试剂2:2×10ml;试剂1:1×25ml,试剂2:1×5ml。
质控品(选配,冻干品):1×1ml。
1.2 试剂盒主要组成成分2.1 外观液体双试剂:试剂1浅黄或红色澄清液体;试剂2无色或浅黄色透明液体。
质控品:冻干品,溶解后为无色至浅黄色透明液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白2.3.1试剂空白吸光度:在37℃、546nm波长、1cm光径条件下,试剂空白吸光度应不大于0.6。
2.3.2试剂空白吸光度变化率:在37℃、546 nm波长、1cm光径条件下,试剂空白吸光度变化率(ΔA/min)应不大于0.03。
2.4 分析灵敏度测定活性为40U/L样本时,吸光度变化值(ΔA/min)应不小于0.01。
2.5 线性范围在(0,300)U/L范围内,线性相关系数r不小于0.996。
(30,300)U/L区间内线性相对偏差不大于±10%;在(0,30]U/L区间内线性绝对偏差不大于±3U/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度与已上市产品进行比对试验:在检测浓度(0,300)U/L范围内,与比对系统的相关系数r不小于0.975;在(30,300)U/L区间内与比对系统的相对偏差不大于±10%;(0,30]U/L区间内与比对系统的绝对偏差不大于±3U/L。

【产品名称】5′核苷酸酶测定试剂盒-5′NT(过氧化物酶法)【包装规格】R1:2×60mL;R2: 2×30mL;R1:1×60mL;R2: 1×30mL。
R1:1×40mL;R2: 1×20mL;R1:1×30mL;R2: 1×15mL。
R1:2×40mL;R2: 2×20mL;R1:3×40mL;R2: 1×60mL。
【预期用途】5'-NT测定试剂盒测定试剂盒临床上用于检测血清中5'-NT 的活性。
一般用于肝胆疾病的鉴别诊断,阻塞性黄疸、肝内占位性病变和浸润性病变时5'-NT活性通常会升高(仅供参考)。
【检验原理】应用5’-NT偶联嘌呤核苷磷酸化酶,黄嘌呤氧化酶和过氧化物酶反应连续监测法。
5’-NT水解次黄苷酸生成次黄苷;再通过偶联PNP的作用,生成次黄嘌呤;后者在XOD 氧化下生成尿酸和过氧化氢;最后在POD的作用下H2O2通过Trinder反应,生成紫红色的有色醌。
通过动态测量有色醌546nm处吸光度上升的速度计算5’-NT活性。
【储存条件及有效期】原包装R试剂在(2-8)℃条件下保存有效期为12个月,失效期见产品标签所示。
开瓶后,如放置于仪器中应在一周内使用,每次使用完毕及时盖上瓶盖。
【适用仪器】本试剂盒适用于奥林帕斯OlympusAU400、日立Hitachi7060、日立Hitachi7180、日立Hitachi7600、贝克曼Beckman Unicel DxC 800、贝克曼Beckman AU680、雅培16000、西门子Dimension xpand。
【样本要求】1、样本种类:标本为血清。
2、样本采集:常规静脉采血约3ml,置于试管中,样本采集后,立即密封送检,严格避免溶血。
3、样本干扰:对反应吸光度有干扰的样本,包括溶血和脂血的样本都可能影响检测结果,遇上述情况建议重新采集。
5′-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:本产品适用于体外定量测定人血清中5’-核苷酸酶(5’-NT)的含量。
1.1 产品规格1.2 主要组成成分注:质控品具有批间、赋值特异性,具体值详见靶值单。
2.1 外观2.1.1试剂盒标签标识清晰,外包装完整无破损;2.1.2试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.3试剂2为浅褐色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.4质控品:无色或浅黄色干粉,复溶后不得有任何沉淀及絮状悬浮物。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1空白吸光度在主波长546nm、副波长800nm、37℃条件下:A≤0.2。
2.3.2空白吸光度变化率在主波长546nm、副波长800nm、37℃条件下:试剂空白吸光度变化率≤0.01。
2.4 线性范围(5,200)U/L范围内,相关系数r≥0.990;(5,40]U/L范围内,绝对偏差不超过±6U/L;(40,200)U/L范围内,相对偏差不超过±15%。
2.5 分析灵敏度在产品说明书规定参数设定条件下,测定样本(质控品)浓度为80U/L时,其吸光度变化率不小于0.010/min。
2.6 精密度2.6.1批内重复性CV≤10%2.6.2 批间差相对极差R≤10.0%。
2.7 准确度与已上市产品比对:相关系数(r)应不低于0.990;(5,40]U/L 线性范围内,绝对偏差不超过±6U/L;(40,200)U/L线性范围内,相对偏差不超过±15%。
2.8 质控品2.8.1赋值有效性测定值在质控靶值范围内2.8.2均一性CV≤5%。
2.8.3瓶间差:CV≤5%。
2.9 稳定性未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.3、2.4、2.5、2.6.1、2.7、2.8.1的要求。
5´-核苷酸酶(5´-NT)检测试剂盒(钼蓝比色法)简介:5´-核苷酸酶(5´-NT 或NTP)广泛分布于肝脏、胆道及其他各种组织中,该酶活性变化常与ALP 活性相平行。
但在骨骼系统的疾病中,如肿瘤骨转移、畸形性骨炎、甲亢、佝偻病等,ALP 活力增高,但是5´-NT 活力正常。
Leagene 5´-核苷酸酶(5´-NT)检测试剂盒(钼蓝比色法)先检测ALP 和5´-NT 总的活性,利用镍离子能选择性的抑制5´-NT 的特性,用总活性减去ALP 活性即获得5´-NT 活性。
通过分光光度计检测680nm 处吸光度。
该酶的检测对于研究自由基代谢平衡,抗衰老和肿瘤发病机制具有一定的价值。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:操作步骤(仅供参考):1、 准备样品:① 血浆、血清和尿液样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的测定,尿液通常也可以直接用于测定,-70℃冻存,用于5´-NT 的检测。
② 细胞或组织样品:取恰当细胞或组织进行裂解,可以采用Leagene Western 及IP细胞裂解液,如果有必要需进行适当匀浆,低速离心取上清,-70℃冻存,用于5´-NT 的检测。
③ 高活性样品:如果样品中含有较高活性的5´-NT ,可以使用 AMP 酸性缓冲液稀释。
④ (选做)样品准备完毕后可以用BCA 蛋白浓度测定试剂盒测定蛋白浓度,以便于后续计算单位蛋白重量组织或细胞内的5´-NT 含量。
2、 配制对照NT Assay 工作液:取适量的NT Assay buffer Ⅰ、Ⅱ、Ⅲ,按Ⅰ:Ⅱ:Ⅲ的比例,配制对照NT Assay 工作液,4℃保存备用。
编号 名称TE0263 100T Storage试剂(A): NT Assay buffer Ⅰ 70ml RT 试剂(B): NT Assay buffer Ⅱ 10ml RT 试剂(C): NT Assay buffer Ⅲ 5ml RT 避光 试剂(D): 5´-AMP buffer 10ml 4℃ 试剂(E): AMP 酸性缓冲液 120ml 4℃ 避光 试剂(F): 磷标准(6mmol/L) 1ml 4℃ 试剂(G): 定磷酸性液 180ml4℃ 使用说明书1份3、配制磷标准工作液:取磷标准(6mmol/L),按磷标准(6mmol/L):AMP酸性缓冲液=99:1的比例,配制磷标准工作液(0.06mmol/L)。
5'-核苷酸酶测定标准操作程序1. 摘要5'-核苷酸酶的测定主要是用于肝胆系统疾病的诊断。
2. 适用范围程序适用于日立7600自动生化分析仪检测血清、血浆中5'-核苷酸酶的浓度。
3. 职责使用日立7600自动生化分析仪进行测定5'-核苷酸酶浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4. 检测方法上海科华生物工程股份有限公司生产的5'-核苷酸酶试剂盒采用的是速率法。
5. 原理5'-次黄苷单磷酸(IMP )和水在5'-核苷酸酶和嘌呤核苷磷酸化酶的催化作用下反应,生成次黄嘌呤,次黄嘌呤和水和氧气在黄嘌呤氧化酶的催化作用下反应,生成尿酸和过氧化氢(H 2O 2),最后过氧化氢在过氧化物酶的催化下与4-氨基安替比林和TOPS 反应生成红色醌亚胺化合物。
OH TOPS O H O H O O H O H IMP 22222225'-24-42222-1-5'-+−−−→−+++−−−−→−+++−−−−−−−−→−++醌亚胺氨基安替比林尿酸次黄嘌呤磷酸核糖次黄嘌呤)次黄苷单磷酸(过氧化物酶黄嘌呤氧化酶嘌呤核苷磷酸化酶核苷酸酶6. 仪器日立7600自动生化分析仪7. 试剂7.1 试剂来源:上海科华生物工程股份有限公司提供 7.2 试剂瓶内主要成分:R1:Good ’s 缓冲液、嘌呤核苷酸氧化酶、黄嘌呤氧化酶、过氧化物酶、4-氨基安替比林。
R2:Tris 缓冲液、5'-次黄苷单磷酸、TOPS7.3 试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为12个月。
试剂不可冰冻。
7.4 试剂准备:试剂为即用式。
8. 标准品和质量控制8.1 校准程序:使用某某公司提供的标准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品响应量通过合适的数学模型绘制校准曲线。
5`-核苷酸酶测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中5`-核苷酸酶的活性。
1.1 包装规格a) 试剂1:1×15mL 试剂2:1×5mLb) 试剂1:2×45mL 试剂2:2×15mLc) 试剂1:4×60mL 试剂2:4×20mLd) 试剂1:2×60mL 试剂2:2×20mL1.2 主要组成成分1.2.1试剂1主要组分三羟甲基氨基甲烷缓冲液30 mmol/L 抗坏血酸氧化酶 2 KU/L嘌呤核苷磷酸化酶(PNP) 2.8 KU/L 4-氨基安替吡啉(4-AA) 1 mmol/L 黄嘌呤氧化酶(XOD) 1.5 KU/L 过氧化物酶(POD) 3 KU/L表面活性剂及稳定剂适量1.2.2试剂2主要组分三羟甲基氨基甲烷缓冲液30 mmol/L 3,5-二氯-2-羟基苯磺酸钠(DHBS) 3 mmol/L 5`-次黄嘌呤核苷酸(5`-IMP) 12 mmol/L 表面活性剂及稳定剂适量2.1 外观试剂1应为无色至浅黄色澄清液体。
试剂2应为无色至浅黄色澄清液体。
2.2 试剂装量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1试剂空白吸光度在546nm波长处测定试剂空白吸光度,应≤0.8。
2.3.2试剂空白吸光度变化率在546nm波长处测定其空白吸光度变化率|△A/min|<0.08。
2.4 分析灵敏度测定5`-NT含量为10 U/L样本时,其|△A/min|应≥0.002。
2.5 线性范围2.5.1在(0~200)U/L范围内,线性回归的确定系数应不低于0.990;2.5.2测试浓度在(0~20] U/L范围内,线性绝对偏差应不超过±2 U/L;测试浓度在(20~200)U/L范围内,线性相对偏差应不超过±10%。
2.6 测量精密度2.6.1重复性:用两个水平质控血清重复测试其变异系数(CV)应不超过5%。
简介:
5´-核苷酸酶(5´-NT 或NTP)广泛分布于肝脏、胆道及其他各种组织中,该酶活性变化常与ALP 活性相平行。
但在骨骼系统的疾病中,如肿瘤骨转移、畸形性骨炎、甲亢、佝偻病等,ALP 活力增高,但是5´-NT 活力正常。
Leagene 5´-核苷酸酶(5´-NT)检测试剂盒(钼蓝微板法)先检测ALP 和5´-NT 总的活性,利用镍离子能选择性的抑制5´-NT 的特性,用总活性减去ALP 活性即获得5´-NT 活性。
通过酶标仪检测680nm 处吸光度。
该酶的检测对于研究自由基代谢平衡,抗衰老和肿瘤发病机制具有一定的价值。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:
操作步骤(仅供参考):
1、 准备样品:
① 血浆、血清和尿液样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的
测定,尿液通常也可以直接用于测定,-70℃冻存,用于5´-NT 的检测。
② 细胞或组织样品:取恰当细胞或组织进行裂解,可以采用Leagene Western 及IP
细胞裂解液,如果有必要需进行适当匀浆,低速离心取上清,-70℃冻存,用于5´-NT 的检测。
③ 高活性样品:如果样品中含有较高活性的5´-NT ,可以使用AMP 酸性缓冲液稀释。
④ (选做)样品准备完毕后可以用BCA 蛋白浓度测定试剂盒测定蛋白浓度,以便于后续
计算单位蛋白重量组织或细胞内的5´-NT 含量。
2、 配制对照NT Assay 工作液:取适量的NT Assay buffer Ⅰ、Ⅱ、Ⅲ,配制对照NT Assay
工作液,4℃保存备用。
3、 配制测定NT Assay 工作液:取适量的NT Assay buffer Ⅰ、Ⅱ,配制测定NT Assay 工
作液,4℃保存备用。
编号 名称
TE0261 100T Storage
试剂(A): NT Assay buffer Ⅰ 15ml RT 试剂(B): NT Assay buffer Ⅱ 2ml RT 试剂(C): NT Assay buffer Ⅲ 1ml RT 避光 试剂(D): 5´-AMP buffer 2ml 4℃ 试剂(F): 磷标准(6mmol/L) 1ml 4℃ 试剂(H): 定磷还原液 3ml
4℃ 避光 使用说明书
1份
4、配制磷标准工作液:取磷标准(6mmol/L),按磷标准(6mmol/L):AMP酸性缓冲液
=99:1的比例,配制磷标准工作液(0.06mmol/L),4℃保存1个月。
5、定磷工作液:按定磷酸性液:定磷还原液=7:1混匀,即为定磷工作液工作液,4℃保
存1个月。
6、酶促反应:按照下表设置对照管、测定管,溶液应按照顺序依次加入,并注意避免产生
气泡。
如果样品中的酶活性过高,可以减少样品用量或适当稀释后再进行测定。
加入物对照管测定管
待测样品0.02 0.02
对照NT Assay工作液(ml) 0.16 -
测定NT Assay工作液(ml) -0.16
混匀,置于水浴保温5min。
5´-AMP buffer(ml) 0.02 0.02
混匀,置于水浴保温30min。
AMP酸性缓冲液(ml) 0.2 0.2
上表中各管充分混匀,离心,取上清液进行显色反应。
7、显色反应:按照下表设置空白管、标准管、对照管、测定管溶液应按照顺序依次加入,
并注意避免产生气泡。
如果样品中的酶活性过高,可以减少样品用量或适当稀释后再进行测定。
加入物空白管标准管对照管测定管蒸馏水(ml) 0.050.05--
标准工作液(ml) -0.05 --
对照管上清液(ml) --0.1 -
测定管上清液(ml) ---0.1
AMP酸性缓冲液(ml) 0.05---
定磷工作液(ml) 0.2 0.2 0.2 0.2
4、混匀,静置,酶标仪检测680nm处吸光度,蒸馏水调零,读取各管吸光度值。
一般应数小时内检测完毕。
计算:
5´-NT活性单位的定义:在37℃条件下1L血清与底物作用,1min催化产生1μmol磷酸(以磷计)为一个5´-NT酶活力单位。
根据酶活性定义,计算出样品中的5´-NT活性。
血清、血浆、尿液中5´-NT活力计算公式:
血清5´-NT活力(U/L)={(A测定-A对照)/(A标准-A空白)}×0.06×1000×N/(30×0.1)
=(A测定-A对照)/(A标准-A空白)×5
组织、细胞中5´-NT活力计算公式:
5´-NT活力(U/mg)={(A测定-A对照)/(A标准-A空白)}×0.06×1000×N/(30×0.1×10-3)/待测样品蛋白浓度(mg/L)
注意事项:
1、本试剂盒亦可用酶标仪进行检测,但检测的样本数相应增多。
如果有条件,尽量采用
分光光度计检测。
2、待测样品中不能含有5´-NT抑制剂,同时需避免反复冻融。
3、用血浆测定有可能引起浑浊。
4、溶血有轻度影响,脂血症不会引起酶活性改变,但可能影响吸光度。
5、与金属螯合的抗凝剂会干扰金属离子的激活作用,因此不宜采用金属螯合抗凝剂。
6、离心管或试管必须清洁,否则感染显色反应。
7、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:12个月有效。
相关产品:
产品编号产品名称
CA0005 氨苄青霉素溶液(Ampicillin,50mg/ml)
DH0006 苏木素伊红(HE)染色液
NR0003 Lezol(总RNA提取试剂)
PE0018 SDS-PAGE凝胶配制试剂盒
TC0713 葡萄糖检测试剂盒(GOD-POD比色法)。