循环伏安法判断电极过程
- 格式:docx
- 大小:229.47 KB
- 文档页数:7
实验七 循环伏安法判断电极过程一、实验目的1.初步掌握电化学工作站的使用方法;2.掌握循环伏安法判断电极过程可逆性的原理和方法。
二、实验原理循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。
CV 法是将循环变化的电压施加于工作电极和参比电极,记录工作电极上得到的电流与施加电压的关系曲线,也叫循环伏安图。
根据循环伏安图,可以得到相应的峰参数,进而判断电极过程。
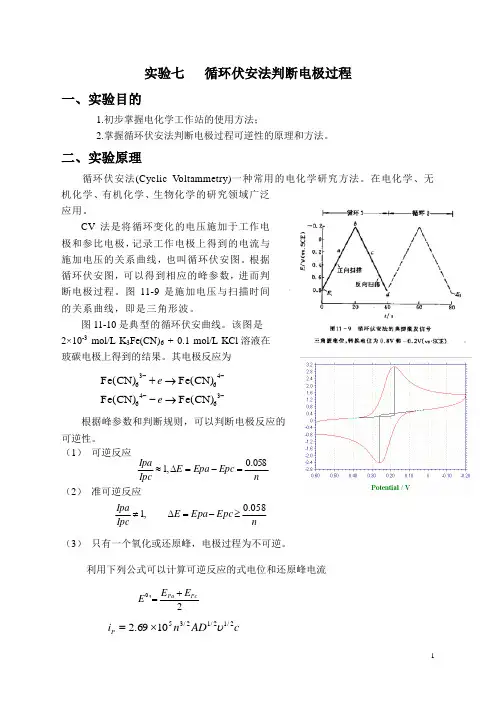
图11-9是施加电压与扫描时间的关系曲线,即是三角形波。
图11-10是典型的循环伏安曲线。
该图是 2×10-3 mol/L K 3Fe(CN)6 + 0.1 mol/L KCl 溶液在玻碳电极上得到的结果。
其电极反应为可逆性。
(1) 可逆反应(2) 准可逆反应(3) 只有一个氧化或还原峰,电极过程为不可逆。
利用下列公式可以计算可逆反应的式电位和还原峰电流----→-→+36464636Fe(CN)Fe(CN)Fe(CN)Fe(CN)e e n Epc Epa E Ipc Ipa 058.0,1=-=∆≈,1≠Ipc Ipa n Epc Epa E 058.0≥-=∆2'0Pc PaE E E +=cAD n i P 2/12/12/351069.2υ⨯=三、仪器与试剂1. CHI660A型电化学工作站(美国CHI公司);三电极体系:工作电极为玻碳电极(d =3㎜)参比电极为饱和甘汞电极(SCE)辅助电极为铂丝电极;2. 超声波清洗器(KQ218型,昆山市超声仪器有限公司)。
3. 2×10-3 mol/L K3Fe(CN)6 + 0.1 mol/L KCl四、实验步骤1. 工作电极预处理2. 装溶液3. 连接三电极4. 选择参数(E i=0.5V, E n=-0.20V,S=1e-5A/V ),作扫描速率为0.05、0.1、0.2、0.3、0.5V/s的循环伏安曲线。

循环伏安法判断电极过程实验报告循环伏安法判断电极过程实验报告引言:循环伏安法是一种常用的电化学测试方法,用于研究电极材料的电化学行为。
本实验旨在通过循环伏安法测定电极材料的氧化还原反应特性,并分析实验结果,探讨其在电化学领域的应用前景。
实验材料与方法:实验所用材料为铂电极和铜电极,实验仪器为循环伏安仪。
首先,将铂电极和铜电极分别清洗并抛光,以确保电极表面的纯净度和光滑度。
然后,将电极插入电解质溶液中,并设置循环伏安仪的扫描速度和电位范围。
接下来,进行循环伏安法测试,记录电流与电位之间的关系曲线。
实验结果与分析:通过循环伏安法测试,我们得到了铂电极和铜电极的电流-电位曲线。
根据曲线的形状和特点,我们可以得到以下结论和分析:1. 铂电极的电流-电位曲线呈现出典型的双电极峰形状,其中一个峰对应氧化反应,另一个峰对应还原反应。
这说明铂电极在测试条件下发生了氧化还原反应,具有良好的电化学活性。
这一特性使得铂电极在催化剂、电池等领域有着广泛的应用前景。
2. 铜电极的电流-电位曲线呈现出单峰形状,没有出现双电极峰。
这说明铜电极在测试条件下只发生了一种氧化还原反应,具有较低的电化学活性。
然而,铜电极在电化学合成、电镀等领域仍然有着重要的应用,其特殊的电化学行为可以被利用。
3. 通过对电流-电位曲线的分析,我们可以得到电极反应的动力学参数,如峰电位、峰电流等。
这些参数可以进一步用于计算电极的表面积、电荷转移速率等重要参数,为电极材料的性能评价提供参考。
结论:本实验通过循环伏安法测试了铂电极和铜电极的电流-电位曲线,并对实验结果进行了分析。
通过曲线的形状和特征,我们可以了解电极材料的氧化还原反应特性和电化学活性。
这对于电化学领域的研究和应用具有重要意义。
循环伏安法作为一种常用的电化学测试方法,具有广泛的应用前景,可以用于研究各种电极材料的性能,并为相关领域的发展提供支持。
总结:循环伏安法是一种重要的电化学测试方法,通过测定电流-电位曲线,可以研究电极材料的氧化还原反应特性和电化学活性。

实验三十四循环伏安法测定铁氰化钾的电极反应过程一、实验目的见《仪器分析实验》p123二、方法原理见《仪器分析实验》p123。
三、仪器和试剂1.JP—303型极谱分析仪2.铁氰化钾标准溶液:5.0×10-2mol/L3.氯化钾溶液:1.0mol/L四、实验步骤1.铁氰化钾试液的配置准确移取1.0mL5.0×10-2mol/L的铁氰化钾标准溶液于10mL的小烧杯中,加入1.0 mol/L 的氯化钾溶液5.0mL,再加蒸溜水4.0mL。
2.测量手续(1)打开303极谱仪的电源。
屏幕显示清晰后,输入当天的日期:××.××.××,按【INT】键。
(2)屏幕显示“运行方式”菜单后,选取“使用当前方法”项,按【YES】键。
屏幕将显示“线性循环伏安法”的方法参数菜单:导数(0~2)0量程(10e nA,e=1~4) 4扫描次数(1~8) 4扫描速率(50~1000mV/s)50起始电位(-4000~4000mV)-100终止电位(-4000~4000mV)600静止时间(0~999s)0如果显示的参数不符合,请按提示修改。
(3)测量铁氰化钾试液在教师指导下,置电极系统于10mL小烧杯的铁氰化钾试液里。
按【运行】键,运行自动完成后,“波高基准”项闪烁,用∧∨键确定“前谷”方法处理图谱,按【YES】键。
请记录波峰电位和波峰电流数据。
按两次【退回】键,再按【方法】键,选取“使用当前方法”项,按【YES】键,显示“线性循环伏安法”的方法参数菜单。
修改扫描速率为100mV,按【ENT】键。
再按【运行】键,照上述的过程一样进行测量。
直至完成扫描速率为50、100、150、200、250mV/s的测量。
上述的循环伏安图打印样本见附图。
五、结果处理见《仪器分析实验》p127五的1、3、5题。
六、问题讨论见《仪器分析实验》p128六的2题。

循环伏安法
循环伏安法(Cyclic Voltammetry,CV)是一种电化学测试方法,用于研究电极反应的动力学和电极反应的电位控制情况。
它的基本原理是:将电位扫过一定的范围,并观察电流的变化情况,从而推断电极反应的动力学和电极反应的电位控制情况。
循环伏安法的基本步验如下:
准备样品:选取合适的电极,并进行清洗和浸渍。
取样处理:根据需要,对样品进行分级、筛选、分离或其他处理。
测定前准备:准备好所需的仪器、试剂和标准品。
测定过程:通过循环伏安法测定电极间的电位差。
数据处理:将测定结果进行计算,得出电极间的电位差。
![《仪器分析实验》(循环伏安法判断电极过程)[详细讲解]](https://uimg.taocdn.com/e2ce933b7275a417866fb84ae45c3b3566ecdd5f.webp)
一、实验目的1、了解电化学工作站的基本构造和使用方法。
2、理解并掌握循环伏安法判断电极过程的原理和方法。
二、实验原理
1、 峰电流方程式:
c
v K i p ⋅⋅=21 c
i p ∝ 21
v i p ∝
2、 可逆性判断?①1≈pc pa
i i ②mV n
pc pa p 56=-=∆ϕϕϕ
三、仪器设备
1、 电化学分析仪:
(LK2005A ,连接到计算
机)。
2、 三电极系统:以铂电极为对电极,Ag|AgCl 电极(或甘汞电极)为参比电极,玻碳电极为工作电极构成三电极系统。
四、实验步骤
1、 电极的预处理。
2、 不同扫描速率下K 3Fe(CN)6溶液的循环伏安图。
3、 不同浓度的K 3Fe(CN)6溶液的循环伏安图。
五、数据处理
循环伏安图
六、思考题
1、为什么要使用三电极系统?
2、循环伏安法如何判断电极过程是否可逆?
附:电化学工作站基本操作
1、打开计算机的电源开关,打开LK2005A电化学工作站主机的电源开关。
2、在WindowsXP操作平台下运行“LK2005A.exe”,进入主界面。
3、方法选择。
4、参数设定。
5、开始实验。
6、保存数据。
7、数据处理。
8、关机。
附:快捷命令
附:三电极系统
目的:减少iR 降
W: 工作电极
R: 参比电极
C: 辅助电极
i : 由W 和C 电路获得 电路获得和由R W w :。



实验循环伏安法判断电极过程实验循环伏安法判断电极过程实验循环伏安法判断电极过程实验一循环伏安法推论电极过程1.学会电化学工作站的使用,学习固体电极表面的处理方法2.掌握用循环伏安法判断电极过程的可逆性。
3.介绍对称波的循环伏安图的特性,学会表述循环伏安图循环伏安法是以等腰三角形的脉冲电压加在工作电极上,在电极上施加线形扫描电压,当到达设定的终止电压后,再反向回扫至某设定的起始电压,电压与扫描时间的关系例如图1右图。
得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图,如图2所示。
假设溶液中有电活性物质)则电极上发生如下电极反应:正向扫描时,电极上将发生o+ze=r反向回扫时,电极上生成的还原态r将发生氧化反应:r=o+ze峰电流可表示为:ip=kn3/2d1/2m2/3t2/3ν1/2c其峰电流与被测物质浓度c、读取速度ν等因素有关。
上式就是扩散控制的对称体系电极过程电流方程式,如果电极过程受到溶解掌控,则电流的大小与ν成正比。
由循环伏安图可以得到氧化峰峰电流(ipa)与还原峰峰电流(ipc)以及氧化峰峰电位φpa、还原峰峰电位φpc值。
对于对称体系,曲线上下等距,水解峰峰电流与还原成峰峰电流比等同于1:ipa/ipc=1水解峰电位与还原成峰电位差:δφ=φpa—φpc≈0.058/nφo′=(φpa+φpc)/2如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差,只有一个氧化或还原峰,电极过程即为不可逆,由此可判断电极过程的可逆性。
不可逆体系:△>58/nmvipa/ipc铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位:[fe(cn)6]3-+e=[fe(cn)6]4-φө=0.36v(vs.nhe)三、仪器与试剂1.仪器电化学工作站;铂盘电极、铂丝电极和饱和状态甘汞电极2.试剂1.0×10-2mol/lk3[fe(cn)6]0.5mol/lkno31.玻璃碳电极的处理首先,液态电极表面的第一步处置就是展开机械研磨、研磨至镜面程度。

循环伏安法判断电极过程实验者: 学号:31指导老师: 同组同学:实验时间:11月21日13:40~17:10一实验目的(1)掌握用循环伏安法判断电极的可逆性。
(2)学会使用循环伏安仪。
(3)学习测量峰电流和峰电位。
(4)验证峰电流与扫描速度和浓度之间的关系。
二实验原理循环伏安法(cyclic vo1tammetry)与单扫描极语法类似。
也是以快速线性扫描的方式施加极化电压于工作电极。
不同之处在于单扫描权谱法所施加的是锯齿波电压,而循环伏安法则是一等腰三角波电压(如图1所示)。
从起始电压Ei 开始沿某一方向作线性扫描到达终止电压Em 后,再以同样的速度反方向扫描至起始电压,完成一次循环。
当电位从正向负扫描时,电活性物质在电极上发生还原反应,产生还原波,其峰电流为ipc ,峰电位为Epc(如图2所示),当逆向扫描时,电极表面上的还原态物质发生氧化反应,其峰电流为ipa ,峰电位为Epa.于是一次三角波扫报可完成一个还原氧化循环。
若需要,可以进行连续循环扫描。
图1:三角波电压 图2:循环伏安图 从波峰到基线的垂直距离叫峰电流,以ip 表示。
波峰所对 应的电位称为峰电位,以Ep 表示。
峰电流方程式可以表示为:三仪器与试剂仪器: 电化学工作站;金圆盘电极、铂圆盘电极或玻碳工作电极,铂丝对电极和饱和甘汞电极或Ag/AgCl 参比电极。
试剂:21.0010/mol L -⨯ 36()e K F CN 溶液,1.0/mol L 3KNO 溶液。
四实验内容与步骤1. 磨电极:目的去除表面氧化层,抛光金电极,得到一个平滑光洁、新鲜的电极表面。
处理方法,依次使用1.0、0.3、0.05的23Al O 粉末在平板上研磨5mins 、5mins 、10mins 。
注意研磨过程中,电极一定要垂直放置,每次研磨后要用去离子水清洗干净。
2. 电极溶液的配制:36()e K F CN 储备液0.1mol/L; 3KNO 储备液1.0mol/L 。

实验4 循环伏安法判断电极过程一、实验目的1.学会使用电化学工作站进行循环伏安法的测定。
2.掌握用循环伏安法判断电极的可逆性。
3.测量峰电流和峰电位,了解扫描速率和浓度对循环伏安图的影响。
二、实验原理1.循环伏安法循环伏安法和单扫描极谱法类似。
是在电极上施加一个线性扫描电压,当到达某设定的终止电位后,再反向回扫至某设定的起始电压。
进行正向扫描时若溶液中存在氧化态O,电极上将发生还原反应:O + ne-≒R反向回扫时,电极上的还原态R将发生氧化反应:R≒O + ne-图1 循环伏安法的典型激发信号三角波电位,转换电位为0.8 V 和-0.2 V(vs.SCE)2.测量原理例循环伏安图,图2峰电流表示为:ip=2.69×105×n3/2v1/2D1/2Ac其中:ip为峰电流(A,安培);n为电子转移数;D为扩散系数(cm2·s-1);v为电压扫描速度(V·s-1);A为电极面积(cm2);c为被测物质浓度(mol·L-1)。
图2 循环伏安图从循环伏安图可获得氧化峰电流ipa与还原峰电流ipc,氧化峰电位Epa与还原峰电位Epc。
对于可逆体系,氧化峰电流ipa与还原峰电流ipc绝对值的比值ipa/ipc=1氧化峰电位Epa与还原峰电位Epc电位差:△E=Epa- Epc= 2.2≈(V)(T = 298 K)条件电位Eo′:Eo′=由此可判断电极过程的可逆性三、仪器与试剂1.仪器:电化学工作站,金元盘电极、铂圆盘电极和玻璃碳电极,铂丝电极和饱和甘汞电极。
2.试剂:1×10-2mol·L-1 K3Fe(CN)6;1.0 mol·L-1 KNO3。
四、实验步骤1.溶液的配制取5.0 mL铁氰化钾的原始溶液于100mL容量瓶中,稀释、定容,得到1.0×10-3的[Fe(CN)6]3-溶液;取10mL1.0×10-3的[Fe(CN)6]3溶液于100mL容量瓶中,稀释、定容,得到1.0×10-4的[Fe(CN)6]3-溶液;取10mL1.0×10-4的[Fe(CN)6]3溶液于100mL容量瓶中,稀释、定容,得到1.0×10-5的[Fe(CN)6]3-溶液。

循环伏安法判断电极过程实验人:王壮 同组实验:余晓波 实验时间:2016.2.22一、实验目的(1)掌握用循环伏安法判断电极过程的可逆性 (2)学习使用电化学工作站 (3)测量峰电流和峰电位二、实验原理循环伏安法与单扫描极谱法类似。
在电极上施加线性扫描电压,当到达某设定的终止电压后,再反向回扫至某设定的起始电压。
若溶液中存在氧化态O ,电极上将发生还原反应:O ze R +反向回扫时,电极上生成的还原态R 将发生氧化反应:R O ze +峰电流可表示为2221133322p i Kz D m t v c =峰电流与被测物质浓度c 、扫描速率v 等因素有关。
从循环伏安图可确定氧化峰峰电流pa i 和还原峰峰电流pc i 、氧化峰峰电位pa ϕ和还原峰峰电位pc ϕ。
对于可逆体系,氧化峰峰电流与还原峰峰电流比为1pa pci i =氧化峰峰电位与还原峰峰电位差为0.058=pa pc zϕϕϕ∆-≈ 条件电位'ϕ为'=2pa pcϕϕϕ-由此可以判断电极过程的可逆性三、仪器与试剂仪器:电化学工作站;金圆盘电极:铂圆盘电极或玻璃碳电极,铂丝电极和饱和甘汞电极。
试剂:-21.0010/mol L ⨯ K 3Fe(CN)6;1.0/mol L KNO 3 四、实验步骤1、电极的预处理 将电极表面进行抛光处理2、K 3Fe(CN)6溶液的循环伏安图在电解池中放入31.0010/mol L -⨯ K 3Fe(CN)6+0.50/mol L KNO 3溶液,插入铂圆盘(或金属盘)指示电极、铂丝辅助电极和饱和甘汞电极,通N 2除去O 2. 扫描速率20/mV s ,从0.800.20V +-扫描,记录循环伏安图以不同扫描速率:10/,40/,60/,80/,100/mV s mV s mV s mV s mV s 和200/mV s ,分别记录从0.800.20V +-扫描的循环伏安图。
3、不同浓度K 3Fe(CN)6溶液的循环伏安图以20/mV s 扫描速率,从0.800.20V +-扫描,分别记录51.0010/mol L -⨯、41.0010/mol L -⨯、31.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的循环伏安图四、实验数据1、31.0010/mol L -⨯ K 3Fe(CN)6+0.50/mol L KNO 3溶液在不同扫描速度下的循环伏安图图1.40mV/s 扫描速度图2.60mV/s 扫描速度图3.80mV/s扫描速度图4.100mV/s扫描速度图5.200mV/s扫描速度由化学工作站软件的测量功能可以测得氧化峰峰电流pa i 、还原峰峰电流pc i 、氧化峰峰电位pa ϕ、还原峰峰电位pc ϕ由40mV/s 扫描速率得出速率为例计算:-6-6-4.3910=||=1.024.3210papc i i ⨯⨯ 氧化峰峰电位与还原峰峰电位差==0.227-0.136=0.1815V pa pc ϕϕϕ∆- 条件电位0.227-'===0.091220.136pa pcϕϕϕ-同理可计算出其他扫描速率下各项数据并得下表: '(V )0.18150.181 表1. 31.0010/mol L -⨯ K 3Fe(CN)6+0.50/mol L KNO 3溶液在不同扫描速度下的数据以pa i 和pc i 对12v 作图,可以得到如下图形v (m V /s )Ipa (10-6A)2、不同浓度K 3Fe(CN)6溶液在100mV/s 扫描速率下的的循环伏安图图8. 31.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的循环伏安图46869v (m V /s )Ipc (10-6A)v (mV/s)Linear Fit of v图7.pc i 对12v 作图测量并计算得下表: 项目pa i ()A pc i ()A pa ϕ(V ) pc ϕ(V ) pa pci i'ϕ(V ) ϕ∆(V )31.0010/mol L -⨯ -5.54E-066.37E-06 0.2380.134 0.87 0.186 0.104 41.0010/mol L -⨯ -5.41E-075.07E-070.272 0.098 1.07 0.185 0.174 51.0010/mol L -⨯ -8.60E-08 4.97E-090.2360.13317.31 0.18450.103表2. 不同浓度K 3Fe(CN)6溶液在100mV/s 扫描速率下的的数据图9. 41.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的循环伏安图图10. 51.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的循环伏安图K 3Fe(CN)6浓度电极过程的可逆性可由1pa pci i =、0.058=pa pc z ϕϕϕ∆-≈两式来判断,如果pa pci i 与1相差很大或者ϕ∆与0.058z相差很大则电极过程为不可逆电极 在表1中,可以计算得到pa pci i 的平均值为=0.98pa pci i ,可以得出本实验电极过程的可逆性较为理想的结论。
循环伏安法判断铁氰化钾的电极反应过程、目的要求1掌握用循环伏安法判断电极反应过程的可逆性2 •学会使用电化学工作站3•学会测量峰电流和峰电位,培养学生的动手操作能力及分析问题解决问题能力二、实验用品1.仪器:电化学工作站,三电极系统(两支铂电极,一支甘汞电极),电解杯数只2■试剂:铁氰化钾标准溶液(6.0 X O-3 mol/L, 1.00 沐0-5、1.00 为0-4、1.00 为0-3、1.00 X0-2含 KCl 溶液 1.0 mol/L),三、实验原理电化学工作站(Electrochemical workstation )是电化学测量系统的简称,是电化学研究和教学常用的测量设备。
将这种测量系统组成一台整机,内含快速数字信号发生器、高速数据采集系统、电位电流信号滤波器、多级信号增益、IR降补偿电路以及恒电位仪、恒电流仪。
可直接用于超微电极上的稳态电流测量。
如果与微电流放大器及屏蔽箱连接,可测量1pA或更低的电流。
如果与大电流放大器连接,电流范围可拓宽为=t2A。
动态范围极为宽广。
可进行循环伏安法、交流阻抗法、交流伏安法等测量。
循环伏安法是用途最广泛的研究电活性物质的电化学分析方法,在电化学、无机化学、有机化学、生物化学等领域得到了广泛的应用。
由于它能在很宽的电位范围内迅速观察研究对象的氧化还原行为,因此电化学研究中常常首先进行的是循环伏安行为研究循环伏安是在工作电极上施加一个线性变化的循环电压,记录工作电极上得到的电流与施加电压的关系曲线,对溶液中的电活性物质进行分析。
铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位:F e(CN)6 】+e_=〔Fe(CN)6 】护=0.36V( vs.NHE)选择施加在起始点的起始电位,沿负的电位正向扫描,当电位负到能够将O([Fe(CN)6]3-)还原时,在工作电极上发生还原反应: 0+ Ze = R,阴极电流迅速增加,电流达到最高峰,此后由于电极附近溶液中的O ([Fe(CN)6]3-)转变为R([Fe(CN)6]4-)而耗尽,电流迅速衰减;电压沿正的方向扫描,当电位正到能够将R([Fe(CN)6]4-) 氧化时,在工作电极表面聚集的 R将发生氧化反应:R= O+Ze,阳极电流迅速增加,电流达到最高峰,此后由于电极附近溶液中的R转变为0 ([Fe(CN)6]3-)而耗尽,电流迅速衰减;当电压达到的起始电位时便完成了一个循环。
循环伏安法测定亚铁氰化钾的电极反应过程实验目的1.学习固体电极表面的处理方法;2.学会利用MEC-16B多功能电化学分析仪,进行循环伏安法探究物质的电极过程。
3.了解扫描速率和浓度对循环伏安图的影响实验原理1.循环伏安法是将线型扫描电压施加在电极上,控制电极电势以不同的速率,电压与随时间以三角波形一次或多次反复扫描。
如图1使电活性物质在电极上能交替发生不同的还原和氧化反应,记录电流—电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
循环伏安法使用小面积工作电极是静止的固体电极,如铂电极、石墨电极、波碳电极、悬汞电极等。
2.当溶液中存在氧化态物质O时,从起始电压E i沿某一方向扫描到终止电压E S它在电极上还原成还原态物质R, O+ne-→R ;电位方向逆转时,电极上生成的R被氧化为O, R →O+ne-所得极化曲线如图2图1 图2上半波是还原波(阴极支),下半部是氧化波(阳极支)如果物质的电极过程是可逆过程,阳极峰电流i pa与阴极峰电流i pc相等,而且与扫描速度的平方根成正比;可逆电流峰的峰电位与电压扫描速度无关。
阴极峰电位φpc与阳极峰电位φpa差Δφp=56.5∕n (mv 25o),通常Δφp与实验条件有关,其值在55mv —65mv就可确定为可逆电极过程。
3.铁氰化钾离子[Fe(CN)6]3-亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3-+ e-= [Fe(CN)6]4-φθ= 0.36V电极电位与电极表面活度的Nernst方程式为φ=φθ+ RT/Fln(C Ox/C Red)在一定扫描速度下,从起始电位-02V正向扫描到+0.8V过程中,溶液中的[Fe(CN)6]4-氧化成[Fe(CN)6]3-产生氧化电流,当负相扫描时即从+0.8V到-0.2V 时,[Fe(CN)6]3-被还原产生还原电流。
实验五循环伏安法判断电极过程二〇二二年3月一、实验目的1.掌握用循环伏安法判断电极过程的可逆性。
2.学会使用循环伏安仪。
3.测量峰电流和峰电位。
二、实验原理循环伏安法与单扫描极谱法相似。
在电极上施加线性扫描电压,当达到某设定的终止电压后,再反向回归至某设定的起始电压。
若溶液中存在氧化态O,电极上将发生还原反应:O+Ze⟺R反向回扫时,电极上生成的还原态R 将发生氧化反应:R⟺O+Ze峰电流可表示为:i p=KZ 32D12m23t23v12c其峰电流与被测物质浓度c、扫描速率v等因素有关。
从循环伏安图可确定氧化峰峰电流i pa和还原峰峰电流i pc,氧化峰峰电位φpa 和还原峰峰电位φpc值。
对于可逆体系,氧化峰峰电流与还原峰峰电流比:φpaφpc=1氧化峰峰电位与还原峰峰电位差:Δφ=φpa−φpc≈0.058Z(V)条件电位φo′:φo′=φpa+φpc2由此可判断电极过程的可逆性。
三、仪器与试剂1.仪器:CHI循环伏安仪;金圆盘电极、铂圆盘电极或玻璃碳工作电极,铂丝对电极和饱和甘汞电极。
2.试剂:1.00×10−2mol/L K3Fe(CN)6,0.50mol/L KNO3四、实验内容和步骤1.金圆盘电极(或铂圆盘电极、玻璃碳电极)的预处理:用Al2O3粉将电极表面抛光,然后用蒸馏水清洗,用超声处理,待用。
2.以1.00×10−2mol/L K3Fe(CN)6溶液为母液,0.50mol/L KNO3溶液为稀释液,配置一系列浓度梯度的K3Fe(CN)6溶液。
包括:1.00×10−2mol/L 、1.00×10−3mol/L 、1.00×10−4mol/L 、1.00×10−5mol/L 的K3Fe(CN)6溶液。
3.在电解池中放入溶液,插入铂圆盘(或金圆盘)工作电极、铂丝辅助电极和饱和甘汞电极,通N2除O2。
4.以不同扫描速率:以1.00×10−3mol/L 浓度的的K3Fe(CN)6溶液,分别在5、10、40、60、80、100 和200 mV/s的扫描速度下从-0.20~+0.80V进行循环伏安扫描,记录扫描得到的循环伏安图。
实验六 循环伏安法测定电极反应参数一、实验目的1.初步掌握电化学工作站的使用方法;2.掌握循环伏安法测定电极反应参数的原理和方法。
二、实验原理循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。
CV 法是将循环变化的电压施加于工作电极和参比电极,记录工作电极上得到的电流与施加电压的关系曲线,也叫循环伏安图。
根据循环伏安图,可以得到相应的峰参数,进而判断电极过程。
图11-9是施加电压与扫描时间的关系曲线,即是三角形波。
图11-10是典型的循环伏安曲线。
该图是 2×10-3 mol/L K 3Fe(CN)6 + 0.1 mol/L KCl 溶液在玻碳电极上得到的结果。
其电极反应为根据峰参数和判断规则,逆性。
(1) 可逆反应 (2) 准可逆反应(3) 只有一个氧化或还原峰,电极过程为不可逆。
利用下列公式可以计算可逆反应的式电位和还原峰电流----→-→+36464636Fe(CN)Fe(CN)Fe(CN)Fe(CN)e e nEpc Epa E Ipc Ipa 058.0,1=-=∆≈,1≠IpcIpan Epc Epa E 058.0≥-=∆2'0PcPa E E E +=cAD n i P 2/12/12/351069.2υ⨯=三、仪器与试剂1. CHI660A型电化学工作站(美国CHI公司);三电极体系:工作电极为导电玻璃电极(ITO)参比电极为饱和甘汞电极(SCE)辅助电极为铂电极;2. 50 mmol/L K3Fe(CN)6; 0.1 mol/L KCl四、实验步骤1. 取0.1mol/L KCl溶液5mL于电解池中,加50 mmol/L K3Fe(CN)6溶液50μL,混匀,连接三电极,选择CV参数(E i=0.6V, E n=-0.20V,S=5e-5A/V ),测CV曲线,保存。
同理,连续加50 mmol/L K3Fe(CN)6溶液50μL 4次,混匀,分别测CV曲线,保存,并将图形添加输出。
实验7 循环伏安法测定铁氰化钾的电极反应过程实验七循环伏安法测定铁氰化钾的电极反应过程一、目的要求1.学习循环伏安法测定电极反应参数的基本原理及方法; 2.学会使用伏安仪;3.掌握用循环伏安法判断电极反应过程的可逆性。
二、试验原理循环伏安法(CV)是最重要的电分析化学研究方法之一。
由于其设备价廉、操作简便、图谱解析直观,能迅速提供电活性物质电极反应过程的可逆性,化学反应历程、电极表面吸附等许多信息。
因而一般是电分析化学的首选方法。
CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
这种方法也常称为三角波线性电位扫描方法。
图1中表明了施加电压的变化方式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点又回扫到+0.8V。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
典型的循环伏安图如图2所示。
该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在Pt工作电极上反应得到的结果。
起始电位Ei为+0.8V(a点),然后沿负的电位扫描(如箭头所指方向),当电1位至Fe(CN)63�C可还原时,即析出电位,将产生阴极电流(b点)。
其电极反应为: [Fe(CN)6]3??e?[Fe(CN)6]4?随着电位的变负,阴极电流迅速增加(b-c-d),直至电极表面的Fe(CN)63-浓度趋近零,电流在d点达到最高峰。
然后迅速衰减(d-e-f),这是因为电极表面附近溶液中的Fe(CN)63-几乎全部因电解转变为Fe(CN)64-而耗尽。
当电压开始阳极化扫描时,由于电极电位仍相当的负,扩散至电极表面的Fe(CN)63-仍在不断还原,故仍呈现阴极电流。
当电极电位继续正向变化至Fe(CN)64-的析出电位时,聚集在电极表面附近的还原产物Fe(CN)64-被氧化,其反应为:[Fe(CN)6]4??e?[Fe(CN)6]3?这时产生阳极电流(i-j-k),阳极电流随着扫描电位正移迅速增加,当电极表面的Fe(CN)64-浓度趋于零时,阳极化电流达到峰值(j点)。
徐州工程学院教案徐州工程学院教案纸峰电流ip 可表示为:(1)式中K、n、D、v、A 和 c 分别为常数、电子转移数、扩散系数、电压扫描速率、电极面积和被测物质浓度。
由式(1) 可见,峰电流与被测物质浓度、扫描速率等因素有关。
从循环伏安图可确定氧化峰峰电流i pa和还原峰峰电流i pc,氧化峰峰电位φpa和还原峰峰电位φpc值。
对于可逆体系,氧化峰与还原峰的峰电流之比为:(2)氧化峰与还原峰的峰电位之差为:(mV) (3)条件电位:由此可判断电极过程的可逆性。
铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位:三、仪器及试剂仪器:LK2005A电化学工作站(CHI);铂片电极2 支;饱和甘汞电极1 支。
试剂:2.0×10-2mol·dm-3铁氰化钾标准溶液,1.0mol·dm-3的氯化钾溶液,蒸馏水。
铬酸洗液:20g的K2Cr2O7,溶于40mL水中,将浓H2SO4360mL徐徐加入K2Cr2O7溶液中(千万不能将水或溶液加入H2SO4中),边倒边用玻璃棒搅拌,并注意不要溅出,混合均匀,冷却后,装入洗液瓶备用新配制的洗液为红褐色,氧化能力很强,当洗液用久后变为黑绿色(可加入固体高锰酸钾使其再生),即说明洗液无氧化洗涤力。
四、操作步骤电极可逆性判断在电解池(小烧) 中放入少(20mL ) 2.0×10-2mol·dm-3铁氰化钾标准溶液,1.0mol·dm-3的氯化钾溶液,插入2 支铂电极和 1 支饱和甘汞电极(取下橡胶帽)。
其中一支铂电极作指示电极,另一支铂电极作辅助电极,饱和甘汞电极作参比电极。
以扫描速率,从+0.30 ~ -0.5 V 扫描,记录循环伏安图并判断电极可逆性。
存盘并记录ipa、ipc 和φpa、φpc 的值。
【铂片电极的处理:如上述判断出电极不可逆,则用铬酸洗液浸泡10 ~ 20 min 进行处理,然后用蒸馏水清洗,备用。
循环伏安法判断电极过程
实验人:王壮 同组实验:余晓波 实验时间:2016.2.22
一、实验目的
(1)掌握用循环伏安法判断电极过程的可逆性 (2)学习使用电化学工作站 (3)测量峰电流和峰电位
二、实验原理
循环伏安法与单扫描极谱法类似。
在电极上施加线性扫描电压,当到达某设定的终止电压后,再反向回扫至某设定的起始电压。
若溶液中存在氧化态O ,电极上将发生还原反应:
O ze R +
反向回扫时,电极上生成的还原态R 将发生氧化反应:
R O ze +
峰电流可表示为
2221133322
p i Kz D m t v c =
峰电流与被测物质浓度c 、扫描速率v 等因素有关。
从循环伏安图可确定氧化峰峰电流pa i 和还原峰峰电流pc i 、氧化峰峰电位pa ϕ和还
原峰峰电位pc ϕ。
对于可逆体系,氧化峰峰电流与还原峰峰电流比为
1pa pc
i i =
氧化峰峰电位与还原峰峰电位差为0.058
=pa pc z
ϕϕϕ∆-≈ 条件电位'ϕ为
'=
2
pa pc
ϕϕϕ-
由此可以判断电极过程的可逆性
三、仪器与试剂
仪器:电化学工作站;金圆盘电极:铂圆盘电极或玻璃碳电极,铂丝电极和饱和甘汞电极。
试剂:-21.0010/mol L ⨯ K 3Fe(CN)6;1.0/mol L KNO 3 四、实验步骤
1、电极的预处理 将电极表面进行抛光处理
2、K 3Fe(CN)6溶液的循环伏安图
在电解池中放入31.0010/mol L -⨯ K 3Fe(CN)6+0.50/mol L KNO 3溶液,插入铂圆盘(或金属盘)指示电极、铂丝辅助电极和饱和甘汞电极,通N 2除去O 2. 扫描速率20/mV s ,从0.800.20V +-扫描,记录循环伏安图
以不同扫描速率:10/,40/,60/,80/,100/mV s mV s mV s mV s mV s 和200/mV s ,
分别记录从0.800.20V +-扫描的循环伏安图。
3、不同浓度K 3Fe(CN)6溶液的循环伏安图
以20/mV s 扫描速率,从0.80
0.20V +-扫描,分别记录51.0010/mol L -⨯、
41.0010/mol L -⨯、31.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的循环伏安图
四、实验数据
1、31.0010/mol L -⨯ K 3Fe(CN)6+0.50/mol L KNO 3溶液在不同扫描速度下的循环伏安图
图1.40mV/s 扫描速度
图2.60mV/s 扫描速度
图3.80mV/s扫描速度图4.100mV/s扫描速度图5.200mV/s扫描速度
由化学工作站软件的测量功能可以测得氧化峰峰电流pa i 、还原峰峰电流pc i 、氧化峰峰电位pa ϕ、还原峰峰电位pc ϕ
由40mV/s 扫描速率得出速率为例计算:
-6-6-4.3910=||=1.024.3210
pa
pc i i ⨯⨯ 氧化峰峰电位与还原峰峰电位差==0.227-0.136=0.1815V pa pc ϕϕϕ∆- 条件电位0.227-'=
=
=0.0912
2
0.136
pa pc
ϕϕϕ-
同理可计算出其他扫描速率下各项数据并得下表: '(V )
0.1815
0.181 表1. 3
1.0010/mol L -⨯ K 3Fe(CN)6+0.50/mol L KNO 3溶液在不同扫描速度下的数据
以pa i 和pc i 对12
v 作图,可以得到如下图形
v (m V /s )
Ipa (10-6
A)
2、不同浓度K 3Fe(CN)6溶液在100mV/s 扫描速率下的的循环伏安图
图8. 31.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的
循环伏安图
468
6
9
v (m V /s )
Ipc (10-6
A)
v (mV/s)
Linear Fit of v
图7.pc i 对12
v 作图
测量并计算得下表: 项目
pa i ()A pc i ()A pa ϕ(V ) pc ϕ(V ) pa pc
i i
'ϕ(V ) ϕ∆(V )
31.0010/mol L -⨯ -5.54E-06
6.37E-06 0.238
0.134 0.87 0.186 0.104 41.0010/mol L -⨯ -5.41E-07
5.07E-07
0.272 0.098 1.07 0.185 0.174 51.0010/mol L -⨯ -8.60E-08 4.97E-09
0.236
0.133
17.31 0.1845
0.103
表2. 不同浓度K 3Fe(CN)6溶液在100mV/s 扫描速率下的的数据
图9. 41.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的
循环伏安图
图10. 51.0010/mol L -⨯K 3Fe(CN)6+0.50/mol L KNO 3溶液的
循环伏安图
K 3Fe(CN)6
浓度
电极过程的可逆性可由
1pa pc
i i =、0.058
=pa pc z ϕϕϕ∆-≈
两式来判断,如果pa pc
i i 与1相差很大或者ϕ∆与
0.058
z
相差很大则电极过程为不可逆电极 在表1中,可以计算得到pa pc
i i 的平均值为
=0.98pa pc
i i ,可以得出本实验电极过程的可
逆性较为理想的结论。
六、 注意事项
1. 电极预处理情况直接影响循环伏安图形,必须仔细清洗。
2. 通氮气除氧后必须等溶液静止1-2 min 再扫描。
七、 思考题
1. 解释K 3Fe(CN)6溶液的循环伏安图的形状。
答:在一定的扫描速率下,从起始电位正向扫描至转折电位期间,溶液之中的还原剂被氧化,产生氧化电流;当反向扫描由转折电位扫描至起始电位,氧化剂被还原,生成还原电流。
2. 如何利用循环伏安法判定极谱电极过程的可逆性
答:当氧化峰峰电流和还原峰的峰电流绝对值比值为一的时候,即可认为极谱电极的可逆性。
3. 若实验的ϕ∆,'ϕ与文献值有差异,试说明原因。
答:实验室的环境与文献中的标准环境有差异。
实验电极和溶液中存在杂质,导致实验误差。