粤教九年级上册化学《化学方程式》PPT课件
- 格式:doc
- 大小:373.00 KB
- 文档页数:6










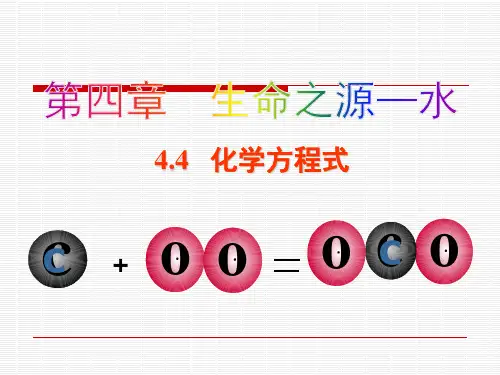
课题 4.4 化学反响方程式授课时间年月日课型新授课教学目标知识与技能1.了解化学反响方程式的意义2.能正确书写化学方程式, 初步学会化学方程式的配平方法过程与方法在理解化学方程式的根底上,使学生掌握常见化学反响方程式的书写情感态度与价值观通过化学式反响方程式涵义培养学生实事求是的科学态度教学重点化学反响方程式的书写教学难点化学方程式的配平教学准备教案教学方法阅读—交流:引导学生阅读教材, 结合质量守恒定律, 分别从定性、定量角度认识化学反响方程式的意义.启发—引导:在阅读交流过程中, 教师给予适当的提示和引导, 使学生更清晰的理解书写化学方程式的根本步骤.板书设计4.4化学方程式一、化学反响方程式1、定义:用化学式表示化学反响的式子.C+O2点燃CO22、意义及读法(1)质的方面:碳和氧气在点燃的条件下生成二氧化碳(2)量的方面:每32份质量的碳和32份质量的氧气完全反响, 生成44份质量的二氧化碳(3)微观方面:每一个碳原子和一个氧分子反响生成一个二氧化碳分子二、化学反响方程式的书写①写:写出反响物和生成物P+O2—P2O5②配:配平化学方程式〔左右两边各原子数目相等〕〔最小公倍数〕4P+5O2——2P2O5③标:标明反响条件和生成物的状态4P+5O2点燃2P2O5④等:⑤查:三、化学方程式配平方法:观察法最小公倍数法奇数配偶法待定系数法平安提示语不要再教室内奔跑做游戏, 小心碰到桌椅会有危险教学过程设计教师活动学生活动设计意图[引入]1、完成学案课前复习2、复习表示化学反响的式子—文字表达式[引入新课]用文字表达式表示化学反响较为复杂, 我们用形如这样的式子表示化学反响, 这样的式子叫做化学反响方程式.[放映总结]一、化学反响方程式1、定义:用化学式表示化学反响的式子.2、[过渡]C+O2点燃CO2从中能得到什么信息呢? 如何读出呢?[放映总结]〔1〕质的方面:碳和氧气在点燃的条件下生成二氧化碳〔2〕量的方面:每32份质量的碳和32份质量的氧气完全反响, 生成44份质量的二氧化碳〔3〕微观方面:每一个碳原子和一个氧分子反响生成一个二氧化碳分子[引入]一个化学反响方程式能表示很丰富的意义, 我们使用很方便, 那同学们一定想学习这个技能, 化学反响方程式如何书写呢?它必须遵循什么原那么呢?[总结]遵循客观事实, 写出反响物和生成物的化学式以质量守恒定律为依据, 反响前后原子种类数目相等[讲述]二、书写步骤写:写出反响物和生成物用短线连接例:P+O2——P2O5配:根据质量守恒定律配平4P+5O2——2P2O5〔最小公倍数〕标:标明反响条件和生成物状态点燃4P+5O2——2P2O5等:把短线改成等号查:检查方程式的原子个数是否守恒[放映总结1]化学反响方程式书写的本卷须知[活动一]总结归纳什么是化学反响方程式.[ 活动二]〔1〕说出从此反响中可得那些信息: C+O2点燃CO2〔2〕试读出以下反响方程式:2H2O通电O2 + H2[活动三]阅读找出化学反响方程式遵循的原那么[活动四]化学反响方程式书写练习让学生深刻体会用化学反响方程式表示化学反响的方便之处进一步加深化学反响方程式的意义的理解知道质量守恒定律在化学反响方程式中的应用无气生气, 加↑无固生固, 加↓[放映总结2]三、化学反响方程式配平1.观察法2.最小公倍数法〔适用条件:所配原子在方程式左右各只出现一次〕3.奇数配偶法〔适用条件:方程式中所配元素的原子个数的奇数只出现一次〕4.定一法〔适用条件:如大多数碳氢化合物或含碳氢氧的化合物与氧气的反响, 以及某些分解反响〕[课堂小结] 总结本节课内容[课后作业]1、完成常见化学反响方程式书写2、完成课后练习 [活动四]化学反响方程式书写练习[活动五]小结本节课内容本节课的重点,要求学生必须学会, 所以要多加练习.课后反思教学目标1.知识与技能(1)了解金属的共同的物理性质(2)了解金属的性质决定金属的用途(3)了解常见的合金(铝合金,生铁和钢)(4)能利用所学知识正确选择和利用金属材料2.过程与方法(1)学习运用观察、实验等方法获取信息。
(2)学习运用比较、分析、归纳等方法对获取的信息进行加工。
3.情感态度与价值观培养对生活中化学现象的好奇心和探究欲,激发学习化学的兴趣。
教学重点1.金属材料的物理性质。
2.物质性质与用途的关系。
教学难点:1.培养学生运用探究方法得出相关结论的能力。
2.提高学生综合分析问题的能力。
教学方法:创设情境→实验探究→得出结论→联系实际→拓展视野→发挥想象→提高兴趣。
学法指导:1.引导自主探究金属的物理性质。
2.在交流学习中认识常见的合金并了解其广泛的用途。
教具准备:金属制品(曲别针、铝箔等)、铜丝、铁丝、铝丝、铜片、合金材料教学过程:一、【引入】根据生活经验,你所知道的金属有哪些?【展示】1.常见金属的图片。
2.校园中所能见到的金属材料。
【教学目标展示】二、自主探究:知识点一:几种重要的金属1.金属材料:【自主学习】阅读教材P2,第一二自然段,完成【学案】内容:【学生展示、点评】1.金属材料。
2.金属材料的使用历史。
3.目前使用量最大的三种金属。
【拓展】金属材料的使用的先后顺序与什么有关?【展示】金属材料的使用历史相关图片。
2.金属材料的物理性质【自主学习】阅读课文P2-3,了解金属共同的物理性质和部分重要金属的特性。
【学生展示、点评】金属共有的物理性质。
【强调】共性中的不同。
(红铜黄金、汞是液态)【拓展】1.我们在春节写对联时和做装饰品时所用的“银粉”主要成分是什么?2.在制造餐具的材料中,铝、铁制品最多。
但需注意的是人体若摄入铝过量,可能导致大脑迟钝,而铁是人体必需的一种元素。
这也是为什么现在铝餐具渐渐淘汰,提倡用铁餐具的原因。
【过渡】我们总结了金属的这么多性质,那么它的性质和用途之间又有什么关系呢?主要是物质的性质决定物质的用途还是物质的用途决定物质的性质呢?3. 一些金属物理性质的比较【自主学习】阅读课本上的表8-1一些金属物理性质的比较。
【介绍解读】表8-1【学生分组讨论,交流】现在请大家根据我们的生活经验和课本上的表8-1所提供的信息,分组讨论以下问题。
(5分钟)1)为什么菜刀、镰刀、锤子等用铁制而不用铝制?2)银的导电性比铜好,为什么电线一般用铜制而不用银制?3)为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?4)为什么有的铁制品如水龙头等要镀铬?如果镀金怎么样?【展示】学生分组讨论后,由学生代表到陈述讨论结果,其他小组可宣布自己的不同答案。
4.性质与用途的关系【提问思考】根据以上讨论结果并结合实际思考物质的性质是否是决定其用途的唯一因素?如若不是,你认为还需考虑哪些因素?【总结,独立或集体回答】【过渡】事实上,目前已制得的纯金属只有90余种。
由于科学技术的日新月异,仅有的这些纯金属已经远远不能满足工农业生产和国防技术现代化的需求。
因此合金材料应运而生。
知识点二:合金1.合金【自主学习】请你阅读课本的P4—P6结束,然后完成学案相应练习【学生展示、点评】什么是合金?常见的合金有那些?【强调】①合金中至少有一种金属;②通过溶合成均匀液体凝固而成,合金的形成过程属于物理变化;③合金是不纯的金属,是混合物。
2、两种铁合金:【讲解】生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%.【拓展】主要区别是含碳量不同【过渡】下面,我们就通过实验来探究合金与组成它们的纯金属性质的差异。
3.合金与纯金属的性质比较【视频展示】合金与纯金属的硬度比较【学生得出结论】【教师总结】合金的硬度大于组成它们的金属【视频展示】实验二:比较焊锡、铅、锡熔点的高低【学生得出结论】【教师总结】合金的熔点低于组成它们的金属【实验结论】与纯金属相比,硬度一般都比纯金属更大、熔点一般都比纯金属更低、抗腐蚀性能力更强、用途更广;4.常见的合金【展示】最常见的合金——铜合金、铝合金图片【视频展示】钛的优质性能与应用被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
5.拓展:形状记忆合金(视频展示)三、课堂检测:【课堂练习】课本P81~3【学案】练习4、5四、【课堂小结】阅读P7“学完本课题你应该知道”五、【布置作业】1.课本P8 “练习与应用”4~62.【课后练习】:1~6六、板书设计:金属材料历史:Cu、Fe、Al用量:Fe 、Al、 Cu一.金属的物理性质1.固体、银白、电和热的良导体,延展性,密度大,熔点高。
2.用途:由性质决定。
二.合金1.定义:生铁和钢2.合金与组成它们的金属的性质差异【课后反思】:。