教师版专题六喷泉实验所得溶液物质的量浓度的有关计算
- 格式:doc
- 大小:505.00 KB
- 文档页数:5

第三节氨铵盐一、选择题1.用浓氯化铵溶液处理过的舞台幕布不易着火。
其原因是()。
①幕布的着火点升高②幕布的质量增加③氯化铵分解吸收热量,降低了温度④氯化铵分解产生的气体隔绝了空气A.①②B.③④C.①④D.②④解答:本题考查氯化铵的性质。
解:氯化铵分解需要吸收热量,从而降低环境温度,③正确;氯化铵分解产生的气体可以隔绝空气,④正确。
本题答案为选项B。
2.同温同压下,两只等体积的干燥圆底烧瓶中分别充满①和②,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为()。
A.①>②B.①<②C.①②D.不能确定解答:本题考查喷泉实验后所得溶液浓度的有关知识。
解:同温同压下同体积的情况下,气体的物质的量必然相等。
可设圆底烧瓶的体积为,所含气体的物质的量为。
由于氨气极易溶于水中,因此而二氧化氮与水会反应生成硝酸:所以。
可见两者浓度相同。
本题答案为选项C。
3.密度为氨水,质量分数为,该氨水用等体积水稀释后,所得溶液的质量分数为()。
A.等于B.大于C.小于D.无法确定解答:本题考查稀释后溶液浓度的计算。
解:质量分数为的氨水用等质量的水稀释后浓度为,已知氨水的密度小于水的密度,因此加入等体积的水稀释时,水的质量会大于氨水的质量,从而使浓度低于。
本题答案为选项C。
4.下列有关工业生产的叙述正确的是()。
A.合成氨生产过程中将液化后分离可增大正反应速率,提高、的转化率B.硫酸工业中在接触室安装热交换器是利用转化为时放出的热量C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的进入阳极室D.合成氨生产过程中,高温不利于平衡向正反应方向移动解答:本题考查工业生产的有关知识。
解:合成氨生产过程中将液化分离能提高、的转化率,但温度的下降会减小反应速率,所以选项A错误;硫酸工业中在接触室安装热交换器是利用二氧化硫催化氧化为时放出的热量,所以选项B错误;电解饱和食盐水,氯气是阳极产物,所以选项C错误;合成氨是放热反应,因此在生产过程中,温度升高会使平衡逆向移动,所以选项D正确。

高考化学复习重点知识专题讲解与练习专题十八、常见的喷泉实验及有关浓度的计算连线高考喷泉实验是课本叙述和演示的一个重要实验,是中学化学实验中的一个重要的知识点,同时也是高考常考内容,并且题型设计屡有创新,难度也在变化中递增。
我们通过实验操作的讨论、计算,不仅要了解溶于水的气体由压强变化形成的美丽喷泉的定性认识,更要掌握气体和溶液或气体和气体只要引起压强的剧烈变化都能形成这一实验现象的本质。
喷泉实验是历年高考试题中的热点,在高考中通常是以选择、填空、计算等形式来考查喷泉实验的原理、操作步骤、浓度的计算等。
通过对喷泉原理的定性和定量分析可以有效的训练培养学生的实验能力、思维能力、创新能力和解题能力。
重点、难点探源一、喷泉实验装置及原理1、喷泉形成的原理:容器内外存在较大的压强差,在这种压强差的作用下,液体迅速流动,通过带有尖嘴的导管喷出,即形成喷泉。
2、使容器内外产生较大压强差的两类情况(1)减小烧瓶内气体的压强产生喷泉容器内气体极易溶于水或容器内气体易与溶液中的溶质发生化学反应。
因此当外部的水或溶液接触容器内气体时,由于气体大量减少,从而使容器内气压迅速降低,在外界大气压作用下,外部液体迅速进入容器,形成喷泉。
气体与吸收剂形成喷泉的几种情况:气体HCl NH3CO2、Cl2、H2S、SO2NO2、O2吸收剂水、NaOH溶液水、盐酸NaOH溶液H2O①如图1所示,上部烧瓶已装满干燥氨气,能使水上喷的操作是:打开橡皮管上的止水夹,挤压滴管的胶头使少量水进入烧瓶。
该实验的原理是:氨气极易溶解于水,致使烧瓶内气体压强迅速减小。
②如图2所示,上部烧瓶已装满干燥氨气,能使水上喷的操作是:打开夹子,用手(或热毛巾等)将烧瓶捂热。
该实验的原理是:氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
或用冰水浇注烧瓶,降低烧瓶内氨气的温度,使烧瓶内的气体压强减少,水上升与氨气接触进一步减少压强形成喷泉。
(2)增大锥形瓶内气体的压强产生喷泉由于液体受热挥发(如浓盐酸、浓氨水、酒精等)或发生化学反应,使容器内产生大量气体,压强迅速增大,促使容器内液体迅速向外流动,也能形成喷泉。

(1)标准状况下,用氨气做喷泉实验,实验完毕后,液体进入烧瓶总容积的32。
假设溶质不外泄,则所得溶液的物质的量浓度为_____________。
(2)标准状况下,1体积水可以溶解700体积氨气,所以溶液的密度为0.90 g ·mL -1,则所得氨水的物质的量浓度为________________。
解析:(1)由c(NH 3·H 2O)=4.221=32ו4.2232=)()(13mol L L aq V NH n mol ·L -1。
c (NH 3·H 2O)=11111113•1000ו90.0•17ו4.22700+•1×1000•1000ו4.22700=)()(L mL mL g mol g mol L L mL g mL L mL mol L L aq V NH n =18.37 mol ·L -1。
通过本题(1)的计算,可以得出如下结论:①无论烧瓶内全部充满NH 3,还是部分充满NH 3,只要溶质不发生扩散,则浓度均为4.221 mol ·L -1。
②无论容器中充入的是NH 3,还是其他易溶于水的气体(如:HCl 、HBr 、SO 2),其浓度均为4.221 mol ·L -1。
③无论气体充入的是什么形状的容器,浓度仍为4.221 mol ·L -1。
理想气体状态方程(也称理想气体定律、克拉佩龙方程)是描述理想气体在处于平衡态时,压强、体积、物质的量、温度间关系的状态方程。
它建立在波义耳定律、查理定律、盖-吕萨克定律等经验定律上。
理想气体状态方程 对于混合理想气体,其压强p 是各组成部分的分压强p1、 p2、……之和pV =( p1+ p2+……)V =(n1+n2+……)RT,式中n1、n2、……是各组成部分的摩尔数。
可由理想气体严格遵循的气体实验定律得出,也可根据理想气体的微观模型,由气体动理论导出。

喷泉实验所得溶液浓度的计算陕西省兴平市西郊高级中学 孟建仓 李强喷泉实验是高中化学的一类重要实验,也是高考中的热点问题之一。
喷泉实验所得溶液物质的量浓度的计算是近年高考中出现的一种小类型题,很有特点。
本文把这种计算的类型和解法总结如下。
一、类型1.气体是溶质:如用3NH HI HBr HCl 、、、等和水进行的喷泉实验。
2.气体不是溶质:如用2NO 和水、2NO 和2O 的混合气体和水进行的喷泉实验。
二、解题思路解决这类问题可从物质的量浓度的计算公式出发,根据题意先确定所得溶液中溶质的物质的量和溶液的体积,再计算出物质的量浓度。
但题中一般没有具体的数值,而且关系比较复杂,所以把握好其中的两大关系是解题的关键:1.容器中的气体和所得溶液溶质的关系(气体是不是溶质,气体和溶质间有何定量关系);2.溶质气体(或生成溶质的气体)体积和溶液体积的关系。
三、例析标准状况下,在六个干燥的圆底烧瓶中分别充满:①纯净的3NH ,②混有少量空气的HCl ,③纯净的2NO ,④混有少量NO 的2NO ,⑤2NO 和2O [1∶4)(O ∶)(NO 22=V V ],⑥2NO 和2O [3∶4)(O ∶)(NO 22=V V ],分别和水进行喷泉实验,经充分反应后,所各溶液的物质的量浓度之比为( )。
A .1︰1︰1︰1︰1︰1B .3︰3︰2︰2︰3︰3C .5︰5︰5︰5︰4︰4D .无法计算解析:1.第①、②个烧瓶属第一种计算类型,其中的两大关系为:(1)气体或主要气体是所得溶液的溶质;(2)烧瓶中有多少体积的溶质气体,就能得到多少体积的溶液,即V (溶质气体)=V (溶液),而与杂质气体无关。
第①个烧瓶最终会充满溶液,V (溶液)=)(NH 3V =V (烧瓶);第②个烧瓶最终不会充满溶液,会剩有空气,V (溶液)=(HCl)V <V (烧瓶)。
设两烧瓶中HCl NH 3、的体积分别为L a 、L b ,则所得溶液的浓度分别为:)mol/L (4.2214.22=a a )mol/L (4.2214.22=b b2.后四个烧瓶属第二种计算类型,2NO 或2NO 和2O 均不是溶质,它们与水反应生成了硝酸,硝酸才是溶质。
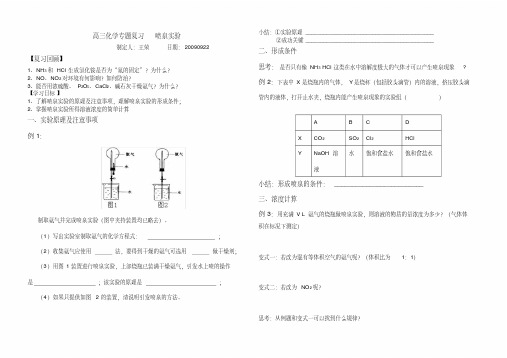
高三化学专题复习喷泉实验制定人:王荣日期:20090922【复习回顾】1、NH3和HCl生成氯化铵是否为“氮的固定”?为什么?2、NO、NO2对环境有何影响?如何防治?3、能否用浓硫酸、P2O5、CaCl2、碱石灰干燥氨气?为什么?【学习目标】1、了解喷泉实验的原理及注意事项,理解喷泉实验的形成条件;2、掌握喷泉实验所得溶液浓度的简单计算一、实验原理及注意事项例1:制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:;(2)收集氨气应使用法,要得到干燥的氨气可选用做干燥剂;(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是;该实验的原理是;(4)如果只提供如图2的装置,请说明引发喷泉的方法。
小结:①实验原理__________________________________________②成功关键__________________________________________二、形成条件思考:是否只有像NH3 HCl这类在水中溶解度极大的气体才可以产生喷泉现象? 例2:下表中X是烧瓶内的气体,Y是烧杯(包括胶头滴管)内的溶液,挤压胶头滴管内的液体,打开止水夹,烧瓶内能产生喷泉现象的实验组()A B C DX CO2SO2Cl2HClY NaOH溶液水饱和食盐水饱和食盐水小结:形成喷泉的条件:_________________________三、浓度计算例3:用充满V L氨气的烧瓶做喷泉实验,则溶液的物质的量浓度为多少?(气体体积在标况下测定)变式一:若改为混有等体积空气的氨气呢?(体积比为1:1)变式二:若改为NO2呢?思考:从例题和变式一可以找到什么规律?能力提升:将NO2和O2按4:1比例收集于试管中,将试管倒置于水槽中,静置后,①剩余气体体积?②求所得溶液浓度?【综合训练】(2005年南京市高三第三次质量检测)利用如图所示的装置,可以验证NH3和HCl 的有关性质.实验前a、b、c活塞均关闭.(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶I中不产生“喷泉”现象,其操作方法是。

关于“喷泉实验”的设计及浓度计算(4) 比较图甲和图乙的两套装置,从产生喷泉的原理分析,二者的不同点是______________________________________________________________【解析】(1)让烧瓶中(图甲)收集到的气体大量溶于水或让气体与接触到的溶液发生反应,引起烧瓶内的压强急剧降低,在外界大气压的作用下,烧杯中的液体迅速通过带有尖嘴的玻璃管喷入烧瓶,形成喷泉。
(2)将锥形瓶(图乙)设计成一个密闭容器,通过该密闭容器中液体的挥发或发生化学反应产生大量气体,使该密闭容器中压强迅速升高,将密闭容器中的液体压入烧瓶形成喷泉。
像城市中常见的人造喷泉、喷雾器喷雾以及火山爆发的原理均是利用了这种原理。
【答案】(1)B (2)D (3)A D 浓硫酸、烧碱溶于水时,放出大量的热,温度升高,使锥形瓶内酒精挥发加快,,瓶内压强增大,从而形成喷泉。
(4)图甲装置利用了减少烧瓶内压强,图乙装置利用了增大锥形瓶内压强。
五、各式各样的喷泉1、颜色各异的喷泉(2008年上海高考)右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。
挤压胶管的胶头,下列与试验事实不相符的是( ) A.CO2(NaHCO3溶液)无色喷泉B.NH3(H2O含酚酞)红色喷泉C.H2S(CuSO4溶液)黑色喷泉D.HCl(AgNO3溶液)白色喷泉【解析】CO2溶于水可发生以下反应:CO2+H2O H2CO3H++ HCO3- 由平衡移动原理可知,CO2在NaHCO3溶液中的溶解度很小,因此不能形成喷泉。
H2S + Cu2+= CuS ↓ + 2H+,CuS为黑色沉淀,故形成黑色喷泉。
D项中的Cl-与Ag+结合生成白色沉淀AgCl。
【答案】A2、双喷泉实验和HCl的利用如图所示的装置,可以验证NH3有关性质.实验前a、b、c活塞均关闭.(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶I中不产生“喷泉”现象,其操作方法是___________________________________________。
完整版)物质的量浓度的有关计算习题及答案详解1.将0.3摩尔的NaCl固体溶解于水中,配成200毫升的溶液,求该溶液的浓度是多少?答案:C,1.5摩尔/升。
解析:根据浓度的定义,浓度=物质的量/体积,所以c(NaCl)=0.3摩尔/0.2升=1.5摩尔/升。
2.有50毫升浓度为0.6摩尔/升的NaOH溶液,其中含有多少摩尔的NaOH?答案:A,0.03XXX。
解析:根据浓度的定义,浓度=物质的量/体积,所以n(NaOH)=0.05升×0.6摩尔/升=0.03摩尔。
3.下列哪个溶液中Cl的物质的量浓度与100毫升1摩尔/升的MgCl2溶液中Cl的物质的量浓度相同?答案:B,100毫升2XXX的NaCl溶液。
解析:题干中给出了MgCl2溶液中Cl的物质的量浓度为2摩尔/升。
各选项中Cl的物质的量浓度分别为A中4摩尔/升;B中2摩尔/升;C中8摩尔/升;D中4摩尔/升,故选B。
4.在一个浓度为0.5升的NaCl溶液中含有0.5摩尔的Na,下列哪个说法是不正确的?A。
该溶液的物质的量浓度为1摩尔/升。
B。
该溶液中含有58.5克NaCl。
C。
配制100毫升该溶液需要用5.85克NaCl。
D。
取100毫升该溶液倒入烧杯中,烧杯中Na的物质的量为0.1摩尔。
答案:B。
解析:根据浓度的定义,浓度=物质的量/体积,所以c(NaCl)=0.5摩尔/0.5升=1摩尔/升,所以A项正确;m(NaCl)=0.5摩尔×58.5克/摩尔=29.25克,所以B项错误;100毫升溶液中含NaCl的质量为5.85克,物质的量为0.1摩尔,所以C、D项正确。
5.有300毫升某浓度的NaOH溶液,其中含有60克溶质。
现在想要配制成1摩尔/升的NaOH溶液,应该取多少毫升的原溶液和蒸馏水?答案:A,1∶4.解析:首先计算出原溶液中NaOH的物质的量,n(NaOH)=60克/40克/摩尔=1.5摩尔。
然后根据浓度的定义,浓度=物质的量/体积,所以1摩尔/升的NaOH溶液中含有1摩尔的NaOH,所以需要1.5升的1摩尔/升的NaOH溶液。
关于“喷泉实验”的设计及浓度计算摘要:喷泉实验是高中化学实验的一个重要知识点,具有趣味性和综合性,在历年的高考中偶有出现。
本文主要是讲解喷泉的实验原理和相关的考察习题。
关键词:喷泉浓度计算喷泉实验具有趣味性、效果性、探究性和综合性,是中学化学实验中的一个重要的知识点,也是历年高考试题中的热点,题型的设计屡有创新。
本文就喷泉实验的形成原理和试题考查方式进行归纳分析,提升学生的思维能力。
一、探究喷泉实验的形成原理喷泉形成的原因是瓶内外存在压强差。
当烧瓶内气体溶于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内,形成美丽的喷泉。
见带有尖嘴的导管喷出红色的喷泉。
原因分析:氨气极易溶于水,烧瓶内压强瞬间变小,外界大气压将烧杯内的水压入烧瓶,形成红色喷泉(氨水呈碱性,遇酚酞变红)。
(必修一实验)二、分析喷泉实验成功的关键①盛气体的烧瓶必须干燥,否则甁中有液体,会使瓶口留下空气,形成的喷泉压力不大(喷泉”无力”);②气体要充满烧瓶;③烧瓶不能漏气(实验前应先检查装置的气密性);④所用气体能大量溶于所用液体或气体与液体快速反应。
三、形成喷泉的组合:①极易溶于水的气体(NH3、HCl、SO2等)与水可形成喷泉;②酸性气体(HCl、CO2、SO2、NO2、H2S等)与NaOH溶液可形成喷泉;③有机气体与其他物质反应也可形成喷泉。
四、阐释形成喷泉的方式1、负压型(减小压强):接纳喷泉的空间低于大气压,而喷起液体容器与大气相通,通常是烧瓶内气体极易溶于水或烧瓶内的气体与溶液反应,使烧瓶内的压强低于大气压。
2、正压型(增大压强):接纳喷泉的空间与大气相通,而喷起液体容器压强大于大气压。
通常是容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)或由于发生化学反应产生大量的气体。
例如:喷泉是一种常见的实验现象,其产生原因是存在压强差。
(1)在图甲的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。
下列组合中不可能形成喷泉的是A.HCl和H2O B.Cl2和H2OC.NH3和H2O D.CO2和烧碱溶液(2)在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是____________________A.Cu与稀盐酸 B.NaHCO3与NaOH溶液C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸(3)在图乙的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。
喷泉实验计算浓度的方法嘿,咱今儿就来唠唠喷泉实验计算浓度这档子事儿!你想想看,那喷泉实验多有意思啊,就像一场奇妙的魔法表演。
咱要从这魔法中找出计算浓度的门道来。
首先呢,咱得搞清楚这实验到底是咋回事。
就好比咱要去一个陌生的地方,得先知道路咋走不是?喷泉实验就是通过气体在液体中形成压强差,从而产生那美丽的喷泉效果。
那怎么用这个来计算浓度呢?这就好比解开一个谜题。
咱得抓住关键线索,也就是那些实验数据。
比如说,气体的体积啦,溶液的体积啦,等等。
比如说吧,咱有个实验,知道了气体的体积是多少,然后看看这喷泉喷得多高多壮观,再结合其他一些条件,就能算出浓度啦。
这就好像你知道了自己走了多少步,又知道目的地有多远,就能算出速度一样。
咱可不能马虎,得仔细分析每一个数据,就像侦探找线索一样。
要是漏了哪个关键信息,那可就全乱套啦。
然后呢,还得注意一些细节。
这就跟做饭似的,盐放多了太咸,放少了没味。
计算浓度也是一样,稍微有点偏差,结果可能就大不一样咯。
咱再打个比方,这就好比你要搭积木,每一块都得放对地方,不然整个塔就歪啦。
而且啊,做实验的时候可不能瞎糊弄,得认真对待。
这可不是闹着玩的,要是算错了浓度,那后面的研究不都白费啦?总之呢,喷泉实验计算浓度这事儿,说难也不难,说简单也不简单。
关键是咱得用心,得仔细,得把每个环节都搞清楚。
你想想,要是咱能熟练掌握这个方法,那以后再遇到类似的实验,不就轻松多啦?咱就能像个大侠一样,轻松应对,游刃有余。
所以啊,大家可得好好琢磨琢磨这其中的门道,多做做实验,多算算数据,相信你肯定能掌握这个神奇的方法!让我们一起在化学的世界里畅游,解开一个又一个的谜题吧!就这么定啦!。
物质的量浓度及相关计算1.溶液组成的两种表示方法 (1)物质的量浓度(c B )(2)溶质的质量分数(w )①概念:用溶质的质量与溶液质量的比值来表示溶液组成的物理量,一般用百分数表示。
②表达式:w =m (溶质)m (溶液)×100%。
2.物质的量浓度的有关计算 (1)物质的量浓度计算的两要素 ①溶质确定 与水发生反应生成新的物质: 如Na 、Na 2O 、Na 2O 2――→水NaOH ; SO 3――→水H 2SO 4;NO 2――→水HNO 3。
特殊物质:如NH 3溶于水后溶质为NH 3·H 2O ,但计算浓度时仍以NH 3作为溶质。
含结晶水的物质: CuSO 4·5H 2O ―→CuSO 4;Na 2CO 3·10H 2O ―→Na 2CO 3。
②溶液体积确定:不是溶剂体积,也不是溶剂体积与溶质体积之和,可以根据V =m (溶液)ρ(溶液)求算。
(2)计算类型①标准状况下,气体溶于水形成溶液的物质的量浓度的计算⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫溶质的物质的量n =V 气体22.4 L·mol -1溶液的体积V =m ρ=m 气体+m 水ρc =n V ②溶液中溶质的质量分数与物质的量浓度的换算推导过程(以1 L 溶液为标准):1 L(1 000 mL)溶液中溶质质量m (溶质)=1_000ρ×w g n (溶质)=1 000ρw M mol 溶质的物质的量浓度c =1 000ρw M mol·L -1。
(c 为溶质的物质的量浓度,单位mol·L -1,ρ为溶液的密度,单位g·cm -3,w 为溶质的质量分数,M 为溶质的摩尔质量,单位g·mol -1) ③溶解度与质量分数的关系某温度下饱和溶液质量分数(w )与溶解度(S )的换算公式:w =S100+S100%。
3.溶液稀释与混合的计算 (1)溶液稀释①溶质的质量在稀释前后保持不变,即m 1w 1=m 2w 2。
专题六喷泉实验所得溶液物质的量浓度的有关计算(教师版)主讲王文博喷泉实验具有趣味性、效果性、探究性和综合性,是中学化学实验中的一个重要的知识点,也是历年高考试题中的热点,题型的设计屡有创新。
本专题就喷泉实验的形成原理和试题考查方式进行归纳分析。
一、探究喷泉实验的形成原理掌握“喷泉实验”形成原理,需要搞清楚:是否只有水溶性很大的气体才能做喷泉实验?多大溶解度的气体才能做好喷泉实验?例题1、在做氯化氢的喷泉实验时,假设实验时所用的烧瓶容积为250mL,玻璃管长为35cm,胶头滴管内能挤出约为0.5mL的水,则在0.5mL水中要溶解多少体积的气体,水才能从尖嘴导管中喷出呢?(假设大气压强为一个标准大气压)解析:要使水通过玻璃管喷入烧瓶形成喷泉,瓶内外压强差必须超过一个特定的值,我们研究玻璃管中的一段水柱,这段水柱受到瓶内气体压力pS、重力mg及向上的大气形成的压力p0S。
要使水柱喷入瓶内,要求:p0S>pS+mg。
式中p0=ρgh,要以水柱计算,一个标准大气压相当于10.34m水柱产生的压强。
题中给出h为0.35m。
从而算出烧瓶内压强要求小于9.99m水柱产生的压强,减少的压强要求大于0.35m 水柱产生的压强。
根据气态方程(pV=nRT)可以求出,压强为0.35 m水柱高、体积为250mL的气体,当压强改变为1个标准大气压(即10.34m水柱形成的压强)的体积V的大小为8.50mL。
因而,当滴管内0.5mL的水挤压入烧瓶后,如能溶解1个标准大气压下8.50mL的以上的氨气,即有喷泉现象发生。
故要求气体的溶解度大于17(8.50/0.5)。
拓展:由本题给出的烧瓶数据不难得到除氨气外,HBr、HCl、SO2等气体的溶解度均大于17,均能形成美丽的喷泉。
(2)、(1)题中能形成喷泉的原因是____ _ __________________。
(3)某学生试图用氨气和水去做喷泉实验,结果实验失败,试分析实验失败可能的原因。
解析:(1)此题起点低,从课本知识点入手须深入理解喷泉实验的原理,再进行类比迁移。
具体思路为:HCl和NH3极易溶于水形成喷泉,再把概念外延,气体极易溶于某一溶剂或溶液便形成喷泉,选A、C。
(2)形成喷泉要知其所以然,该小题的能力要求显然高于(1)小题。
气体极易溶解(如有少量水进入后能溶解大量气体)。
导管容器内气体物质的量减小,容器内压强减小,容器内外产生较大压强差,从而形成喷泉。
(3)实验失败原因的分析则需要学生大胆假设,在理解基础上需进行创新。
其实验失败可能的原因有:制备氨气时烧瓶潮湿;装置漏气;滴入烧瓶里的水太少,导管又偏长;或氨气中混入了空气等。
答案:(1)AC (2)气体极易溶解,导致容器内压强减小,致使容器内外产生较大压强差,从而形成喷泉(3)制备氨气时烧瓶潮湿;装置漏气;滴入烧瓶里的水太少,导管又偏长;氨气中混入了空气等。
三、阐释形成喷泉的方式1、用“增大压强”的方式形成喷泉当液柱两端受到气体的压强处于平衡状态时,不会形成喷泉。
但当增大液体进入口端气体的压强时,可以破坏液柱的平衡,使液柱发生运动而形成喷泉。
在体积一定的情况下,要增大气体压强,可以采用升温的方法或增加气体的分子数方法。
升温可以用热水浇注或用手或热毛巾等将烧瓶捂热(物理方法),也可以用放热反应放热升温(化学方法);增加气体的分子数可以用打气机打入部分气体或使液体蒸发(物理方法),也可以用化学反应产生大量气体而增加气体的分子数(化学方法)。
2、用“减小压强”的方式形成喷泉当液柱两端受到气体的压强处于平衡状态时,不会形成喷泉。
但当减小喷出端气体的压强时,可以破坏液柱的平衡,使液柱发生运动而形成喷泉。
在体积一定的情况下,要减小气体压强,可以采用降温的方法或减少气体的分子数方法。
降温可以用冷水浇注(物理方法),也可以用吸热反应吸热降温(化学方法);减少气体的分子数可以用抽气机抽出部分气体(物理方法),也可以让气体大量溶解于液体之中而减少气体的分子数(化学方或物理方法)。
例题3、喷泉实验是中学化学的一个重要性质实验,也是一种自然现象。
其产生原因是存在压强差。
试根据附图,回答下列问题:(1)在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是()A.Cu与稀盐酸 B.NaHCO3与NaOH溶液 C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸(2)在图乙的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。
水槽中加入的物质不可能是()A.浓硫酸 B.生石灰 C.硝酸铵 D.烧碱 (3)城市中常见的人造喷泉及火山爆发的原理与上述_____ ___装置的原理相似。
(4)如果只提供如图丙的装置,引发喷泉的方法是________ ______。
解析: (1)题设的四个选项,既是对常见气体的制备方法的一个概括,又是对形成喷泉原理的一个深化,答案选D。
(2)浓硫酸、生石灰、烧碱溶于水时,放出大量的热,温度升高,酒精挥发加快,锥形瓶内压强增大,从而形成喷泉,而硝酸铵溶于水时,吸收大量的热。
故答案为C。
(3)图甲装置是因为上部烧瓶内气体压强突然减小而产生压强差形成喷泉;图乙装置恰恰相反,是因为下部锥形瓶气体压强增大而产生压强差形成喷泉。
并将视角转向生活与自然进行联想和比较。
故答案为乙。
(4) 方法一、打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉;方法二、烧瓶上覆盖冷毛巾或淋洒冷水,使烧瓶内温度降低,压强减小,从而引发喷泉;方法三、在烧瓶上涂抹无水乙醇,由于乙醇挥发带走热量使烧瓶内温度降低,压强减小,引发喷泉。
四、总结喷泉实验后浓度的计算喷泉实验所得溶液物质的量浓度的计算是近年高考中出现的一种小类型题,很有特点。
把这种计算的类型和解法总结如下。
1、类型⑴、气体是溶质:如用HCl、HBr、HI、NH3等和水进行的喷泉实验。
⑵、气体不是溶质:如用NO2和水、NO2和O2的混合气体和水进行的喷泉实验。
2、解题思路解决这类问题可从物质的量浓度的计算公式出发,根据题意先确定所得溶液中溶质的物质的量和溶液的体积,再计算出物质的量浓度。
但题中一般没有具体的数值,而且关系比较复杂,所以把握好其中的两大关系是解题的关键:①容器中的气体和所得溶液溶质的关系(气体是不是溶质,气体和溶质间有何定量关系);②溶质气体(或生成溶质的气体)体积和溶液体积的关系。
例4、标准状况下,在六个干燥的圆底烧瓶中分别充满:①纯净的NH3,②混有少量空气的HCl,③纯净的NO2,④混有少量NO的NO2,⑤NO2和O2[V(NO2)∶V(O2)=4∶1],⑥NO2和O2[V(NO2)∶V(O2)=4∶3],分别和水进行喷泉实验,经充分反应后,所各溶液的物质的量浓度之比为()。
A.1∶1∶1∶1∶1∶1 B.3∶3∶2∶2∶3∶3 C.5∶5∶5∶5∶4∶4 D.无法计算解析:(1).第①、②个烧瓶属第一种计算类型,其中的两大关系为:(1)气体或主要气体是所得溶液的溶质;(2)烧瓶中有多少体积的溶质气体,就能得到多少体积的溶液,即V(溶质气体)=V(溶液),而与杂质气体无关。
第①个烧瓶最终会充满溶液,V(溶液)=V(NH3)=V(烧瓶);第②个烧瓶最终不会充满溶液,会剩有空气,V(溶液)=V(HCl)<V(烧瓶)。
设两烧瓶中NH3、HCl的体积分别为aL、bL,则所得溶液的浓度分别为:(2)后四个烧瓶属第二种计算类型,NO2或NO2和O2均不是溶质,它们与水反应生成了硝酸,硝酸才是溶质。
由3NO2+H2O=2HNO3+NO可知③、④两个烧瓶中的具体情况为:n(HNO3)=(2/3)n(NO2),V(溶液)=(2/3)V(NO2)。
设两个烧瓶中的NO2分别为cL、dL,则溶液的浓度分别为:由4NO2+O2+2H2O=4HNO3可知第⑤、⑥两个烧瓶中的具体情况为:HNO3的物质的量是恰好完全反应的NO2和O2 (体积比4:1的总物质的量的4/5,溶液体积等于恰好完全反应的NO2和O2的总体积。
第⑤个烧瓶最终会充满溶液,第⑥个烧瓶不会充满,剩有过量的O2,但溶液与反应了的气体间的关系不受影响。
设两个烧瓶中恰好完全反应的NO2和O2的总体积为mL、nL,则溶液浓度分别为:综上所述,溶液的物质的量浓度之比为:1:1:1:1(4/5):(4/5),即5:5:5:5:5:4:4,故该题的答案为C。
巩固提高1.制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:(2)收集氨气应使用法,要得到干燥的氨气可选用做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是。
该实验的原理是。
(4)如果只提供如图2的装置,请说明引发喷泉的方法:。
答案(1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O (2)向下排空气碱石灰(3)打开止水夹,挤出胶头滴管中的水。
氨气极易溶解于水,致使烧瓶内气体压强迅速减小。
(4)打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
2. 在标准状况下,将O2与NO按3:4体积比充满一个干燥烧瓶,将烧瓶倒置于水中,最后烧瓶内溶液物质的量浓度约是()A.0.036mol/L B.0.026mol/L C .mol/L D.0.030 mol/L解析:在干燥瓶内O2与NO混合后立即发生发应 2NO +O2 = 2NO2,因此烧瓶中实际上充满的气体是NO2和O2,且V(NO2):V(O2) = 4:1,所以烧瓶倒置于水中,发生的反应实际上是 4NO2+ O2+2 H2O = 4 HNO3,即硝酸浓度为 4/22.4÷5=0.036(mol/L)。
3.在右图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。
则a和b分别是( )a(干燥气体)b(液体)A NO2水B CO24mol/LNaOH溶液C Cl2饱和NaCl水溶液D NH31mol/L盐酸3.BD4.喷泉实验是中学化学的一个重要性质实验,也是一种自然现象。
其产生的原因是存在压强差。
试根据附图,回答下列问题:(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。
下列组合中不可能形成喷泉的是 A.HCl和H 2O B.NH3和H2O C.NH3和苯 D.CO2和烧碱溶液(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后能产生喷泉现象的是A.Cu与稀盐酸 B.NaHCO3与NaOH溶液 C.大理石与稀硫酸 D.碳铵与稀硝酸(3)若图B的锥形瓶内是无水酒精,水槽内是冷水,则向水槽中加入足量的下列哪些物质也会产生喷泉现象? A.浓硫酸 B.生石灰C.氢氧化钡晶体与NH4Cl固体D.氢氧化钠固体(4)城市中常见的人造喷泉及火山喷发的原理与上述装置的原理相似。