气体动理论
- 格式:doc
- 大小:196.50 KB
- 文档页数:4


气体动理论的基本假设气体动理论是研究气体行为和性质的学科,它基于一系列假设和原理,用于解释气体分子的运动和相互作用。
这些假设是对实际情况的简化和理想化,使得我们能够通过数学模型更好地理解气体的行为。
本文将就气体动理论的基本假设进行探讨。
1. 气体分子是微观粒子气体动理论的基本假设之一是将气体看作是由大量微观粒子组成的物质。
这些微观粒子可以是分子,也可以是原子。
根据这一假设,气体的物态特性可以通过对这些微观粒子的运动和相互作用进行研究来解释。
这种假设可以追溯到19世纪早期,由波尔特曼和马克斯韦尔等人提出。
2. 碰撞是气体分子的基本作用基于气体分子是微观粒子的假设,气体动理论认为气体分子之间的碰撞是其基本作用。
这些碰撞会导致分子的运动和相互作用,从而决定了气体的性质。
在碰撞中,气体分子之间会交换能量和动量,使得气体分子的速度和方向发生改变。
碰撞的频率和能量转移的大小会受到温度等因素的影响。
3. 气体分子运动是无规则的气体动理论假设气体分子的运动是无规则的。
这意味着在宏观层面上,气体分子的运动是随机的,无法准确预测。
每个气体分子根据自身能量和速度的微小差异,会呈现出不同的运动轨迹和行为。
尽管分子的总体行为是未知的,但是通过大量气体分子的统计平均,可以得到气体的宏观性质,如压强、温度和体积等。
4. 分子之间的相互作用力可以忽略不计气体动理论的另一个基本假设是忽略气体分子之间的相互作用力。
这意味着在描述气体分子的运动时,我们不考虑分子之间的引力或斥力等相互作用。
这一假设在许多情况下是合理的,尤其是当气体分子之间的距离足够远时,相互作用力可以忽略不计。
因此,气体动理论可以建立在这种简化的假设下,更好地解释气体的宏观性质。
总的来说,气体动理论基于一系列假设和原理,用于解释气体分子的运动和相互作用。
这些基本假设包括气体分子是微观粒子、碰撞是气体分子的基本作用、气体分子运动是无规则的以及分子之间的相互作用力可以忽略不计。

气体动理论公式总结气体动理论是研究气体分子的运动规律和性质的科学理论。
在研究气体动理论时,我们常常会用到一些重要的公式来描述气体的状态和性质。
下面我们将对一些常用的气体动理论公式进行总结和归纳,以便更好地理解和应用这些公式。
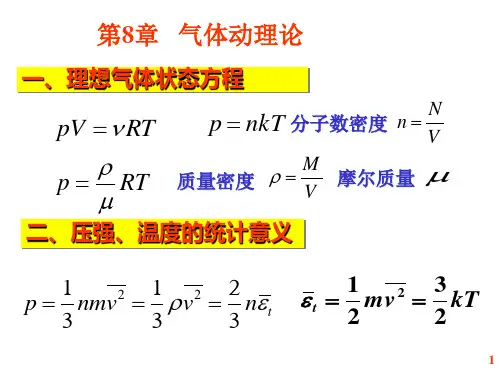
1. 理想气体状态方程。
理想气体状态方程是描述气体状态的重要公式之一,它表达了气体的压强、体积和温度之间的关系。
理想气体状态方程的数学表达式为:PV = nRT。
其中,P表示气体的压强,V表示气体的体积,n表示气体的物质量,R为气体常数,T表示气体的温度。
这个方程描述了理想气体在一定条件下的状态,对于理想气体的研究和应用具有重要意义。
2. 理想气体内能公式。
理想气体内能是气体分子的平均动能,它与气体的温度有直接的关系。
理想气体内能的数学表达式为:U = (3/2)nRT。
其中,U表示气体的内能,n表示气体的物质量,R为气体常数,T表示气体的温度。
这个公式表明了理想气体内能与温度的关系,对于研究气体的热力学性质和能量转化具有重要意义。
3. 理想气体压强公式。
理想气体的压强是描述气体状态的重要参数之一,它与气体的温度和体积有直接的关系。
理想气体压强的数学表达式为:P = (nRT)/V。
其中,P表示气体的压强,n表示气体的物质量,R为气体常数,T表示气体的温度,V表示气体的体积。
这个公式描述了理想气体的压强与温度、体积的关系,对于理想气体的状态和性质具有重要意义。
4. 理想气体密度公式。
理想气体的密度是描述气体物质分布的重要参数,它与气体的压强和温度有直接的关系。
理想气体密度的数学表达式为:ρ = (nM)/V。
其中,ρ表示气体的密度,n表示气体的物质量,M表示气体的摩尔质量,V 表示气体的体积。
这个公式描述了理想气体的密度与物质量、摩尔质量、体积的关系,对于理想气体的物质分布和性质具有重要意义。
5. 理想气体平均速度公式。
理想气体分子的平均速度是描述气体分子运动规律的重要参数,它与气体的温度和摩尔质量有直接的关系。


气体分子动理论气体分子动理论是物理学中研究气体行为的理论框架。
它基于原子和分子在气体中的微观运动,试图解释和预测气体的宏观性质。
本文将介绍气体分子动理论的基本原理和相关概念。
分子运动和气体行为气体由大量分子组成,这些分子在气体容器中不断运动,并与容器和其他分子发生碰撞。
气体的宏观性质,如温度、压力和体积,可以从分子的运动状态推导出来。
气体分子动理论通过研究分子之间的相互作用和运动规律,解释了气体的行为。
分子运动规律根据气体分子动理论,分子具有以下运动规律:1.分子无规则运动:分子在气体容器中呈现无规则、自由的运动状态。
它们在容器内沿不同方向高速运动,并不断改变运动方向和速度。
2.分子之间的弹性碰撞:分子之间发生弹性碰撞,碰撞后能量和动量守恒,但在碰撞中的分子可能会发生运动速度和方向的改变。
3.平均运动速度:分子的速度服从Maxwell-Boltzmann分布,即分子的速度呈现连续分布,平均速度与温度相关。
4.分子间距和碰撞:分子之间的距离很大,相对于分子的体积而言,分子之间的相互作用可以忽略不计。
然而,当分子靠近时,它们之间的碰撞会对气体的性质产生影响。
气体宏观性质的解释气体分子动理论通过分子的运动规律,解释了气体的一些宏观性质:1.压力:气体分子运动产生的碰撞力对容器壁施加压力,压力与分子速度和碰撞频率有关。
2.温度:气体分子的平均动能与其速度平方成正比,因此温度可以视为分子的平均运动速度的度量。
3.体积:气体分子之间的距离较大,在碰撞时每个分子所占的体积可以忽略不计,因此气体没有固定的形状和体积,可以完全填满容器。
气体状态方程气体状态方程描述了气体的状态和性质。
根据气体分子动理论,可以推导出理想气体状态方程:PV = nRT其中,P是气体的压力,V是气体的体积,n是气体的摩尔数,R是气体常数,T是气体的温度。
这个方程表明,在一定温度下,气体的压力和体积成正比,与摩尔数成正比。
该方程也可以用来推导气体的其他性质。

气体动理论公式总结气体动理论是研究气体分子在微观层面上的运动规律的一门学科。
它主要研究气体分子的速度、能量、碰撞等方面的性质。
气体动理论公式是描述气体分子运动规律的数学表达式,可以用来计算气体分子的平均速度、平均能量等参数。
下面将总结一些常见的气体动理论公式。
1. 理想气体状态方程理想气体状态方程描述了理想气体在一定温度、压力和体积下的状态关系。
它的数学表达式为:PV = nRT其中,P为气体的压力,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度。
2. 平均动能公式平均动能公式描述了气体分子的平均动能与温度之间的关系。
它的数学表达式为:K = (3/2)kT其中,K为气体分子的平均动能,k为玻尔兹曼常数,T为气体的温度。
3. 动量-速度关系动量-速度关系描述了气体分子的动量与速度之间的关系。
它的数学表达式为:p = mv其中,p为气体分子的动量,m为气体分子的质量,v为气体分子的速度。
4. 均方根速度公式均方根速度公式描述了气体分子的速度分布规律。
它的数学表达式为:v = √(3kT/m)其中,v为气体分子的均方根速度,k为玻尔兹曼常数,T为气体的温度,m为气体分子的质量。
5. 平均自由程公式平均自由程公式描述了气体分子在运动过程中与其他分子或壁面碰撞的平均距离。
它的数学表达式为:λ = (1/√2πd^2n)其中,λ为气体分子的平均自由程,d为气体分子的直径,n 为气体分子的密度。
6. 分子碰撞频率公式分子碰撞频率公式描述了气体分子碰撞的频率与气体分子数密度之间的关系。
它的数学表达式为:Z = 4πn(d^2)v其中,Z为气体分子的碰撞频率,n为气体分子的数密度,d 为气体分子的直径,v为气体分子的速度。
以上是一些常见的气体动理论公式总结,它们可以用来描述气体分子的运动规律和性质。
利用这些公式,我们可以进行气体的热力学计算和分析,深入理解气体的特性和行为。
同时,这些公式也为相关实验提供了理论基础,促进了气体动理论的发展。

气体动理论(kinetic theory of gases)是19世纪中叶建立的以气体热现象为主要研究对象的经典微观统计理论。
气体由大量分子组成,分子作无规则的热运动,分子间存在作用力,分子的运动遵循经典的牛顿力学。
根据上述微观模型,采用统计平均的方法来考察大量分子的集体行为,为气体的宏观热学性质和规律,如压强、温度、状态方程、内能、比热以及输运过程(扩散、热传导、黏滞性)等提供定量的微观解释。
气体动理论揭示了气体宏观热学性质和过程的微观本质,推导出宏观规律,给出了宏观量与微观量平均值的关系。
它的成功印证了微观模型和统计方法的正确性,使人们对气体分子的集体运动和相互作用有了清晰的物理图像,标志着物理学的研究第一次达到了分子水平。

气体分子动理论气体是物质存在的其中一种形态,它的分子运动对于我们理解气体的性质至关重要。
气体分子动理论是一种描述气体性质的科学理论,它通过解释气体分子的运动行为和碰撞规律,为我们提供了对气体行为的深入认识。
1. 分子运动的基本规律气体分子的运动有其基本规律,其中最重要的是玻尔兹曼分布规律。
根据玻尔兹曼分布规律,气体分子的速度分布服从高斯分布,即呈现一个钟形曲线。
这意味着气体分子的速度有一定的平均值,同时也存在一定的速度分散。
这种分布规律的存在,决定了气体的宏观性质,如压强、温度等。
2. 碰撞与压强气体分子之间的碰撞是气体压强产生的主要原因。
当气体分子运动速度较慢,分子之间碰撞不频繁时,气体的压强较低。
相反,当气体分子运动速度较快,分子之间碰撞频繁时,气体的压强较高。
根据气体分子动理论,气体压强与温度呈正相关,其数学关系为压强和温度的乘积与分子间平均速度的平方成正比。
3. 温度与分子速度气体分子运动的速度与气体的温度有着密切的关系。
根据气体分子动理论,气体温度与分子平均动能成正比。
换句话说,温度越高,气体分子的平均动能越大,分子的平均速度也会增加。
这也解释了为什么在相同温度下,不同气体的分子速度可能不同的原因。
例如,氢气分子较轻,根据等温分子速度公式,它的速度较大;而氮气分子较重,其速度相对较低。
4. 分子扩散与扩散速率分子扩散是气体分子运动的另一个重要现象。
根据气体分子动理论,气体分子会自发地从高浓度区域向低浓度区域扩散。
扩散速率受到多种因素的影响,如温度、分子间相互作用力以及分子质量等。
高温下的气体分子动能较大,扩散速率较快;而分子间的相互作用力越大,扩散速率越慢。
5. 分子间相互作用力气体分子间存在一定的相互作用力,这种作用力对气体性质有着重要影响。
分子间相互作用力可以分为吸引力和斥力。
对于吸引力较大的气体分子,它们的运动速度相对较慢,而分子间距离较小。
这种相互作用力称为范德华力。
相反,当气体分子间的斥力较大时,其运动速度较快,分子间距离较大,这种相互作用力被称为排斥力。


气体动理论公式总结气体动理论是研究气体运动的基本理论,涉及到气体的压力、体积、温度等性质。
在研究气态物质的行为和性质时,气体动理论公式是非常重要的工具。
本文将对一些常用的气体动理论公式进行总结和解析。
1. 状态方程公式状态方程是描述气体状态的物理方程,常见的状态方程包括理想气体状态方程和范德华方程。
理想气体状态方程:PV = nRT其中,P表示气体的压力,V表示气体的体积,n表示气体的摩尔数,R为气体常数,T表示气体的绝对温度。
范德华方程:(P + an^2/V^2)(V - nb) = nRT其中,a和b为范德华常数,和实际气体分子之间的作用有关。
2. 理想气体状态方程的推导理想气体状态方程可以通过气体分子的平均动能推导得到。
根据气体分子的平均运动能量定理,可得到以下公式:KE = (3/2)kT其中,KE表示气体分子的平均动能,k为玻尔兹曼常数,T表示气体的绝对温度。
另外,气体分子的动能与气体分子的速度和质量有关:KE = (1/2)mv^2其中,m为气体分子的质量,v为气体分子的速度。
将上述两个公式相等,可以得到:(1/2)mv^2 = (3/2)kT由此,可以推导出理想气体状态方程:PV = (1/3)Nm<v^2>其中,N为气体分子的个数,<v^2>表示气体分子速度的平方的平均值。
3. 分子平均自由程公式分子平均自由程是指气体分子在碰撞间隔期间所飞过的平均距离。
分子平均自由程与气体分子的摩尔数、体积和气体分子直径有关。
分子平均自由程的公式为:λ = (1/√2) * (V/nπd^2)其中,λ表示分子平均自由程,V表示气体的体积,n表示气体的摩尔数,d表示气体分子的直径。
4. 均方根速度公式气体分子的运动速度可以用均方根速度来描述,均方根速度是指所有气体分子速度平方的平均值的平方根。
均方根速度的公式为:v(rms) = √(3kT/m)其中,v(rms)表示气体分子的均方根速度。
气体运动理论气体是物质的一种形态,其分子在空间中自由运动并具有一定的独立性。
气体的运动行为被广泛研究,形成了气体运动理论。
本文将从分子速度分布、气体扩散、气体压强和气体温度等几个方面探讨气体运动的基本原理和相关理论。
一、分子速度分布气体分子在运动过程中具有不同的速度。
根据气体分子的速度分布可以揭示气体内部的动力学特性。
根据麦克斯韦-波尔兹曼速度分布定律,气体分子的速度服从高斯分布。
高斯分布的曲线呈钟形,其峰值对应着最常见的分子速度,而曲线两侧的尾部则表示了高速和低速分子的相对少见性。
高速分子的出现频率低于中等速度分子,而低速分子的出现频率也较低。
这一分布规律揭示了气体运动中分子速度分布的统计特性。
二、气体扩散气体扩散是指气体分子沿其浓度梯度自发传播的过程。
根据弗里克定律,气体扩散速率与气体分子的平均速度成正比,与气体分子的自由程成反比。
气体分子的平均速度越大,扩散速率越快;气体分子的自由程越小,扩散速率越慢。
气体扩散的速率还受到温度、压强和介质粘度等因素的影响。
温度升高会增加气体分子的平均速度,进而加快扩散速率;而压强升高会使气体分子更加密集,扩散速率也会相应增加。
介质的粘度越小,气体分子的碰撞频率越低,扩散速率越大。
三、气体压强气体的压强是指气体分子对容器壁面单位面积所产生的压力。
根据动理学理论,气体压强与气体分子的碰撞频率和分子速度的平均平方值成正比。
气体分子的碰撞频率与分子浓度成正比,分子速度的平均平方值与温度成正比。
因此,气体的压强与气体的浓度、温度和分子质量有关。
四、气体温度气体的温度是指气体分子运动的热度程度。
根据运动理论,气体分子的速度与温度成正比。
气体温度的单位是开尔文(K),其与摄氏度(℃)的换算关系是K = ℃ + 273.15。
绝对零度为0K,即-273.15℃,在此温度下气体分子的速度趋近于零。
随着温度的升高,气体分子的速度和能量也相应增加。
结语气体运动理论是研究气体分子运动行为的重要理论体系。
7-4 一个能量为12
10ev 的宇宙射线粒子,射入一氖气管中,氖管中含有氦气0.10mol,如果宇宙射线粒子的能量全部被氖气分子所吸收而变为热运动能量,问氖气的温度升高了多少? 分析 对确定的理想气体,其分子能量是温度的单值函数,因此能量的变化对应着温度的变化。
由能量守恒求解氖气的温度变化。
解: 依题意可得:
23
12193
0.1 6.0210 k T 10 1.6102
-⨯⨯⨯
∆=⨯⨯ 7
71.610 1.28100.1 6.02 1.5 1.38
T K -=⨯∆=
=⨯⨯⨯⨯ 7-5 容器内贮有1摩尔某种气体。
今自外界输入2
2.0910⨯焦耳热量,测得气体温度升高10K.求该气体分子的自由度。
分析 理想气体分子能量只与自由度和温度有关。
解: ,2A i E N k T ∆=∆222 2.091056.02 1.3810
A E i N k T ∆⨯⨯∴===∆⨯⨯
7-7 温度为27C ︒时,1mol 氢气分子具有多少平动动能?多少转动动能? 分析 气体的能量为单个分子能量的总合。
解:2323333
6.0210 1.3810300 3.741022t A
E N kT J -==⨯⨯⨯⨯⨯=⨯ 23233
226.0210 1.3810300 2.491022
r A E N kT J -==⨯⨯⨯⨯⨯=⨯
7-8有33210 m ⨯刚性双原子分子理想气体,其内能为26.7510 J ⨯。
(1) 试求气体的压强;
(2) 设分子总数为 225.410 ⨯个,求分子的平均平动动能及气体的温度. 分析 将能量公式2i E N
kT =结合物态方程N
P kT V
=求解气体的压强。
由能量公式2
i
E N
kT =求解气体的温度。
再由气体的能量为单个分子能量的总合求解单个分子的平均平动动能。
解:(1) 设分子数为N 。
2i N
E N kT P kT V
==据
及 52 1.3510E
P pa iV
=
=⨯得
(2) 3252
kt
kT E N kT ε=由
得 ()213/57.510kt E N J ε-==⨯ 又 kT N E 2
5= 得 23625E
T K Nk
==
7-10 2L 容器中有某种双原子刚性气体,在常温下,其压强为51.510pa ⨯,求该气体的内能. 分析 内能公式与物态方程结合可将内能公式表述为压强与体积的函数。
解:据RT M m
PV =
, 5355
1.510210750222
m i E RT pV J M -=
==⨯⨯⨯⨯= 7-12温度为273K ,求(1)氧分子的平均平动动能和平均转动动能(2)3410kg -⨯氧气的内能. 分析 分子的能量只与自由度与温度有关,分析分子的平动自由度和转动自由度即可求解平均平动动能和平均转动动能。
而内能只需根据内能公式求解。
解:氧分子为双原子分子。
其平均自由度t=3,转动自由度r=2.当视为刚性分子时,振动自由度s=0.所以:
(1) 氧分子的平均平动动能和转动动能分别为:
232133 1.3810273 5.651022kt kT J ε--==⨯⨯⨯=⨯
232122
1.3810273 3.771022
kr kT J ε--==⨯⨯⨯=⨯
(2) 当3410m kg -=⨯时,其内能为:
()32
3
41058.312737.0910232102
t r m E RT J M --+⨯=⋅=⨯⨯⨯=⨯⨯ 7-13 在相同温度下,2摩尔氢气和1摩尔氦气分别放在两个容积相同的容器中。
试求两气体(1)分子平均平动动能之比;(2)分子平均总动能之比;(3)内能之比;(4)方均根速率之比;(5)压强之比(6)密度之比.
分析 此题是平均平动动能公式、分子平均总动能公式、内能公式、方均根速率公式、理想气体物态方程等的应用。
解: 因为氢气的自由度i=5;氦气的自由度i=3 (1) 3
1:12
kt kt kt kT εεε==氢氦: (2) 5:32
k k k i E kT
E E ==氢氦:
(3)RT i
M m E 2⋅=
,3:10=:氦氢E E (4) M
RT V 32= ,2:22
2=氦氢:V V (5)N P nkT kT V ==
, :2:1P P =氢氦 (6) PM RT
ρ=,1:1=:氦氢ρρ
7-14 已知()f v 是气体速率分布函数。
N 为总分子数,,n 为单位体积内的分子数,。
试说明以下各式的物理意义。
21(1)()(2)()(3)()v Nf v dv
f v dv
Nf v dv v ⎰ 2
1(6)()v f v dv v ⎰ 分析 根据速率分布函数()dN
f v Ndv =中的各个物理量的概念(有的问题需结合积分上下
限)比较容易理解各种公式的含义。
解:
(1)dv v Nf )(表示分布在(dv v v +~)]范围内的分子数
(2)dv v f )(表示(dv v v +~)范围内的分子数占总分之数的百分比
(3)
dv v v v Nf ⎰2
1
)(表示速率在(1
2v
v )之间的分子数
(6)
2
1
()v f v dv v ⎰
表示速率在(1
2v v )区间内的分子数占总分之数的百分比.
7-15 N 个粒子的系统,其速度分布函数 C Ndv
dN
v f ==
)( 0(0,v v c <<为常数)
(1)根据归一化条件用定出常数C; (2) 求粒子的平均速率和方均根速率.
分析 将分布函数定义,用归一化条件用定出常数C 。
根据定义计算平均速率和方均根速率。
解:(1) 根据归一化条件
00
1
()11v f v dv Cdv Cv C v ∞
===∴=
⎰
⎰
,
, (2) 000
01()2
v
v vf v dv vCdv v ∞
=
==⎰
⎰
00==
=
=
7-17 已知某气体在温度273T K =,压强2
1.010P atm -=⨯时,密度
,1024.112--⋅⨯=L g ρ求(1)此气体分子的方均根速率;(2)此气体的摩尔质量并确定它是
什么气体.
分析 首先根据物态方程确定气体的摩尔质量,代入方均根速率公式即可。
解:(1) ,m RT
P RT RT M MV M
P
ρρ===
214.9510m s -=
=⨯⋅
(2) 2122.810,RT
M kg mol N CO p
ρ--=
=⨯⋅或
7-19 设容器内盛有质量为1m 和质量为2m 的两种不同单原子分子理想气体,并处于平衡态,其内能均为E .则此两种气体分子的平均速率之比为多少?
分析 在一容器内温度相同,都为单原子分子则自由度都为3,根据内能公式和平均速率的公式即可求解。
解: 2,2
m i RT E
E RT M M im
=
⋅∴
= M
RT
v π8=
,所以:1
2
21:m m v v = 7-21 电子管的真空度在27C ︒时为51.010mmHg -⨯,求管内单位体积的分子数及分子的平均自由程.设分子的有效直径10
3.010
d m -=⨯。
分析 应用物态方程的变形公式P nkT =可得到分子数密度,代入平均自由程公式即可。
解:52173
23
1.010 1.3310,
3.22101.3810300
P P nkT n m kT ---⨯⨯⨯====⨯⨯⨯
λ=
()2101717.83.010 3.210
m -==⨯⨯⨯⨯ 此结果无意义,因为它已超过真空管的长度限度。
实际平均自由程是真空管的长度。