化学反应的速率方程课件分解
- 格式:ppt
- 大小:459.50 KB
- 文档页数:40






第三章化学反应速率化学动力学(chemical kinetics):研究化学反应速率的科学 .主要研究 :化学反应速率的理论反应机理影响反应速率的因素第一节化学反应速率和反应机理一化学反应速率表示方法化学反应速率(rate of a chemical reaction):衡量化学反应过程进行的快慢,即反应体系中各物质的数量随时间的变化率。
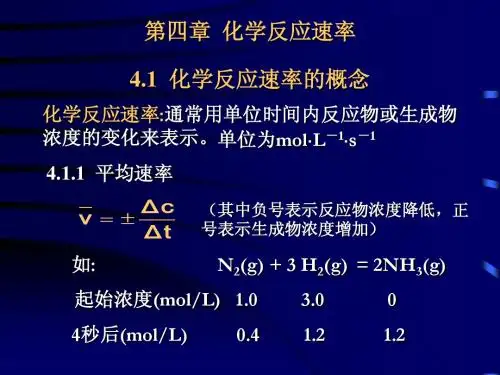
反应速率:平均速率瞬时速率过氧化氢(H2O2)水溶液的分解反应为:H2O2(aq)H2O(l) +12O2(g)I-v00.80200.400.40/20=0.020400.200.20/20=0.010600.10t /min[H 2O 2]/ (mol ⋅L -1)/(mol ⋅L -1⋅⋅min -1)800.050表7-1 H 2O 2水溶液在室温时的分解0.10/20=0.005 00.050/20=0.002 5平均速率(average rate) :瞬时速率(instantaneous rate) :令Δt 趋近于零时的速率。
通常所表示的反应速率均指瞬时速率。
tc v Δ)O H (Δ22-=tc t cd )O (H d O (H lim 2222-=∆∆-=)v反应的瞬时速率可通过作图法求得。
20min时H2O2分解的瞬时速率,A点切线的斜率,去负号即可.如合成氨的反应 :N 2 + 3H 2 ==== 2NH 3一般地,对于化学反应aA + bB = gG + hH 其反应速率定义为:tc t c t c t c νt ξVd NH d d H d d N d d d d d 1B B )(21)(31)(111322=-=-=⋅=⋅=v二 反应机理概念反应机理(reaction mechanism):就是化学反应进行的实际步骤,即实现该化学反应的各步骤的微观过程。
H 2(g)+I 2(g)2HI(g)I 2(g)2I(g)快反应)慢反应(速率控制步骤)H 2(g)+2I(g)2HI(g))2(g)2I(g)快反应(1)慢反应(速率H 2(g)+2I(g)2HI(g)(2)(一)基元反应和非基元反应(基)元反应(elementary reaction)是指反应物分子一步直接转化为产物分子的反应。



