丝状噬菌体展示
- 格式:ppt
- 大小:367.50 KB
- 文档页数:43
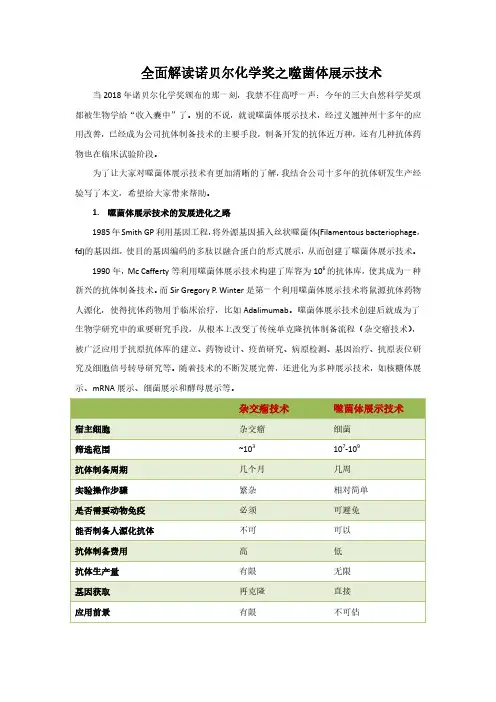
全面解读诺贝尔化学奖之噬菌体展示技术当2018年诺贝尔化学奖颁布的那一刻,我禁不住高呼一声:今年的三大自然科学奖项都被生物学给“收入囊中”了。
别的不说,就说噬菌体展示技术,经过义翘神州十多年的应用改善,已经成为公司抗体制备技术的主要手段,制备开发的抗体近万种,还有几种抗体药物也在临床试验阶段。
为了让大家对噬菌体展示技术有更加清晰的了解,我结合公司十多年的抗体研发生产经验写了本文,希望给大家带来帮助。
1.噬菌体展示技术的发展进化之路1985年Smith GP利用基因工程,将外源基因插入丝状噬菌体(Filamentous bacteriophage,fd)的基因组,使目的基因编码的多肽以融合蛋白的形式展示,从而创建了噬菌体展示技术。
1990年,Mc Cafferty等利用噬菌体展示技术构建了库容为106的抗体库,使其成为一种新兴的抗体制备技术。
而Sir Gregory P. Winter是第一个利用噬菌体展示技术将鼠源抗体药物人源化,使得抗体药物用于临床治疗,比如Adalimumab。
噬菌体展示技术创建后就成为了生物学研究中的重要研究手段,从根本上改变了传统单克隆抗体制备流程(杂交瘤技术),被广泛应用于抗原抗体库的建立、药物设计、疫苗研究、病原检测、基因治疗、抗原表位研究及细胞信号转导研究等。
随着技术的不断发展完善,还进化为多种展示技术,如核糖体展示、mRNA展示、细菌展示和酵母展示等。
噬菌体展示技术(phage display)是将外源编码多肽或蛋白质的基因通过基因工程技术插入到噬菌体外壳蛋白结构基因的适当位置,在阅读框能正确表达,使外源多肽或蛋白在噬菌体的衣壳蛋白上形成融合蛋白,随子代噬菌体的重新组装呈现在噬菌体表面,可以保持相对的空间结构和生物活性。
然后利用靶分子,采用合适的淘洗方法,洗去未特异性结合的噬菌体。
再用酸碱或者竞争的分子洗脱下结合的噬菌体,中和后的噬菌体感染大肠杆菌扩增,经过3-5轮的富集,逐步提高可以特异性识别靶分子的噬菌体比例,最终获得识别靶分子的多肽或者蛋白。


单链丝状噬菌体展示系统、λ噬茵体展示系统和T4噬茵体展示系统一、单链丝状噬茁体展示系统1、pIII展示系统及噬苗体抗体丝状噬茵体是单链DNA病毒,pIII是病毒的次要外完蛋白(minor coat protein)、位于病毒颗粒的一端,每个病毒颗粒都有3—5个拷贝pIII蛋白,pIII有两个位点可供外源序列插入,即N端和近N端可伸屈胃内。
当抗体片段或蛋白质融合到PIII的N端时,噬菌体仍有感染性,但若融合到后一位点则会切去N端而丧失感染性,这时就需有辅助噬菌体提供野生型 pIII蛋白。
PIII很容易为蛋白水解酶水解。
所以有辅助噬菌体超感染时.可以使每个噬菌体平均显示不到一个融合蛋白,即所谓“单价“噬茵体,从而使抗体部分最大限度地保持原构型而功能完好。
PIII展示系统的主要用途是制备噬茵体抗体,它的突出优点是模拟了自然免疫选择系统。
自然免疫系统中.抗原结合于B细胞表面受体而使其活化并分裂增殖、分化成有抗体分泌功能的浆细胞。
这个过程可以从约5×109个鼠细胞和约1012人细胞中选出一个至几个特异B细胞,并有选择性地富集特异性B细胞,通过多轮突变和选择使抗体亲和力成熟。
pIII展示系统完全模拟了自然选择系统;噬菌体展示的抗体片段可以由抗原包被的板、柱等选择,或者用生物素标记的抗原从液相中捕获。
结合在固相抗原的噬茵体抗体经洗涤后可用可溶性半抗原、酸、碱等洗脱,然后感染大肠杆菌培养扩增,再经下一轮的“吸附—洗脱—扩增”筛选。
首轮筛选可使特异性噬菌体富集20一1000倍,一般经4轮筛选,可富集107倍。
对初步筛选的抗体,可以用错构酶及PCR锗配技术等实行多轮突变或采用链置换法使其亲和力成熟。
用PIII系统制备抗体的基本程序是:从经免疫或未免疫者获取淋巴细胞(外周血淋巴细胞,或脾、淋巴结、骨髓等的淋巴细肥),提取细胞mRNA(或细胞基因组DNA),逆转录成cDNA,用PCR方法扩增抗体重链和轻链基因,若制备ScFv抗体片段,还需设计接头Linker,如(Gly 4— Ser),做成VH—Linker—VL连接)。


噬菌体展示技术的原理和方法噬菌体展示技术是一种利用噬菌体表面展示特定肽段或蛋白的技术。
这项技术自20世纪80年代问世以来,已在许多领域显示出广阔的应用前景,包括药物研发、疫苗设计、蛋白质相互作用研究等。
本文将详细介绍噬菌体展示技术的原理和方法,并探讨其优缺点和发展趋势。
噬菌体展示技术利用的是噬菌体的特性,噬菌体是一种病毒,专门感染细菌等微生物。
它们由蛋白质外壳和内部遗传物质组成,其中蛋白质外壳又由多个蛋白亚基组成。
噬菌体展示技术利用噬菌体表面展示特定的肽段或蛋白,这些肽段或蛋白可以来自天然蛋白质,也可以是人工合成的。
展示在噬菌体表面的这些肽段或蛋白能够与特异性受体结合,从而实现表面展示的功能。
噬菌体展示技术的关键之一是选择合适的展示载体。
载体通常是一种丝状噬菌体,其基因组可以容纳较小的外源基因片段。
常用的载体包括M filamentous phage等。
这些载体具有一些共同的特性,如对外源蛋白质的容纳能力较强,能在体内和体外环境中稳定存在等。
在噬菌体展示技术中,需要筛选出能感染特定细菌的噬菌体。
这些噬菌体可以是自生的,也可以是通过基因工程改造得到的。
在筛选过程中,可以利用不同细菌的特性,如受体类型、细胞壁结构等,来选择合适的噬菌体。
还需要考虑噬菌体的毒性、繁殖能力等因素。
在噬菌体展示过程中,需要反复感染以积累足够数量的展示肽段或蛋白。
这个过程中,通常需要使用超滤或凝胶过滤等手段对噬菌体进行纯化,以确保得到的展示肽段或蛋白的纯度和浓度。
反复感染的过程不仅可以增加展示肽段或蛋白的数量,还能帮助排除展示过程中可能产生的突变。
克隆选择是噬菌体展示技术的另一个关键步骤。
这个过程中,通过将展示肽段或蛋白与特定配体结合,筛选出能够与配体结合的克隆。
这些克隆可以进一步扩增和纯化,从而获得高亲和力和高特异性的克隆。
噬菌体展示技术的优点在于其能够将蛋白质或多肽特异性与噬菌体的生物学特性相结合,从而实现表面展示的功能。






噬菌体展示技术在生物检测中的应用摘要:噬菌体展示技术(Phage display technology,PDT)是通过将外源基因与噬菌体基因组中编码外壳蛋白的基因融合,在噬菌体侵染宿主细胞后,能够将目的基因编码的多肽展示在噬菌体表面的技术。
噬菌体展示技术已被用于药物开发、肿瘤研究以及免疫学等领域。
本文主要介绍噬菌体展示技术的基本原理以及该技术在真菌毒素、农药等生物检测上的应用。
关键词:噬菌体展示技术;生物检测;真菌毒素;农药Phage Display Technology and Its Application in BiologicalDetectionGuan Pang Academic advisor: Yongheng LiangAbstract:Phage display technology is a technology which fuses exogenous gene and phage gene encoding phage coat protein,which can display the protein encoded by target gene on phage surface after infecting the host cell. Nowadays, phage display technology has been used in the fields of drug development, cancer research and immunology. This paper mainly introduces the basic principle of phage display technology and its application in mycotoxin and pesticide detection.Key words: Phage display technology;biological detection;mycotoxin;pesticide噬菌体展示技术是最早是由美国的Smith GP创建,首次将外源基因插入丝状菌体f1的基因Ⅲ,使目的基因编码的多肽展示在噬菌体表面[1]。
噬菌体展示[3篇]以下是网友分享的关于噬菌体展示的资料3篇,希望对您有所帮助,就爱阅读感谢您的支持。
噬菌体展示(一)测定噬菌体滴度只有当噬菌体的感染复度MOI (噬菌体数/细菌数)值远低于1时(即细菌过量时),噬菌斑的数量才会随着加入噬菌体的量而呈线性增加。
正因如此,建议检测噬菌体贮液的滴度时,在感染前进行稀释,而不是在高MOI值的情况下稀释被感染的细胞。
低MOI值有助于确保每个噬菌斑仅含一个DNA序列。
1. 接种ER2738单菌落于5-10 ml LB培养基中,摇床培养至对数中期(OD600 ~0.5)。
2. 细胞生长时,微波炉融化上层琼脂,分成3 ml等份于灭菌试管中,每个噬菌体稀释度一管。
保存于45℃备用。
3. 37℃预温LB/IPTG/Xgal平板,每个噬菌体稀释度取一个平板备用。
4. 在LB中准备10倍系列稀释的噬菌体。
建议稀释范围:扩增的噬菌体培养物上清:108-1011;未扩增的淘选洗脱物:101-104。
每个稀释度换一新鲜吸头,建议使用带滤芯吸头以避免交叉污染。
5. 当菌体培养物达对数中期,分成200 μl等份于微量离心管中,每个噬菌体稀释度一管。
6. 每管加入10 μl不同稀释度的噬菌体,快速震荡混匀,室温温育1-5 min。
7. 将感染细胞加入45℃预温的上层琼脂培养管中,每次一管,快速混匀,立即倾注于37℃预温的LB/IPTG/Xgal平板上。
适当倾斜平板将上层琼脂均匀铺开。
8. 待平板冷却5 min后,倒置于37℃培养过夜。
9. 检查平板,计数有~102个噬菌斑的平板上的斑数。
然后用此数目乘以稀释因子即得到每10 μl噬菌体的空斑形成单位(pfu)滴度。
淘选程序最简单直接的淘选方法有:直接将靶分子包被于塑材表面(通过非特异的疏水作用或静电相互作用),洗去过量的未吸附分子,然后将噬菌体库覆盖在已包被的靶分子的表面。
根据靶分子的不同,直接包被法偶尔会导致配体结合位点难以进入,这或许是由于分子的立体封阻或许是由于靶分子表面的部分变性而引起。
噬菌体展示技术在及其在食品检测上的应用摘要:本文介绍了噬菌体展示技术的原理、分类和筛选方法,综述了噬菌体表面展示技术在检测食品有害小分子物质中的应用,展望这种技术目前存在的不足与今后发展的方向。
关键词:噬菌体展示技术、食品检测1噬菌体展示技术的原理和内容作为一项已广泛运用的技术,噬菌体展示是一种将外源肽或蛋白质与特定噬菌体衣壳蛋白融合并展示于噬菌体表面的技术[1]。
它将外源基因插入到噬菌体展示载体的信号肽基因和衣壳蛋白编码基因之间,从而使外源基因编码的多肽或蛋白质与外壳蛋白以融合蛋白质形式展示在噬菌体表面,被展示的外源肽或蛋白质可保持相对独立的空间结构和生物活性。
与其他表达系统相比,噬菌体展示技术可将基因型和表型、分子结合活性与噬菌体的可扩增性结合在一起,实现了基因型和表型的转换,是一种高效的筛选系统。
噬菌体显示技术主要包括三方面内容(图1):一是通过DNA重组的方法插入外源基因,形成的融合蛋白表达在噬菌体颗粒的表面,同时保持外源蛋白的天然构象,不影响噬菌体的生活周期,也能被相应的抗体或受体所识别;二是筛选目的噬菌体,利用固定于固相支持物的靶分子,采用适当的淘洗方法,洗去非特异结合的噬菌体,筛选出融合噬菌体;三是外源多肽或蛋白质表达在噬菌体的表面,而其编码基因作为病毒基因组中的一部分可通过分泌型噬菌体的单链DNA测序推导出来[2]。
噬菌体亲和筛选的方法包括直接法和间接法,前者是将蛋白质分子偶联到固相支持物上,加入噬菌体肽库,与固相支持物温育,洗去未结合的噬菌体,既获得亲和噬菌体,其中固相支持物有很多,包括树脂、各种尺寸的珠子、96孔板甚至可用于分析的生物传感芯片;后者是将生物素标记的蛋白质分子与文库噬菌体温育后铺在结合有链亲和素的平皿上,洗去未结合的噬菌体,保留结合状态的噬菌体,再洗脱结合的噬菌体,用这部分噬菌体感染细菌,扩增噬菌体,开始新一轮的筛选,通过吸附、洗脱、扩增的重复过程,就能选择性地富集并特异性扩增结合这种蛋白质或DNA分子的噬菌体。
噬菌体展示肽库的筛选方法及其应用1985年,SmithGP利用基因工程手段将一段外源肽序列展示在丝状噬菌体的表面[1]。
1988年[2]他们又将合成的随机序列的寡核苷酸片段克隆到丝状噬菌体,表达后每个噬菌体粒子的表面展示一种肽段,所有这些展示不同肽段的噬菌体构成了噬菌体展示肽库。
1990年,他们通过亲合筛选,得到了与特定蛋白结合的结合肽,并由于噬菌体表达的肽与编码基因直接相关,扩增和分离目的克隆后,很容易得到其DNA序列[3]。
这样就建立了噬菌体表面展示的随机肽库技术,这项技术一经产生就显示其无与伦比的生命力,被广泛用于生命科学的各个领域,并带来广泛而深远的影响。
传统的药物筛选大多数是从自然界的动、植物及微生物中分离天然的具有特定药理作用的化学物质,然后直接应用或再以此作为药物化学的先导化合物,再进一步设计、加工、合成,筛选有效的功能药物。
此方法具有一定的盲目性,筛选周期长。
而采用分子进化工程技术则会大大加速这一过程。
根据所需要的药物特性,选用适当的方法构建含有大量异质性分子的组合库,用靶分子进行筛选,先筛选药物先导化合物,然后进一步优化设计,最终确定候选的药物结构。
近年来,引入组合策略和模拟进化思想,建立了一种从噬菌体随机肽库中筛选药物先导化合物的新方法[4],即用库容量极大的随机肽库去快速筛选具有较高特异性和亲和力的理想目的肽。
通过此种方法可以快速筛选生物活性肽、蛋白质、受体及其他化合物等新型药物或先导化合物。
这一方法具有传统的药物筛选无法比拟的优越性,将药物开发带入了一个崭新的时代。
1噬菌体展示系统的建立早在1986年Geysen就认为含有关键残基的短肽能够模拟蛋白质上的决定族。
在多数情况下,几个关键残基与它的结合分子所形成的非共价键构成了全部结合的主要部分,即蛋白质之间的相互作用或识别是通过局部残基肽段间的相互作用来实现的。
1982年,Dulbecco提出将病原体的免疫原与λ噬菌体和其他病毒的衣壳蛋白融合,便可产生能够用作疫苗的表面展示外来多肽的病毒颗粒。