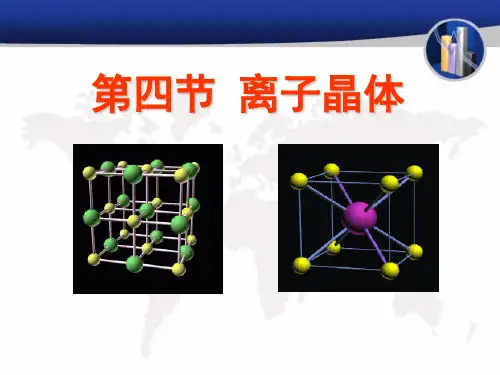
什么是离子晶体
- 格式:ppt
- 大小:1.61 MB
- 文档页数:18




离子晶体,分子晶体1. 离子晶体与分子晶体的定义离子晶体是由阴阳离子通过离子键结合形成的晶体,其结构非常规整、紧密,具有高度的硬度和脆性。
分子晶体是由分子通过弱范德华力、氢键等相互作用力结合而成的晶体,具有较低的硬度和脆性,并且其结构相对不太稳定和松散。
2. 离子晶体的结构特点离子晶体的结构具有以下特点:(1)阴离子和阳离子的离子键结合非常强,因此结构十分紧密且有序,一般不会发生形变;(2)离子晶体具有高度的硬度和脆性,因为它们的克氏硬度大约在6.5-7之间;(3)离子晶体的固体都是化学反应的产物,并且它们的组成及结构都是由元素的离子及其价电子排列而成的,因此离子晶体的特性往往被元素的性质所支配。
3. 离子晶体的种类和应用离子晶体又分为简单离子晶体和复杂离子晶体。
简单离子晶体常见的有NaCl、KCl等。
复杂离子晶体常见的有SiO2等。
离子晶体广泛应用于材料学、电子学、光学等领域。
比如,NaCl晶体可以用于制造光学器件、传感器等,同时还能产生广泛的光学现象。
4. 分子晶体的结构特点分子晶体的结构特点有:(1)受到分子的相互作用力而形成,这些力一般是弱的范德华力、氢键等;(2)分子晶体的结构相对不太稳定和松散,比较容易发生形变;(3)分子晶体的硬度和脆性比较低,因为没有强的化学键固定分子位置和方向,分子可以比较容易地相互滑移。
5. 分子晶体的种类和应用分子晶体有机晶体、金属-有机框架材料(MOF)晶体、聚合物晶体等,这些晶体广泛应用于医药、化工、材料等多个领域。
其中,一些药物如硝酸甘油、维生素C等都是分子晶体。
此外,MOF材料由于其具有高度的孔隙率和选择性吸附性,被广泛用于催化、气体吸附、分子存储等方面。
6. 离子晶体和分子晶体的比较离子晶体和分子晶体之间具有很大的异同:(1)从结构上看,离子晶体中阴离子和阳离子之间的相互作用比分子晶体中分子之间的相互作用力更强;(2)从特性上看,离子晶体硬度和脆性大,而分子晶体硬度和脆性都比较低;(3)从应用领域来看,离子晶体广泛应用于电子、材料等领域,而分子晶体则主要应用于医药、化工等领域。

知识点8——氯、溴、碘单质活泼性比较一、知识疏理1、卤素单质在物理性质上的主要差异和递变规律F2Cl2Br2I2颜 色:淡黄绿色 黄绿色 深棕红色 紫黑色 (颜色逐渐加深)水中溶解性: 反应 溶解(少量反应)微溶 难溶 (溶解度减小)熔 沸 点: (气态) (气态) (液态) (固态) (由低到高)2、卤素化学性质的相似性和递变性(1)相似性① 卤素单质与氯气相似,都能跟金属、非金属(如P、H2等)、水、碱等物质反应:Zn+I2ZnI2(水作催化剂)(特殊反应,反应过程中能看到紫色蒸气,这说明了什么问题?)Fe+I2 → FeI2(不能生成FeI3)(表明I2的活泼性比Cl2、Br2、F2弱)(所以,盛碘的试剂瓶不能用铁盖。
)Br2+2NaOH→NaBr+NaBrO+H2O② 化合价相似:均有-1价,除氟外,均有+1、+3、+5、+7价。
如:HF、HBrO(次溴酸)、NaIO3(碘酸钠)、HClO4(高氯酸)。
(就知道各种价态,会写不同价态的物质的化学式。
)③ 形成气态氢化物的化学式相似,可表示为HX。
HX均易溶于水,形成氢卤酸,HX在空气中均形成白雾。
(2)递变性按氟、氯、溴、碘顺序单质氧化性:逐渐减弱。
(除氟外,其它的卤素单质也有弱还原性)卤离子(X-)还原性:逐渐增强。
(F-不能被常见的氧化剂氧化。
)气态氢化物(HX)稳定性:逐渐减弱。
(会从键长解释吗?)气态氢化物(HX)还原性:逐渐增强。
(HBr、HI能被常见的氧化剂氧化)氢卤酸酸性:增强。
(只有氢氟酸是弱酸)最高价氧化物水化物(HXO4)酸性:减弱。
(氟没有含氧酸,高氯酸为无机酸中酸性最强的酸)(3)卤素间的置换反应(略)注意:F2能从熔融状态下的卤化物中置换出其他卤素,而在水溶液中F2更易与水发生反应。
3、氟的特殊性① F原子半径小,获得电子能力强,无正价,无含氧酸。
F2是氧化性最强的非金属单质。
② F2与H2反应剧烈,低温、黑暗处妈会发生爆炸。


离子晶体知识点总结一、离子晶体的结构离子晶体的结构是由正负离子通过静电相互作用形成的,其晶胞结构可以用晶体学的方法进行描述。
一般来说,离子晶体的结构可以分为六种类型:1. 离子节构这种结构由大部分阳离子和阴离子相互交错排列组合而成。
其中阳离子通常占据晶格的交叉点,而阴离子则占据空隙。
这种结构常见于氯化钠、氧化镁等物质中。
2. 离子面心结构在这种结构中,阳离子和阴离子分别占据晶格的面心位置,形成一种规则的排列方式。
这种结构常见于氧化铝、氟化钙等物质中。
3. 离子体心结构在这种结构中,阳离子占据晶格的体心位置,而阴离子则占据晶格的角落位置。
这种结构常见于氧化锌、氯化钠等物质中。
4. 同心柱状结构这种结构由阳离子和阴离子分别沿晶轴的方向排列组合而成。
这种结构常见于氯化铵等物质中。
5. 同心层状结构这种结构由阳离子和阴离子分别沿晶轴的垂直方向排列组合而成。
这种结构常见于氧化镁、氯化铜等物质中。
6. 同心环状结构这种结构由阳离子和阴离子分别沿晶轴的环状方向排列组合而成。
这种结构常见于氧化铝、氟化钙等物质中。
以上这几种结构都是离子晶体常见的结构类型,通过这些结构,我们可以更好地理解离子晶体的排列方式和性质特点。
二、离子晶体的性质离子晶体具有一些特殊的性质,其中包括:1. 高熔点和硬度由于离子晶体中离子之间的静电作用力非常强大,因此离子晶体通常具有较高的熔点和硬度。
这也使得离子晶体可以在高温和高压下稳定存在。
2. 良好的导电性由于离子晶体中包含正负离子,因此在一定条件下,离子晶体可以导电。
但在晶格结构稳定的情况下,离子晶体通常是绝缘体,不导电。
3. 显著的光学效应在一些特殊的条件下,离子晶体可以表现出显著的光学效应,如双折射、自旋光等。
这些光学效应使得离子晶体在光学器件和光学应用方面有着重要的应用价值。
4. 良好的热稳定性由于离子晶体中存在强大的离子键,使得离子晶体具有良好的热稳定性。
即使在高温和高压条件下,离子晶体的晶格结构也能保持稳定。

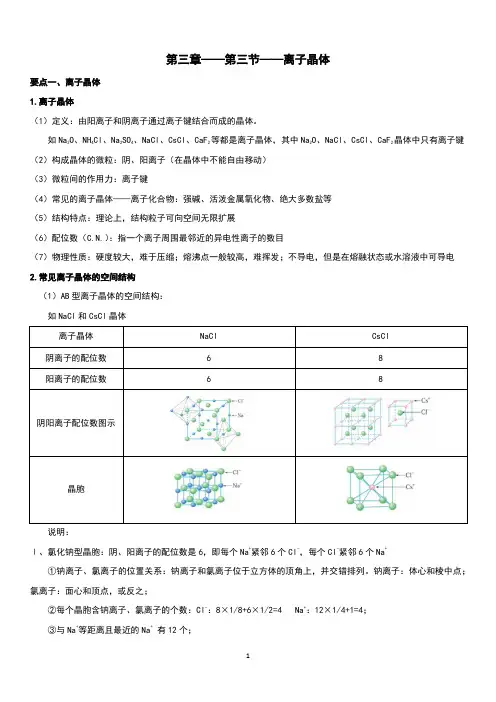
第三章——第三节——离子晶体要点一、离子晶体1.离子晶体(1)定义:由阳离子和阴离子通过离子键结合而成的晶体。
如Na2O、NH4Cl、Na2SO4、NaCl、CsCl、CaF2等都是离子晶体,其中Na2O、NaCl、CsCl、CaF2晶体中只有离子键(2)构成晶体的微粒:阴、阳离子(在晶体中不能自由移动)(3)微粒间的作用力:离子键(4)常见的离子晶体——离子化合物:强碱、活泼金属氧化物、绝大多数盐等(5)结构特点:理论上,结构粒子可向空间无限扩展(6)配位数(C.N.):指一个离子周围最邻近的异电性离子的数目(7)物理性质:硬度较大,难于压缩;熔沸点一般较高,难挥发;不导电,但是在熔融状态或水溶液中可导电2.常见离子晶体的空间结构(1)AB型离子晶体的空间结构:如NaCl和CsCl晶体说明:Ⅰ、氯化钠型晶胞:阴、阳离子的配位数是6,即每个Na+紧邻6个Cl-,每个Cl-紧邻6个Na+①钠离子、氯离子的位置关系:钠离子和氯离子位于立方体的顶角上,并交错排列。
钠离子:体心和棱中点;氯离子:面心和顶点,或反之;②每个晶胞含钠离子、氯离子的个数:Cl-:8×1/8+6×1/2=4 Na+:12×1/4+1=4;③与Na+等距离且最近的Na+有12个;④Na+、Cl-比例为1︰1,化学式为NaCl,属于AB型离子晶体。
Ⅱ、氯化铯型晶胞:阴、阳离子的配位数是8,即每个Cs+紧邻8个Cl-,每个Cl-紧邻8个Cs+每个Cs+周围最邻近的Cl-有8个,每个Cl-周围最邻近的Cs+有8个,则Cs+、Cl-的配位数都是8。
因此整个晶体中,Cs+、Cl-比例为1︰1,化学式为CsCl,属于AB型离子晶体。
同是AB型离子晶体, CsCl与NaCl的晶体结构和配位数不一样(2)CaF2晶体的空间结构由图可知,Ca2+的配位数为8,F-的配位数是43.决定离子晶体结构的主要因素:(1)几何因素:正、负离子的半径比的大小晶体的阴、阳离子所带的电荷数相同的AB型离子晶体的几何因素与配位数(阴、阳离子个数相同,配位数也相同)的关系:r+/ r-配位数0.225-0.414 40.414-0.732 60.732-1.00 8(2)电荷因素:正、负离子所带电荷的多少晶体中阴、阳离子的电荷数不相同,阴、阳离子个数不相同,各离子的配位数也不相同。

离子晶体定义离子晶体是一种结构紧凑的复合物,由化学强相互作用的有规律排列的离子和它们的水溶液的分子构成,这个物质的结构是由强烈的团簇相互作用而形成的。
离子晶体是现代化学及物理学领域中的一个发展中的领域,它可以应用于许多方面,如电子材料、光子学、光电子器件、液体晶体、以及生物分离,等等。
离子晶体也与其他类型的晶体有一定的区别,比如离子晶体不同于石英晶体,是由质子与电子组成的。
离子晶体结构由离子团簇组成,由离子组成的团簇是晶体结构的基本组成单元,它们的布局是呈现出有规律的排列的形式。
离子晶体的主要特性是它的立体结构,由离子团簇构成,团簇有规律的排列呈现出八面体或正方体结构。
离子晶体与传统硅晶体或金刚石晶体有一定的区别,他们的晶胞构造中由非金属原子和金属原子组成。
离子晶体也可以分为双相离子晶体和单相离子晶体。
双相离子晶体的组成单元是由两种不同的离子组成,它们的离子有相互作用,形成一定的结构;而单相离子晶体的组成单元只有一种离子,形成的结构则与双相离子晶体不同,它们的立体构造是由离子团簇与团簇之间的距离来构成的。
离子晶体有多种性质,它们可以根据其团簇结构来分类。
离子晶体分为两类,一类是用氢键结合的,通常是以水形式溶解的;另一类是用极性作用力结合的,如离子间的电相关作用、极性作用、相互结合作用等。
离子晶体是一种可用于新型材料的高活性材料,它可以在液体和固态之间构成一种界面。
由于它具有很高的活性性,因此被广泛应用于电子材料、光子学、电态材料等领域,并且有很多实际应用,如液体晶体显示器、高温发动机、电极、以及生物分离等。
离子晶体在未来也将被广泛用于新型电子材料、高温量子电子学、耐火材料、石墨烯、抗菌涂料、光学晶体及药物分离等领域。
最后,离子晶体在现代物理学及化学领域中发挥着重要作用,它具有优良的结构特性,可被广泛应用于多种新型材料及实际应用领域,为新材料、电子材料、光电子器件、生物分离等领域的研究提供重要基础。
第一讲 金属晶体与离子晶体一、金属晶体1.定义:金属晶体是指金属原子通过金属键形成的晶体。
2.金属键:金属晶体中金属阳离子和自由电子之间的强烈的相互作用。
金属键的特征:由于自由电子为整个金属所共有,所以金属键没有方向性和饱和性。
金属原子的外层电子数比较少,容易失去电子变成金属离子和电子,金属离子间存在反性电荷的维系――带负电荷的自由移动的电子(运动的电子使体系更稳定),这些电子不是专属于某几个特定的金属离子这就是金属晶体的形成的原因。
例1.金属晶体的形成是因为晶体中存在( C)①金属原子②金属离子③自由电子④阴离子A.只有①B.只有③C.②③D.②④3.金属晶体的结构型式:(1)特点:最常见的结构型式具有堆积密度大,原子配位数高,能充分利用空间等特点。
(2)分类:Ca 、Al 、Cu 、Ag 、Au 等金属晶体属于A 1型最密堆积,Mg 、Zn 等金属晶体属于A 3型最密堆积,A 2型密堆积又称为体心立方密堆积,Li 、Na 、K 、Fe 等金属晶体属于A 2型密堆积。
A 1型配位数为12,A 2型配位数为8,A 3型配位数为 12。
4.金属晶体中的金属键和原子的堆积方式与金属晶体的物理性质的关系(1)金属晶体具有良好的导电性:金属中有自由移动的电子,金属晶体中的自由电子在没有外加电场存在时是自由运动的,当有外加电场存在的情况下,电子发生了定向移动形成了电流,呈现良好的导电性。
(2)金属晶体具有良好的导热性:自由电子在运动时经常与金属离子碰撞,从而引起两者能量的交换。
当金属某一部分受热时,在那个区域里的自由电子能量增加,运动速度加快,于是通过碰撞,自由电子把能量传给金属离子。
金属容易导热就是由于自由电子运动时,把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。
(3)金属晶体具有良好的延展性:当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,由于金属离子与自由电子之间的相互作用没有方向性,滑动以后,各层之间仍(4)金属的熔点、硬度等取决于金属晶体内部作用力的强弱。
离子晶体的名词解释离子晶体是一种固态物质,由离子构成的有序排列形成晶格结构。
离子是带有正电荷或负电荷的原子或分子,在形成晶体结构时通过静电力互相聚集在一起。
离子晶体通常具有高熔点、高硬度和良好的导电性能,因此在许多领域有着广泛的应用。
1. 离子与晶格离子晶体的基本结构是由正离子和负离子组成的晶格。
正离子和负离子之间通过静电相互作用力形成稳定的晶格结构。
正离子和负离子的数目必须相等,以保持整体电中性。
离子晶体的晶格结构对其性质起着重要的影响。
2. 离子晶体的物理性质离子晶体通常具有高熔点和高硬度。
这是因为在离子晶体中,正离子和负离子之间的静电相互作用力较强,需要很高的能量才能破坏这种结构。
因此,离子晶体往往具有非常稳定的结构。
此外,离子晶体还具有良好的光学性能。
离子晶体中的离子对光的吸收和发射起着重要作用,因此离子晶体通常具有特殊的光学效应,例如双折射和荧光。
3. 离子晶体的导电性由于离子晶体中带电离子的存在,它们通常具有良好的导电性能。
当离子晶体受到外界电场的作用时,带电离子会迅速在晶体内部移动,从而产生电流。
这种特性使离子晶体被广泛应用于电池、电解质和导电材料等领域。
4. 离子晶体的应用离子晶体在日常生活中有着广泛的应用。
其中一个典型的应用是在电子设备中的显示技术。
例如,液晶显示屏就是一种以离子晶体为基础的显示技术。
液晶分子具有可控的旋转和排列方式,通过控制电场来改变液晶分子的排列状态,从而实现图像的显示。
此外,离子晶体还常用于人工合成宝石的制备。
通过控制离子的成分和结构,制造出具有与天然宝石相似甚至更好的光学性能的合成宝石。
另外,离子晶体还在能源领域有着重要的应用。
例如,某些离子晶体在高温下具有良好的离子导电性能,可以用于制造固体氧化物燃料电池。
总之,离子晶体作为一种固态物质,在物理性质、导电性以及应用方面都具有独特的特点和广泛的应用前景。
通过深入研究离子晶体的结构和性质,我们可以更好地理解和应用这种材料,推动科学技术的发展。