高中化学 盖斯定律及其应用
- 格式:doc
- 大小:47.02 KB
- 文档页数:4


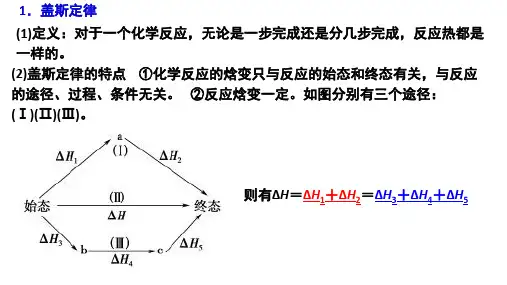
1、盖斯定律的涵义:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变是一样的的。
这就是盖斯定律。
也就是说,化学反应的反应热只与反应体系的始态和终态有关,而与具体的反应进行的途径无关。
2、盖斯定律的应用盖斯定律在科学研究中具有重要意义。
因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。
此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
例如:C(S)+0.5O2(g)=CO(g)上述反应在O2供应充分时,可燃烧生成CO2、O2供应不充分时,虽可生成CO,但同时还部分生成CO2。
因此该反应的△H无法直接测得。
但是下述两个反应的△H却可以直接测得:C(S)+O2(g)=CO2(g) ;△H1= - 393.5kJ/molCO(g)+0.5 O2(g)=CO2(g) ;△H2=- 283.0kJ/mol根据盖斯定律,就可以计算出欲求反应的△H3。
分析上述反应的关系,即知△H1=△H2+△H3△H3=△H1-△H2=-393.5kJ/mol-(-283.0kJ/mol)=-110.5kJ/mol 例5图由以上可知,盖斯定律的实用性很强。
3、反应热计算根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。
反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。
热化学方程式的简单计算的依据:(1)热化学方程式中化学计量数之比等于各物质物质的量之比;还等于反应热之比。
(2)热化学方程式之间可以进行加减运算。
例1:按照盖斯定律,结合下述反应方程式,回答问题,已知:(1)NH3(g)+HCl(g)===NH4Cl(s)△H1=-176kJ/mol(2)NH3(g)+H2O(l)===NH3.H2O(aq) △H2=-35.1kJ/mol(3)HCl(g) +H2O(l)===HCl(aq) △H3=-72.3kJ/mol(4)NH3(aq)+ HCl(aq)===NH4Cl(aq) △H4=-52.3kJ/mol(5)NH4Cl(s)+2H2O(l)=== NH4Cl(aq) △H5=?则第(5)个方程式中的反应热△H是____。


盖斯定律及其应用盖斯定律及其应用1.盖斯定律的内容对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都一样,即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2.盖斯定律的应用AΔH 1ΔH 2B2 ①C(s)+O 2(g)===CO 2(g) ΔH 1 ②C(s)+12O 2(g)===CO(g) ΔH 2由①-②可得:CO(g)+12O 2(g)===CO 2(g) ΔH =ΔH 1-ΔH 23.运用盖斯定律的三个注意事项(1)热化学方程式乘以某一个数时,反应热的数值必须也乘上该数。
(2)热化学方程式相加减时,物质之间相加减,反应热也必须相加减。
(3)将一个热化学方程式颠倒时,ΔH 的“+”“-”随之改变,但数值不变。
[细练过关]题点(一) 根据盖斯定律确定反应热的关系1.已知:2H 2(g)+O 2(g)===2H 2O(g) ΔH 1 3H 2(g)+Fe 2O 3(s)===2Fe(s)+3H 2O(g) ΔH 2 2Fe(s)+32O 2(g)===Fe 2O 3(s) ΔH 32Al(s)+32O 2(g)===Al 2O 3(s) ΔH 42Al(s)+Fe 2O 3(s)===Al 2O 3(s)+2Fe(s) ΔH 5 下列关于上述反应焓变的判断正确的是( ) A .ΔH 1<0,ΔH 3>0 B .ΔH 5<0,ΔH 4<ΔH 3 C .ΔH 1=ΔH 2+ΔH 3D .ΔH 3=ΔH 4+ΔH 5解析:选B 大多数化合反应为放热反应,而放热反应的反应热(ΔH )均为负值,故A 错误;铝热反应为放热反应,故ΔH 5<0,而2Fe(s)+32O 2(g)===Fe 2O 3(s) ΔH 3 ③,2Al(s)+32O 2(g)===Al 2O 3(s) ΔH 4 ④,由④-③可得:2Al(s)+Fe 2O 3(s)===Al 2O 3(s)+2Fe(s) ΔH 5=ΔH 4-ΔH 3<0,可得ΔH 4<ΔH 3、ΔH 3=ΔH 4-ΔH 5,故B 正确、D 错误;已知:3H 2(g)+Fe 2O 3(s)===2Fe(s)+3H 2O(g) ΔH 2 ②,2Fe(s)+32O 2(g)===Fe 2O 3(s) ΔH 3 ③,将(②+③)×23可得:2H 2(g)+O 2(g)===2H 2O(g) ΔH 1=23(ΔH 2+ΔH 3),故C 错误。



盖斯定律及其在热化学方程式中的应用一:盖斯定律要点1840年,瑞士化学家盖斯(G 。
H 。
Hess,1802—1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径来完成。
如上图表:已知:H 2(g )+21O 2(g )= H 2O (g );△H 1=-241.8kJ/molH 2O (g )=H 2O (l );△H 2=-44.0kJ/mol根据盖斯定律,则△ H=△H 1+△H 2=-241.8kJ/mol+(-44.0kJ/mol )=-285.8kJ/mol盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。
因此,热化学方程式之间可以进行代数变换等数学处理。
该定律使用时应注意: 热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
二:盖斯定律在热化学方程式计算中的应用盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
,它在热化学方程式中的主要应用在于求未知反应的反应热,物质蒸发时所需能量的计算 ,不完全燃烧时损失热量的计算,判断热化学方程式是否正确,涉及的反应可能是同素异形体的转变,也可能与物质三态变化有关。
其主要考察方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol 的气态高能燃料乙硼烷(B 2H 6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 热量,该反应的热化学方程式为_____________。
又已知:H 2O (g )=H 2O (l );△H 2=-44.0kJ/mol ,则11.2L (标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ 。


考点34 盖斯定律的应用1.[2019新课标Ⅲ节选]近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。
因此,将氯化氢转化为氯气的技术成为科学研究的热点。
回答下列问题: (2)Deacon 直接氧化法可按下列催化过程进行: CuCl 2(s)=CuCl(s)+12Cl 2(g) ΔH 1=83 kJ·mol − 1 CuCl(s)+12O 2(g)=CuO(s)+12Cl 2(g) ΔH 2=− 20 kJ·mol − 1 CuO(s)+2HCl(g)=CuCl 2(s)+H 2O(g) ΔH 3=− 121 kJ·mol − 1 则4HCl(g)+O 2(g)=2Cl 2(g)+2H 2O(g)的ΔH =_________ kJ·mol − 1。
【答案】(2)-116【解析】(2)根据盖斯定律知,(反应I+反应II+反应III )×2得2224HCl(g)O (g)2Cl (g)2H O(g)+=+ ∆H=(∆H 1+∆H 2+∆H 3)×2=−116kJ·mol − 1。
2.[2017江苏]通过以下反应可获得新型能源二甲醚(CH 3OCH 3)。
下列说法不正确的是 ①C(s) + H 2O(g)CO(g) + H 2 (g)ΔH 1 = a kJ·mol −1②CO(g) + H 2O(g)CO 2 (g) + H 2 (g)ΔH 2 = b kJ·mol −1③CO 2 (g) + 3H 2 (g)CH 3OH(g) + H 2O(g) ΔH 3 = c kJ·mol −1 ④2CH 3OH(g)CH 3OCH 3 (g) + H 2O(g)ΔH 4 = d kJ·mol −1A .反应①、②为反应③提供原料气B .反应③也是CO 2资源化利用的方法之一C .反应CH 3OH(g)12CH 3OCH 3 (g) +12H 2O(l)的ΔH =2dkJ·mol −1 D .反应 2CO(g) + 4H 2 (g)CH 3OCH 3 (g) + H 2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol −1【答案】C【解析】A .反应①、②的生成物CO 2和H 2是反应③的反应物,A 正确;B .反应③可将二氧化碳转化为甲醇,变废为宝,B 正确;C .4个反应中,水全是气态,没有给出水由气态变为液态的焓变,所以C 错误;D .把反应②③④三个反应按(②+③)2+④可得该反应及对应的焓变,D 正确。

盖斯定律及其应用高考频度:★★★★☆难易程度:★★★☆☆典例在线在25℃、101kPa时,:2H2O(g)===O2(g)+2H2(g)H1Cl2(g)+H2(g)===2HCl(g)22Cl2(g)+2H2O(g)===4HCl(g)+O2(g)H3那么H3与H1和H2间的关系正确的选项是A.H3=H1+2H2B.H3=H1+H 2C.H=H-2H D.H=H-H312312【参考答案】 A【试题解析】第三个方程式可由第二个方程式乘以2与第一个方程式相加得到,由盖斯定律可知H3= H1+2 H2。
解题必备1.在化学科学研究中,常常需要通过实验测定物质在发生化学反响的反响热。
但是某些反响的反响热,由于种种原因不能直接测得,只能通过化学计算的方式间接地获得。
通过大量实验证明,不管化学反响是一步完成或分几步完成,其反响热是相同的。
换句话说,化学反响的反响热只与反响体系的始态和终态有关,而与反响的途径无关,这就是盖斯定律。
2.从能量守恒定律理解盖斯定律从S→L,H1<0,体系放出热量;从L→S,H2>0,体系吸收热量。
根据能量守恒,H1+H2=0。
3.盖斯定律的应用方法〔1〕“虚拟路径〞法假设反响物A变为生成物D,可以有两个途径①由A直接变成D,反响热为 H;②由A经过B变成C,再由C变成D,每步的反响热分别为 H1、H2、H3。
如下列图:那么有H= H1+H2+H3。
2〕“加合〞法运用所给热化学方程式通过加减乘除的方法得到所求的热化学方程式。
先确定待求的反响方程式? 找出待求方程式中各物质在方程式中的位置?根据待求方程式中各物质的计量数和位置对方程式进行处理,得到变形后的新方程式?将新得到的方程式进行加减反响热也需要相应加减?写出待求的热化学方程式4.运用盖斯定律计算反响热的 3个关键〔1〕热化学方程式的化学计量数加倍,H也相应加倍。
2〕热化学方程式相加减,同种物质之间可加减,反响热也相应加减。
盖斯定律及其应用
高考频度:★★★★☆难易程度:★★★☆☆
典例在线在25 ℃、101 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1−2ΔH2 D.ΔH3=ΔH1−ΔH2
【参考答案】A
【试题解析】第三个方程式可由第二个方程式乘以2与第一个方程式相加得到,由盖斯定律可知ΔH3=ΔH1+2ΔH2。
解题必备
1.在化学科学研究中,常常需要通过实验测定物质在发生化学反应的反应热。
但是某些反应的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接地获得。
通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关,这就是盖斯定律。
2.从能量守恒定律理解盖斯定律
从S→L,ΔH1<0,体系放出热量;
从L→S,ΔH2>0,体系吸收热量。
根据能量守恒,ΔH1+ΔH2=0。
3.盖斯定律的应用方法
(1)“虚拟路径”法
若反应物A变为生成物D,可以有两个途径
①由A直接变成D,反应热为ΔH;
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
则有ΔH=ΔH1+ΔH2+ΔH3。
(2)“加合”法
运用所给热化学方程式通过加减乘除的方法得到所求的热化学方程式。
先确定待求的反应方程式⇒找出待求方程式中各物质在已知方程式中的位置⇒根据待求方程式中各物质的计量数和位置对已知方程式进行处理,得到变形后的新方程式⇒
将新得到的方程式进行加减反应热也需要相应加减⇒写出待求的热化学方程式4.运用盖斯定律计算反应热的3个关键
(1)热化学方程式的化学计量数加倍,ΔH也相应加倍。
(2)热化学方程式相加减,同种物质之间可加减,反应热也相应加减。
(3)将热化学方程式颠倒时,ΔH的正负必须随之改变。
学霸推荐
1.已知25 ℃、101 kPa条件下:
①4Al(s)+3O2(g)===2Al2O3(s) ΔH=−2 834.9 kJ·mol−1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH=−3 119.1 kJ·mol−1
由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量高,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
2.已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1 2H2(g)+O2(g)===2H2O(g) ΔH2
C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A.12ΔH3+5ΔH2−2ΔH1B.2ΔH1−5ΔH2−12ΔH3
C.12ΔH3−5ΔH2−2ΔH1D.ΔH1−5ΔH2−12ΔH3
3.已知:①2C(s)+O2(g)===2CO(g) ΔH=−221.0 kJ·mol−1;②2H2(g)+O2(g)===2H2O(g) ΔH=−483.6 kJ·mol−1。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为
A.+262.6 kJ·mol−1B.−131.3 kJ·mol−1
C.−352.3 kJ·mol−1D.+131.3 kJ·mol−1
4.某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺,因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。
”(已知煤炭的燃烧热ΔH为−393.15 kJ·mol−1,氢气的燃烧热ΔH为−242 kJ·mol−1,一氧化碳的燃烧热ΔH为−283 kJ·mol−1)
(1)写出该同学看到燃烧现象所涉及到的所有反应的热化学方程式:。
(2)你认为该同学的结论是否正确,请简要说明其理由:。
(3)烟气(主要污染物SO2、NO x)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NO x的含量。
O3氧化烟气中SO2、NO x的主要反应的热化学方程式为
①NO(g)+O3(g)===NO2(g)+O2(g) ΔH=−200.9 kJ·mol−1
②NO(g)+O2(g)===NO2(g) ΔH=−58.2 kJ·mol−1
③SO2(g)+O3(g)===SO3(g)+O2(g) ΔH=−241.6 kJ·mol−1
反应3NO(g)+O3(g)===3NO2(g)的ΔH= kJ·mol−1。
答案
1.【答案】A
【解析】根据盖斯定律②−①得2O3(g)===3O2(g) ΔH=−284.2 kJ·mol−1,等质量的O2能量低。
2.【答案】A
3.【答案】D
【解析】根据盖斯定律,把已知两个反应相加减,可求得制备水煤气反应的ΔH。
①−②得2C(s)+2H2O(g)===2H2(g)+2CO(g) ΔH=−221.0 kJ·mol−1−(−483.6 kJ·mol−1)=+262.6 kJ·mol−1,则C(s)+H2O(g)===CO(g)+H2(g)的ΔH=(+262.6 kJ·mol−1)÷2=+131.3 kJ·mol−1。
4.【答案】(1)C(s)+O2(g)===CO2(g)ΔH=−393.15 kJ·mol−1、H2(g)+O2(g)===H2O(l) ΔH=−242 kJ·mol−1、CO(g)+O2(g)===CO2(g) ΔH=−283 kJ·mol−1、C(g)+H2O(l)===CO(g)+H2(g) ΔH=+131.85 kJ·mol−1
(2)不正确。
因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的状态有关
(3)−317.3。