铁测定试剂盒(亚铁嗪法)产品技术要求zhongshengbeikong
- 格式:docx
- 大小:16.35 KB
- 文档页数:3

铁测定试剂盒(亚铁嗪法)
适用范围:该产品用于体外定量测定人血清中铁(Fe)的含量。
1.1规格
规格1(试剂1:20mL;试剂2:5mL);
规格2(试剂1:40mL;试剂2:10mL);
规格3(试剂1:60mL;试剂2:15mL);
规格4(试剂1:60mL×2;试剂2:15mL×2);
规格5(试剂1:60mL×3;试剂2:15mL×3) 。
1.2组成
试剂盒组成见表1
表1 铁测定试剂盒组成
2.1外观
试剂盒外观应整洁,文字符号标识清晰, 组分齐全,液体无漏液;试剂1为无色透明液体;试剂2为橙黄色液体;不能有沉淀和絮状物。
2.2装量
每瓶不少于标示值。
2.3试剂空白吸光度
用指定的空白样品测试试剂(盒),在光径1cm下,在A570nm处测定试剂空白吸光度A≤0.8。
2.4分析灵敏度
测定17.9μmol/L的样品,吸光度变化≥0.01A。
2.5线性范围
在[3,90] μmol/L内,相关系数R≥0.990。
2.6 重复性
重复测试(20±4)μmol/L和(44±9)μmol/L的样本,所得结果的变异系数(CV%)应不大于10%。
2.7批间差
测定(20±4)μmol/L和(44±9)μmol/L的样本,所得结果的批间相对极差(R)应不大于10%。
2.8准确度
测定国家标准物质相对偏差不超过±15%。
2.9 效期稳定性
试剂(所有组份)有效期为12个月到效期后一个月内进行检测,测定结果应符合2.3、2.4、2.5、2.6、2.8项要求。

铁测定试剂盒(亚铁嗪法) 适用范围:用于体外定量测定人血清中铁的浓度。
1.1规格试剂1: 1×30mL,试剂2: 1×10mL;试剂1: 2×60mL,试剂2: 2×20mL;试剂1: 1×50mL,试剂2: 1×10mL;试剂1: 1×40mL,试剂2: 1×10mL;试剂1: 2×40mL,试剂2: 1×20mL;试剂1: 2×40mL,试剂2: 2×10mL;试剂1:3×28mL,试剂2:3×7mL;试剂1:1×4L,试剂2:1×1L;试剂1:2×4L,试剂2:1×2L。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1应为无色或浅色澄清液体,试剂2应为浅色或橙色澄清液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白在600nm处测定试剂空白吸光度,应≤1.5;2.4 分析灵敏度测试25µmol/L的被测物时,吸光度变化(ΔA)应不低于0.005.2.5 准确度用参考物质(GBW09152)对试剂(盒)进行测试,相对偏差不超过±5%。
2.6 重复性批内变异系数(CV)应不超过5%。
2.7 线性2.7.1在[1,100]µmol/L 区间内,线性相关系数r应不低于0.990;2.7.2[1,8)µmol/L区间内绝对偏差不超过±0.64µmol/L;[8,100]µmol/L区间内相对偏差不超过±8%。
2.8 批间差对同一份样品进行重复测定,相对极差≤6%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。

医疗器械产品技术要求编号:铁(Fe)测定试剂盒(亚铁嗪比色法)1.产品型号/规格及其划分说明1.1型号规格R1:1×20ml R2:1×10ml、R1:2×40ml R2:2×20ml、R1:2×50ml R2:1×50ml、R1:2×70ml R2:1×70ml、R1:2×80ml R2:1×80ml、R1:4×50ml R2:2×50ml、R1:4×70ml R2:2×70ml、R1:4×100ml R2:2×100 ml、校准品:1×1ml(可选购)。
1.2结构组成包括试剂R1:盐酸羟胺、硫脲、乙酸钠;R2:亚铁嗪;校准品(可选购):含硫酸亚铁的溶液,基质为20%小牛血清-PBS缓冲液。
1.3适用范围用于体外定量测定人血清中铁(Fe)的含量。
2、性能指标2.1外观和性状外观和性状应符合表2要求。
表2试剂盒内各组成的外观性状组成外观性状R1无色澄清液体R2黄绿色液体校准品无色或浅黄色澄清液体2.2试剂空白吸光度试剂以蒸馏水为空白时,主波长578nm,光径1.0cm,温度37℃±1℃,A0≤0.2。
2.3分析灵敏度浓度为35.8μmol/L时,吸光度变化值△A/min≥0.02。
2.4线性范围2.4.1试剂盒在5μmol/L~90μmol/L区间(范围)内,其回归系数r≥0.990。
2.4.2相对偏差或绝对偏差应符合表3要求。
表3相对偏差或绝对偏差浓度范围(μmol/L)相对偏差(B)绝对偏差(D) [5,25]--±5μmol/L(25,90]±15%--2.5测量精密度2.5.1试剂盒批内精密度CV值应≤6.0%。
2.5.2试剂盒批间相对极差应≤10.0%。
2.6准确度相对偏差(Bias%)应在参考物质靶值±15%范围以内。

亚铁嗪直接比色法测铁原理:血清铁与运铁蛋白结合成复合物,在酸性介质中铁从复合物中解离出来,再被还原剂还原成二价铁,并与亚铁嗪生成紫红色化合物,在562nm 处有吸收峰,可比色测定。
试剂:R1试剂:甘氨酸/盐酸缓冲液(PH2.8):0.4mol/L 甘氨酸溶液58mL 、0.4mol/L 盐酸溶液42ml 和Triton X-100 3ml 混合后加入无水亚硫酸钠800mg ,使溶解。
R2试剂亚铁嗪显色液:称取亚铁嗪0.6g 溶于100ml 去离子水中。
铁标准贮存液(1.79mmol/L ):精确称取经室温干燥恒重的硫酸高铁铵[O H SO FeNH 224412)(•,AR]0.8635g ,置于烧杯中,加去离子水50ml ,逐滴加入浓硫酸5ml ,溶解后移入1L 容量瓶中并用去离子水稀释至刻度。
置棕色瓶中可长期保持。
铁标准应用液(35.8μmol/L ):在100ml 容量瓶中加入铁标准贮存液2ml ,加适量去离子水后,再加浓硫酸0.5ml ,最后以去离子水稀释至刻度。
操作:如表:混匀,用波长562nm ,光径0.5cm ,空白调零,读取测定管吸光度,然后再加充分混匀,置室温15分钟或37℃ 10分钟后用同样的条件和方法读取各管吸光度。
计算结果:)铁标准应用液浓度(标准管吸光度血清空白管吸光度测定管吸光度)血清铁(μm ol/L *0.97*-μm ol/L =测定意义:铁是人体必需的微量元素,是合成红细胞中血红蛋白的主要原料,存在于正常人体内的铁平均为3~4.5g 。
全身所有的约70%存在血红蛋白中,少量存在于肌红蛋白中。
而各种酶和血浆中运输状态中的铁,仅占全身铁的极小部分。
血清铁增高:①红细胞破坏增多是,如溶血性贫血;②红细胞的再生或成熟屏障,如再生障碍性贫血、巨幼红细胞性贫血;③铝中毒时铁利用率过低;④维生素6B 缺乏引起造血功能减退时。
血清铁降低:①机体摄入不足,如营养不足、胃肠道病变、消化性溃疡、慢性腹泻等;②机体失铁增加,如失血,包括大量和隐性失血,特别是肾炎、肾结核、阴道出血、溃疡病等,泌尿生殖道和胃肠道的出血;③体内铁的需要增加又未及时补充,如妊娠、婴儿生长期试剂(ml) 测定管 标准管 空白管 血清 0.45 铁标准应用液 (35.8μmol/L ) 0.45 去离子水 0.45 甘氨酸/盐酸缓冲液 1.20 1.20 1.20 亚铁嗪显色液 0.05 0.05 0.05等;④体内贮存体释放减少,如急性和慢性感染、尿毒症等均可引起铁释放减少;⑤某些药物治疗,如促肾上腺皮质激素或肾上腺皮质激素、大剂量的阿司匹林、考来烯胺等;⑥生理性降低:妇女在月经期、妊娠期,婴儿在生长期,因体内铁的需要量增加,可使血清铁降低,属于生理现象物品清单甘氨酸0.4mol/L 100ml 盐酸0.4mol/L 100ml Triton X-100 3ml无水亚硫酸钠 2g亚铁嗪 2g硫酸高铁铵 2g去离子水 2L浓硫酸 50ml50ml移液管3支5ml移液管2支电子天平滤纸3张药匙3个200ml烧杯2个100ml烧杯1个1L容量瓶1个棕色瓶1个100ml容量瓶1个玻璃棒1根紫外可见分光光度计1台比色皿3个。

本试剂盒仅用于科研、实验室血清铁测定试剂盒说明书50T一、原理:在酸性溶液和还原剂的作用下,使运铁蛋白中铁与蛋白分离,使血清中的高铁还原成亚铁,后者与双吡啶结合成粉红色的络合物,在一定范围内,铁离子的多少与色泽成正比。
二、试剂的组成与配制:1、100mg/L铁标准贮备液:1ml 溶液一瓶,4℃保存3个月。
2mg/L铁标准应用液的配制:取铁标准贮备液0.2ml加蒸馏水定溶至10ml, 4℃保存。
2、铁显色剂:2号甲粉剂一支,2号乙粉剂一支,二号丙液100ml×1瓶,4℃保存6个月。
用时将甲、乙二粉剂倒入丙液中,充分混匀,溶解,即为铁显色剂,4℃避光保存。
2mg/L铁标准应用液(ml)0.5血清(ml) 0.5 铁显色剂(ml) 1.51.51.5混匀后,沸水浴5分钟,(空白及标准管可以不煮),冷却后离心,3500转/分,离心10分钟,取上清液1.0ml,0.5cm光径,波长520nm,双蒸水调零,测各管吸光度OD值。
四、计算与举例:1、计算公式:血清铁(mg/L)=空白管吸光度标准管吸光度空白管吸光度测定管吸光度??×标准浓度(2mg/L)血清铁(umol/L)=空白管吸光度标准管吸光度空白管吸光度测定管吸光度??×标准浓度(35.81umol/L)*标准管铁含量为2000ug/L,铁原子量为55.847,所以标准管铁含量为35.81umol/L 2、举例:取血浆0.5ml按操作表进行血清(浆)铁测定,在520nm处,0.5cm光径,测定各管吸光度为:空白管0.000,标准管0.038,测定管0.037,则计算如下:血清铁(umol/L)=空白管吸光度标准管吸光度空白管吸光度测定管吸光度??×标准液浓度=0038.00037.0??×35.81=34.87(umol/L)五、注意点:1、玻璃器材需严格清洗,避免铁的污染,建议最好用一次性塑料试管。
2、若上清浑浊,可再用另一试管再次离心后比色。
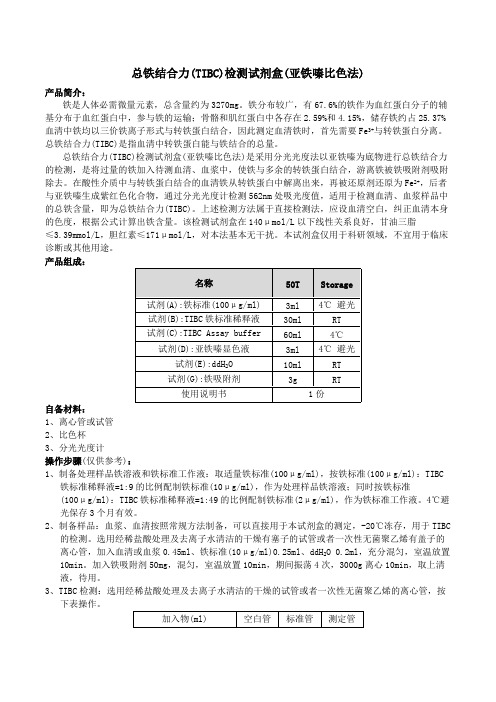
铁离子(Fe)测定试剂盒(Ferene法)组成:试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成:试剂1(R1):醋酸缓冲液:200mmol/L,硫脲:42mmol/L, Trion X-100:0.50%;试剂2(R2):呋喃三嗪二钠盐:2mmol/L,盐酸羟胺:200mmol/L。
校准品(选配):单水平的液态校准品,在盐酸缓冲液中添加Fe离子,稳定剂<0.1%。
定值范围:(80.0~120.0)μmol/L。
校准品具有批特异性,详见瓶签。
预期用途:本产品用于体外定量测定人体血清或血浆中铁离子的含量。
2.1 外观液体双试剂:R1:无色透明液体; R2:黄绿色澄清液体。
校准品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品可溯源至国家标准物质GBW08616。
2.4 试剂空白吸光度在37℃、600 nm波长、1cm光径条件下,试剂空白吸光度(A)应<0.3。
2.5 分析灵敏度测定浓度为50μmol/L时,吸光度差值(△A)应在(0.085~0.180) 范围之间。
2.6 线性范围在[2,120]μmol/L线性范围内,线性相关系数r2≥0.996。
在(50,120]μmol/L范围内的相对偏差≤10%;测定结果[2,50]μmol/L时绝对偏差≤5.0μmol/L。
2.7 重复性试剂盒测试项目重复性 CV< 6%。
2.8 批间差不同批号之间测定结果的相对极差应< 6%。
2.9 准确度相对偏差:用参考物质作为样本进行检测,测量结果与参考物质靶值的相对偏差应不超过±10%。
2.10稳定性2.10.1效期稳定性原包装试剂(含校准品)在(2~8)℃下有效期为18个月,取失效期的试剂盒检测其试剂空白、分析灵敏度、线性范围、重复性、准确度应分别符合2.4、2.5、2.6、2.7、2.9的要求。
铁测定试剂盒 (亚铁嗪法)适用范围:用于体外定量测定人血清或血浆中铁的含量。
1.1 包装规格见表1表1 包装规格试剂1:3×60mL、试剂2:3×15mL试剂1:4×40mL、试剂2:2×20mL试剂1:1×80mL、试剂2:2×20mL试剂1:1×80mL、试剂2:1×20mL试剂1:7×50mL、试剂2:2×42mL试剂1:1×40mL、试剂2:1×20mL试剂1:24×3.8mL、试剂2:6×3.8mL试剂1:2×40 mL、试剂2:2×10 mL试剂1:1×60 mL、试剂2:1×15 mL试剂1:1×20 mL 试剂2:1×5 mL800测试/盒(试剂1:4×40 mL、试剂2:2×20 mL)1000测试/盒(试剂1:4×40 mL、试剂2:2×20 mL)1200测试/盒(试剂1:4×40 mL、试剂2:2×20 mL)1.2 主要组成成分表2 主要组成成分试剂成分浓度试剂1醋酸盐缓冲液pH100 mmol/L4.20还原剂及表面活性剂防腐剂0.05%试剂2亚铁嗪5mmol/L防腐剂0.05%2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 测定项目2.3.1 试剂空白吸光度A570nm下测定空白吸光度应≤0.1000。
2.3.2 准确度用国家标准物质GBW09152,对试剂盒进行测试,准确性偏差应不超过±20%。
2.3.3 分析灵敏度样本浓度为35μmol/L时,其吸光度变化在0.0300~0.1000之间。
铁测定试剂盒(亚铁嗪法)适用范围:本产品用于体外定量测定人血清中铁的浓度。
1.1包装规格液体双剂型(液体Ⅰ型)试剂1(R1):55mL×2,试剂2(R2):15mL×2;试剂1(R1):60mL×2,试剂2(R2):15mL×2。
1.2主要组成成分1.2.1 试剂1(R1)(液体)酸性缓冲液0.4mol/L1.2.2 试剂2(R2)(液体)抗坏血酸57mmol/L亚铁嗪 5.0mmol/L2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为无色透明液体,无杂质、无絮状物,外包装完整无破损;2.1.2 试剂2(R2)应为淡黄色透明液体,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长570nm(光径1cm)处,试剂空白吸光度(A)应≤0.080。
2.4准确度测定GBW09152,相对偏差应不超过±15%。
2.5分析灵敏度对应于浓度为 17.9μmol/L的Iron所引起的吸光度差值(△A)的绝对值应在0.010~0.050的范围内。
2.6重复性重复测试高、中、低浓度样本,变异系数(CV)应≤10%。
2.7批间差测定同一样本,批间差(R)应≤10%。
2.8线性范围在[1.0,179]μmol/L范围内,线性相关系数(r)应≥0.990;在(20,179 ]μmol/L范围内,线性相对偏差应不超过±10%;在[1.0,20]μmol/L范围内,线性绝对偏差应不超过±2μmol/L。
2.9试剂稳定性2.9.1试剂效期稳定性:原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.9.2开盖稳定性:开盖后,在2℃~8℃避光保存,稳定期为14天;稳定期满后1天内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
铁测定试剂盒(PAPS显色剂法)
适用范围:本试剂盒用于体外定量测定人血清中铁的含量。
1.1产品规格
1.2产品组成
无水醋酸钠缓冲液(pH5.0)200mmol/L,PAPS 2.26mmol/L。
2.1 外观
试剂为深棕色溶液;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量
液体试剂的净含量应不少于标示量。
2.3试剂空白吸光度
在578nm波长、1cm光径条件下,试剂空白吸光度应不大于0.30。
2.4分析灵敏度
测定30μmol/L铁时,吸光度变化在(0.50±0.10)范围内。
2.5 准确度
相对偏差应在±10%范围内。
2.6 精密度
2.6.1 重复性
用血清样品或质控样品重复测试所得的变异系数(CV)应不大于10.0%。
2.6.2 批间差
试剂(盒)批间相对极差应不大于10.0%。
2.7 线性区间
试剂线性在[1.0,179.0]μmol/L区间内:
a) 线性相关系数|r|应不小于0.990;
b) [1.0,50.0]μmol/L区间内,线性绝对偏差应不超过±7.5μmol/L;(50.0,179.0]μmol/L区间内,线性相对偏差应不超过±15%。
2.8稳定性
原包装试剂2~8℃避光保存有效期12个月,到效期后的样品检测试剂空白、分析灵敏度、准确度、重复性、线性区间应符合2.3、2.4、2.5、2.6.1、2.7的要求。
铁测定试剂盒(亚铁嗪法)
适用范围:本试剂用于体外定量测定人血清中铁的浓度。
1.1包装规格
液体双剂型
试剂1(R1):60mL×2,试剂2(R2):15mL×2,校准品:2mL×1;
试剂1(R1):40mL×2,试剂2(R2):10mL×2,校准品:2mL×1。
1.2 主要组成成分
1.2.1 试剂1(R1)(液体)
酸性缓冲液0.4mol/L
1.2.2 试剂2(R2)(液体)
抗坏血酸57mmol/L
亚铁嗪 5.0mmol/L
1.2.3校准品(液体)
水基质、硫酸铁铵,目标浓度:17.9μmol/L。
(每批定值,值有批特异性,详见值单)
2.1 外观
试剂盒中各组件的外观应满足:
2.1.1 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;
2.1.2 试剂2(R2)应为淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损;
2.1.3 校准品应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量
液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度
在波长570nm(550nm~580nm)处(光径1cm),试剂空白吸光度(A)应≤0.080。
2.4 准确度
测定GBW09152,相对偏差应不超过±10%。
2.5 分析灵敏度
对应于浓度为17.9μmol/L的Iron所引起的吸光度差值(△A)的绝对值应≥0.01。
2.6 重复性
重复测定高、中、低浓度样本,变异系数(CV)应≤10%。
2.7 批间差
测定同一样本,批间差(R)应≤10%。
2.8 线性范围
在[1.0,179]μmol/L范围内,线性相关系数(r)应≥0.990。
在(20,179]μmol/L范围内,相对偏差应不超过±10%;
在[1.0,20]μmol/L范围内,绝对偏差应不超过±2μmol/L。
2.9 试剂稳定性
原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.10 校准品稳定性
原包装校准品在2℃~8℃避光贮存,有效期为42个月。
在校准品有效期满后3个月内,用该校准品校准合格的试剂盒,试剂准确度应符合2.4的要求。
2.11校准品溯源性
校准品溯源性应符合GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,并提供校准品的来源、定值过程及测量不确定度等内容。
校准品溯源至GBW09152。