总蛋白(TP)测定试剂盒(双缩脲法)产品技术要求百奥泰康
- 格式:docx
- 大小:14.04 KB
- 文档页数:3


(本试剂盒仅供体外研究使用,不用于临床诊断!)Elabscience®总蛋白(TP)比色法测试盒(双缩脲法) Biuret Protein Colorimetric Assay Kit产品货号:E-BC-K165-S产品规格:100 assays(96 samples)/ 500 assays(480 samples)检测仪器:紫外-可见分光光度计(540 nm)使用前请仔细阅读说明书。
如果有任何问题,请通过以下方式联系我们:销售部电话************,************技术部电话131****6790具体保质期请见试剂盒外包装标签。
请在保质期内使用试剂盒。
联系时请提供产品批号(见试剂盒标签),以便我们更高效地为您服务。
用途本试剂盒适用于检测血清、血浆、动植物组织样本中的蛋白含量。
检测原理凡分子中含有两个氨基甲酰基(-CONH2)的化合物都能与碱性铜溶液作用,形成紫色复合物,这一反应称为双缩脲反应,蛋白质分子中有许多肽键(-CONH-)都能起此反应,各种蛋白显色程度基本相同。
测定样本总蛋白浓度:样本背景值较高时,推荐使用考马斯亮蓝法(货号:E-BC-K168-S);样本蛋白浓度较低时,推荐使用BCA法(货号:E-BC-K318-M)。
提供试剂和物品说明:试剂严格按上表中的保存条件保存,不同测试盒中的试剂不能混用。
对于体积较少的试剂,使用前请先离心,以免量取不到足够量的试剂。
所需自备物品仪器:紫外-可见分光光度计(540 nm)试剂:双蒸水、生理盐水(0.9% NaCl)或PBS(0.01 M,pH 7.4)试剂准备①试剂三从-20℃取出,放在冰上缓慢融化(避免反复冻融),其他试剂平衡至室温。
②规格(100 assays)试剂配制:试剂一工作液的配制:取一瓶试剂一用100 mL双蒸水溶解,2-8℃保存3个月。
试剂二工作液的配制:取一瓶试剂二用200 mL双蒸水溶解,2-8℃避光保存3个月。

总蛋白液体测定(双缩脲法)Total Protein (TP)1检验目的本试剂盒用于体外定量测定人血清或血浆总蛋白。
2方法双缩脲比色终点法。
3原理在碱性条件下,蛋白与铜离子生成紫蓝色复合物。
显色强度和蛋白浓度成正比。
4 标本血清或血浆。
稳定性:20~25℃保存可稳定6天,4~8℃保存可稳定4周,-20℃保存至少可稳定1年。
不可使用已被污染的标本。
5 试剂5.1在测定时的各组分和浓度试剂1(R1):氢氧化钠80 mmol/L酒石酸钾钠12.8 mmol/L试剂2(R2):氢氧化钠100 mmol/L酒石酸钾钠16 mmol/L碘化钾15 mmol/L硫酸铜 6 mmol/L5.2试剂稳定性与贮存试剂避光保存于2~25℃,若无污染,可稳定至失效期。
试剂不可冰冻!标准品避光保存于2~8℃,若无污染,可稳定至失效期。
6 仪器OLYMPUS AU400全自动生化分析仪7测定程序见参数表8 校准品和质控品8.1使用Roche公司提供的Roche多项目定标液对自动分析仪进行校准。
每批样品检测时,使用Roche 公司提供的Roche定标液和控制品进行内部质量控制。
8.2质控物的保存和稳定性:质控物存放于4-8℃可保存一个月,分装存放于-20℃至有效期。
8.3室内质控规则:X±2S为警告线, X±3S为失控线。
8.4 不准确度允许范围:X±10%8.5不精密度:RCV:4.0%9 性能特性9.1病人结果可报告范围本法对总蛋白的检测范围为0.5~150 g/L。
当样品测定值超过上限时,应将样品用9 g/L氯化钠溶液作1+ 1稀释,重新测定,结果乘以2。
9.2特异性/干扰当样品中抗坏血酸浓度≤ 1704 μmol/L,胆红素浓度≤ 684 μmol/L,血红蛋白浓度≤ 5.00 g/L,甘油三酯浓度≤ 11.3 mmol/L时没有观察到干扰。
9.3灵敏度/检测限本试剂的检测限为0.5 g/L。

总蛋白定量(TP)测试盒 比色法:100管/96样一、测定原理:碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA 试剂形成紫色的络合物,562nm 处有最大吸收峰,依据吸光度与浓度成正比,通过测吸光度即可计算待测蛋白的浓度。
二、试剂组成及配制:试剂一:粉剂×2 支,稀释液,12.5ml×2 瓶,4℃冷藏密封保存 6 个月。
试剂一应用液的配制:取试剂一粉剂 1 支与试剂一稀释液 1 瓶混匀,溶解完全后4℃待用。
试剂二:250μl×2 支,4℃冷藏密封保存 6 个月。
工作液的配制:按试剂一应用液:试剂二=50∶1 的比例配制,混匀后待用,用多少配多少。
试剂三:终止剂贮备液20ml×1 瓶,4℃冷藏密封保存 6 个月。
终止剂应用液:取终止剂贮备液用双蒸水5 倍稀释后备用,4℃冷藏。
试剂四:524μg/ml 蛋白标准液0.2ml×1 支。
4℃保存1 个月。
三、样本前处理:详见试剂盒内说明书关于样本处理的说明。
四、操作步骤:空白管标准管测定管双蒸水(μl)20524μg/ml 标准品(μl)20待测样本(μl)20工作液(μl)250 250 250五、计算公式:总蛋白浓度 = 测定OD 值 -空白OD 值 ⨯ 标准品浓度 ⨯样本测试前(μg / ml ) 标准OD 值 -空白OD 值 (524μg / ml ) 稀释倍数漩涡混匀,37℃孵育 30 分钟 终止剂应用液(μl ) 750 750 750 漩涡混匀,静置 5 分钟,562nm 波长,0.5cm 光径,双蒸水调零,测定各管吸光度值。

q 总蛋白测定(双缩脲法)SOP1.原理:所有蛋白质分子都含有肽键。
在碱性溶液中,肽键与铜离子结合,生成蓝紫色的化合物。
蓝紫色化合物在546nm(540nm-560nm)处的吸光度与肽键的数量成正比关系,依次可以计算蛋白质的含量。
2.方法:双缩脲法3.试剂:总蛋白试剂其含量为氢氧化钠0.6mol/L酒石酸钾钠32mol/L碘化钾20mol/L硫酸铜12mol/L4.储存条件及有效期:(1)原包装试剂在2℃-8℃避光贮存,有效期36个月。
(2)试剂开盖后在2℃-8℃避光保存,稳定期30天。
5. 样本要求:(1)样本种类:新鲜无溶血血清。
(2)样本采集:取空腹静脉血 3.0ml,置于带分离胶试管中,标本采集后,3000r/min离心5min,分离血清,立即密封送检。
(3)样本干扰:对反应吸光度有干扰的样本,包括溶血和浑浊的样本都可能影响检测结果,遇上述情况建议重新采集。
(4)样本保存:密封无蒸发条件下样本2℃-8℃可稳定3天。
6. 检验步骤:(1)开生化仪见生化仪的SOP。
(2)操作步骤:参数设置;试剂装载;校准;质控;样本装载;测定;结果审查;报告。
a.参数设置b.试剂装载每天在生化仪上进行试剂检查,检测的样本数,如发现量不多或不能满足当天需要,则需要加试剂,注意同一批号,不同批号的不能混用。
c.校准换一批新试剂或质控做的不理想需要校准。
d.质控在做样本之前每天做质控,质控符合要求才可以做样本,不符合要求需要做校准,做完校准后,用校准品当样本来测,做质控。
e.样本装载样本符合要求,放在试管架上,编号,上机检测。
f.测定g.结果审查h.报告7. 参考值55-85g/L8 .临床意义:+(1) 血清总蛋白浓度增高a.血清中水分减少,而使总蛋白浓度相对增高。
凡体内水分的排出大于水分的摄入时,均可引起血浆浓缩,尤其是急性失水时(如呕吐,腹泻,高热等)变化更为显著,血清总蛋白浓度有时可达100-150 g/L。

2性能指标
2.1外观
试剂1(R1)应为清澈透明的液体,无沉淀、悬浮物和絮状物;
试剂2(R2)应为清澈透明的液体,无沉淀、悬浮物和絮状物;
试剂盒各组分应齐全、完整,液体无渗漏;包装标签文字符号应完整、清晰。
2.2净含量
液体试剂的净含量应不少于标示值。
2.3试剂空白吸光度
试剂以水为空白在37 ℃ 1 ℃,546 nm 波长条件下,吸光度应小于0.200。
2.4分析灵敏度
当样本浓度为70 g/L 时,吸光度变化应不小于0.150。
2.5线性范围
试剂盒在(2~120)g/L 范围内:
a)线性相关系数r 应不小于0.995;
b)当样本浓度不小于30 g/L 时,线性相对偏差应不超过±6.0%;当样本浓度小于30 g/L 时,线性绝对偏差应不超过±3.6g/L。
2.6测量精密度
2.6.1重复性
变异系数:CV 应不大于 2.0%。
2.6.2批间差
相对极差:R 应不大于 4.5%。
2.7准确度
2.7.1国家标准品测试
测定国家标准品,测定结果与靶值的相对偏差应不超过±5.0% 。
2.7.2质控品测试
测定质控品,测定结果应在靶值范围内。
2.8分析特异性
血红蛋白浓度在250 mg/dL 内、抗坏血酸浓度在30 mg/dL 内、内源性酯浓度在1200 mg/dL 内、结合胆红素在21 mg/dL 内、非结合胆红素浓度均在21 mg/dL 内、葡聚糖(分子量:7w 或4w)浓度在3000 mg/dL 内,对试剂检测结果的偏差影响应在±10 .0%以内。

总蛋白测定试剂(盒)产品技术审查规范(2016版)本规范旨在指导注册申请人对总蛋白测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对总蛋白测定试剂(盒)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围总蛋白测定试剂(盒)用于体外定量测定人血清或血浆中总蛋白的浓度。
从方法学考虑,本规范主要指基于分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室采用双缩脲法进行总蛋白定量检验所使用的临床化学体外诊断试剂。
本文不适用于干式总蛋白测定试剂。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)总蛋白测定试剂(盒)管理类别为Ⅱ类,分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》(以下简称《办法》)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)相关要求。
下面着重介绍与总蛋白测定试剂(盒)预期用途有关的临床背景情况。
总蛋白(TP)是血清固体成分中含量最多的一类物质。
在机体中具有重要的生理功能。
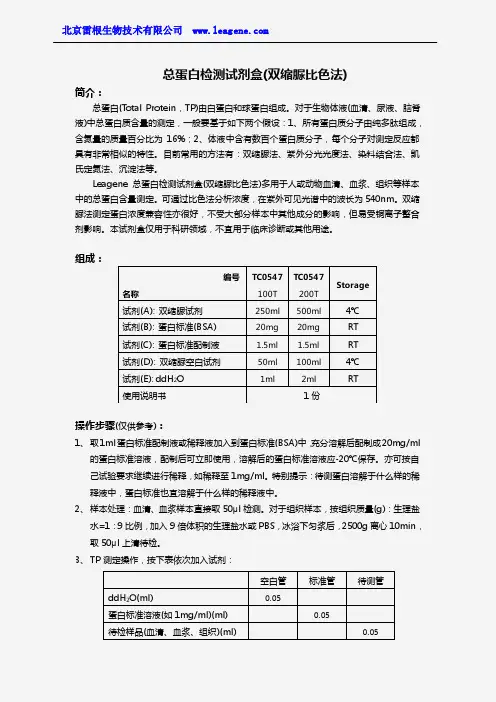
总蛋白检测试剂盒(双缩脲比色法)简介:总蛋白(T otal Protein ,TP)由白蛋白和球蛋白组成。
对于生物体液(血清、尿液、脑脊液)中总蛋白质含量的测定,一般要基于如下两个假设:1、所有蛋白质分子由纯多肽组成,含氮量的质量百分比为16%;2、体液中含有数百个蛋白质分子,每个分子对测定反应都具有非常相似的特性。
目前常用的方法有:双缩脲法、紫外分光光度法、染料结合法、凯氏定氮法、沉淀法等。
Leagene 总蛋白检测试剂盒(双缩脲比色法)多用于人或动物血清、血浆、组织等样本中的总蛋白含量测定。
可通过比色法分析浓度,在紫外可见光谱中的波长为540nm 。
双缩脲法测定蛋白浓度兼容性亦很好,不受大部分样本中其他成分的影响,但易受铜离子螯合剂影响。
本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:操作步骤(仅供参考):1、 取1ml 蛋白标准配制液或稀释液加入到蛋白标准(BSA)中,充分溶解后配制成20mg/ml的蛋白标准溶液,配制后可立即使用,溶解后的蛋白标准溶液应-20℃保存。
亦可按自己试验要求继续进行稀释,如稀释至1mg/ml 。
特别提示:待测蛋白溶解于什么样的稀释液中,蛋白标准也宜溶解于什么样的稀释液中。
2、 样本处理:血清、血浆样本直接取50μl 检测。
对于组织样本,按组织质量(g):生理盐水=1:9比例,加入9倍体积的生理盐水或PBS ,冰浴下匀浆后,2500g 离心10min ,取50μl 上清待检。
3、 TP 测定操作,按下表依次加入试剂:编号 名称TC0547100T TC0547200T Storage试剂(A): 双缩脲试剂 250ml 500ml 4℃ 试剂(B): 蛋白标准(BSA) 20mg 20mg RT 试剂(C): 蛋白标准配制液 1.5ml 1.5ml RT 试剂(D): 双缩脲空白试剂 50ml 100ml 4℃ 试剂(E): ddH 2O 1ml2mlRT使用说明书1份空白管 标准管 待测管ddH 2O(ml)0.05 蛋白标准溶液(如1mg/ml)(ml) 0.05 待检样品(血清、血浆、组织)(ml)0.05双缩脲试剂(ml) 2.5 2.5 2.54、混匀, 37℃孵育。

1、方法依据:深圳迈瑞生物医疗电子股份有限公司总蛋白(TP)测定试剂盒(双缩脲法)测定方法2、适用范围:适用于人血清或血浆总蛋白(TP)的测定。
3、试剂仪器:3.1 试剂:深圳迈瑞生物医疗电子股份有限公司原装试剂盒。
3.2 试剂储存:未开启的试剂盒在2℃~8℃保存有效期为一年。
试剂开瓶后应避光保存,在2℃~8℃可稳定28天。
试剂不可冰冻3.3 仪器:迈瑞BS-2000M全自动生化分析仪.4、操作程序4.1方法原理在碱性条件下,蛋白质与铜离子生成紫蓝色复合物。
显色强度和蛋白质浓度成正比4.2样本要求新鲜血清、肝素抗凝或EDTA抗凝血浆样本。
采集后及时测定,应避免溶血和污染4.3上机操作4.3.1试剂装载、校准、样品和质控血清分析操作详见“《迈瑞BS-2000M全自动生化分析仪标准操作、维护、保养规程》”。
4.3.2 校准:4.3.2.1 标准液的准备:标准液的准备:校准品使用深圳迈瑞生物医疗电子股份有限公司配套冻干品,按说明书要求稀释后分装,-20℃冷冻保存,用前提前15分钟从冰箱中取出,复溶到室温后上机检测。
4.3.2.2 校准程序:首次使用校准。
当有以下情况时需重新校准:1)换试剂批号或出现质控漂移时;2)当仪器做完保养后;3)仪器进行零件更换时。
每次试验前用准备好的校准品进行校准,校准通过后进行检测。
4.3.2.3 质控:在标本开始之前做质控,质控通过后方能进行标本的检测。
4.3.3 测试基本参数4.4参考范围60~80 g/L(注:各实验室应有自己的参考范围。
)4.5 方法评价线性范围:2~120 g/L。
样本中含量超出可报告范围,请用生理盐水稀释后测定,结果乘以稀释倍数。
反应曲线异常时应进行重复测定确认。
精密度:批内 CV ≤ 3%批间 CV ≤ 4.5%分析灵敏度:本试剂盒检测低限2 g/L。
5、临床意义TP 分为白蛋白和球蛋白两类,具有维持胶体渗透压,运输多种代谢物,调节被运输物质生理作用等功能,与机体免疫功能密切相关。

医疗器械产品技术要求编号:
总蛋白(TP)测定试剂(盒)(双缩脲法)
2.性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2装量
试剂装量的装量应按表1,液体装量的最大允许负偏差应为5%。
2.3试剂空白吸光度
试剂(盒)测试空白样本,在37 ℃±0. 1 ℃ 、546 nm 波长、1 cm 光径条件下,试剂空白吸光度≤0.200 Abs。
2.4分析灵敏度
试剂(盒)测试60.5 g/L 的被测物时,吸光度变化(ΔA)≥0.150 Abs。
2.5线性区间
试剂(盒)线性在(0.00,150.00] g/L区间内:
a)线性相关系数r≥0.990;
b) (0.00,20.00] g/L 区间内,线性绝对偏差应在±2.00 g/L 范围内;(20.00,150.00] g/L 区
间内,线性相对偏差应在±10% 范围内。
2.6精密度
2.6.1重复性
试剂(盒)测试浓度在(59±12 )g/L 和(46±9 )g/L 范围内的样本时,变异系数CV≤4.0%。
2.6.2批间差
试剂(盒)测试浓度在(59±12 )g/L 和(46±9 )g/L 范围内的样本时,相对极差R≤6.0%。
2.7准确度
测试国家标准品或可溯源至有证参考物质的校准品,相对偏差 B 在±10% 范围内。
1。

总蛋白测定试剂盒(双缩脲法)适用范围:本试剂用于体外定量测定人血清中总蛋白的含量。
1.1 产品型号/规格1×50 ml;2×50ml;4×50ml;8×50ml;5×50ml;2×100ml;6×100ml;4×70ml;9×70ml;6×50ml;2×125ml;4×125ml;1.2 划分说明硫酸铜 12mmol/L酒石酸钾钠 64mmol/L碘化钾 30mmol/L氢氧化钠 200mmol/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 试剂应为蓝色澄清液体。
2.2 净含量不少于标示值。
2.3 试剂空白吸光度在光径1 cm、主波长546 nm下,以蒸馏水为检测样本时,吸光度应不大于0.250。
2.4 分析灵敏度TP含量为50 g/L时,测定吸光度差值(△A)应在0.107—0.199范围内。
2.5 线性范围TP试剂在线性范围(0~120] g/L内:(a)回归系数r应不小于0.990;(b)在(0~12] g/L范围内,线性绝对偏差应不大于±1.2 g/L;(c)在(12~120] μmol/L范围内,线性相对偏差应不大于±10%。
2.6 测量精密度2.6.1 重复性变异系数(CV)均应不大于10%。
2.6.2 批间差相对偏差(R)应不大于10%。
2.7 准确度采用GBW09815牛血清白蛋白含量标准物质对试剂盒进行测试,相对偏差应不超过±10%。
2.8 稳定性TP试剂盒贮存于2 ℃~8 ℃、避光环境中,有效期为12个月。
有效期满后应满足2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
总蛋白测定试剂盒(双缩脲法)适用范围:用于体外定量测定人血清中的总蛋白含量。
1.1 包装规格
包装规格见表1。
表1 包装规格
1.2 主要组成成分
主要组成成分见表2。
表2 主要组成成分
2.1 外观
试剂为蓝色澄清液体,目测不得有任何沉淀及絮状悬浮物;
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量
试剂的净含量应不少于标称量。
2.3 试剂空白吸光度
试剂空白:A546nm(主)/A700nm(副)下测定空白吸光度应≤0.3000。
2.4 准确度
使用国际标准物质SRM927,对试剂盒进行测试,其测量结果的相对偏差应不超过±10%。
2.5 分析灵敏度
样本浓度为45g/L时,其吸光度变化在0.0300~0.1100之间。
2.6 线性区间
在[2.0,120.0]g/L区间内,线性相关系数r≥0.995,在[2.0,10.0]g/L区间内测定的绝对偏差应不超过±1.0g/L,在(10.0,120.0]g/L区间内测定的相对偏差应不超过±10%。
2.7 测量精密度
2.7.1 重复性
对高、低两个浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差
随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性
试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
总蛋白(TP)测定试剂盒
2、性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白吸光度
试剂以生理盐水为空白时,在波长546 nm,光径1.0 cm,温度37℃条件下,吸光度≤0.200。
2.3分析灵敏度
试剂盒测试70 g/L被测物时,吸光度变化值≥0.150。
2.4线性范围
2.4.1 试剂盒在30.0~120.0 g/L区间(范围)内,其回归系数r≥0.995。
2.4.2 在30.0~120.0 g/L 区间(范围)内,线性相对偏差应不超过±6.0%。
2.5精密度
2.5.1试剂盒重复性CV 值应≤2.0%。
2.5.2试剂盒批间相对极差(R)应≤5.0%。
2.6准确度
相对偏差(Bias%)应在±5.0%范围内。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。
双缩脲法测定总蛋白含量双缩脲法是一种常用的方法,用于测定生物体中的总蛋白含量。
本文将介绍双缩脲法的原理、步骤和应用,以及一些注意事项。
总蛋白是生物体中一类重要的生化指标,它包括了多种蛋白质分子的总量。
测定总蛋白含量可以用于评估生物体的健康状态、疾病诊断以及药物疗效的监测等方面。
而双缩脲法则是一种常用的测定总蛋白含量的方法。
双缩脲法的原理是利用了蛋白质与染料间的结合反应。
当染料分子与蛋白质结合时,会导致染料的吸收光谱发生变化。
通过测量吸光度的变化,可以间接地推算出样品中的总蛋白含量。
在进行双缩脲法测定总蛋白含量时,需要准备一系列试剂和仪器设备。
首先是双缩脲试剂,它是一种含有染料的溶液。
其次是样品,可以是血清、尿液、细胞提取液等。
还需要分光光度计,用于测量吸光度的变化。
具体操作步骤如下:1. 首先准备好双缩脲试剂和待测样品。
将双缩脲试剂稀释至适当浓度,使其能够与样品中的总蛋白发生反应。
2. 取一定量的样品,加入双缩脲试剂中,充分混合。
注意避免产生气泡。
3. 置于室温下静置一段时间,使样品与试剂充分反应。
4. 使用分光光度计,设置好波长,并将样品吸光度读数。
5. 根据吸光度的读数,结合标准曲线,计算出样品中的总蛋白含量。
双缩脲法的应用非常广泛。
它可以用于临床医学中,用于评估病人的肾功能、肝功能等。
在实验室研究中,双缩脲法也是常用的测定总蛋白含量的方法之一。
需要注意的是,双缩脲法测定总蛋白含量也有一些限制和注意事项。
首先,双缩脲法只能测定总蛋白的含量,无法区分不同种类的蛋白质。
其次,双缩脲法的准确性受到样品的干扰因素影响较大,所以在操作过程中需要尽量减少干扰物的存在。
此外,双缩脲法对某些物质有一定的选择性,因此在应用时需要根据具体情况进行调整和修正。
双缩脲法是一种常用的测定总蛋白含量的方法。
它通过测量吸光度的变化,间接地推算出样品中的总蛋白含量。
双缩脲法具有简单、快速、经济的特点,广泛应用于临床医学和科学研究领域。
总蛋白(TP)测定试剂盒(双缩脲法)适用范围:用于体外定量测定人体血清中总蛋白的含量。
1.1 试剂盒包装规格试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;2×30ml。
校准品:1×1ml;1×3ml。
1.2 试剂盒主要组成成分2.1 外观试剂:亮蓝色澄清液体。
校准品:无色至浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、546nm波长、1cm光径条件下,试剂空白吸光度应不大于0.2。
2.4 分析灵敏度测定浓度为50g/L样本时,吸光度变化值(ΔA)应不小于0.2。
2.5 线性范围在(10,100)g/L线性范围内,线性相关系数r应不小于0.990。
在[30,100)g/L范围内的线性相对偏差应不大于±10%;在(10,30)g/L范围内的线性绝对偏差应不大于±3.0g/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于3%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于5%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM927)。
2.10 稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果应满足2.1、2.3、2.4、2.5、2.6、2.8要求。
总蛋白测定试剂盒(双缩脲法)
适用范围:本试剂用于体外定量测定人血清中总蛋白的含量。
1.1 规格
试剂盒是由试剂组成的液体单试剂。
规格及装量见表1。
表1 规格及装
量
1.2主要组成成分
试剂主要组分:
2.1 净含量
应不低于试剂瓶标示装量。
2.2 外观
试剂为淡蓝色或深蓝色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白
在546nm处测定试剂空白吸光度,应≤1.5。
2.4 分析灵敏度
测试70g/L的被测物时,吸光度变化(ΔA)应不低于0.05。
2.5 准确度
用国家标准品(360012)对试剂(盒)进行测试,相对偏差不超过±10%。
2.6 重复性
批内变异系数(CV)应不超过5%。
2.7 线性
2.7.1在[2,120]g/L区间内,线性相关系数r应不低于0.990;
2.7.2 [2,9.6)g/L区间内绝对偏差不超过±0.77g/L;[9.6,120]g/L区间内相对偏差不超过±8%。
2.8 批间差
对同一份样品进行重复测定,相对极差不大于8%。
2.9 稳定性
取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
血清总蛋白TP测定1 检验目的指导本室工作人员规范操作本检测项目,确保检测结果的准确。
2 实验原理双缩脲比色终点法。
在碱性条件下,蛋白与铜离子生成紫蓝色复合物。
显色强度和蛋白浓度成正比。
— OH2+﹥紫红色复合物蛋白质 + Cu ------------- 3 标本采集病人准备:应禁食抽血3.1类型:血清3.2℃保存可稳8天;4~6203.3 标本存放~25℃保存可稳定1年。
周;定4-20℃保存至少可稳定 3.4 标本运输室温条件下运输细菌污染的不能做测定。
标本拒收标准3.5:实验材料44.1 试剂:上海复星长征医学科学有限公司TP试剂盒(沪食药监械(准)字2014第2400166号 YZB/沪 1546-40-2014)4.1.1试剂组成氢氧化纳:200mmol/l 碘化钾 6mmol/l硫酸铜:12mmol/l 稳定剂淀石酸钾钠:64mmol/l4.1.2 试剂准备:试剂为即用式。
4.1.3 试剂稳定性与贮存:试剂避光保存于2~25℃,若无污染,可稳定至失效期。
试剂有效期为24个月。
试剂不可冰冻。
开盖后应避免污染。
4.1.4 变质指示:当试剂有浊度时,表明有细菌污染,不能继续使用。
4.1.5 注意事项:试剂中含有氢氧化钠,不可入口!如与皮肤及粘膜接触,请立即用大量水冲洗。
使用试剂时应采取必要的防护。
4.2 校准品:使用上海复星长征医学科学有限公司提供的TP 校准品对自动分析仪进行校准。
.4.3 质控品:使用正常值、病理值复合控制品。
5 仪器AU2700生化分析仪,罗氏P800生化分析仪,西门子ADVIA-2400生化分析仪,东芝TBA-120生化分析仪6 操作步骤6.1 样品的准备:将标好号的样品离心后放到仪器规定的位置。
6.2 试剂的检测:仪器开机后,检查各种试剂的位置,体积等确认无误后方可进行测定。
6.3 项目基本参数:参见生化检验AU2700生化分析仪,罗氏P800生化分析仪,西门子ADVIA-2400生化分析仪,东芝TBA-120生化分析仪项目测定参数。
总蛋白(TP)测定试剂盒(双缩脲法)
适用范围:该试剂盒用于体外定量测定人血清中总蛋白的浓度。
1.1 产品规格
1.2 组成成分
该试剂盒由试剂1(R1)和校准品(选配)组成。
1.2.1试剂组成
试剂1: 硫酸铜≥6.0mmol/L 酒石酸钾钠≥50.0mmol/L
碘化钾≥15.0mmol/L
NaOH ≥100.0mmol/L
1.2.2 校准品组成
总蛋白目标浓度:60.0g/L
该校准品为水基质液体校准品
2.1 外观
a) R1应为蓝色溶液,无混浊,无未溶解物。
b) 校准品应为无色至暗黄色溶液,无混浊,无未溶解物。
2.2 净含量
液体组分不少于标示值。
2.3 试剂空白
2.3.1试剂空白吸光度
应不大于0.200。
2.4 分析灵敏度
TP试剂盒测定浓度50.0g/L的被测物时,吸光度差值(ΔA)应不小于0.150。
2.5 准确度
测试参考物质,相对偏差应不超过±10%。
2.6 精密度
2.6.1重复性
变异系数应不大于5%。
2.6.2批间差
批间相对极差(R)应不大于10%。
2.7 线性
在(0,120.0]g/L范围内,TP试剂盒的线性相关系数r应不低于0.9900;在(0,40.0]范围内绝对偏差应不超过4.0g/L,在(40.0,120.0]范围内相对偏差应不超过±10%。
2.8校准品溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总蛋白校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家标准物质GBW09815。
2.9稳定性
原包装的TP试剂盒在2℃~8℃避光保存,有效期为24个月。
试剂在规定的条件下保存到有效期末,产品的性能应符合2.3、2.4、2.5、2.6.1和2.7的要求。