特异性生长因子测定试剂盒(化学法)产品技术要求jiuqiang
- 格式:docx
- 大小:15.23 KB
- 文档页数:4

注:不同批号的校准品、质控品赋值有差异。
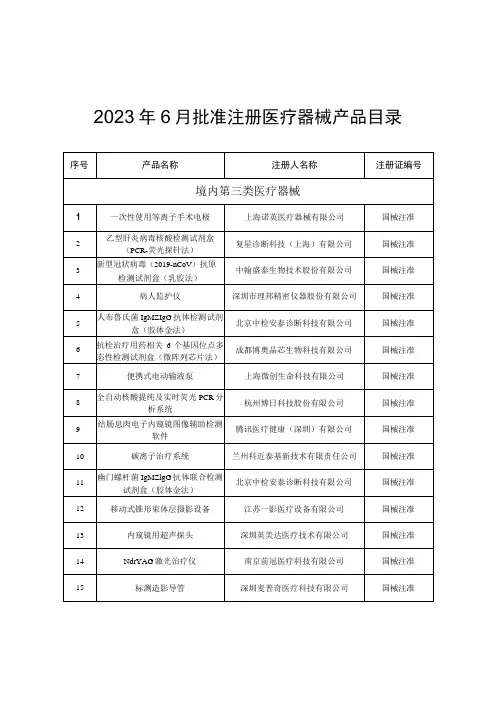
1.1 包装规格包装规格见表1。
1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色至淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色至淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色至淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
质控品为无色至淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1试剂空白吸光度A340nm下测定空白吸光度应≥0.8000。
2.3.2试剂空白吸光度变化率A340nm下测定空白吸光度变化率≤0.0100。
2.4 准确度用国际参考物质NIST SRM1950,对试剂盒进行测试,相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为10.0 μmol/L时,其吸光度变化率应≥ 0.0100。
2.6 线性线性区间在[1.5,50.0]μmol/L,线性相关系数r应≥0.995,在[1.5,10.0]μmol/L区间内测定的绝对偏差应不超过±1.0μmol/L,在(10.0,50.0]μmol/L范围内测定的相对偏差应不超过±10%。
2.7 测量精密度2.7.1重复性使用高、低不同浓度的样本重复测定10次,其测定值的变异系数(CV%)应不大于3%。
2.7.2批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8质控品赋值有效性使用质控品进行测定,所得结果应在质控范围内。
2.9 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
取到效期后试剂盒进行检测,检测结果应符合2.1、2.3、2.4、2.5、2.6、2.7.1、2.8的要求。
2.10校准品溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所用产品校准品的来源、赋值过程以及测量不确定度,试剂盒校准品溯源至ID-LC/MS/MS参考方法。

1.性能指标1.1外观1.1.1M:免疫磁珠应为棕褐色或黄褐色悬浊液,静置久后,棕(黄)褐色磁珠沉于底部,上清应为澄明液体;1.1.2R:酶结合物应为无色或乳白色澄明液体;1.1.3校准品和质控品应为无色或乳白色澄明液体。
1.2净含量液体试剂的净含量应不少于标示值,具体标示值见下表。
1.3空白限应不大于0.015ng/mL。
1.4线性试剂盒在0.02~35ng/mL 浓度区间内,其相关系数r 应不低于0.9900。
1.5准确度用生长激素国家标准品配制成要求的浓度进行检测,其测量结果的相对偏差不超过±10 .0%。
1.6重复性变异系数CV≤8.0%。
1.7批间差变异系数CV≤15.0%。
1.8分析特异性1.8.1类似物试验测定浓度不低于2000mIU/L 的泌乳素样本,其测定结果应不大于0.5ng/mL。
1.8.2干扰物试验样本中添加以下浓度的化合物,测定结果较对照样本偏差不超过±10% 。
检测物质检测浓度胆红素400μmol/L血红蛋白 4.0g/L甘油三酯800mg/dL生物素20ng/mL1.9质控品准确度质控品测定值应在试剂盒规定的质控范围内。
1.10质控品瓶内均一性≤10%。
变异系数CV瓶内1.11质控品瓶间均一性变异系数CV≤15%。
瓶间1.12校准品准确度相对偏差不超过±10%。
1.13校准品瓶内均一性变异系数CV≤10%。
瓶内1.14校准品瓶间均一性变异系数CV≤15%。
瓶间。
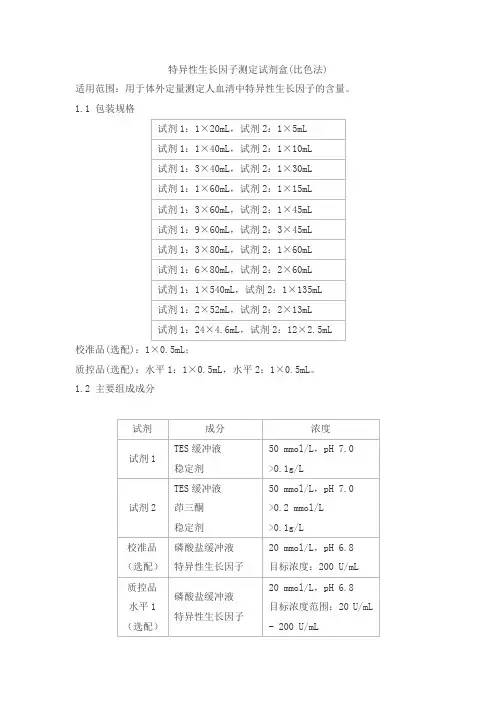
特异性生长因子测定试剂盒(比色法)适用范围:用于体外定量测定人血清中特异性生长因子的含量。
1.1 包装规格校准品(选配):1×0.5mL;质控品(选配):水平1:1×0.5mL,水平2:1×0.5mL。
1.2 主要组成成分注:校准品靶值、质控品质控范围批特异,详见包装标签。
2.1 外观2.1.1 试剂1、试剂2、校准品、质控品:无色至淡黄色液体,无可见不溶物。
2.1.2 包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3试剂空白2.3.1试剂空白吸光度试剂空白吸光度≤1.0。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率ΔA/min≤0.003。
2.4 分析灵敏度样本浓度为100 U/mL时,ΔA/min≥0.001。
2.5 线性在[10,400] U/mL的范围内,线性相关系数r≥0.990。
测试浓度在[10,50] U/mL时;绝对偏差不超过±5 U/mL;测试浓度在(50,400] U/mL时,相对偏差不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本进行测试,各重复测试10次,其变异系数(CV)不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)不大于10%。
2.7 准确度与已上市产品进行比对试验,样本浓度在[10,400] U/mL的范围内,线性相关系数r≥0.990。
测试浓度在[10,50] U/mL时;绝对偏差不超过±5 U/mL;测试浓度在(50,400] U/mL时,相对偏差不超过±10%。
2.8 校准品/质控品瓶内重复性校准品/质控品瓶内重复性(CV)应不大于10%。
2.9 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,溯源至柏定公司内部工作校准品,并与已上市产品比对赋值。
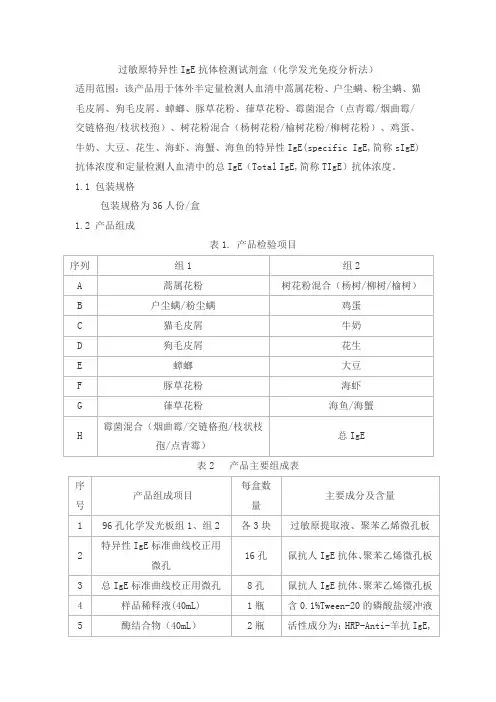
过敏原特异性IgE抗体检测试剂盒(化学发光免疫分析法)适用范围:该产品用于体外半定量检测人血清中蒿属花粉、户尘螨、粉尘螨、猫毛皮屑、狗毛皮屑、蟑螂、豚草花粉、葎草花粉、霉菌混合(点青霉/烟曲霉/交链格孢/枝状枝孢)、树花粉混合(杨树花粉/榆树花粉/柳树花粉)、鸡蛋、牛奶、大豆、花生、海虾、海蟹、海鱼的特异性IgE(specific IgE,简称sIgE)抗体浓度和定量检测人血清中的总IgE(Total IgE,简称TIgE)抗体浓度。
1.1 包装规格包装规格为36人份/盒1.2 产品组成表1. 产品检验项目表2 产品主要组成表2.1 外观外观应符合如下要求:2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无破损。
2.2 校准品溯源性按照GB/T 21415-2008标准,特异性IgE试剂盒校准品溯源到WHO人血清IgE国际标准品(WHO International Standard Immunoglobulin E(IgE),human serum)。
2.3 准确度2.3.1 特异性IgE2.3.1.1 偏差Ⅰ表3中过敏原偏差试验按以下方法操作:用WHO人血清IgE国际标准品(WHO International Standard Immunoglobulin E(IgE),human serum)标定的过敏原血清作为参考物质进行检测,其测量结果的相对偏差应在±25%范围内;表3:特异性IgE偏差试验Ⅰ中的过敏原Ⅱ表4中过敏原偏差试验按以下方法操作:用Phadia ImmunoCAP试剂标定分级级别的过敏原血清作为参考物质进行检测,其测量结果应该符合对应参考品的分级级别。
表4. 特异性IgE偏差试验Ⅱ中的过敏原2.3.1.2 符合率Ⅰ阳性符合率每种过敏原用5份过敏原阳性内部参考品检测,相应检测结果≥0.35IU/mL,不得出现阴性。
Ⅱ阴性符合率每个检测项目用5份相应过敏原阴性内部参考品检测,相应检测结果<0.35IU/mL,不得出现阳性。

卡马西平测定试剂盒(均相酶免疫法)适用范围:本试剂盒用于体外定量测定人血清中卡马西平的含量。
1.1包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2主要组成成分注:不同批号的校准品、质控品赋值有差异,具体赋值详见靶值单。
2. 性能指标2.1 外观试剂1为无色至黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色至黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
质控品为无色至黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1 空白吸光度在A340nm下测定空白吸光度应≤1.8000。
2.3.2 空白吸光度变化率在A340nm下测定试剂空白吸光度变化率(ΔA/min)应≥0.0500。
2.4 准确度回收试验:在临床样本中加入一定体积的高浓度纯品,进行测定,回收率在90%-110%之间。
2.5 分析灵敏度样本浓度为8.00μg/mL时,其吸光度变化应不小于0.0300。
2.6 线性区间在[2.00,20.00]μg/mL区间内,线性相关系数r≥0.990,在[2.00,5.00]μg/mL 区间内测定的绝对偏差应不超过±0.50μg/mL,在(5.00,20.00] μg/mL区间内测定的相对偏差应不超过±10.00%。
2.7 测量精密度2.7.1 重复性使用高、低不同浓度的样本重复测定10次,其测定值的变异系数(CV%)应不大于10.00%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10.00%。
2.8 质控品赋值有效性使用质控品进行测定,所得结果应在质控范围内。
2.9稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1、2.8的要求。

神经元特异性烯醇化酶测定试剂盒技术要求神经元特异性烯醇化酶(Neuron Specific Enolase, NSE)是一种在神经元和神经内分泌细胞中表达的特异性酶,在临床上被广泛应用于神经系统疾病的诊断与监测。
为了满足临床需求,神经元特异性烯醇化酶测定试剂盒的技术要求应包括以下几个方面。
首先,测定试剂盒的灵敏度要求较高,能够在低水平下快速、准确地检测到神经元特异性烯醇化酶的存在。
灵敏度的提高可以帮助医生更早地诊断和监测神经系统疾病,从而采取更及时的治疗措施。
其次,测定试剂盒的准确性也是至关重要的。
准确度可以通过标准物质的选择和优化实验条件来保证。
标准物质应具有高纯度和稳定性,并能与患者样本中的神经元特异性烯醇化酶相准确地匹配。
实验条件的优化包括反应时间、温度、pH值等,以确保测定结果的准确性和可重复性。
另外,测定试剂盒的选择性也是需要考虑的因素。
由于神经元特异性烯醇化酶与其他相似酶存在交叉反应的可能性,因此试剂盒应具有高度的选择性,能够辨别并测定神经元特异性烯醇化酶的特异性。
此外,试剂盒的稳定性也是一个重要的技术要求。
试剂盒应具有较长的保质期,并能够在不同存储条件下保持稳定性,以确保在各种实验条件下的测定结果的一致性和可比性。
最后,测定试剂盒的操作简便性和快速性也是一个重要考量因素。
操作简便性可以帮助医生和实验室人员节省时间和精力,提高工作效率。
同时,快速性也非常重要,尤其是对于紧急情况下的临床诊断和监测。
综上所述,神经元特异性烯醇化酶测定试剂盒的技术要求应包括高灵敏度、准确性、选择性、稳定性、操作简便性和快速性。
这些要求的满足,可以提高临床应用中的诊断准确性和效率,为神经系统疾病的早期诊断和监测提供有力支持。

特异性生长因子测定试剂盒(酶法)适用范围:本试剂用于体外定量测定人血清中特异性生长因子[TSGF]的浓度。
1.1包装规格1.2主要组成成分本试剂由试剂1(R1)和试剂2(R2)组成试剂1(R1):HEPPS 20mmol/LNaCL 106mmol/L EDTA-2Na 0.5g/LBSA 1g/L海藻糖 1g/L聚乙二醇6000 1g/L凯松 0.05%试剂2(R2):HEPPS 50mmol/L无水乙醇 10ml/L茚三酮 0.5%凯松 0.05%2.1 外观试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰;R1试剂应为无色澄清液体,R2试剂应为无色或淡黄色澄清液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在572nm处测定试剂空白吸光度,应≤0.8A。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.01A。
2.4 分析灵敏度测试80U/ml的被测物时,吸光度变化(ΔA)应不低于0.005A。
2.5 准确性参照EP9-A2的方法,用比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990;每个浓度点在[28,89]U/ml范围内相对偏差不超过±10%。
2.6 重复性用两个水平的样本检测,检测结果批内变异系数(CV)应不超过5%。
2.7 线性2.7.1在[28,89]U/ml范围内,线性相关系数r应不低于0.990;2.7.2 在[28,89]U/ml范围内相对偏差不超过±10%。
2.8 批间差对同一份样品进行重复测定,相对极差≤10%。
2.9 稳定性该产品在2℃~8℃条件下贮存有效期为12个月,取到效期后的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
医疗器械产品技术要求编号:
神经元特异性烯醇化酶(NSE)测定试剂盒(化学发光免疫分析法) 1.产品型号/规格及其划分说明
1.1型号规格
480测试/盒,96测试/盒。
1.2结构组成
校准品靶值批特异,详见定值单。
不同批号的组分不得混用。
1.3适用范围
用于体外定量测定人血清中神经元特异性烯醇化酶(NSE)的含量。
2.性能指标
2.1外观
组分齐全、完整;溶液无混浊,无沉淀或絮状物;微孔板包装袋无破损、漏气现象。
2.2准确度
回收率应在90%~110%范围内。
2.3线性
在[0.5,200]ng/mL范围内,r应不小于0.9900。
2.4空白限
应不大于0.50ng/mL。
2.5精密度
2.5.1批内精密度
手工操作应不大于10.0%,全自动操作应不大于8%。
2.5.2批间精密度
应不大于15.0%。
2.6特异性
根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》规定了校准品的来源、赋值以及不确定度等内容,溯源至企业工作校准品。
2.8稳定性
2.8.1效期末稳定性
NSE试剂盒在2~8℃保存,有效期12个月。
在NSE试剂盒有效期满后2个月内,分别检测2.1~2.4,2.5.1项,结果应符合各项要求。
2.8.2校准品复溶后稳定性
复溶后的校准品在2~8℃条件下保存7天后检测2.2~2.4,2.5.1项,结果应符合各项要求。

人转化生长因子β2(TGFβ2)ELISA试剂盒试验步骤中文别名:人转化生长因子Β2(TGFΒ2)ELISA试剂盒英文名称:Human transforming growth factors β2, TGFβ2 Elisa Kit特异性:可检测样本中的人转化生长因子β2,且与其仿佛物无明显交叉反应。
种属:人保管温度:28℃样本类型:血清、血浆、组织匀浆、细胞培养上清和其他生物液体背景:转化生长因子β2(TGFβ2)前体蛋白由19个氨基酸的信号肽、283个氨基酸的前区和112个氨基酸的成熟区构成。
人TGFβ2成熟区与人TGFβ1和TGFβ3的同源性分别为71%和80%,与小鼠TGFβ2的同源性为97%。
它可由各类细胞表达,包含破骨细胞、胸腺上皮细胞、角蛋白细胞、肝细胞、胃的主细胞和卫星细胞等。
TGFβ2具有显著的种属交叉生物活性,如人TGFβ2对小鼠细胞具有活性,而猪TGFβ2对兔细胞具有活性等。
TGFβ2具有4种基本活性:是大部分类型细胞的生长抑制因子;可加强细胞外基质的沉积;具有免疫抑制作用,抑制抗原递呈细胞表达IL12和CD40L,上调IL10分泌;在胚胎发育期表达于离散区域,如上皮、心肌、手足的软骨和骨骼、神经系统,提示其具有特异性的功能。
工作原理:本试剂盒采用的是双抗体夹心法酶联免疫吸附检测技术(ELISA)。
测定样品中人转化生长因子β2水平。
向预先包被了抗人转化生长因子β2抗体的酶标孔中,加入标准品和样本,温育后,加入生wu素标记的抗转化生长因子β2抗体。
再与HRP标记的链霉亲和素结合,形成免疫复合物,再经过温育和洗涤,去除未结合的酶,然后加入显色底物TMB,产生蓝色,并在酸的作用下转化成最终的黄色。
最终,在450 nm处测定反应孔样品吸光度(OD)值,样本中的人转化生长因子β2浓度与OD值成正比,通过绘制标准曲线计算出样本中人转化生长因子β2的浓度。
产品描述试剂名称数量试剂名称数量96孔板(预包被) 1 96孔板覆膜 2标准品 2 稀释液1×45mL检测溶液A 1×120μL 检测溶液B 1×120μLTMB底物1×9mL 停止液1×6mL浓洗涤液(30×)1×20mL 使用说明书 1需自备的设备及试剂45010nm滤光片的酶标仪(建议仪器使用前提前预热)单道或多道微量加液器及吸头稀释样品的EP管蒸馏水或去离子水吸水纸盛放洗液的容器试剂盒的储存及有效期未开封的试剂盒:全部试剂均按试剂瓶标签上所示保管。

人恶性肿瘤特异性生长因子(TSGF)ELISA试剂盒说明:每次实验的标准曲线一般设7个不同浓度,加上空白孔,标准曲线一共需要8个孔。
因此,一个48T 试剂盒zui多可以测定40个样本(不做重复且一次用完),一个96T试剂盒zui 多可以测定88个样本(不做重复且一次用完)。
可以根据实际样本数量和实验计划选择合适的产品规格。
操作注意事项:
1.实验中不用的板条应立即放回包装袋中,密封保存,以免变质。
2.试剂应按标签说明书储存,使用前恢复到室温。
稀稀过后的标准品应丢弃,不可保存。
3.使用一次性的吸头以免交叉污染,吸取终止液和底物A、B液时,避免使用带金属部分的加样器。
4.不用的其它试剂应包装好或盖好。
不同批号的试剂不要混用。
保质前使用。
5.洗涤酶标板时应充分拍干,不要将吸水纸直接放入酶标反应孔中吸水。
6.使用干净的塑料容器配置洗涤液。
使用前充分混匀试剂盒里的各种成份及样品。
7.加入试剂的顺序应一致,以保证所有反应板孔温育的时间一样。
8.按照说明书中标明的时间、加液的量及顺序进行温育操作。
9.底物A应挥发,避免长时间打开盖子。
底物B对光敏感,避免长时间暴露于光下。
避免用手接触,有毒。
实验完成后应立即读取OD值。
我司ELISA试剂盒五大优点:
一、高效、灵敏、特异的抗体;
二、稳定的重复性和可靠性;
三、吸附性能好,空白值低,孔底透明度高的固相载体;
四、适用血清、血浆、组织匀浆液、细胞培养上清液、尿液等等多种标本类型;
五、zui大限度的节省实验经费。
人转化生长因子β1(TGF—β1)ELISA试剂盒说明书产品名称:人转化生长因子β1(TGFβ1)ELISA试剂盒英文名称:TGFβ1 ELISA Kit检测原理:ELISA试剂盒采纳抗体夹心法:将抗某蛋白抗体包被于酶标板上,标本和标准品中的某蛋白与抗体结合,加入生物素化的抗某蛋白抗体,再加入SABC复合物与生物素抗体结合,形成免疫复合物,然后加入TMB显色底物,显色剂显蓝色,最后加停止液变黄色,游离的成分被洗去。
在450 nm处测OD值,某蛋白浓度与OD值之间呈正比,可通过绘制标准曲线计算出标本中某蛋白的浓度。
试剂盒组分: (保管温度4℃)名称规格(48 T)规格(96 T)预包被酶标板8×6条8×12条1支1支标准品/样品稀释液10ml15ml生物素化检测抗体(100×)60ul120ul生物素化检测抗体稀释液6ml12mlSABC复合物6ml12mlTMB显色液(A/B)各3ml停止液6ml12ml20×浓缩洗涤液30ml60ml封板胶纸2张4张产品说明书1份1份本试剂盒用于血清、血浆、组织匀浆、细胞培育上清液及其它生物体液。
标本收集与试剂准备:1. 血清、血浆样本收集应使用一次性的无热原,无内毒素试管(EDTA、柠檬酸盐、肝素抗凝均可),血清、血浆躲避使用溶血,高血脂标本,标本悬浮物应离心去除,使标本清亮透亮。
待测样本应尽早检测,28℃保管48小时;更长时间须冷冻(20℃或80℃)保管,躲避反复冻融。
2. 洗涤液配置:用蒸馏水1:20稀释(示例:1ml浓缩洗涤液加入19ml的蒸馏水)3. 标准品配制:取7个1.5ml离心管,分别标注1/2,1/4,1/8,1/16,1/32,1/64,blank。
从第一至七管中分别加入标准品/样品稀释液200ul。
在第一管中加入标准品溶液200ul,置于漩涡混合器上混匀后用加样器吸出200ul,移至第二管。
如此反复作对倍稀释,从第六管中吸出200ul弃去,第七管为空白对比。
同型半胱氨酸测定试剂盒产品技术要求九强生物一、样品要求1.样品类型:全血或血清样品。
2.储存条件:样品需要在-20℃下保存,并确保样品的冻结-解冻循环次数不超过三次。
3.样品预处理:样品需要去除蛋白质沉淀和红细胞。
二、试剂要求1.包装:试剂需密封,防止阳光直射和潮湿。
2.试剂稳定性:试剂应具有长期稳定性,一旦包装被打开,应在规定的时间内使用完。
3.试剂成分:试剂应包含同型半胱氨酸酶、辅助试剂和缓冲液等。
三、仪器设备要求1. 分光光度计:能够在340-412nm范围内进行检测。
2.移液器:能够准确分配不同容量的试剂。
3.震荡器:能够提供充分的震荡来混合试剂。
四、操作步骤1.样品准备:按照说明书中的提示,样品需要经过适当的处理和稀释。
2.试剂准备:根据说明书中的比例,将检测试剂和辅助试剂配制好。
3.试剂添加:将样品和试剂按照说明书中的顺序逐步添加到反应孔中。
4.反应孔处理:根据说明书的要求,对反应孔进行震荡混合和温度控制。
5.检测:在设定好的波长下使用分光光度计检测吸光度,并计算同型半胱氨酸的浓度。
五、结果解读1.结果计算:使用提供的标准曲线对吸光度进行计算,并得出同型半胱氨酸的浓度。
2.结果判读:根据相应的参考值范围,对结果进行判读,判断是否正常。
六、质量控制要求1.质量控制品:需要提供适当的质量控制品,用于每种批次的产品质量控制。
2.质量控制记录:需要记录质控样品的结果,并按照规定要求进行评估和分析。
七、结果报告1.报告模板:提供标准的结果报告模板,包括患者信息、样品信息、浓度结果等。
2.结果解释:提供相应的结果解释,包括可能的异常情况和需要采取的进一步检查。
以上是同型半胱氨酸测定试剂盒(酶循环法)的产品技术要求。
这些要求主要涉及样品和试剂的要求、仪器设备和操作步骤的要求、结果解读和质量控制的要求,以及结果报告的要求。
通过满足这些要求,可以确保试剂盒的性能和结果的准确性。
Humanβ-NGF ELISA Kit检测试剂盒(酶联免疫吸附法)Catalog NumberEK1141-48EK1141-96定量检测血清、血浆和细胞培养上清中的人β神经生长因子(β-NGF)浓度。
本产品仅用于科学研究,非诊断试剂,不能用于临床诊断。
一、产品介绍1.背景介绍神经生长因子(NGF)是一种神经肽,主要参与调节某些靶神经元的生长、增殖和存活。
当表达时,NGF最初是以7S、分子量为130kDa的复合物存在,这个复合物由α-NGF、β-NGF和γ-NGF(2:1:2比例)三个蛋白组成。
“神经生长因子”通常指的是2.5S、分子量为26kDa的β亚基蛋白。
β亚基是7S NGF复合物中唯一一个有生物活性的成分(如作为信号分子)。
NGF在先天性和获得性免疫中都起着重要作用。
研究表明NGF通过血浆在机体中循环,对整体的稳态维持很重要。
NGF可促进髓鞘的修复,亦可参与多种精神疾病,如老年痴呆症、抑郁症、精神分裂症、自闭症、雷特综合征、神经性厌食症,神经性贪食症。
NGF信号失调与阿尔茨海默病有关。
同样,NGF在许多心血管疾病中发挥作用,如冠状动脉粥样硬化、肥胖、2型糖尿病、代谢综合征。
NGF也可促进伤口愈合。
2.检测原理本试剂盒采用双抗体夹心酶联免疫吸附检测技术。
特异性抗人β-NGF抗体预包被在高亲和力的酶标板上。
酶标板孔中加入标准品、待测样本和生物素化的检测抗体,经过孵育,样本中存在的β-NGF与固相抗体和检测抗体结合。
洗涤去除未结合的物质后,加入辣根过氧化物酶标记的链霉亲和素(Streptavidin-HRP)。
洗涤后,加入显色底物TMB,避光显色。
颜色反应的深浅与样本中β-NGF的浓度成正比。
加入终止液终止反应,在450nm波长(参考波长570-630nm)测定吸光度值。
3.试剂盒检测的局限1)请在本试剂盒标示的有效期内使用。
2)试剂盒的试剂不能与其他批号的试剂或其他来源的试剂混合使用。
3)任何标准品稀释、操作人员、移液技术、洗涤技术、孵育温度、试剂盒保存时间的改变,都将影响结合反应。
人肿瘤特异生长因子/肿瘤相关因子(TSGF)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T3 IU/ml -100 IU/ml使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中肿瘤特异生长因子/肿瘤相关因子(TSGF)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人肿瘤特异生长因子/肿瘤相关因子(TSGF)水平。
用纯化的人肿瘤特异生长因子/肿瘤相关因子(TSGF)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤特异生长因子/肿瘤相关因子(TSGF),再与HRP标记的肿瘤特异生长因子/肿瘤相关因子(TSGF)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤特异生长因子/肿瘤相关因子(TSGF)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤特异生长因子/肿瘤相关因子(TSGF)浓度。
标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
鳞状细胞癌相关抗原(SCC)测定试剂盒(化学发光法)
:
注:校准品靶值批特异,具体浓度详见靶值单。
1.1 规格
96人份/盒。
1.2 主要组成成分
表1 主要组成成分
注:校准品靶值批特异,具体浓度详见靶值单。
2.1 外观
试剂盒各组分应齐全、完整,液体无渗漏;
中文包装标签应清晰,无磨损。
2.2 溯源性
根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 准确度
回收率应在90%~110%之间。
2.4 线性
在线性范围[1.0,5.0]ng/mL内,线性相关系数r应大于0.99。
2.5 重复性
分别检测低浓度和高浓度的样本,重复性(CV%)应不大于15%。
2.6 批间相对极差
用三个不同批次试剂盒检测,批间相对极差(RR)应不大于20%。
2.7 空白限
空白限应不高于0.5ng/mL。
2.8 特异性
表2 与CEA、tPSA的交叉反应
2.9 稳定性
2℃~8℃储存,有效期12个月,效期后分别检测2.3~2.5、2.7~2.8项,其结果应符合各项要求。
特异性生长因子测定试剂盒(化学法)
适用范围:用于体外定量测定人血清中特异性生长因子的含量。
1.1 包装规格
包装规格见表1。
表1 包装规格。
2.1 外观
试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;
试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色到淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色到淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量
试剂的净含量应不少于标称量。
2.3 试剂空白吸光度
试剂空白:A570nm下测定空白吸光度应≤0.1000。
2.4 准确度
与已上市产品进行比对试验:在SGF
浓度[60,400]U/mL区间内,相关系数r
当量
≥0.990,在[60,200]U/mL区间内测定的绝对偏差应不超过±20U/mL,在(200,400]U/mL区间内测定的相对偏差应不超过±10%。
2.5 分析灵敏度
浓度200 U/mL时,其吸光度变化率在0.0050~0.0300之间。
样本SGF
当量
2.6 线性区间
浓度[60,400]U/mL区间内,线性相关系数r≥0.990,在[60,200]U/mL 在SGF
当量
区间内测定的线性绝对偏差应不超过±20U/mL,在(200,400]U/mL区间内测定的线性相对偏差应不超过±10%。
2.7 测量精密度
2.7.1 重复性
对高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差
随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 质控品赋值有效性
使用质控品进行测定,所得结果应在靶值范围内。
2.9 稳定性
试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.10 溯源性
试剂盒校准品溯源至企业工作校准品。
按《GB/T 21415-2008体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,与湖南新大陆生物技术有限公司试剂盒比对赋值。