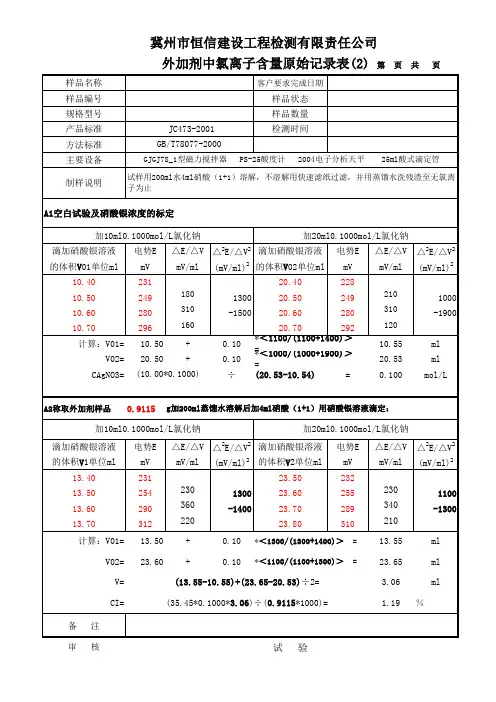
水氯离子试验记录表
- 格式:xls
- 大小:43.50 KB
- 文档页数:1


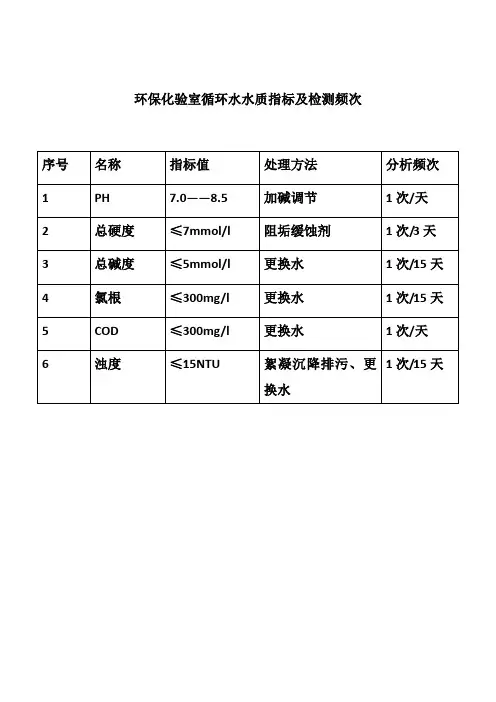
环保化验室循环水水质指标及检测频次1.氯离子的检测检测方法:移取25ml试样于250ml锥形瓶中,加2~3滴酚酞指示剂,摇匀,用硝酸调节PH至试样无色,再加入1ml铬酸钾试剂,使用硝酸银标准溶液滴定,至溶液呈橙红色为滴定终点。
计算:V:消耗硝酸银标准溶液体积。
C:硝酸银标准溶液浓度。
:移取试样体积。
2.COD测定165℃量取2.5ml→加D试剂0.7ml→加E试剂4.8ml→摇匀擦干→消解10min→空气冷却2min→取出加2.5ml蒸馏水摇匀→清水冷却2min→注入30mm比色皿测量→空白→通信→保存3.水硬度测定量取100ml水样→与250ml锥形瓶中→加5mlNH3-NH4CL 缓冲溶液(PH=10)→加铬黑T指示剂3滴→用EDTA标准溶液滴定→由酒红黑色→至亮蓝色30s不退色为终点硬度(mmol/L)=CEDTA*VEDTA**1000/V水样氯离子的测定方法氯离子的测定是在PH5~9条件下测定的。
试剂与材料:酚酞指示剂:1%乙醇溶液铬酸钾指示剂:50g /L水溶液硝酸:1+300的硝酸溶液硝酸银标准溶液:C(AgNO3)=0.0141 mol/L,称取预先干燥并已恒重过的硝酸银2.3996g溶于水中,转移至1L棕色容量瓶中定容。
摇匀,置于暗处(不用标定)。
测定步骤:移取25ml水样于250ml锥形瓶中,加入2~3滴酚酞指示剂,用硝酸调至无色。
加入1ml铬酸钾指示剂,用硝酸银滴定至橙红,同时做空白试验。
计算公式:X(mg/L)=(V-VO)×C×0.03545÷V样×106式中:V—滴定时消耗硝酸银标准溶液的体积,mlV0—空白试验时消耗硝酸银标准溶液的体积,ml V样—水样的体积,mlc—硝酸银标准溶液的浓度,mol/L0.03545——与1mlAgNO3标准溶液c(AgNO3)=1 .000mol/L相当的以克表示的氯的质量。
硝酸银标准溶液的配制和标定二、原理AgNO3标准滴定溶液可以用经过预处理的基准试剂AgNO3直接配制。

一、药品准备 (1)硝酸银溶液(5g/L ):将5g 硝酸银(AgNO 3)溶于水中,加水稀释至1L 。
(2)硝酸(0.5mol/L ):取3ml 硝酸,加水稀释至100ml 。
(3)过氧化氢(H 2O 2):1.11g/cm ³,质量分数30%。
(4)磷酸(H 3PO 4):1.68g/cm ³,质量分数85%。
(5)乙醇或无水乙醇(C 2H 5OH ):乙醇的体积分数95%,无水乙醇的体积分数不低于99.5%。
(6)溴酚蓝指示剂溶液(2g/L ):将0.2g 溴酚蓝溶于100ml 乙醇(1+4)中。
(7)氢氧化钠溶液(0.5mol/L ):将2g 氢氧化钠(NaOH )溶于100ml 水中。
(8)二苯偶氮碳酸肼(10g/L):将1g 二苯偶氮碳酸肼溶于100ml 乙醇(5)中。
(9)硝酸汞标准滴定溶液(0.001mol/L ):称取0.34g 硝酸汞[Hg(NO 3)2·1/2H 2O ],溶于10ml 硝酸(2)中,移入1000ml 容量瓶内,用水稀释至标线,摇匀。
(10)氯离子标准溶液:称取0.3297g 已在105℃— 110℃烘2h 的氯化钠NaCl ,基准试剂或光谱试剂),精确至0.001g ,置于200ml 烧杯中,加水溶解后,移入1000ml 容量瓶中,用水稀释至标线,摇匀。
此标准溶液每毫升含0.2mg 氯离子。
吸取50.OO mL 上述标准溶液放入250 mL 容量瓶中,用水稀释至标线,摇匀。
此标准溶液每毫升含O.04 mg 氯离子。
二、硝酸汞标准滴定溶液[C (Hg(N03)2)=0.O01mol/L]对氯离子滴定度的标定准确加入5.00ml0.04mg/L 氯离子标准溶液(10)于50ml 锥形瓶中,加入20ml 乙醇(5)及1~2滴溴酚蓝指示剂溶液(6),用氢氧化钠溶液(7)调节至溶液呈蓝色,然后用硝酸(2)调节至溶液刚好变黄色,再过量一滴,加入10滴二苯偶氮碳酸肼指示剂溶液(8),用硝酸汞标准滴定溶液滴定至紫红色出现。

自来水中氯离子含量的测定实验报告实验题目:自来水中氯离子含量的测定一、实验目的1、学习使用钾铁氰化钠法测定自来水中氯离子的含量;2、学会分析实验结果并对其合理解释;3、加深对自来水中氯离子含量的了解,关注水质安全。
二、实验原理自来水中的氯离子含量可以通过钾铁氰化钠法进行测定。
该法是利用盐酸与自来水中的氯离子反应形成氯化物,再加入钾铁氰化钠后,与氯化物形成可溶性的钾三氯铁,此时用硫酸二氢钠将样品中的钾离子沉淀下来,剩余的溶液测定吸收光谱即可求出氯离子的含量。
三、实验仪器及试剂1、电子天平;2、分析天平;3、防护眼镜、手套等安全用品;4、去离子水;5、标准氯化钠溶液;6、盐酸;7、钾铁氰化钠溶液;8、硫酸二氢钠溶液。
四、实验步骤1、将200mL自来水放入瓶中;2、用分析天平称取0.1g钾铁氰化钠溶液,加入瓶中;3、加入2mL 10%的盐酸;4、将瓶塞拧紧,慢慢颠瓶反复摇动2分钟;5、将样品的过滤装置过滤,留下过滤废液;6、用洁净容器取3mL上清液,加入试管中,再加入2mL的硫酸二氢钠溶液,用去离子水稀释至10mL;7、在洁净容器中以去离子水为控制组,调整380nm波长测定氯离子的吸收光谱;8、用上清液的吸光度与标准氯化钠溶液所测定的吸光度标准曲线对照求出样品的氯离子含量。
五、实验结果经过测定,自来水中氯离子的含量为32.56mg/L。
六、实验分析与结论本实验通过采用钾铁氰化钠法测定出了自来水中氯离子的含量,该含量大于我国卫生标准所规定的20mg/L。
经过分析实验结果,该水源的氯离子含量高于标准,这说明水源受到了污染或溶解了过多的氯化物,需要采取合适的措施进行处理。
七、实验注意事项1、安全第一,戴好个人防护用品;2、试剂使用前需要认真查看标签,确认无误后使用;3、使用实验仪器前,需进行检查,确认正常后方可操作;4、按照操作步骤依次操作;5、操作结束后,彻底清洗实验器具,做好实验记录。

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载水中氯离子的测定(莫尔法)地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容实验12 水中氯离子的测定(莫尔法)一.实验目的1. 掌握用莫尔法进行沉淀滴定的原理和方法;2. 学习滴定管等实验仪器的使用。
二.背景知识及实验原理1. 背景知识氯离子几乎存在于所有的水中,其含量各处不同。
海水、苦咸水、生活污水和工业废水中,往往都有大量氯离子,甚至天然淡水源中也含有一定的数量。
天然水中氯离子的来源有如下几方面:(1)水源流经含有氯化物的地层;(2)水源受生活污水或工业废水的污染;(3)近海地区的水源受海水的影响。
地面水会因潮汐影响或枯水季节使海水倒灌;海风也会挟带氯离子;地下水有时会由海水渗入补给,这些都会使氯离子的含量增高。
山水、溪水的氯离子含量较低,只有几至几十毫克每升。
海水和地下水中常会有几十至几百毫克每升。
苦咸水中氯离子含量高达2000~5000mg/L。
海水的氯离子含量很高,有15000~20000mg/L。
一般来说,氯离子的含量随水中矿物质的增加而增多。
人体摄入氯离子过多所引起的机体危害作用并不多见。
仅见于严重失水、持续摄入高氯化钠或过多氯化铵的情况。
一般来说,锅炉的省煤器、水冷壁、对流管束以及锅铜等零部件都会由于氯离子含量高而出现被腐蚀的现象,这样往往会造成这些金属部件变得越来越薄,甚至还会出现穿孔等问题。
更为严重的就是腐蚀也可能会造成金属内部结构上的破坏。
被长期腐蚀的金属,它的强度会有显著下降。
这样,不但会严重影响到锅炉的安全运行,还会缩短锅炉可以使用的期限,造成经济上的损失。
2. 实验原理沉淀反应很多,但是能用于沉淀滴定法中的沉淀反应却很少,相当多的沉淀反应都不能完全符合滴定对化学反应的基本要求,而无法滴定。