432 金属指示剂
- 格式:ppt
- 大小:2.13 MB
- 文档页数:50

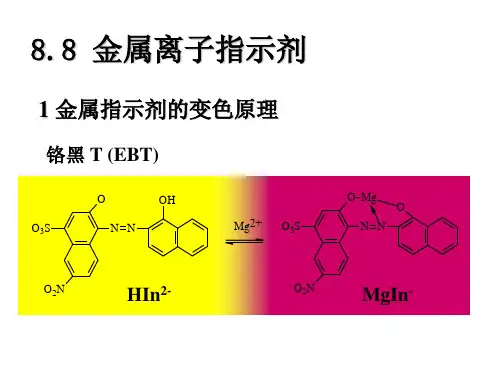
常用金属指示剂①铬黑T铬黑T属于O,O′-二羟基偶氮类染料,简称EBT,化学名称是1-(1-羟基-2-萘偶氮基)-6-硝基-2-萘酚-4-磺酸钠,铬黑T溶于水时,磺酸基上的Na+全都解离,形成H2In-,它在溶液中有下列酸碱平衡:pKa2=6.3 pKa3=11.55H2In-=== HIn2- === In3-紫红蓝橙根据酸碱指示剂的变色原理,可近似估计出铬黑T在不同pH下的颜色如下:pH=pKa2=6.3时,[H2In-]=[HIn2-],呈现蓝色与紫红色的混合色;pH<6.3时,[H2In-]>[HIn2-],呈紫红色;pH=6.3~11.55 时,呈蓝色;pH>11.55时,呈橙色。
铬黑T与金属离子形成的配合物显红色。
可以预料,在pH<6.3和pH>11.55的溶液中,由于指示剂本身接近红色,故不能使用。
根据实验结果,使用铬黑T的最适宜酸度是pH=9~10.5。
在pH=10的缓冲溶液中,用EDTA直接滴定Mg2+、Zn2+、Cd2+、Pb2+和Hg2+等离子时,铬黑T是良好的指示剂,但Al3+、Fe3+、Co2+、Ni2+、Cu2+、Ti4+等对指示剂有封闭作用。
固体铬黑T性质稳定,但其水溶液只能保存几天。
这是由于发生聚合反应和氧化反应的缘故。
铬黑T的聚合反应如下:nH2In- (H2In-)n紫红色棕色在pH<6.5的溶液中,聚合更为严重。
指示剂聚合后,不能与金属离子显色。
在配制溶液时,如加入三乙醇胺,可减慢聚合速度。
在碱性溶液中,空气中的O2以及Mn(IV)和Ce4+等能将铬黑T氧化并褪色。
加入盐酸羟氨或抗坏血酸等还原剂,可防止其氧化。
配制指示剂的另一方法是:将铬黑T与干燥的纯NaCl按1:100混合研细,密闭保存。
使用时用药匙取约0.1g,直接加于溶液中。
用以指示滴定终点的试剂。
在各类滴定过程中,随着滴定剂的加入,被滴定物质和滴定剂的浓度都在不断变化,在等当点附近,离子浓度会发生较大变化,能够对这种离子浓度变化作出显示(如改变溶液颜色,生成沉淀等)的试剂就叫指示剂。

酸碱指示剂的种类和用途酸碱指示剂是化学实验中常用的一种试剂,可以通过改变颜色显示溶液的酸碱性质。
根据其化学性质和颜色变化特点的不同,酸碱指示剂可以分为多种类型。
本文将介绍常见的酸碱指示剂的种类和用途。
一、自然指示剂1. 红蓝石蕊(litmus)红蓝石蕊是应用广泛的自然指示剂,它可以将溶液的酸碱性质显示为红色或蓝色。
当溶液为酸性时,红蓝石蕊呈现红色;当溶液为碱性时,红蓝石蕊呈现蓝色。
这种指示剂比较方便使用,对一般实验来说已经足够。
2. 酚酞(phenolphthalein)酚酞是另一种常见的自然指示剂,它在酸性溶液下呈现无色,而在碱性溶液下呈现粉红色。
酚酞的颜色转变非常明显,适用于中性溶液和弱碱溶液的测定。
二、合成指示剂1. 甲基橙(methyl orange)甲基橙是一种合成指示剂,它在酸性溶液下呈现红色,而在碱性溶液下呈现黄色。
甲基橙的颜色转变较为鲜明,适用于酸碱中度浓度测定。
2. 溴腈酚蓝(bromothymol blue)溴腈酚蓝是一种常见的合成指示剂,它在酸性溶液下呈现黄色,而在碱性溶液下呈现蓝色。
溴腈酚蓝的颜色转变范围较宽,青绿色是其中间的过渡颜色,常应用于酸碱量的测定。
3. 苏丹红(sudan red)苏丹红是一种有机合成指示剂,它在酸性溶液下呈现红色,而在碱性溶液下呈现粉红色。
苏丹红的颜色转变较为饱和,适用于高酸度和高碱度的测定。
三、金属指示剂1. 酞菁钴(cobalt thiocyanate)酞菁钴是一种金属指示剂,它在酸性溶液中呈现红色,而在碱性溶液中呈现蓝色。
酞菁钴的颜色转变非常明显,适用于测定沉淀中的酸碱度。
2. 锌指示剂(zinc indicator)锌指示剂是一种金属指示剂,它在酸性溶液中呈现无色,而在碱性溶液中呈现蓝色。
锌指示剂对于酸碱中度浓度的测定具有较高的准确性。
四、其他指示剂除了上述常见的酸碱指示剂外,实验中还可以使用一些特殊的指示剂,如溴酚蓝(bromophenol blue)、溴酚绿(bromophenol green)和酮酚蓝(thymol blue)等。



金属指示剂具备的条件金属指示剂是一种用于检测金属离子存在与否或进行金属离子浓度分析的化学试剂。
以下是金属指示剂具备的一些条件和相关参考内容。
1. 明显的颜色变化能力:金属指示剂应能够产生明显的颜色变化来指示金属离子的存在。
这是由于金属离子与金属指示剂发生配位或氧化还原反应而产生的。
颜色变化应该是可观察的,以便进行定性或定量分析。
2. 选择性:金属指示剂应该具备一定的选择性,即能够与特定金属离子发生反应,而不与其他金属离子发生反应。
这可以通过合适的配体选择和反应条件控制来实现。
例如,酞菁类染料可以选择性地与铜离子反应形成稳定的络合物。
3. 灵敏度:金属指示剂应具备足够的灵敏度,即能够检测到低浓度的金属离子。
这可以通过增加指示剂的摩尔吸光系数或灵敏度来实现。
4. 耐久性:金属指示剂应该稳定,并能在常规实验条件下保持其反应性能。
这样可以确保金属指示剂的可靠性和可重复性。
5. 可逆性:金属指示剂的颜色变化应该是可逆的,即颜色变化能随金属离子的存在或消失而变化。
这样可以进行多次使用和操作。
除了以上条件,金属指示剂的选择还受到以下因素的影响:- 容易获取和储存的:金属指示剂应该是容易获得和储存的,以便在实验室中广泛使用。
- 经济性:金属指示剂的制备成本应该相对较低,能够提供经济有效的分析方法。
- 可持续性和环境友好性:金属指示剂的使用和处理过程应符合环境保护的要求,不对环境造成污染或危害。
金属指示剂的研究和开发是一个广泛的领域,有许多文献和研究文章可供参考。
例如,研究人员可以通过查阅化学文摘数据库或相关学术期刊来了解最新的金属指示剂制备和应用方法。
一些常见的金属指示剂家族包括酞菁类染料、锂离子缓冲盐、肼氧化铀盐等。
此外,相关化学实验教材和指南中也会提供关于金属指示剂的详细信息和实验操作步骤,供学生和实验员参考。



金属指示剂的作用原理金属指示剂是一种能够与金属离子发生化学反应并产生可观察的颜色变化的化合物。
它通常用于检测金属离子的存在和浓度。
金属指示剂的作用原理涉及到化学配位和电子跃迁的过程。
下面将详细讨论金属指示剂的基本原理以及与之相关的化学现象。
1. 金属指示剂的选择金属指示剂的选择是根据所要检测的金属离子的特性和需要进行的分析方法进行的。
不同的金属离子对应的金属指示剂是不同的,因此在选择金属指示剂时需要考虑到金属离子的种类和浓度。
常见的金属指示剂包括:天蓝素、酞菁、卤代苯酚类、联醋酸纸、指示剂酶等。
这些指示剂根据不同的金属离子能够呈现出不同的颜色变化,在金属离子的存在下形成显色化合物。
2. 金属离子与配位反应金属指示剂与金属离子发生配位反应是金属指示剂作用的关键步骤。
在配位反应中,金属离子与金属指示剂中的配体发生配位作用,形成配位化合物。
配位反应的基本原理涉及到配体和金属离子之间的化学结合。
通常情况下,金属离子所具有的正电荷会与配体中的阴离子或氧化还原体发生静电或共价键结合,从而形成金属配合物。
这种配位反应是可逆的,其平衡状态可以通过配位反应的速度和反应条件来控制和调整。
3. 配位化合物的颜色变化金属指示剂的特殊之处在于它们与金属离子形成的配位化合物通常具有不同的颜色。
这是因为配合物中的金属离子所处的电子能级发生了改变,导致了电子跃迁的现象。
在配位化合物中,金属离子被配位体所包围,而配位体中的电子与金属离子之间发生相互作用。
这种相互作用导致了原子轨道的混合和重新排布,形成了新的电子能级。
当金属离子发生电子跃迁时,能级差的能量对应着某种特定的电磁辐射,通常体现为可见光的一部分。
这种辐射在光谱上表现为特定波长的吸收或发射峰,从而产生了特定的颜色。
不同金属离子和配体之间的电子跃迁能级差不同,因此产生的吸收或发射峰也不同,导致了不同的颜色变化。
这就是金属指示剂的颜色变化背后的基本原理。
4. 具体实例下面以酞菁作为金属指示剂为例,来解释金属指示剂的作用原理。

50种常用PH指示剂1 乙氧基黄叱精指示液取乙氧基黄叱精0.1g,加乙醇100ml使溶解,即得。
变色范围pH3.5~5.5(红→黄)。
二甲基黄指示液取二甲基黄0.1g。
加乙醇100ml使溶解,即得。
变色范围pH2.9~4.0(红→黄)。
2 二甲基黄-亚甲蓝混合指示液取二甲基黄与亚甲蓝各15mg,加氯仿100ml,振摇使溶解(必要时微温),滤过,即得。
3 二甲基黄-溶剂蓝19混合指示液取二甲基黄与溶剂蓝19各15mg,加氯仿100ml使溶解,即得。
4 二甲酚橙指示液取二甲酚橙0.2g,加水100ml使溶解,即得。
5 二苯偕肼指示液取二苯偕肼1g,加乙醇100ml使溶解,即得。
6 儿茶酚紫指示液取儿茶酚紫0.1g,加水100ml使溶解,即得。
变色范围pH6.0~7.0~9.0(黄→紫→紫红)。
7 中性红指示液取中性红0.5g,加水使溶解成100ml,滤过,即得。
变色范围pH6.8~8.0(红→黄)。
8 孔雀绿指示液取孔雀绿0.3g,加冰醋酸100ml使溶解,即得。
变色范围pH0.0~2.0(黄→绿);11.0~13.5(绿→无色)9 石蕊指示液取石蕊粉末10g,加乙醇40ml,回流煮沸1小时,静置,倾去上层清液,再用同一方法处理2次,每次用乙醇30ml,残渣用水10ml洗涤,倾去洗液,再加水50ml煮沸,放冷,滤过,即得。
变色范围pH4.5~8.0(红→蓝)。
10 甲基红指示液取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml使溶解,再加水稀释至200ml,即得。
变色范围pH4.2~6.3(红→黄)。
11 甲基红-亚甲蓝混合指示液取0.1%甲基红的乙醇溶液20ml,加0.2%亚甲蓝溶液8ml,摇匀,即得。
12 甲基红-溴甲酚绿混合指示液取0.1%甲基红的乙醇溶液20ml,加0.2%溴甲酚绿的乙醇溶液30ml,摇匀,即得。
13 甲基橙指示液取甲基橙0.1g,加水100ml使溶解,即得。
变色范围pH3.2~4.4(红→黄)。

金属指示剂的僵化名词解释
金属指示剂是一种用于检测金属离子的化学试剂。
它通常是一种有机
分子,能够与金属离子形成配合物,从而呈现出不同的颜色或发生其
他可观察的变化。
金属指示剂广泛应用于分析化学、环境监测、生物
医学等领域。
金属指示剂的作用基于其与金属离子之间的化学反应。
当金属指示剂
与金属离子配位时,它们之间的电荷转移会导致分子内部电荷分布的
改变,从而引起吸收光谱或发射光谱的变化。
这些变化可以通过光谱
仪等设备进行检测和定量分析。
不同种类的金属指示剂对不同类型的金属离子具有不同的选择性。
EDTA是一种常用于配合镁、钙等碱土金属离子的指示剂;硫氰酸铵则可选择性地配合铁离子;而苯酚蓝则可用于检测铜、镍等过渡金属离子。
在实际应用中,常见的金属指示剂包括溴甲酚绿、二茂铁、菲咯啉等。
它们具有灵敏度高、选择性好等优点,可广泛用于水质检测、食品安
全检测等领域。
同时,也有一些缺点,如对环境的影响、对人体的毒
性等问题需要注意。
金属指示剂是一种重要的化学试剂,在各个领域中都有广泛的应用和
研究。
随着科技的不断进步和需求的不断增加,金属指示剂也将不断
发展和完善。