程守洙《普通物理学》(第6版)(上册)(课后习题详解 热力学基础)【圣才出品】
- 格式:pdf
- 大小:1.77 MB
- 文档页数:36

十万种考研考证电子书、题库视频学习平台圣才电子书 第6章热力学基础一、选择题1.一定量的理想气体,分别进行如图6-1所示的两个卡诺循环abcda 和a′b′c′d′a′,若在PV 图上这两个循环曲线所围面积相等,则可以由此得知这两个循环()。
图6-1A.效率相等B.由高温热源处吸收的热量相等C.由低温热源处放出的热量相等D.在每次循环中对外作的净功相等【答案】D【解析】循环曲线所围面积就是循环过程做的净功。
2.如图6-2所示,和为两条等温线。
若ab 为一绝热压缩过程,则理想气体由状态c 经cb 过程被压缩到b 状态,在该过程中气体的热容C 为()。
A.C>0B.C<0十万种考研考证电子书、题库视频学习平台圣才电子书 C.C=0D.不能确定图6-2【答案】B3.关于可逆过程和不可逆过程有以下几种说法,正确的是().(1)可逆过程一定是准静态过程;(2)准静态过程一定是可逆过程;(3)对不可逆过程,一定找不到另一过程使系统和外界同时复原;(4)非静态过程一定是不可逆过程。
A.(1),(2),(3)B.(2),(3),(4)C.(1),(3),(4)D.(1),(2),(3),(4)【答案】C4.图6-3示四个循环过程中,从理论上看能够实现的循环过程是图()。
图6-3【答案】(a)二、填空题1.一台理想热机按卡诺循环工作,每一个循环做功,高温热源温度T1=100℃,低温热源温度T2=0℃,则该热机的效率为______,热机每一循环从热源吸收的热量为______J,每一循环向低温处排出的热量是______J。
【答案】0.268;2.73×105;2.008×105【解析】由卡诺循环的效率公式,有热机每一个循环从热源吸收的热量为每一个循环向低温热源排出热量是2.质量为1kg的氧气,其温度由300K升高到350K。
若温度升高是在下列三种不同情况下发生的:(1)体积不变;(2)压强不变;(3)绝热。


8.2 课后习题详解一、复习思考题§8-1 恒定电流8-1-1 电流是电荷的流动,在电流密度j≠0的地方,电荷的体密度ρ是否可能等于零?答:是,原因如下:电流密度j是指单位时间内单位面积上有多少电荷量流过;电荷的体密度ρ是指单位体积内有多少净电荷.对一段均匀金属导体,其内部有大量的自由电子,可分以下两种情况讨论:(1)无电流时宏观层面,任一体积元内其正负电荷数量是相等的,净电荷数为零,那么导体内的电荷体密度ρ等于零;(2)有电流时电流密度j≠0,根据电流的连续性原理,对任一段导体都有流进与流出的电流相等,金属导体内没有正电荷的移动,即单位时间内流入的和流出的负电子数相等,因此该段导体内的正负电荷数量仍然相等,净电荷数为零,导体内的电荷体密度ρ等于零.8-1-2 一金属板(如图8-1-1(a))上A、B两点如与直流电源连接,电流是否仅在AB直线上存在?为什么?试说明金属板上电流分布的大致情况.答:(1)否.因为当A、B两点接在直流电源的正负极上后,就存在电势差.该金属板上连接A、B两点的任一直线或弧线都可以看作是一条电阻线,用图8-1-1(b)所示的模型来描述,即在A 、B 之间的金属板可以分割为无数条电阻线,这些电阻并联且两端有相同的电势差,因此理论上在整个金属板上都存在电流线,只是电流主要集中在靠近A 、B 两点的线段上,远离A 、B 两点的地方电流很小.(2)金属板上电流分布的大致情况为:连接A 、B 两点的直线段对应于电阻R 1,那么流过该直线段的电流就最大(电阻最小);连接A 、B 两点的弧线段对应于电阻R 2、R 3、…、R n ,弧线越长,电阻越大,电流越小.因此可得如图8-1-1(c )所示的电流线分布图:图8-1-1金属板上的电流线分析图8-1-3 两截面不同的铜杆串接在一起(如图8-1-2),两端加有电压U ,问通过两杆的电流是否相同?两杆的电流密度是否相同?两杆内的电场强度是否相同?如两杆的长度相等,两杆上的电压是否相同?图8-1-2图8-1-3 粗细不均匀的导线中的电流线答:(1)电流是.原因为:如图8-1-3,在粗细不均匀的导线中,电流线在不同截面处没有突然断失或长出,是连续的,即电流在这种导线中处处相同.同时若把粗细不等的两段导线视为两个阻值不同的电阻串联在一起,加上电压U后,串联电路的电流是处处相同的,即通过两杆的电流相同.(2)电流密度否.原因为:两杆的截面不相同,流过杆的电流密度j则不相同,因此电流密度在细的一段较大,在粗的一段较小.(3)电场强度否.原因为:欧姆定理的微分形式j=γE说明,电流密度与电场强度成正比.因此细杆内的电流密度大,电场强;粗杆内的电流密度小,电场弱.(4)长度相等时,两杆的电压否.原因为:若同样的材质和长度,根据欧姆定律U=IR,当二者串联时有相同的电流,电阻大的细杆两端电压较高,电阻小的粗杆两端电压较低.8-1-4 电源中存在的电场和静电场有何不同?答:电源中同时存在两种电场:非静电性电场和恒定电场.(1)非静电性电场与静电场的不同点①作用力不同:a.非静电性电场对电荷的作用力是非静电力,如化学力、核力等,因此非静电性电场的大小是指单位正电荷所受到的非静电性力;b.静电场是由静止电荷激发产生的,静电场的大小是指单位正电荷所受到的静电力.②方向不同:a.非静电性电场的方向:在电源内部从电源的负极(低电势)指向电源的正极(高电势),在电源外部没有没有非静电性电场;b.静电场的的方向:由高电势指向低电势.③性质不同:a.非静电性电场是非保守力场;b.静电场是保守力场.(2)恒定电场与静电场的不同点静电场是由静止电荷激发产生;而恒定电场是由运动电荷产生,而其电场分布是恒定的.但是二者均为保守力场,均由不随时间变化的电荷或电荷分布所激发产生.8-1-5 一铜线外涂以银层,两端加上电压后在铜线和银层中通过的电流是否相同?电流密度是否相同?电场强度是否相同?答:(1)电流否,原因为:将铜线外涂以银层的电线结构视为两阻值不同的电阻并联而成,尽管二者长度相同,但电阻率不同,截面积也不同,因此铜线和银层的电阻不同.在电压相同的情况下,并联电阻通过的电流随阻值不同而不同,所以通过铜心和银层的电流不相同.(2)电流密度否,原因如下:设铜和银的电阻率分别为ρ1和ρ2,铜心和银层的截面积分别为S1和S2,它们的长度都是l ,那么它们的电阻分别为电流分别为电流密度分别为由此可见,电流密度与电阻率成反比,而与导线的截面积无关.由于铜的电阻率ρ1比银的电阻率ρ2大,所以铜心的电流密度比银层的电流密度小.(3)电场强度是,原因如下:根据欧姆定律的微分形式J =γE ,可求出铜心与银层中的电场强度大小分别是:可见铜心与银层中的电场强度是相同的,与铜心和银层的截面积、电阻率都无关.上式描述的是电场强度与电势梯度的关系,由于铜心和银层两端的电压和自身的长度相同,因此内部的电势梯度相同,电场强度也相同.§8-2 磁感应强度8-2-1 一正电荷在磁场中运动,已知其速度v 沿着Ox 轴方向,若它在磁场中所受力有下列几种情况,试指出各种情况下磁感应强度B 的方向.(1)电荷不受力;(2)F 的方向沿Oz 轴方向,且此时磁力的值最大;(3)F 的方向沿Oz 轴负方向,且此时磁力的值是最大值的一半.答:运动电荷在磁场中受到的洛伦兹力,F =q v ×B ,洛伦兹力的大小为F =qvBsinθ,θ为v 与B 之间的夹角,因此:(1)电荷不受力时此时洛伦兹力F =qvBsinθ=0,即磁感应强度B 的方向与电荷的运动方向一致(θ=0),或者相反(θ=π);(见图8-1-4(a ))(2)磁力的值最大时此时磁感应强度B 的方向与运动电荷的运动方向垂直其方向可由矢积F max ×v 的方向确定,因此沿y 轴方向;(见图8-1-4(b ))(3)磁力的值是最大值的一半时此时磁感应强度B 的方向与运动电荷运动方向之间的夹角由于F 的方向总是与B 与v 所在的平面垂直,而F 的方向沿O z 轴负方向,因此B 的方向在xy 平面内,且与x 轴之间的夹角(见图8-1-4(c ))图8-1-4 不同情况下磁感应强度B 的方向8-2-2 (1)一带电的质点以已知速度通过某磁场的空间,只用一次测量能否确定磁。

4.2 课后习题详解一、复习思考题§4-1 狭义相对论基本原理洛伦兹变换4-1-1 爱因斯坦的相对性原理与经典力学的相对性原理有何不同?答:(1)经典力学的相对性原理:运动关系的相对性表明,物质之间存在着相对运动的关系而非彼此孤立.相对运动的形式丰富多样,由相对运动产生的相互作用力也形式不一.(2)爱因斯坦的相对性原理:在所有惯性系中,物理定律的形式相同,或者说,所有惯性系对于描述物理现象都是等价的.(3)二者的分析比较:①经典力学的相对性原理说明一切惯性系对力学规律的等价性,而爱因斯坦的相对性原理将此种等价性推广到一切自然规律上去,包括力学定律和电磁学定律.②爱因斯坦的相对性原理的等价性推广意义深刻.我们可借助于电学或光学实验确定出本系统的“绝对运动”来,绝对静止的参考系是存在的,然而这与实验事实相矛盾.③爱因斯坦基于对客观规律的根本认识以及对实验事实的总结,才提出这个相对性原理的.相对论是研究相对运动和相互作用的科学.它使研究物质、能量及其相互作用的物理学发展到更高更深的层次.4-1-2 洛伦兹变换与伽利略变换的本质差别是什么?如何理解洛伦兹变换的物理意义?答:(1)洛伦兹变换与伽利略变换的本质差别:①洛伦兹变换是相对论时空观的具体表述;②伽利略变换是经典力学绝对时空观的具体表述.(2)洛伦兹变换的物理意义①洛伦兹变换集中地反映了相对论关于时间、空间和物质运动三者紧密联系的观念.②洛伦兹变换是建立相对论力学的基础.a.运用洛伦兹变换,评判一条物理规律是否符合相对论的要求,凡是通过洛伦兹变换能保持不变式的物理规律都是相对论性的规律.b.在v<<c时,洛伦兹变换将转换为伽利略变换,从这个角度出发,相对论力学就是经典牛顿力学的继承、批判和发展.4-1-3 设某种粒子在恒力作用下运动,根据牛顿力学,粒子的速率能否超过光速?答:(1)牛顿力学认为粒子的质量不会改变,粒子的加速度正比于所受外力.外力越大,粒子所得的加速度也越大.因此,粒子速度是没有极限的,粒子的速率可以超过光速.(2)相对论力学认为,粒子的质量随速度的增大而增大,粒子的加速度并非与所受外力成简单正比关系,加速度的大小有限制,使得粒子的速率不会超过光速.§4-3 狭义相对论的时空观4-3-1 长度的量度和同时性有什么关系?为什么长度的量度和参考系有关系?答:(1)长度的量度:测量一物体的长度就是在本身所处的参考系中测量物体两端点位置之间的距离.(2)同时性分析:①当待测物体相对于观测者静止时,在不同的时刻测量两端点的位置,其距离总是物体的长度;②当待测物体相对于观测者运动时,物体的长度就必须同时测定物体两端点的位置.若非同时测定,测量了一端的位置时,另一端已移动到新的位置,其坐标差值不再是物体的长度了.(3)由于同时性的相对性,所以长度的量度与同时性紧密相连,从而与测量的参考系有关.(4)下面举例说明:假设有一细棒静止在K′系的x′轴上,而K′系相对惯性系K 以速度v沿O x 轴运动.如把记录细棒左端坐标为事件1,记录细棒右端坐标为事件2,则两事件在两参考系中相应的时空坐标为由于细棒静止在K '系,所以△x'=x '2-x '1就是细棒的固有长度,根据洛伦兹变换在K 系测量两端坐标必须同时进行,即△t=0,故有所以在K 系中测得物体的长度为这就是长度收缩效应现象.4-3-2 下面两种论断是否正确?(1)在某一惯性系中同时、同地发生的事件,在所有其他惯性系中也一定是同时、同地发生的.(2)在某一惯性系中有两个事件,同时发生在不同地点,而在对该系有相对运动的其他惯性系中,这两个事件却一定不同时.答:(1)正确.在一个惯性系中同时、同地发生的事件,实质上就是一个事件.因而,可得:△x=0,△t=0根据洛伦兹变换:△x'=0,△t'=0因此,在所有其他惯性系中也一定是同时、同地发生的.(2)正确.对惯性系K 中同时发生在不同地点的两个事件,可得△t=0.△x≠0在相对运动的其他惯性系K '中,有在惯性系K '中这两个事件一定不同时.因此,同时性是相对的.4-3-3 两只相对运动的标准时钟A 和B ,从A 所在惯性系观察,哪个钟走得更快?从B 所在惯性系观察,又是如何呢?答:(1)从A 所在惯性系观察,根据“时间膨胀”或“原时最短”的结论,相对静止的时钟A 所指示的时间间隔是原时,它走得“快”些;而时钟B 给出的时间间隔是运动时,因“时间膨胀”而走得“慢”些.(2)同理,从B所在惯性系观察时,则相反,时钟B走得“快”些,而时钟A走得“慢”些.4-3-4 相对论中运动物体长度缩短与物体线度的热胀冷缩是否是一回事?答:不是一回事.(1)“热胀冷缩”①是涉及分子微观热运动的基本热学现象;②这与物体的温度有关,与其宏观运动速度无关.(2)“长度收缩”①是由狭义相对论所得到的重要结论,指在相对物体运动的惯性系中测量物体沿运动方向的长度时,测得的长度总是小于固有长度或静长这一现象;②这与物体的运动速度有关,与物体的组成和结构无关,是普遍的时空性质的反映.4-3-5 有一枚以接近于光速相对于地球飞行的宇宙火箭,在地球上的观察者将测得火箭上的物体长度缩短,过程的时间延长,有人因此得出结论说:火箭上观察者将测得地球上的物体比火箭上同类物体更长,而同一过程的时间缩短.这个结论对吗?答:此结论不正确.(1)狭义相对论认为,“长度收缩”和“时间膨胀”都是相对的.(2)若以火箭和地球为相对运动的惯性参考系,则火箭上的观察者也会观测到“长度收缩”和“时间膨胀”的现象.4-3-6 比较狭义相对论的时空观与经典力学时空观有何不同?有何联系?答:(1)两种时空观的不同:①狭义相对论时空观:a.狭义相对论中关于不同惯性系之间物理事件的时空坐标变换的基本关系式是洛伦兹变换.在洛伦兹变换关系中,长度和时间都是相对的,反映了相对论的时空观.b.狭义相对论时空观认为:第一,空间和时间不可分割,与物质运动密切相关;第二,时间是相对的,时间间隔因惯性系不同则会有差别;第三,空间是相对的,在不同的惯性系中,相同两点的空间间隔会有差别.②经典力学时空观:a.经典力学中关于不同惯性系之间物理事件的时空坐标变换的关系式是伽利略变换.在伽利略变换关系中,长度和时间都是绝对的,反映了经典力学的绝对时空观.b.经典力学时空观认为:时间、空间是彼此独立的,都是绝对的,与物质运动无关.(2)两种时空观的联系:①洛伦兹变换式通过狭义相对论的两个基本原理推导得出,并由此得出反映相对论时空观的几个重要结论,比如同时性的相对性、长度收缩、时间膨胀等;②当v<<c时,洛伦兹变换可以过渡到伽利略变换,即经典力学是相对论力学的低速近似.§4-4 狭义相对论动力学基础4-4-1 化学家经常说:“在化学反应中,反应前的质量等于反应后的质量.”以2g 氢与16g氧燃烧成水为例,注意到在这个反应过程中大约放出了25J的热量,如果考虑到相对论效应,则上面的说法有无修正的必要?。

普通物理学第六版答案引言本文档为《普通物理学第六版》的习题答案,旨在帮助读者更好地理解和掌握书中的内容。
答案是根据该版本的章节和习题整理而成,涵盖了从基本概念到高级问题的解答过程。
读者可以通过对比自己的答案,找到解题思路上的差异,并做出相应的调整。
目录1.第1章:引言2.第2章:运动学3.第3章:相对论运动学4.第4章:力学5.第5章:电磁学6.第6章:热学第1章:引言本章主要介绍了普通物理学的基本概念和研究方法。
习题涉及了科学方法、物理量和单位、测量等内容。
以下是一道题目的答案示例:1.假设有一个实验,需要测量一个物体的质量。
你应该如何选择测量方法?请详细描述你的策略和步骤。
答案:首先,我们可以选择使用天平进行质量的测量。
下面是测量质量的步骤:1.确保天平是精确的,没有偏差。
可以通过进行零位校准来验证天平的准确性。
2.将待测物体放置在天平的平台上,并保持其稳定。
3.观察天平的示数,记录下物体的质量。
如果天平的示数不稳定,可以多次测量并求取平均值。
4.确认测量结果的单位是否与预期一致,如果单位不同,需要进行单位换算。
第2章:运动学本章讨论了运动学的基本概念和运动规律。
习题涵盖了位移、速度、加速度等方面的内容。
以下是一道题目的答案示例:2.一个人以匀速9 m/s的速度行走了30s,求他的位移。
答案:由于匀速运动的速度保持不变,我们可以使用以下公式计算位移:位移 = 速度 × 时间位移 = 9 m/s × 30 s = 270 m因此,这个人的位移为270米。
第3章:相对论运动学本章讨论了相对论运动学的基本原理和公式。
习题涉及了速度叠加、光速不变等内容。
以下是一道题目的答案示例:3.一个物体以0.8c的速度向东运动,一个观察者以0.6c的速度相对于该物体运动。
求观察者相对于地面的速度。
答案:根据相对论速度叠加公式:v’ = (v1 + v2) / (1 + v1 * v2 / c^2)其中,v1为物体相对于地面的速度,v2为观察者相对于物体的速度。


2.2 课后习题详解一、复习思考题§2-1 质点系的内力和外力质心质心运动定理2-1-1 一物体能否有质心而无重心?试说明之.答:一物体可能有质心而无重心.(1)质心是表征物体系统质量分布的一个几何点,任何物体都有其质量分布,因此物体都有质心.(2)重心是地球对物体重力的作用点.在失重环境中,物体不受重力作用,重心就没有意义.2-1-2 人体的质心是否固定在体内?能否从体内移到体外?答:(1)质心是从平均意义上来表示物体的质量分布中心.它的位置由物体的质量分布来决定.所以,当物体质量改变时,质心的位置可以不固定.(2)质心可以由体内移到体外.人体在直立时,质心在体内,如果人体弯曲,就可把质心从体内移到体外.2-1-3 有人说:“质心是质量集中之处,因此在质心处必定要有质量”.这话对吗?答:(1)说法不对.(2)质心是描述物体系统质量分布的一个几何点,并非质量集中之处,质心所在处不一定有质量分布.如:质量均匀分布的空心球,其质心在球心,但质量却均匀分布于球面上.§2-2 动量定理动量守恒定律2-2-1 能否利用装在小船上的风扇扇动空气使小船前进?答:这是可以的.(1)假定风扇固定在小船上.当风扇不断地向船尾扇动空气时,风扇同时也受到了空气的反作用力.(2)该反作用力是向着船头的、并通过风扇作用于船身.根据动量定理,该力持续作用时会使船向前运动的动量获得增量.(3)当该作用力大于船向前运动时所受的阻力时,小船就可向前运动了.2-2-2 在地面的上空停着一气球,气球下面吊着软梯,梯上站着一个人.当这人沿软梯往上爬时,气球是否运动?答:选择人、气球和软梯组成的系统为研究对象.(1)当人相对软梯静止时,系统所受合力等于零.系统的动量在垂直方向上等于零并守恒,系统的质心将保持原有的静止状态不变.(2)当人沿软梯往上爬时,人与软梯间的相互作用力是内力,系统所受合外力仍为零,总动量恒定不变.系统的质心位置仍保持不变.根据动量守恒定律可知,当人沿软梯往上爬时,气球和软梯将向下运动.2-2-3 对于变质量系统,能否应用?为什么?答:(1)变质量系统的问题属于质点系的动力学问题,牛顿第二定律依然适用,但式中mν应理解为质点系的总动量.(2)这类问题的代表是发射中的火箭、下落中的雨滴等问题,其研究对象一般是主体的运动规律,对于运动过程中所吸附或排出的那一部分质量,在变化前后与运动主体有不同的运动速度,所以用来处理主体的运动是不正确的.(3)一般从质点系的动量定理的角度入手,由系统的动量定理可得式中m 为运动主体的质量,为附加物在吸附或排出后相对于运动主体的速度.上式变形得:该式是指主体的动量变化率等于主体所受的外力与单位时间内附加物变化的动量的矢量和.2-2-4 物体m 被放在斜面m'上,如把m 与m'看成一个系统,问在下列何种情形下,系统的水平方向分动量是守恒的?(1)m 与m'间无摩擦,而m'与地面间有摩擦;(2)m 与m'间有摩擦,而m'与地面间无摩擦;(3)两处都没有摩擦;(4)两处都有摩擦.图2-1-1答:如图2-1-1所示,物体与斜面视为一个系统,对系统进行受力分析:物体与斜面受到重力作用,地面对斜面有支持力,地面与斜面之间存在摩擦力.其中物体与斜面间的摩擦力和支持力均是系统的内力.当系统在水平方向的合外力为零时,系统的水平方向分动量守恒.讨论如下:(1)m'与地面间有摩擦时,系统在水平方向的合外力不为零,故水平方向的分动量不守恒.(2)m'与地面间无摩擦时,系统的水平方向的分动量守恒.(3)与(2)结论一致,系统的水平方向的分动量守恒.(4)与(1)结论一致,系统的水平方向的分动量不守恒.2-2-5 用锤压钉,很难把钉压入木块,如用锤击钉,钉就很容易进入木块,这是为什么?答:钉子打入木块,主要是钉子与木块之间的摩擦力小于钉子所受的作用力.(1)锤压钉子的压力一般不大,当钉子所受的摩擦力大于锤对钉子的压力时,钉子就无法进入木块,,因此难以把钉压入木块.(2)锤击钉子时,具有一定的动量,打击到钉子后,动量变成零.根据动量定理和牛顿第三定律,由于打击时间很短,钉子受到平均冲力很大,因此很容易克服木块的阻力而进入木块.2-2-6 如图2-1-2所示,用细线把球挂起来,球下系一同样的细线.拉球下细线,逐渐加大力量,哪段细线先断?为什么?如用较大力量突然拉球下细线,哪段细线先断?为什么?图2-1-2答:任何细线只能承受一定张力,当给予细线的拉力超过它所能承受的极限张力,线就会断掉.如图示的情况:(1)当逐渐加大力量拉球下线时:在任一时刻,线中的张力与拉力达到平衡,而球上面线中的张力等于拉力和球的重力.因此,在渐渐增大拉力的过程中,球上面的线中的张力首先超过其极限张力会先断.(2)当用较大的力量突然拉球下线时:由动量定理可知,作用在线上的拉力就是冲力,由于力的作用时间较短,冲力还未传到球上面的线前,球下面的线就已经断了.2-2-7 有两只船与堤岸的距离相同,为什么从小船跳上岸比较难,而从大船跳上岸却比较容易?答:(1)选择人和船作为一个系统,并将人和船视为质点,忽略水的阻力.人以水平速度跳出时,系统在水平方向的动量分量守恒,即(2)由上式可知,大船没有小船后退厉害,人与小船的作用时间比较短了,在作用力相等时,所得的冲量就比较小了.因此人用同样大的力自小船上前跳的速度比自大船上前跳时的小,所以从小船跳上岸比从大船要困难.§2-3 功 动能 动能定理2-3-1 物体可否只具有机械能而无动量?一物体可否只有动量而无机械能?试举例说明.答:一个物体的动能和动量与相对于某参考系的速度有关;而物体的势能则与势能零点的选取有关.机械能是动能和势能的代数和.(1)一物体可能只具有机械能而无动量.如:①静止在离地面h 处的物体,它的动能和动量均为零.不将势能零点选在离地面高h 处时,物体就具有势能.因此,物体具有机械能而无动量.②弹簧振子在水平面内振动,在位移最大处,速度等于零,动能和动量也等于零.如将弹簧的原长处作为弹性势能的零点,那么此时弹簧振子具有弹性势能,其机械能不为零而动量为零.(2)一物体也可能只有动量而无机械能.如:物体离地面h 处自由下落至地面时,物体速度不为零,那么物体具有动量和动能.如将重力势能的零点选定在物体下落处,则到达地面时具有重力势能-mgh .由于开。

第1章力和运动1.1复习笔记一、质点运动的描述机械运动是指一个物体相对于另一个物体的位置,或者一个物体的某些部分相对于其他部分的位置,随着时间而变化的过程.1.质点(1)质点是指具有一定质量且大小和形状可以忽略的理想物体;(2)质点的简化具有相对性.2.参考系和坐标系(1)参考系①参考系是指在描述物体运动时,被选作参考的物体或物体系;②参考系的选择具有任意性.(2)坐标系①选取在参考系上选定一点作为坐标系的原点O,取通过原点并标有长度的线作为坐标轴.②常用坐标系笛卡尔坐标系、平面极坐标系和球坐标系等.(3)参考系和坐标系的关系坐标系用来定量地描述一个物体在各时刻相对于参考系的位置.3.空间和时间(1)空间反映物质的广延性,与物体的体积和物体位置的变化相联系;(2)时间反映物理事件的顺序性和持续性.4.运动学方程在选定的参考系中,运动质点的位置P(x,y,z)是t 的函数,即x=x(t),y=y(t),z=z(t)5.位矢(1)位矢是用来确定某时刻质点位置的矢量,用r 表示.(2)特点①矢量性;②瞬时性;③相对性.6.位移位移表示质点在一段时间内位置改变的矢量,用r表示.7.速度(1)平均速度:(2)瞬时速度(速度):8.加速度(1)质点的平均加速度(2)瞬时加速度加速度是矢量:①a与v成锐角,速率增加;②a与v成钝角,速率减小;③a与v成直角,速率不变.二、圆周运动和一般曲线运动1.切向加速度和法向加速度自然坐标系下的加速度式中,切向加速度a t和法向加速度a n分别为:2.圆周运动的角量描述(1)圆周运动的瞬时角速度(角速度)式中,△θ为角位移,单位为rad;ω的单位为1/s或rad/s.(2)圆周运动的瞬时角加速度(角加速度)式中,α的单位为1/s2或rad/s2.(3)角量和线量的关系22 d d t n R a R t a R R υωυαυω⎧⎫⎪=⎪⎪⎪⎪⎪==⎨⎬⎪⎪⎪⎪==⎪⎪⎭⎩线量角量3.抛体运动的矢量描述(1)速度分量:(2)速度矢量:(3)加速度:(4)位矢:(5)轨迹方程:三、相对运动常见力和基本力1.相对运动(1)伽利略坐标变换(2)速度变换与加速度变换质点P 在K’系的速度/加速度与它在K 系的速度/加速度的关系质点在两个相对作匀速直线运动的参考系中的加速度是相同的.2.常见力(1)重力重力是指地球表面附近的物体受到地球的吸引作用而使物体受到的力.(2)弹力弹力是指形变物体恢复原状时与它接触的物体产生的力.弹力的三种表现形式:①两物体间的相互挤压两物体间相互挤压所产生的弹力又称正压力或支承力.该力大小取决于相互挤压的程度,方向总是垂直于接触面并指向对方.②绳线对物体的拉力该力大小取决于绳线收紧的程度,方向总是沿着绳线并指向绳线收紧的方向.③弹簧的弹力弹簧的弹力总是力图使弹簧恢复原状,又称恢复力.F=-kx(胡克定律)式中:k为弹簧的劲度系数或劲度,负号表示弹力和位移方向相反.(3)摩擦力摩擦力是指两个相互接触的物体在沿接触面相对运动或有相对运动的趋势时,在接触面间产生的一对阻止相对运动的力.(4)万有引力万有引力是存在于任何两个物体之间的吸引力.式中:G为引力常量,.3.基本力(1)电磁力电磁力是指存在于静止电荷之间的电性力以及存在于运动电荷之间的电性力和磁性力.(2)强力强力是指存在于核子、介子和超子之间的强相互作用.(3)弱力弱力是指在亚原子领域中存在的短程相互作用.四、牛顿运动定律1.牛顿第一定律任何物体都保持静止或匀速直线运动状态,直到作用在它上面的力迫使它改变这种状态为止,又称惯性定律.相关说明:(1)惯性是物体所具有的保持其原有运动状态不变的特性.(2)力是引起运动状态改变的原因.(3)牛顿定律只适用于惯性系.2.牛顿第二定律物体受到外力作用时,它所获得的加速度的大小与外力的大小成正比,并与物体的质量成反比,加速度方向与外力方向相同.dtv d m a m F ==力是物体产生加速度的原因,并非物体有速度的原因.3.牛顿第三定律两个物体之间的作用力和反作用力,在同一直线上,大小相等方向相反.BAAB F F -=。
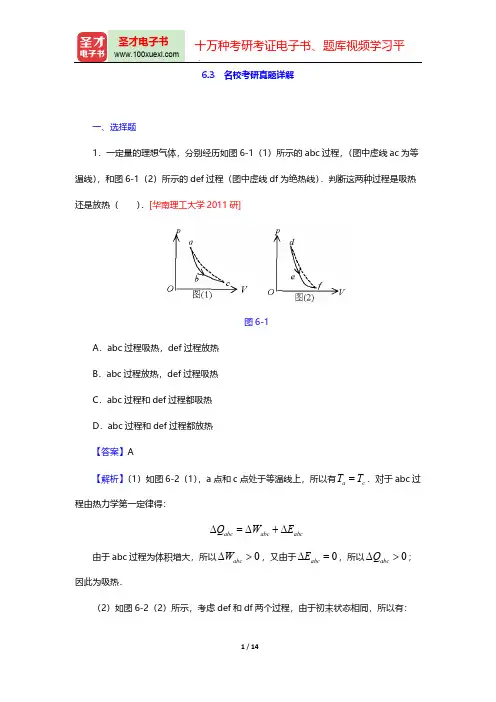
6.3 名校考研真题详解一、选择题1.一定量的理想气体,分别经历如图6-1(1)所示的abc 过程,(图中虚线ac 为等温线),和图6-1(2)所示的def 过程(图中虚线df 为绝热线).判断这两种过程是吸热还是放热( ).[华南理工大学2011研]图6-1A .abc 过程吸热,def 过程放热B .abc 过程放热,def 过程吸热C .abc 过程和def 过程都吸热D .abc 过程和def 过程都放热【答案】A【解析】(1)如图6-2(1),a 点和c 点处于等温线上,所以有.对于abc 过ac T T =程由热力学第一定律得:abc abc abcQ W E ∆=∆+∆由于abc 过程为体积增大,所以,又由于,所以;0abcW ∆>0abc E ∆=0abc Q ∆>因此为吸热.(2)如图6-2(2)所示,考虑def 和df 两个过程,由于初末状态相同,所以有:def dfT T ∆=∆对df 过程,因为是绝热过程,则有:,而df 为体积增大,所0dfdf df Q W E ∆=∆+∆=以,;且.0df W ∆>0df E ∆<df df E W ∆=-∆考虑def 过程,有.由图形可以看出defdef def def df Q W E W W ∆=∆+∆=∆-∆,def df W W ∆<∆所以,因此def 过程为放热.0def Q ∆<图6-22.一定量的理想气体,从p-V 图上初态a 经历(1)或(2)过程到达末态b ,已知a 、b 两态处于同一条绝热线上(图6-3中虚线是绝热线),则气体在().[华南理工大学2009研]图6-3A .(1)过程中吸热,(2)过程中放热B .(1)过程中放热,(2)过程中吸热D .两种过程中都放热【答案】B【解析】当沿绝热线由a 状态到b 状态时,气体对外做功等于内能的减少量.当沿(1)曲线变化时,内能减少量不变,但气体对外做功变小.故要放热,当沿(2)曲线变化时,内能减少量人不变,但气体对外做功增大,故需吸热.3.对于室温下的双原子分子理想气体.在等压膨胀的情况下,系统对外所作的功A 与从外界吸收的热量Q 之比A /Q 等于( ).[电子科技大学2008研]A .2/3B .1/2C .2/5D .2/7【答案】D【解析】由理想气体状态方程可知,则系统对外所作的功为PV nRT =A =PV =nRT ;因为等压膨胀,则系统从外界吸收的热量(双原7()2p Q nc T dT n ==⎰子分子)故.7()2p c T R =27A Q =4.已知在三相点T =273.16K ,冰融化为同温度的水时,熔解热L =3.35×105J /kg ,则2.5千克的冰化为水时的熵变为( ).[电子科技大学2008研]A .3.06×103J /kC .8.37×105J /kD .3.35×105J /k【答案】A 【解析】在这个过程中,温度保持不变,即T =273.16K ,设冰从273.16K 的恒源热源中吸热,过程是可逆的,则5231 2.5 3.3510 3.0610273.16dQ Q S S S J K J K T T ⨯⨯∆=-====⨯⎰冰水5.关于熵,下面叙述中哪一个是正确的?( )[电子科技大学2010研]A .熵是为描述自发过程进行的方向而引入的,因此熵是过程量B .熵增加原理表明,任何系统中一切自发过程总是沿着熵增加的方向进行C .熵是热力学系统无序性的量度D .任何过程,熵变都可以用下式来计算:【答案】C【解析】A 项,错在“熵是过程量”,应该为“状态函数”;B 项,错在“任何系统”,应该为“封闭系统”;D 项,错在“任何过程”,应该为“可逆过程”.2、填空题1.某理想气体经历的某过程的方程的微分形式为,则此过程应为______过0dp dV p V+=程.[南京理工大学2011研]【答案】等温过程pV =恒量对上式取全微分得:0pdV Vdp +=两边同除以得:pV 0dp dV p V+=2.同一种理想气体的定压摩尔热容C p 大于定体摩尔热容C v ,其原因是______.[华南理工大学2010研]【答案】升高相同的温度时,定压过程需要对外做功,因此需要吸收更多的热量3.一气缸内贮有10mol 的单原子分子理想气体,在压缩过程中外界作功209J ,气体升温1K ,此过程中气体内能增量为______,外界传给气体的热量为______.(普适气体常量R =8.31J /mol.K )[华南理工大学2010研]【答案】124.65J ;-84.35J【解析】内能增加为:;J RT n E 65.12423=⨯=∆外界传入热量:.J E W Q 35.8465.124209-=+-=∆+=3、计算题1.一摩尔的双原子理想气体,从某体积为40l 的初态先绝热压缩到压强为2atm ,体积减半,再等压膨胀至原体积,最后等容冷却回到初态.(2)求初态的压强;(3)求该循环的效率.[南京理工大学2011研]解:(1)该循环过程分为三个过程:,三个过程对应如下:1231→→→图6-4:绝热过程;12→:等压过程;23→:等容过程.31→(2):绝热过程有:12→1122PV PV γγ=所以初态的压强2121()0.76V P P atm V γ==(3)温度分别可以算得:111364.6PV T K Rν== 222486.2PV T K Rν== 213972.3PV T K R ν==绝热过程,吸收的热量为:12→10Q =对外做功为:。

1.2 课后习题详解一、复习思考题§1-1 质点运动的描述1-1-1 回答下列问题:(1)一物体具有加速度而其速度为零,是否可能?(2)一物体具有恒定的速率但仍有变化的速度,是否可能?(3)一物体具有恒定的速度但仍有变化的速率,是否可能?(4)一物体具有沿Ox轴正方向的加速度而又有沿Ox轴负方向的速度,是否可能?(5)一物体的加速度大小恒定而其速度的方向改变,是否可能?答:速度是表示物体运动的方向和快慢的物理量,为矢量,是位矢r的时间变化率;速率是表示速度的大小,为标量,是路程s对时间的的变化率;加速度是表示速度变化的快慢和方向的物理量,为矢量,是速度v的时间变化率.(1)可能.如:①竖直上抛物体运动到最高点的时刻,具有加速度(等于重力加速度),物体的速度为零;②弹簧振子在水平面上振动时,在位移达到最大值时,加速度不为零,而速度为零.(2)可能.速度是矢量,有大小和方向;速率是速度的大小.如,物体作匀速率圆周运动时,速度的大小(即速率)不变,但其方向不断变化着,因而其速度一直变化.(3)不可能.因为速度是矢量,有大小(即速率)和方向,当速率变化时,速度必将改变,不可能恒定.(4)可能.如:物体匀减速直线运动时的加速度方向和速度方向相反.(5)可能.如:①物体作抛体运动时,其加速度为重力加速度,大小和方向恒定保持不变,而其速度(大小和方向)却时刻变化着;②物体作匀速率圆周运动,其向心加速度的大小保持不变,但其速度的方向时刻沿圆周的切线方向,即速度的方向在改变着.1-1-2 回答下列问题:(1)位移和路程有何区别?在什么情况下两者的量值相等?在什么情况下并不相等?(2)平均速度和平均速率有何区别?在什么情况下两者的量值相等?瞬时速度和平均速度的关系和区别是怎样的?瞬时速率和平均速率的关系和区别又是怎样的?答:(1)①位移和路程的区别a .位移是矢量,是以质点在△t 时间内从起点到终点的有向线段来表示;b .路程是标量,是在△t 时间内质点实际路径的长度.在图1-1中,是位移,是路程.图1-1-1②两者量值相等和不相等时的情况a .两者相等的情况:在直线运动中,如运动方向不变,则质点的位移的大小与路程相等.曲线运动中,在△t 趋近于0的极限情况下,位移与轨迹重合,位移的大小才等于路程.b.两者不相等的情况:一般的曲线运动中,位移的大小|△r|与路程并不相等,只有在△t很短的情况下,质点的位移和运动轨迹近似地看作重合.(2)①平均速度和平均速率a.平均速度定义为,它是矢量.b.平均速率定义为,它是标量.②两者量值相等时的情况在一般情况下,在相同的时间内|△r|≠△s,所以平均速度和平均速率并不相等.只有在运动方向不变的直线运动中,平均速度在量值上才和平均速率相等.③瞬时速度和平均速度的关系与区别a.二者的关系瞬时速度是时间△t趋于零时平均速度的极限,即.b.二者的区别第一,瞬时速度和平均速度都是矢量.一般情况下,二者大小和方向都不相同.平均速度的方向是△t时间内位移△r的方向,而瞬时速度的方向是△t→0时沿运动轨迹的切线方向.第二,只有在匀速直线运动中,瞬时速度和平均速度的大小和方向才相等.④瞬时速率和平均速率的关系和区别a.二者的关系瞬时速率是指瞬时速度的大小,平均速率的大小等于单位时间内所经过的路程.它们都是标量.b.二者的区别一般情况下,它们不相等,只有在匀速直线运动中,瞬时速率才等于平均速率.1-1-3 回答下列问题:(1)有人说:“运动物体的加速度越大,物体的速度也越大”,你认为对不对?(2)有人说:“物体在直线上运动前进时,如果物体向前的加速度减小,物体前进的速度也就减小”,你认为对不对?(3)有人说:“物体加速度的值很大,而物体速度的值可以不变,是不可能的”,你认为如何?答:(1)这种说法是错误的.运动物体的加速度很大,只说明物体运动速度在变,且变化地很大,并不是运动的速度很大.如,弹簧振子在位移最大处,其加速度的值最大,而速度却等于零.(2)这种说法是错误的.物体作直线运动时,若向前运动的加速度减小,表明向前运动的速度的变化率在减小,但速度还是因有加速度继续增大,只是增大得平缓些.即使加速度减到零,物体仍向前作匀速直线运动,而不会减小.(3)这种说法是错误的.物体速度的大小不变,但速度的方向可改变.如,物体作匀速率圆周运动时,其向心加速度,如v的值很大,那么可得到很大的加速度,但是速度大小却保持不变.1-1-4 设质点的运动学方程x=x(t),y=y=(t),,在计算质点的速度和加速度时,有人先求出然后根据及而求得结果;又有人先计算速度和加速度的分量,再合成求得结果,即及你认为哪一种正确?两者差别何在?答:(1)在计算速度和加速度的大小时,前一种方法有错误,后面一个方法是正确的.(2)二者的差别:①前面一个计算方法错误在于忽视了位移、速度和加速度的矢量性,求出的只是速度v和加速度a的径向分量.②质点的速度按定义是,而不是.|d r|是位矢增量d r的大小,而dr是位矢r2和r1大小的差值,即r2-r1的极值,按速度定义应为速度的大小为同样,加速度的大小应为用平面极坐标表示时,设位置矢量r的大小为极径r,方向用极角θ表示.质点运动的速度v和加速度a也都可表示为沿径向的和垂直于径向的两个分量的叠加,即和其中所以,前者求出的只是速度v和加速度a的径向分量.§1-2 圆周运动和一般曲线运动1-2-1 试回答下列问题:(1)匀加速运动是否一定是直线运动?为什么?(2)在圆周运动中,加速度方向是否一定指向圆心?为什么?答:(1)不一定.如抛体运动,它的加速度为重力加速度g,大小和方向都不变,然而速度v的方向总是沿着轨迹的切线方向,时刻变化,不是直线运动.(2)不一定.如在变速率圆周运动中,质点既有向心(法向)加速度,又有切向加速度,合加速度就不指向圆心.1-2-2 对于物体的曲线运动有下面两种说法:(1)物体作曲线运动时,必有加速度,加速度的法向分量一定不等于零.(2)物体作曲线运动时速度方向一定在运动轨迹的切线方向,法向分速度恒等于零,因此其法向加速度也一定等于零.试判断上述两种说法是否正确,并讨论物体作曲线运动时速度、加速度的大小、方向及其关系.答:(1)第一种说法是正确的,第二种说法是错误的.①对于说法(1),因为物体作曲线运动时,它的速度方向一直在变化,因而一定存在法向加速度.②对于说法(2),法向加速度反映物体运动速度的方向变化.(2)物体作曲线运动时速度、加速度的大小、方向及其关系。
第1章力和运动[视频讲解]1.1 本章要点详解█质点运动状态的描述█圆周运动和一般曲线运动█相对运动,常见力与基本力█牛顿运动定律█伽利略相对性原理,非惯性系与惯性力1.2 重难点导学一、质点运动描述1.质点(1)概念当物体的大小和形状忽略不计时,可以把物体当做只有质量没有形状和大小的点——质点。
(2)说明质点的概念是在考虑主要因素而忽略次要因素引入的一个理想化的力学模型。
一个物体能否当做质点,取决于研究问题的性质。
2.参考系和坐标系(1)参考系的概念为描述物体的运动而选择的标准物称为参考系。
(2)参考系的说明①为描述物体的运动而选择的标准物称为参考系; ②参考系的选择是任意的;③在描述物体的运动时,必须指明参考系,若不指明参考系,则认为以地面为参考系; ④参考系不同,则对运动的描述是不同的。
(3)坐标系的意义坐标系用于定量地描述物体相对于参照系的运动。
(4)坐标系的分类 ①直角坐标系(一般应用) ②球坐标系 ③柱坐标系 ④自然坐标系 3.空间和时间 4.运动学方程在选定的参考系中,运动质点的位置P (x ,y ,z )是t 的函数,即x =x (t ),y =y (t ),z =z (t )5.位矢(1)位矢是用来确定某时刻质点位置的矢量,用r r表示.(2)特点①矢量性(有大小和方向);②瞬时性;③相对性;④单位:米(m)。
6.位移位移表示质点在一段时间内位置改变的矢量,用r 表示.7.速度(1)平均速度:物体在一个时间段内的平均快慢程度。
(2)瞬时速度(速度):物体在某一时刻的速度。
8.加速度(1)平均加速度平均加速度是指速度的增量与所用时间的比值。
(2)瞬时加速度瞬时加速度是指平均加速度的极限值。
(3)注意①加速度为矢量,有大小和方向;②与速度具有相同的特点;③匀变速运动加速度为恒量;④非匀变速运动加速度为变量。
二、圆周运动和一般曲线运动1.切向加速度和法向加速度(1)切向加速度a t和法向加速度a n的公式(2)切向加速度和法向加速的说明①切向加速度改变线速度的大小;②法向加速度只改变运动方向,法向加速度方向始终指向圆心,R为曲率半径。
7.2 课后习题详解一、复习思考题§7-1 物质的电结构库仑定律7-1-1 一个金属球带上正电荷后,该球的质量是增大、减小还是不变?答:理论上质量减小,但仍可认为该球的质量没有变化.因为金属球带正电荷实际上是失去了负电子,所以理论上质量减小,但由于一个电子的质量m e=9.1×10-31kg,所带电荷量为-1.6×10-19C,金属球失去了1 C的负电荷相当于失去了9.1×10-31kg×1 C/1.6×10-19C=5.7×10-12kg的质量,这相对于整个金属球来说是微不足道的,所以仍可认为该球的质量没有变化.7-1-2 点电荷是否一定是很小的带电体?什么样的带电体可以看作是点电荷?答:(1)不是,因为点电荷是研究带电体电性质时提出的一个理想模型,“大小”是一个相对的概念,所以点电荷也只具有相对的意义,它本身不一定是很小的带电体.(2)可以看作是点电荷的带电体有以下两种情况:①相对所论点的位置距离,即当带电体的几何大小相对它至所论点的距离小很多,可忽略时,该带电体才可以看作是“点电荷”;②某一点至一带电体的距离,或者两带电体之间的距离只有在带电体可以当作“点”处理时才有确切的意义,此时带电体的形状、大小和电荷分布都可以不予考虑,而仅当作有一定电量的几何点.如:在一般情况下,半径为R,电荷面密度为σ均匀带电圆盘轴线上与盘心相距为x 的任一给定点P处的电场强度是仅当若x>>R 时,上式可以简化为这正是点电荷的电场强度公式,它说明当点P 离开圆盘的距离远远大于圆盘本身的大小时,点P 的电场强度与电荷量q集中在圆盘的中心的一个点电荷在该点所激发的电场强度相同,即此时带电圆盘可以看作是点电荷.但若R>>x ,即在点P 处看来均匀带电圆盘可认为是无限大,则点P 的电场强度又可化简为无限大均匀带电平面所激发的电场由此可见,同一带电体是否能看作点电荷完全由所讨论的问题决定.7-1-3在干燥的冬季人们脱毛衣时,常听见噼里啪啦的放电声,试对这一现象作一解释.答:脱毛衣时,毛衣与内衣发生摩擦,会使两者分别带有异号电荷,由于毛衣和内衣都是绝缘材料,这些电荷会在其表面积聚起来;在一般情况下,空气比较潮湿,含有大量的正负离子,它们很容易快速地与出现在毛衣和内衣表面上的电荷中和掉;但在干燥的冬季里,空气中的正负离子很少,毛衣与内衣发生摩擦会导致两者表面积聚很多电荷,从而产生很高的电场强度,其大小往往高于空气的击穿电场强度,因此会将空气击穿,产生噼里啪啦的放电声.7-1-4 带电棒吸引干燥软木屑,木屑接触到棒以后,往往又剧烈地跳离此棒.试解答:(1)木屑被吸引移向带电棒的原因:假定带电棒带有正电荷,则处于该正电荷电场中的干燥软木屑会被极化,木屑靠近带电棒一端被极化出负电荷,木屑背着带电棒的一端被极化出正电荷,它们分别受到带电棒正电荷的吸引力和排斥力,但因木屑上负电荷更靠近带电棒,受到的吸引力大于木屑上正电荷的排斥力,所以木屑总是被吸引移向带电棒.(2)木棒剧烈地跳离带电棒的原因:假定带电棒带有正电荷,则一旦木屑接触到带电棒后,木屑上负电荷会被带电棒上的正电荷所中和,此时木屑受到的吸引力会消失,而由于木屑上正电荷仍旧存在,因此它会受到带电棒上的正电荷排斥,便又立即跳离带电棒.若带电棒带有负电荷,除了木屑两端极化电荷的极性相反以外,整个过程都与上述情况相同,即木屑总是先被吸引,接触到棒以后,又剧烈地跳离带电棒.§7-1 静电场电场强度7-2-1 判断下列说法是否正确,并说明理由.(1)电场中某点电场强度的方向就是将点电荷放在该点处所受电场力的方向;(2)电荷在电场中某点受到的电场力很大,该点的电场强度E一定很大;(3)在以点电荷为中心、r为半径的球面上,电场强度E处处相等.答:(1)不一定,这取决于该点电荷所带的电荷量.有以下两种情况:①该点电荷所带的电荷量比较小时它的引入几乎不会改变原场源电荷所激发的电场分布,而且正电荷所受到的电场力方②该点电荷所带的电荷量比较大时它的引入破坏了原场源电荷所激发的电场分布,那么该点电荷所受到的电场力就不能反映原来电场的性质,其方向当然就不能代表其所在点的电场方向,尤其是所带电荷是负电荷的话,电场力方向就更不能说是所在点的电场方向.(2)不一定.原因如下:①电荷在电场中所受到的电场力不仅取决于该电荷所在处的电场强度,而且还与该电荷的电量有关,即F=qE;②当用电场力来确定某点的电场强度,且受力的电荷是带电量不太大的点电荷时:a.该电荷可以当作是点电荷处理该电荷在电场中的线度足够小,此时所受到的电场力越大,说明点电荷所在处的电场强度也越强;b.该点电荷不能当作点电荷处理该电荷在电场中的线度比较大,此时所受到的电场力就无法说明是哪一点的电场强度.(3)不准确.电场强度是一矢量,既有大小也有方向.①大小相同在真空中一点电荷所激发的电场具有球对称,在以点电荷为中心的同一球面上的点都有相等的电场强度大小;②方向不同同一球面上不同的点其径向不同,所以就电场强度方向来说不同点有不同的方向(电场强度方向沿半径方向).因此,电场强度E并不处处相等.7-2-2 根据点电荷的电场强度公式当所考察的场点和点电荷的距离r→0时,电场强度E→∞,这是没有物理意义的,对这似是而非的问题应如何解释?答:当场点和电荷距离很近时,该电荷已不能再看作是点电荷了,即在r→0时点电荷的模型不成立,那么点电荷的电场强度公式也不能用,即推不出E→∞.7-2-3 点电荷q如只受电场力的作用而运动,电场线是否就是点电荷q在电场中运动的轨迹?答:不一定.(1)在一般情况下,电场线并不能代表点电荷q在电场中的运动轨迹电场线上任一点的切线方向反映了该点电场方向,是点电荷q在该处受到的电场力方向,也即加速度的方向.而电荷运动轨迹上任一点的切线方向是电荷在该点的速度方向.加速度的方向并不总是和速度的方向一致,因此点电荷q不可能总是沿电场线运动.如:一正点电荷q以初速度v0入射一平行板电场,如图7-1-1所示,其电场线由上板指向下板,即电场力(加速度)方向总是垂直向下,而运动轨迹是一条曲线,电子速度沿其切线方向,与加速度方向并不重合.(2)在某些特殊的情况下,点电荷也有可能沿电场线运动①初速度为零的正点电荷q在平行板电场中的运动轨迹就与电场线重合;②在点电荷Q的非均匀电场中,初速度为零的正点电荷q沿径向电场线运动.上述两种情况速度与加速度方向一致,电场线都是直线,运动轨迹也是直线.图7-1-1 正点电荷q在平行板电场中的运动7-2-4 在正四边形的四个顶点上,放置四个带相同电荷量的同号点电荷,试定性地画出其电场线图.答:可分为两个步骤:(1)画出两个带相同电荷量的同号点电荷的电场线图正电荷的电场线总是从电荷出发呈辐射状的,对于两个正电荷的系统,它们的电场线在空中相遇不能相交,只能相互排斥改变路径.同时在两个正电荷连线的中点电场强度为零,即该处的电场线密度为零.因此两个正电荷系统的电场线可描绘如图7-1-2(a)所示.(2)画出四个带相同电荷量的同号点电荷的电场线图当一正四边形的四个顶点上都放上正点电荷时,边线中点的电场强度不再为零,此时对角线中点电场强度为零,即正四边形中心处电场线密度为零.由此正四边形的四个顶点上都放上正点电荷系统的电场线可描绘如图7-1-2(b)所示.图7-1-2 正点电荷系统的电场线。
5.2 课后习题详解一、复习思考题§5-1 热运动的描述理想气体模型和状态方程5-1-1 试解释气体为什么容易压缩,却又不能无限地压缩.答:(1)气体容易压缩:物质都是由大量分子组成的.分子之间总是存在一定的间隙,并存在相互作用力.气体分子之间的间隙是最大的,而在常温常压下除了碰撞以外分子间的相互作用可以忽略,这就使得气体非常容易被压缩.(2)不能无限压缩不仅因为分子有一定的大小,而且当分子之间距离压缩到一定程度后,分子之间的相互作用就不可忽略了.例如,分子之间的作用力与分子距离的关系如图5-1-1所示.①当r =r 0(r 0≈10-10m )或很大时,相互作用力等于零.②当r>r 0时,作用力表现为吸引力,距离的增加时引力也增大,达到某个最大值后又随距离的增加而减小,当r>10-9m 时这个吸引力就可忽略了.③如果r<r 0,分子之间的作用力表现为排斥力并随分子之间距离迅速增加.气体的体积不能无限压缩的根本原因就在于此.图5-1-15-1-2 气体在平衡状态时有何特征?这时气体中有分子热运动吗?热力学中的平衡与力学中的平衡有何不同?答:(1)气体的平衡态是指一定容积内的气体,其温度、压强处处相等,且不随时间发生变化的状态.描述气体状态的三个宏观参量分别是体积、温度和压强.因此,气体在平衡状态的特征是宏观参量不随时间发生变化.(2)气体分子的热运动是大量分子无休止的随机运动.①从微观而言,这种随机运动是永不停息的,单个分子的运动速度大小和方向都会因彼此碰撞而随机改变.②平衡态时,从宏观而言,大量分子的这种热运动平均效果是不随时间而变化的.因此平衡态是说分子处于“动态平衡”,仍存在分子热运动.(3)①气体的平衡状态是指在无外界作用下气体系统内大量分子热运动的统计平均效果,此时分子系统整体没有运动,系统内分子却一直在无规则地运动;②力学中的平衡状态是指分子系统整体上无合外力或合外力矩的作用,因而处于静止或匀速定向运动或转动,微观上的单个分子,它们总是不断互相发生碰撞,并相互作用,因而永远不会处于力学的平衡态.§5-4 能量均分定理理想气体的内能5-4-1 对一定量的气体来说,当温度不变时,气体的压强随体积的减小而增大;当体积不变时,压强随温度的升高而增大.就微观来看,它们是否有区别?答:气体的压强是指气体分子作用在容器壁上单位面积的碰撞力.由压强公式知,单位体积内的分子数n和分子平均平动动能是气体压强的影响因素.(1)对一定量理想气体,当温度一定时,分子热运动的平均平动动能保持不变,当减小气体体积时,单位体积内的分子数n就会增加,即单位时间内对容器壁的碰撞次数也增多,因而压强增大.(2)若保持体积V不变,则单位体积内的分子数n也不变,升高温度后,气体分子的平均平动动能会增大,而平均平动动能为,说明气体分子方均根速率增大,对容器壁的冲量亦增大,这会使气体压强的增大.5-4-2 如果气体由几种类型的分子组成,试写出混合气体的压强公式.答:(1)根据理想气体状态方程,对一质量为m1,摩尔质量为M1的理想气体,其压强为(2)当向该容器(体积为V)内充以另一质量为m2,摩尔质量为M2同一温度T的理想气体时,该气体也对容器壁产生p2的压强:(3)由于理想气体分子的大小可忽略不计,而且分子之间没有相互作用.因此,第二种气体是否加入都不影响第一种气体的压强,反之亦然.当两种气体同时装入同一容器后,容器内气体的压强就是满足力的加和原理.推广到多种理想气体混合在一起的压强就是式中是混合气体单位体积的分子数.综上所述,混合理想气体的压强就是各类分子单独存在于同一容器时的压强和,即道尔顿分压定律.5-4-3 对汽车轮胎打气,使达到所需要的压强.问在夏天与冬天,打入轮胎内的空气质量是否相同?为什么?答:根据理想气体的压强公式,压强与温度T、单位体积分子数有关.假设轮胎的容积V在夏天与冬天都相同,可承受的压强p也相同.因为冬天与夏天的气温不同,为了保证相同的轮胎压强,需要充入轮胎内的空气分子数就不同:(1)夏天气温高,空气分子的平均平动动能高,平均单个分子对轮胎的碰撞冲量增大,比较少的分子数就能保持足够的压强.因此,充入轮胎的空气分子数N就可少一些.(2)冬天气温低,空气分子的平均平动动能小,对轮胎壁的碰撞冲量减小,充入更多的空气可增加碰撞次数,以保持足够的碰撞冲量.因此,充入轮胎内空气分子数N就要多些.§5-5 麦克斯韦速率分布律5-5-1 试用气体的分子热运动说明为什么大气中氢的含量极少?答:在大气中包含有不同成分的气体,它们的质量各不相同,受到的地球引力大小亦不同,造成各气体的方均根速率也不相同.(1)如氢分子由于质量最小,受到的地球引力也最小,在相同温度下其方均根速率却最大,所以它从地球表面逃逸的可能性最大.因此氢在空气中的含量极低.(2)空气中如氧、氮等其他成分的分子质量都比氢分子大,受到的地球引力也较大,而方均根速率又相对小,就不容易从地球逃逸出去.5-5-2 回答下列问题:(1)气体中一个分子的速率在v~v +△v 间隔内的概率是多少?(2)一个分子具有最概然速率的概率是多少?(3)气体中所有分子在某一瞬时速率的平均值是,则一个气体分子在较长时间内的平均速率应如何考虑?答:(1)根据麦克斯韦分布律,速率在v ~v +△v 间隔内的分子数占分子总数的百分比为假设本题速率区间内的百分比为4%,说明100个分子中有4个分子的速率落在v ~v +△v 间隔内,亦即,对每一个分子的速率尽管随机可变的,但总有4%的可能处于v ~v +△v 区间内.(2)①最概然速率v p 是指处于一定温度的平衡状态中的系统内大量分子最可能具有的速率,这是对大量分子的速率分布所作的统计规律的一个特征值.②它只对大量分子的整体有意义.对单个分子,我们只用“处于v p ~v p +△v 间隔内的概率”来描述其速率,而探讨其一定速率的概率是没有意义的.(3)①气体在一定温度下处于平衡状态,其速率服从麦克斯韦速率分布律,表明大量气体分子中速率有高有低,不同瞬间单个分子的速率通过分子间的碰撞都会发生变化.但根据统计规律,在任一瞬间大量分子的速率有一确定的平均值.②对于单个分子,在此时可能处于较高的速率,碰撞后,在彼时又可能处于较低的速率,而其他的分子处于相反的速率变化,保持统计规律不变.③因此,长时间一个分子可以经历大大小小不同的速率,但其不同时刻的统计平均速率仍是.5-5-3 气体分子的最概然速率、平均速率以及方均根速率各是怎样定义的?它们的大小由哪些因素决定?各有什么用处?答:(1)最概然速率①定义最概然速率是指平衡态下气体分子速率分布函数f (v )最大值对应的速率,其物理含义是指在一定温度下分子速率在vp 附近的概率最大.经麦克斯韦分布函数求导并令f'(v )=0,可求出最概然速率,它表示在所有相等的速率区间中,在包含v p 的区间内分子数的百分比最高.②影响因素a .对一定的气体,温度越高,最概然速率v p 越大;b .在一定的温度下,分子质量大的气体最概然速率较小.③应用可以通过最概然速率的大小来比较不同情况下的速率分布.(2)平均速率和均方根速率①定义平均速率是指在平衡态下,大量分子速率的算术平均值,它可由麦克斯韦速率分布律求出。
9.2 课后习题详解一、复习思考题§9-1 电磁感应定律9-1-1 在下列各情况下,线圈中是否会产生感应电动势?何故?若产生感应电动势,其方向如何确定?(1)线圈在载流长直导线激发的磁场中平动,如图9-1-1(a )、(b );(2)线圈在均匀磁场中旋转,如图(c )、(d )、(e );(3)在均匀磁场中线圈从圆形变成椭圆形,如图(f );(4)在磁铁产生的磁场中线圈向右移动,如图(g );(5)如图(h)所示,两个相邻近的螺线管1与2,当1中电流改变时,试分别讨论在增加与减少的情况下,2中的感应电动势.图9-1-1确定可能产生感应电动势的情况答:根据法拉第电磁感应定律,通过回路所包围面积的磁通量发生变化时回路中将产生感应电动势,感应电动势的方向可用楞次定律来确定,据此:(1)无限长载流导线的磁场距直导线为x 处的磁感应强度为:①在(a)的情况下,虽然线圈各点的磁场各不相同,但是线圈内的总磁通量与线圈的位置无关,无论线圈如何运动都不发生变化,因此线圈中不会产生感应电动势.当然,从局部来看,线圈中垂直于直长导线的两条边框会因切割磁感应线出现电磁感应,但是产生的感应电动势的方向都是自下而上,对整个线圈回路来说感应电动势由于方向相反而抵消,整体为零;②在(b)的情况下,线圈向远离直长导线的方向运动,线圈内磁场随x距离的增加而变小,磁通量也变少,发生了变化,因此线圈中会产生感应电动势;通过楞次定律判断,感应电动势的方向为顺时针方向.(2)①(c)的情况,如图示所标定的两个位置通过线圈内的磁通量是不同的.实线位置,线圈平面与磁场方向垂直,通过线圈的磁通量最大,而虚线位置,线圈平面平行磁场方向,通过线圈的磁通量为零;因此当线圈旋转时线圈内的磁通量发生变化,产生感应电动势,其方向会随着线圈旋转所达到的位置发生变化相应改变,如图示所标定的由实线位置旋转到虚线位置时,通过线圈的磁通量变少,感应电动势的方向为顺时针方向;此后由虚线位置继续旋转时,感应电动势的方向为逆时针方向;②(d)的情况,与(c)完全相同;③(e)的情况,线圈运动时其平面始终垂直磁场方向,线圈内的磁通量始终保持不变,所以线圈中不会产生感应电动势;(3)如图(f)所示,当线圈从圆形变成椭圆形的过程中,线圈面积逐渐减小,所包围的磁通量也就变少,于是线圈中产生了顺时针方向的感应电动势;(4)如图(g)所示,当线圈向右移动时,由于磁场越来越弱,通过线圈的磁通量也越来越少,线圈中会产生感应电动势,感应电动势的方向从左向右看为逆时针方向;(5)在图(h)中,当螺线管1中电阻的滑动头向左滑动时,螺线管1中的电流逐渐增大,所激发的磁场逐渐增强,通过螺线管2的磁通量增加,所以在螺线管2中将会产生逆时针方向的感应电动势;相反,当螺线管1中电阻的滑动头向右滑动时,类比可知,在螺线管2中有顺时针方向的感应电动势产生.9-1-2 将一磁铁插入一个由导线组成的闭合电路线圈中,一次迅速插入,另一次缓慢地插入.问:(1)两次插入时在线圈中的感应电动势是否相同?感生电荷量是否相同?(2)两次手推磁铁的力所作的功是否相同?(3)若将磁铁插入一不闭合的金属环中,在环中将发生什么变化?答:(1)①感应电动势:由法拉第电磁感应定律可知,感应电动势的大小有线圈中磁通量的变化率决定,迅速插入磁通量的变化率比缓慢地插入要大,因而迅速插入产生的感应电动势要大一些;②感生电量:在相同时间内通过导线截面的电荷量与导线回路所包围的磁通量的变化值成正比,而与磁通量变化的快慢无关,设线圈的电阻为R,磁铁插入前后线圈中磁通量分别为和,则感生电荷量均是,因此产生的感生电荷量相同.(2)手推磁铁的力所作功的大小与感应电动势在这段时间内所作的功相等,即由于迅速插入时磁通量的变化率比缓慢插入时的大,因此迅速插入时手推磁铁的力所作的功要比缓慢插入时大.(3)当磁铁插入金属环时,金属环所在空间的磁场发生了变化(由弱到强),因而会产生感生电动势,在金属环上有感生电场的存在,但由于金属环没有闭合,所以没有感应电流产生.9-1-3 让一块很小的磁铁在一根很长的竖直铜管内下落,若不计空气阻力,试定性说明磁铁进入铜管上部、中部和下部的运动情况,并说明理由.答:(1)磁铁处于铜管上部时:铜管中将产生感应电流,此时磁铁速度较小,产生的感应电流较小,磁铁受到的阻力较小,因此磁铁仍然加速下落.(2)磁铁处于铜管中部时:感应电流随着磁铁下落速度的增大而增大,感应电流的磁场对下落磁铁的阻力也逐渐增大.竖直铜管足够长时,磁铁所受的重力和阻力的合力可在管内某处等于零.然后,磁铁以恒定速率速率下落.(3)磁铁处于铜管下部时:磁铁即将离开铜管,由于磁铁在管内的磁感应强度逐渐减小,磁铁的重力将大于感应电流的磁场对磁铁的阻力,因而磁铁将加速离开铜管.§9-2 动生电动势9-2-1 如图9-1-2所示,与载流长直导线共面的矩形线圈abcd作如下的运动:(1)沿x方向平动;(2)沿y方向平动;(3)沿xy平面上某一L方向平动;(4)绕垂直于xy平面的轴转动;(5)绕x轴转动;(6)绕y轴转动;问在哪些情况下矩形线圈abcd中产生的感应电动势不为零?图9-1-2 与载流直导线共面的运动线圈答:(1)穿过矩形线圈的磁通减少,感应电动势不为零;(2)穿过矩形线圈的磁通不变,感应电动势为零;(3)穿过矩形线圈的磁通减少,感应电动势不为零;(4)穿过矩形线圈的磁通发生变化,感应电动势不为零;(5)穿过矩形线圈的磁通发生变化,感应电动势不为零;(6)穿过矩形线圈的磁通发生变化,感应电动势不为零.9-2-2 如图9-1-3所示,一个金属线框以速度v从左边匀速通过一均匀磁场区,试定性地画出线框内感应电动势与线框位置的关系曲线.(a)一个金属线框以匀速通过一均匀磁场区(b)感应电动势与线框位置的关系曲线图9-1-3 进入和离开磁场区的金属线框内感应电动势的变化答:只有当金属线框正在进入和正在离开磁场区、且线框有一部分在磁场区外时才有可能产生感应电动势.进入磁场区时穿过金属线框的磁通量增加,离开磁场区时则减少,因此只在这两个时间段内产生的感应电动势方向相反.设金属线框的宽度为d,磁场区的宽度为L,则线框内感应电动势与线框位置的关系曲线如图9-3(b)所示.9-2-3 如图9-1-4所示.当导体棒在均匀磁场中运动时,棒中出现稳定的电场E=vB,这是否和导体中E=0的静电平衡的条件相矛盾?为什么?是否需要外力来维持棒在磁场中作匀速运动?图9-1-4 在均匀磁场中运动的导体棒答:(1)不矛盾.这是两个不同的情况:①当导体棒在均匀磁场中运动时,棒中出现稳定的电场E=vB是“非静电性场”,它反映的是单位正电荷受到的非静电力,即洛伦兹力.非静电性场的场强沿整个闭合电路的环流不等于零,等于电源的电动势.此时,导体内的电荷在包括非静电力场E=vB和库仑力场的作用下的平衡,不是单一的静电平衡.②导体在静电平衡时导体中等于零的电场是静止电荷激发的电场,静电场的场强反映。
6.2 课后习题详解
一、复习思考题
§6-1 热力学第零定律和第一定律
6-1-1 怎样区别内能与热量?下面哪种说法是正确的?
(1)物体的温度越高,则热量越多.
(2)物体的温度越高,则内能越大.
答:(1)内能
①定义:内能是由热力学系统状态所决定的能量.微观上讲,内能是系统内粒子动能和势能的总和.
②理解内能的概念时要注意以下问题:
a.内能是状态函数,一般用宏观状态参量(如p、T、V)描述的系统状态,是单值函数;而理想气体的内能仅是温度T的单值函数;
b.内能的增量只与确定的系统始、终态有关,与变化的过程无关;
c.系统的状态若经历一系列过程又恢复原状态,则系统的内能不变;
d.对系统作功或者传热可以改变系统的内能.
(2)热量
①定义:是指存在温度差的系统之间传递的能量.微观上讲,传递热量是通过分子之间的相互作用完成的.
②理解热量的概念时要注意以下问题:
a.热量是过程量,对某确定的状态,系统有确定的内能,但无热量可言;
b.系统的热量传递,不仅与系统的始、终状态有关,也与经历的过程有关;
c.在改变系统的内能方面,传热也是改变系统内能的一个途径,与作功等效,都可作为系统内能变化的量度.
(2)①说法(1)是不正确的.温度是状态量,热量是过程量.“温度高”表示物体处在一个分子热运动的平均效果比较剧烈的宏观状态,无热量可言.
②说法(2)不完全正确.
a.对理想气体的内能仅是温度T的单值函数,故是正确的.
b.对一般热力学系统,内能是分子热运动的动能与势能之和,即内能并非只是温度的单值函数.
6-1-2 说明在下列过程中,热量、功与内能变化的正负:(1)用气筒打气;(2)水沸腾变成水蒸气.
答:(1)功的分析:①气筒打气是外力压缩气筒内的空气,气筒内空气体积减小,即△V<0,因此气筒内空气作负功;
②传热的分析:压缩过程进行得很快,气体还来不及与外界交换热量就已被压缩,因此可近似看作是绝热压缩过程,即Q=0.
③内能的分析:根据热力学第一定律△E=Q-A=-A>0,因此气筒内空气的内能增加.
(2)①若容器体积可以变化,水到达沸点时:a.大量吸收热量(Q>0);b.此过程温度不变,因而内能不变(△E=0);c.水汽的体积增加,对外作功(A>0).
②若容器体积不能变化,水沸腾时:a.吸取足够的热量(Q>0);b.水汽不能对外膨胀作功;c.水汽从外界吸取大量热量而成为过热蒸汽,温度上升,内能增加.
§6-2 热力学第一定律对于理想气体准静态过程的应用
6-2-1 为什么气体热容的数值可以有无穷多个?什么情况下,气体的摩尔热容是零?
什么情况下,气体的摩尔热容是无穷大?什么情况下是正值?什么情况下是负值?
答:(1)气体热容的数值可以无穷多个的原因:
根据热容定义,即不发生化学反应且在同等条件下温度升高1 K所需的热量.由于热量dQ是过程量,热力学系统可以经过无数个过程从一平衡态过渡到另一平衡
态,不同的过程传热不同,因此这就对应有无数个不同的热容C.
(2)C m=0
气体的摩尔热容的定义是指1 mol气体温度升高1 K所需的热量,用C m表示.根据
热容定义知,在绝热过程中dQ=0
,因此C m=0.
(3)
等温过程中dT=0,由知,
(4)C m取正值:
根据热容定义:,C m的符号取决于dQ.如,
①在恒压膨胀过程中,由于△E>0,A=p△V>0,则Q=△E+A>0,因此
C p,m>0.
②在恒容升温过程中,Q=△E>0,其摩尔热容C v,m也为正值.
(5)C m取负值:
在多方过程中,如果多方指数1<n<γ(γ为摩尔热容比),即系统温度升高1 K,反而放出热量(△Q<0),则将出现多方负热容,如6-2-2第(1)问.
6-2-2 一理想气体经图
6-1-1所示各过程,试讨论其摩尔热容的正负:
(1)过程Ⅰ-Ⅱ;(2)过程Ⅰ′-Ⅱ(沿绝热线);(3)过程Ⅱ'-Ⅱ.
图6-1-1
答:设以上三个过程代号分别1,2,3,都经过升温后,系统的初、末状态的温度都相同,因此内能的增量都相同,即△E 1=△E 2=△E 3>0;过程曲线下的面积表示所作的功,包围的面积越大,作负功的绝对值也越大.由图可知
.(1)过程2:为绝热过程,即,因此该过程的摩尔热容等于零.(2)过程1:
根据热力学第一定律
,则,得到.那么,
,该过程升温反而放出热量,其摩尔热容为负值.这是因为
外界压缩气体作功不仅提高了系统的内能,而且还向外界放出了一些热量,导致摩尔热容为负.
(3)过程3:
同理可得,,该过程中外界压缩系统作正功的同时系统还从外界吸取了热量才使系统升温,因此其摩尔热容为正值.
6-2-3 对物体加热而其温度不变,有可能吗?没有热交换而系统的温度发生变化,有可能吗?
答:这两种情况都是可能的.
(1)对物体加热而温度不变时,则Q>0,内能不变△E=0,由热力学第一定律可知Q=A,说明系统吸收外界的热量全部用于对外作功,例如理想气体的等温膨胀.(2)没有热交换,说明是绝热过程,Q=0.若系统的温度发生变化,则内能也会发生相应变化.根据热力学第一定律有Q=△E+A=0,△E=-A.
①假设是绝热膨胀过程,系统对外作功,则内能减少,说明这是通过消耗内能来做功的;
②假设是绝热压缩过程,内能增加,说明外界对系统作功提高了系统的内能.
§6-3 循环过程卡诺循环
6-3-1 为什么卡诺循环是最简单的循环过程?任意热机的循环需要多少个不同温度的热源?
答:(1)热力学第二定律表明,不可能制造一种只依靠一个热源循环动作的热机.也就是说,至少要两个以上的热源才可能制造循环动作的热机.卡诺循环是由两个可逆的等温过程和两个可逆的绝热过程组成的循环,包括一个提供热量的高温热源和一个接受热量的低温热源,因此这是构成循环热源数最少、最简单的理想循环.(2)如图6-1-2所示,任一可逆循环都可分割成许多小卡诺循环,小卡诺循环的数目越多,就与实际的循环过程越接近,所对应的不同温度热源数也就越多.
图6-1-2
6-3-2 有两个热机分别用不同热源作卡诺循环,在p-V 图上;它们的循环曲线所包围的面积相等,但形状不同,如图6-1-3所示.它们吸热和放热的差值是否相同?对外所作的净功是否相同?效率是否相同?
图6-1-3
答:(1)做功分析:
p-V 图中循环曲线所包围的面积即是循环系统对外作的净功,面积相同,而不论形状如何,这两个循环对外作的净功就相同;
(2)热量分析:
循环过程,系统的内能不变(△E=0),因此对外作的净功和系统与外界交换的热量相等,即吸热与放热之差相同.
(3)效率分析:
①根据热机效率的定义知:。