不同厂家盐酸左氧氟沙星片的质量考察_王丽荣
- 格式:pdf
- 大小:229.22 KB
- 文档页数:2

对主要研究结果的总结及评价xxxx制药有限责任公司1、综述资料:盐酸左氧氟沙星原料药、盐酸左氧氟沙星片收载于《中华人民共和国药典》(20xx年版)2004年增补本,故名称如下:【药品名称】通用名:盐酸左氧氟沙星片ﻫ英文名:Levofloxacin Hydrochloride Tablets汉语拼音:Yansuan zuoYangfushaxing Pian本品主要成分为盐酸左氟沙星。
其化学名为(-)-(S)-9-氟-2,3-二氢-3-甲基-10-(4-甲基-1-哌嗪基)-7-氧-7H –吡啶并[1,2,3-de]-[1,4]苯并嗪-6-羧酸盐酸盐一水合物。
其化学结构式为:分子式:C18H20FN3O4·HCl·H2O分子量:415.852、药学研究资料:2. 1处方:盐酸左氧氟沙星115.0 g预胶化淀粉 35.0 g10%淀粉浆10.0g(折淀粉)羧甲基淀粉钠 2.0g微晶纤维素 5.0g制成1000片2.2工艺规程:2.2.1 称取盐酸左氧氟沙星原料药、预胶化淀粉分别过80目筛网。
2.2.2 称取处方量盐酸左氧氟沙星原料药115g、预胶化淀粉35g,按等量递加法混合均匀。
2.2.3称取淀粉20g,加纯化水(约20g)搅拌溶解。
加沸纯化水至200g,搅拌,制成10%淀粉浆。
2.2.4 加入处方量的10%的淀粉浆搅拌5分钟,并高速制粒。
2.2.5 将颗粒在80℃以下烘干。
2.2.6 将烘干的颗粒,用旋涡振荡筛整粒,外加2 g羧甲基淀粉钠,5g微晶纤维素混合均匀,制得半成品。
2.2.7 半成品检验合格后,定片重,压片。
2.2.8素片检验合格后,包薄膜衣。
2.2.9 铝塑罩泡包装即得。
2.3、三批小试技术数据:2.2、质量研究:盐酸左氧氟沙星片试制样品批号为:xx0216 xx0217 xx0218和对照样品(浙江京新药业股份有限公司批号:xx01312 )按《中华人民共和国药典》(2010年版)进行实验,试验研究结果如下:2.3、稳定性试验2.3.1、加速试验20xx年02月23日到20xx年08月28日对盐酸左氧氟沙星片进行了加速试验,对性状、含量、有关物质等项目进行了检测,并在0月、6月末对微生物限度进行考察,试验结果见表1、表2、表3、表4、表5。

批号:【依据】《中华人民共和国药典》(2000年版)2004年增补本【性状】(规定:本品为类白色或淡黄色片或薄膜衣片,除去薄膜衣后显类白色或淡黄色。
)结论:【鉴别】(1)取本品的细粉,置干燥试管中,加丙二酸约10mg与醋酐0.5ml,在水浴中加热5~10分钟,。
(规定:溶液应显红棕色。
)结论:(2)取本品细粉,加0.1mol/L盐酸溶液制成每1ml中含左氧氟沙星0.1mg的溶液,滤过,取续滤液适量,用流动相稀释成每1ml中含左氧氟沙星0.02mg的溶液,作为供试品溶液;另取氧氟沙星对照品,用0.1mol/L 盐酸溶液制成每1ml中含氧氟沙星0.1mg的溶液,精密量取适量,用流动相稀释成每1ml中含氧氟沙星0.04mg的溶液,作为对照品溶液。
照高效液相色谱法试验。
用十八烷基硅烷键合硅胶为填充剂;以硫酸铜D-苯丙氨酸溶液(取D-苯丙氨酸溶液1.32g、硫酸铜1g,加水1000ml溶解后,用氢氧化钠试液调节pH值至3.5)—甲醇(82∶18)为流动相;柱温为40℃;流速为1ml/分钟;检测波长为293nm。
分别取上述两种溶液各20ul,分别注入液相色谱仪,记录色谱图,氧氟沙星右、左旋异构体之间的分离度应大于1.5。
供试品溶液主峰的保留时间应与氧氟沙星对照品中左氧氟沙星峰(后)的保留时间(规定:保留时间应一致)结论:(3)取本品细粉,加水振摇,滤过,a:取滤液,加硝酸使成酸性,滴加硝酸银试液,;分离,沉淀加氨试液,,再加硝酸,。
(规定:滴加硝酸银试液,即生成白色凝胶状沉淀;分离,沉淀加氨试液,沉淀即溶解,再加硝酸,沉淀复生成)结论:b:滤液置试管中,加等量的二氧化锰,混匀,加硫酸湿润,缓缓加热,,使接触湿润的碘化钾淀粉试纸。
(规定:应即发生氯气,能使湿润的碘化钾淀粉试纸显蓝色。
)结论:【检查】有关物质取本品 g,置100mL量瓶中,加0.03mol/l盐酸溶液使溶解并稀释至刻度,摇匀,滤过,制成每1ml约含0.5mg的溶液,作为供试品溶液。

盐酸左氧氟沙星片工艺验证文件编号:V/RP-011-00验证项目立项申请编码:QA(A)-004-R1-001.引言1.1验证方案名称:盐酸左氧氟沙星片工艺验证文件1.2验证方案编号:V/RP-011-001.3.1验证小组成员:组长:李小晶组员:曾建根、叶海亮、魏涛、程宏芬、彭财英、武小龙1.3.2验证小组职责:组长:李小晶(生产车间),主要负责验证管理的日常工作,制订验证计划,参与验证方案制订,验证的协调及验证工作结束后对验证报告的汇总和结果评价。
组员:曾建根(生产车间)主要负责确定待验证的工艺条件、标准、限度;实施验证并同时培训、起草生产有关规程,监督工艺规程和岗位标准操作程序的执行,指导完成首批产品验证;收集验证资料、数据、会签验证报告。
组员:叶海亮(生产车间),主要负责设备预确认,确定设备标准、限度、能力和维护保养要求,设备操作、维护保养方面的培训,设备安装及验证中提供技术服务。
组员:魏涛、程宏芬(QA中心),主要负责制订产品质量标准和取样程序。
组员:彭财英、武小龙(QC中心),主要负责验证过程检测方法和取样检验。
1.4验证范围:此次验证包括3个批次的盐酸左氧氟沙星片,每批重量58.212kg,折合36万片,片剂外观为白色圆形片,采用主要设备请详见设备描述,按照«规范»要求提供验证用的产品工艺规程、批记录及相关操作SOP,连续生产3个批次,并按取样计划进行取样、监控,按制定的质量标准、分析方法进行测定。
逐个工序确认工艺操作规程的有效性和重现性,对出现偏差的工艺参数做好偏差处理工作及必要的调整。
1.5产品处方:物料名称36万片备料量盐酸左氧氟沙星40.68kg淀粉(1) 4.32 kg淀粉(2) 0.54 kg二氧化硅 5.4 kg聚山梨酯-80 0.864kg淀粉(3) 5.4 kg硬脂酸镁0.288kg合计57.492 kg1.6工艺过程简述:经过筛、粉碎后达到细度要求的盐酸左氧氟沙星原料、维晶纤维素、淀粉等辅料按工艺规程要求进行备料,加入粘合剂,在湿法混合颗粒机内混合,用摇摆颗粒机制粒,湿颗粒经沸腾干燥床干燥,干颗粒整粒后加入润滑剂,在多向运动混合机内总混合,用旋转式压片机压片,在泡罩包装机上进行铝塑包装,最后进入外包工序进行外包。

样品的检验报告书xxxx制药有限公司x x x x制药有限公司检验项目检验标准检验结果[性状] 应为类白色片或淡黄色片或薄膜衣薄膜衣片,除去包衣后显类片,除去包衣后显类白色或淡黄色。
白色[鉴别][1] 应显红棕色显红棕色[2] 供试品溶液主峰的保留时间应与供试品溶液主峰的保留时间与氧氟沙星对照品中左氧氟沙星氧氟沙星对照品中左氧氟沙星峰(后)的保留时间一致峰(后)的保留时间一致[3] 应显氯化物鉴别反应显氯化物鉴别反应[检查]崩解时限不得过30分钟 7分钟重量差异应符合规定符合规定微生物限度细菌数≤1000个/g 30个/g霉菌数≤100个/g <10个/g大肠杆菌不得检出未检出活螨不得检出未检出[含量测定] 含盐酸左氧氟沙星以左氧氟沙99.2%星(C18H20FN3O4)计应为标示量的90.0~110.0%结论:本品按中国药典(20xx年版)20xx年增补本检验,结果符合规定。
────────────────────────────────────────质量部长:xxx 复核员:xxx检验员:xxxx x x x制药有限公司检验项目检验标准检验结果[性状] 应为类白色片或淡黄色片或薄膜衣薄膜衣片,除去包衣后显类片,除去包衣后显类白色或淡黄色。
白色[鉴别][1] 应显红棕色显红棕色[2] 供试品溶液主峰的保留时间应与供试品溶液主峰的保留时间与氧氟沙星对照品中左氧氟沙星氧氟沙星对照品中左氧氟沙星峰(后)的保留时间一致峰(后)的保留时间一致[3] 应显氯化物鉴别反应显氯化物鉴别反应[检查]崩解时限不得过30分钟 10分钟重量差异应符合规定符合规定微生物限度细菌数≤1000个/g 20个/g霉菌数≤100个/g <10个/g大肠杆菌不得检出未检出活螨不得检出未检出[含量测定] 含盐酸左氧氟沙星以左氧氟沙98.7%星(C18H20FN3O4)计应为标示量的90.0~110.0%结论:本品按中国药典(20xx年版)20xx年增补本检验,结果符合规定。

HPLC法测定盐酸左氧氟沙星片的含量HPLC法测定盐酸左氧氟沙星片的含量摘要:目的:对HPLC及UV测定盐酸左氧氟沙星片的含量进行比较。
方法:高效液相色谱法选择色谱柱为Agilent C18 (150 mm×4.6 mm,5 μm),流动相为醋酸铵高氯酸钠溶液(pH=2.2)-乙腈(85:15),流速为1.0mL·min-1,检测波长为294nm;紫外分光光度法选择294nm波长测定含量.结果:HPLC法中盐酸左氧氟沙星片在2.05ug·mL-1 ~51.15ug·mL-1范围内线性关系良好.回归方程Y =523247X-23331(r=0.9995),加样回收率平均值为100.36%,RSD 1.8%。
结论:HPLC法及紫外分光光度法均准确性、重复性高、精密度好,可考虑将紫外分光光度法作为盐酸左氧氟沙星含量测定的替代方法使用。
关键词:高效液相法;紫外分光光度法;盐酸左氧氟沙星左氧氟沙星是氧氟沙星的L-型光学活性异构体,因其抗菌谱广、抗菌作用强、不良反应率较低,而被广泛使用[1]。
2015版药典推荐高效液相法来分析本品及其相关剂型,考虑到基层药物监测机构尚不能完全普及高效液相设备[2],本文对比分析高效液相法及紫外分光光度法测定盐酸左氧氟沙星含量。
1 材料1.1 仪器与试药岛津LC-20A (改为LC-2010CHT)型高效液相色谱仪;岛津UV-2501(改为UV-2450)型紫外分光光度计;超声波清洗器;乙腈由国药集团化学试剂有限公司提供(改为霍尼韦尔贸易(上海)有限公司提供),为色谱醇;磷酸、醋酸铵、高氯酸钠均为分析纯;盐酸左氧氟沙星对照品(美国西格玛公司,批号:160122)(中国食品药品检定研究院,批号:130455-20116);盐酸左氧氟沙星片(四川科伦药业股份有限公司)。
2 方法2.1 高效液相法2.1.1 色谱条件[2]色谱柱选择Agilent C18 (150 mm×4.6 mm,5 μm),,流动相:醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85:15),检测波长:294 nm, 进样量10μl,1.0 mL/min流速,柱温为室温(25℃)。

不同剂型左氧氟沙星溶出度的测定及比较
蔡雪桃
【期刊名称】《国际医药卫生导报》
【年(卷),期】2009(15)10
【摘要】目的考察不同厂家不同剂型左氧氟沙星(胶囊、片剂)的体外溶出度,为药品采购及临床用药提供参考.方法采用转篮法进行体外溶出度实验,以紫外分光光度法进行含量测定,计算累积溶出百分率,以威布尔方程拟合溶出参数T<,50>、Td、m.结果左氧氟沙星胶囊剂及片剂的体外溶出度均符合2005版<中国药典>规定,但片剂与胶囊剂的Td问有显著性差异(P<0.05).结论左氧氟沙星片剂溶出度比胶囊快,药品采购及临床用药时应加以注意.
【总页数】3页(P84-86)
【作者】蔡雪桃
【作者单位】528000,佛山市第一人民医院药剂科
【正文语种】中文
【中图分类】R9
【相关文献】
1.快速测定布洛芬不同剂型的溶出度 [J], 丁炼;赵锦春
2.紫外分光光度法测定不同剂型清开灵中黄芩苷的溶出度 [J], 刘凤荣;赵春艳;董红梅
3.吲达帕胺不同剂型溶出度的比较研究 [J], 龚秋红
4.HPLC法测定盐酸左氧氟沙星片的溶出度 [J], 彭博;董斌;田洁;王戈;邹亮
5.不同剂型桂枝茯苓丸的溶出度比较 [J], 张佳欢;李智慧;石森林;葛卫红;吴素香因版权原因,仅展示原文概要,查看原文内容请购买。


左氧氟沙星口服制剂评价性抽验结果及3年结果的质量评价孟长虹;金卫红;李晶晶;汪玉馨;黄青;刘琦;陆益红【摘要】目的评价国产左氧氟沙星口服制剂的质量现状及存在问题.方法按照国家评价性抽验计划总体要求,采用现行标准规定检验方法结合探索性研究进行药品检验,统计分析检验结果.结果 324批样品均按现行标准进行了检验,结果2批溶出度低于限值;探索性研究采用2010年版药典方法检测,9批溶出度低于限值;大部分企业的产品3年来质量稳定,个别企业的有关物质、含量测定和溶出度结果3年变化较大.结论左氧氟沙星口服制剂总体质量状况良好.但是同品种标准不统一,建议对相同品种、相同规格、相似工艺的制剂统一并提高质量标准,尤其是有关物质和溶出度项目等.【期刊名称】《中国抗生素杂志》【年(卷),期】2014(039)011【总页数】5页(P825-829)【关键词】左氧氟沙星口服制剂;评价性抽验;质量评价【作者】孟长虹;金卫红;李晶晶;汪玉馨;黄青;刘琦;陆益红【作者单位】江苏省食品药品监督检验研究院,南京210009;江苏省食品药品监督检验研究院,南京210009;江苏省食品药品监督检验研究院,南京210009;江苏省食品药品监督检验研究院,南京210009;江苏省食品药品监督检验研究院,南京210009;江苏省食品药品监督检验研究院,南京210009;江苏省食品药品监督检验研究院,南京210009【正文语种】中文【中图分类】R9781.1左氧氟沙星(levofloxacin)是日本第一制药株式会社于上个世纪90年代初开发成功的喹诺酮类抗菌药,它结构简单,高效、广谱、安全,在国际上得到广泛应用,是目前全球销量最大的喹诺酮类药物。
自1995年首次在我国上市以来,一直倍受瞩目并逐渐广泛应用于临床。
左氧氟沙星主要作用于细菌的脱氧核糖核酸(DNA)拓扑异构酶Ⅱ,抑制细菌DNA的复制和转换,以此达到抗菌作用。
对多种革兰阳性菌、革兰阴性菌包括铜绿假单胞菌、非典型致病菌均作用较强,均衡的抗菌谱和可靠的安全性促成了其临床广泛的应用,其适应症包括敏感菌引起的泌尿生殖系统感染、呼吸道感染、胃肠道感染、伤寒、骨和关节感染、皮肤软组织感染和败血症等[1]。

盐酸左氧氟沙星片处方优化研究刘增平;黄洁【摘要】目的:筛选盐酸左氧氟沙星片的最优处方。
方法以溶出度为指标优选处方,溶出度测定方法为转篮法,溶出介质为0.1 mol/L盐酸900 mL,转速为100 r/min。
结果优选处方为盐酸左氧氟沙星115.1 g、乳糖43.0 g、微晶纤维素20.0 g、羟丙基纤维素18.0 g、硬脂酸镁为处方用量的1.0%、5%聚维酮K30(50%乙醇)40 mL。
结论采用优选处方,颗粒流动性、片剂外观、硬度、脆碎度、崩解时间均符合制剂要求,溶出较完全。
%Objective To screen the optimal prescription of Levoflozacin Tablets. Methods The prescription was optimized with the dissolution as the indicator. The dissolution determination adopted the basket method with the dissolution medium of 0. 1 mol/L hydrochloric acid and the rotation speed of 100 r/min. Results The prescription was levoflozacin ( 115. 1 g ) ,lactose ( 43. 0 g ) ,microcrys-talline cellulose ( 20. 0 g ) ,hydrozypropyl cellulose ( 18. 0 g ) ,magnesium stearate 1. 0% of prescription dosage and 5% povidone K30 (50% ethanol)40 mL. Conclusion With this prescription,the granular flowability,tablet appearance,hardness,friability and disintegration time all conform to the requirements of the preparation with complete dissolution.【期刊名称】《中国药业》【年(卷),期】2015(000)014【总页数】2页(P40-41)【关键词】盐酸左氧氟沙星片;处方筛选;溶出度【作者】刘增平;黄洁【作者单位】陕西省延安市食品药品检验所,陕西延安 716000;陕西省西安市食品药品检验所,陕西西安 710054【正文语种】中文【中图分类】R978.69;TQ460.6左氧氟沙星为氧氟沙星的左旋异构体,抗菌效力是右旋异构体的8~128倍,是氧氟沙星的2倍,且不良反应明显小于右旋异构体[1],临床应用广泛,主要用于治疗呼吸系统、泌尿系统、生殖系统、皮肤软组织、肠道等感染[2]。

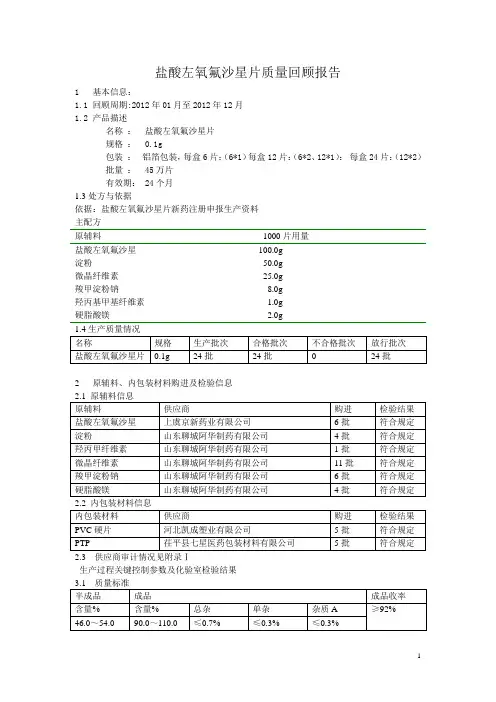
盐酸左氧氟沙星片质量回顾报告1 基本信息:1.1 回顾周期:2012年01月至2012年12月1.2 产品描述名称:盐酸左氧氟沙星片规格: 0.1g包装:铝箔包装,每盒6片;(6*1)每盒12片:(6*2、12*1):每盒24片:(12*2)批量: 45万片有效期: 24个月1.3处方与依据依据:盐酸左氧氟沙星片新药注册申报生产资料主配方原辅料1000片用量盐酸左氧氟沙星100.0g淀粉50.0g微晶纤维素25.0g羧甲淀粉钠8.0g羟丙基甲基纤维素 1.0g硬脂酸镁 2.0g2 原辅料、内包装材料购进及检验信息生产过程关键控制参数及化验室检验结果3.2检测数据及趋势图成品收率图显示:本年度生产的盐酸左氧氟沙星片所有批次成品收率均符合标准规定。
C1----------盐酸左氧氟沙星片半成品含量控制图和过程能力图显示:生产过程保持在受控状态,产品质量符合规定;工序能力符合生产要求。
C2----------盐酸左氧氟沙星片成品含量控制图和过程能力图显示:生产过程保持在受控状态,产品质量符合规定;工序能力符合生产要求。
C3-----------半成品溶出度控制图和过程能力图显示:生产过程保持在受控状态,产品质量符合规定;工序能力符合生产要求。
C4-----------成品溶出度控制图和过程能力图显示:生产过程保持在受控状态,产品质量符合规定;工序能力符合生产要求。
C5---------成品总杂过程能力图显示:生产过程稳定可靠,生产能力符合生产要求。
C6---------成品的单杂过程能力图显示:生产过程稳定可靠,生产能力符合生产要求。
C7的单值控制图检验结果检验 1。
1 个点,距离中心线超过 3.00 个标准差。
检验出下列点不合格: 22C7----------成品的杂质A过程能力图显示:生产过程稳定可靠,生产能力符合生产要求。
4 工艺用水监测情况回顾见附录Ⅳ5 环境监测情况附录Ⅱ6 验证与确认情况回顾见附录Ⅲ7 稳定性考察留样批号:20120301留样批号:20111001留样批号:20110301留样批号:20090502检测数据及趋势图显示:留样20120301、20120901、20110301、20110301在考察期间各监测项目均符合规定;留样20100101、20090502、20091201经过36个月(有效期后一年)长期稳定性考察,监测项目均符合规定。
2023年盐酸左氧氟沙星片行业市场调研报告盐酸左氧氟沙星片是一种抗菌药物,广泛应用于医院和家庭医疗领域。
由于其广泛的应用和稳定的市场需求,盐酸左氧氟沙星片行业一直是医药行业的一个重要组成部分。
市场需求分析随着人们健康意识的提高和医疗技术的不断发展,盐酸左氧氟沙星片的应用范围不断扩大。
预计未来几年,随着老龄化人口的增加和医疗保健的不断改善,盐酸左氧氟沙星片市场需求将稳步增长。
行业市场份额分析盐酸左氧氟沙星片市场竞争激烈,但市场集中度较高,主要的企业包括拜耳医药、瑞士诺华、罗氏等大型跨国企业。
在国内市场中,盐酸左氧氟沙星片的主要供应商包括上海利民制药、江苏国泰医药、浙江中宇药业等。
市场价格分析盐酸左氧氟沙星片的价格受供求关系影响较大,同时由于其作为处方药品的特殊性,价格波动较为频繁。
经过调查发现,不同品牌的盐酸左氧氟沙星片价格存在一定差异,一般在0.5-5元一片之间。
市场销售渠道分析盐酸左氧氟沙星片的销售渠道主要包括零售药房、医院药房、超市等。
经过调查发现,绝大多数消费者在购买盐酸左氧氟沙星片时选择到医院药房购买,因为这种方法更加安全和可靠,而且方便快捷。
此外,部分消费者也愿意到零售药房和超市购买盐酸左氧氟沙星片,因为价格更加便宜。
市场前景分析随着医疗技术的不断进步和人们健康意识的不断提高,盐酸左氧氟沙星片市场需求将持续增长。
此外,随着人口老龄化的加剧,某些疾病例如尿路感染等的发病率也将不断增加,这将为盐酸左氧氟沙星片的发展提供更多机会。
由此可见,盐酸左氧氟沙星片市场前景广阔,但在市场竞争激烈的情况下,企业必须保持产品质量和价格的稳定性,才能保持市场优势。
54China Pharmaceuticals2013年3月20日第22卷第6期Vol.22,No.6,March 20,2013左氧氟沙星为第3代氟喹诺酮类药物[1],是氧氟沙星的左旋体,抗菌效力是右旋体的8 128倍,是氧氟沙星的2倍,且不良反应明显小于右旋体,临床应用广泛[2]。
盐酸左氧氟沙星片剂是目前临床常用药品,已被2010年版《中国药典(一部)》收载[3],在国内、外有多个厂家生产。
为考察其质量,现选取国内、外4个厂家共12批片剂样品,对其有关物质、溶出度、异构体及含量等进行考察并比较。
1仪器与试药岛津LC -10A 型及LC -20A 型高效液相色谱仪(日本岛津公司);溶出仪(Hanson 公司)。
左氧氟沙星对照品(批号为130455-200905,含量为97.3%)、氧氟沙星对照品(批号为130454-200905,含量为98.8%)均由中国药品生物制品检定所提供;左氧氟沙星片(规格为0.1g )、盐酸左氧氟沙星片(规格为0.1g )分别来自4个厂家(A ,B ,C ,D ),共12个批号(每个厂家3个批号,分别以A1,A2,A3,B1,B2,B3,C1,C2,C3,D1,D2,D3表示);甲醇、乙腈均为色谱纯,其余试剂均为分析纯。
2方法与结果2.1有关物质检测取本品片剂10片,研细,取适量,精密称定,用流动相溶解并稀释成每1mL 中约含1.0mg 的溶液,摇匀,作为供试品溶液;精密量取适量,加流动相稀释成每1mL 中含左氧氟沙星5μg 的溶液,作为对照溶液。
照含量测定项下的色谱条件,取对照溶液10μL 注入液相色谱仪,调节仪器的灵敏度,使主成分色谱峰的峰高约为满量程的50%,再精密量取对照溶液和供试品溶液各10μL ,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
按照外标法,以峰面积计算供试品溶液中杂质A ,B ,C (相对于保留时间约为0.74,1.08,2.57处)和其他各杂质的量,结果见表1。
不同厂家盐酸左氧氟沙星片的质量考察王丽荣;王俊秋;周立春【期刊名称】《中国药业》【年(卷),期】2013(022)006【摘要】Objective To compare the quality of Levofloxacin Hydrochloride Tablets from different manufactories. Methods The determination of Levofloxacin Hydrochloride Tablets produced by 4 different manufacturers from inland and abroad was performed on several aspects: the related substance, dissolution, isomer content and content of levofloxacin. Results The determined indexes of all products of Levofloxacin Hydrochloride Tablets produced by 4 different manufacturers were all in line with the specification of the China Pharmacopoeia , but the differences existed in the detection results of various indexes among different manufacturers. Conclusion The detection results can provide the reference for increasing the quality of this product.%目的比较不同厂家盐酸左氧氟沙星片的质量.方法对国内、外4个厂家盐酸左氧氟沙星片产品的主要检测项目如有关物质、溶出度、异构体及含量等进行测定.结果所有被测产品各项指标均符合国家标准要求,但不同厂家之间各指标结果存在差异.结论测定结果可为产品质量标准提高提供参考.【总页数】2页(P54-55)【作者】王丽荣;王俊秋;周立春【作者单位】北京市药品检验所抗生素室,北京100035【正文语种】中文【中图分类】R927.2;R978.69【相关文献】1.不同厂家一次性使用医用注射器及活塞体外细胞毒性的质量考察 [J], 王文佳;何华红;李薇;吴婷;庞智慧2.不同厂家阿司匹林肠溶片质量考察 [J], 陈亚;陈清;张琼3.光纤传感过程分析比较不同厂家盐酸左氧氟沙星片溶出度 [J], 张明玥n;李新霞;王伟萍;刘扬4.不同厂家维生素B12注射液的不溶性微粒质量考察 [J], 张心悦;武海萍;卜莹5.不同厂家及批次的复方丹参制剂的质量考察研究 [J], 张偲偲;李雯珊;王德勤;李楚源;匡艳辉因版权原因,仅展示原文概要,查看原文内容请购买。
6厂家左氧氟沙星片质量评价
陶金成;钱文璟;时涛;简炎林;李澎灏;肖青
【期刊名称】《中国药房》
【年(卷),期】2004(015)006
【摘要】目的:考察6厂家左氧氟沙星片的质量.方法:参照相关标准考察6厂家17个批号左氧氟沙星片质量,并采用同一溶出条件考察各样品溶出曲线.结果:6厂家左氧氟沙星片质量均符合规定,但溶出特性、治疗费用均有显著性差异(P<0.01).结论:不同厂家生产的左氧氟沙星片质量有差异,拥有专利的原研发厂家药品价格较高,但质量较稳定.
【总页数】3页(P363-365)
【作者】陶金成;钱文璟;时涛;简炎林;李澎灏;肖青
【作者单位】深圳市第二人民医院药剂科,深圳市,518035;深圳市第二人民医院药剂科,深圳市,518035;深圳市第二人民医院药剂科,深圳市,518035;深圳市第二人民医院药剂科,深圳市,518035;深圳市第二人民医院药剂科,深圳市,518035;深圳市第二人民医院药剂科,深圳市,518035
【正文语种】中文
【中图分类】R927.11
【相关文献】
1.4厂家左氧氟沙星片溶出度考察 [J], 何光明;王南松
2.不同厂家盐酸左氧氟沙星片的质量考察 [J], 王丽荣;王俊秋;周立春
3.不同厂家左氧氟沙星片体外溶出度质量考察 [J], 张丽;周学琴;张耀东;李宁;吕如刚
4.光纤传感过程分析比较不同厂家盐酸左氧氟沙星片溶出度 [J], 张明玥n;李新霞;王伟萍;刘扬
5.国产左氧氟沙星片的质量评价 [J], 吴静萍; 陈茜; 刘钐; 林晨煦; 伍雯琦; 高丹玲因版权原因,仅展示原文概要,查看原文内容请购买。
盐酸左氧氟沙星片的溶出行为评价
吴静萍
【期刊名称】《中国药物评价》
【年(卷),期】2024(41)2
【摘要】目的:考察7家企业盐酸左氧氟沙星片的溶出行为,并评价其与参比制剂溶出行为的一致性。
方法:采用桨法,转速50 r·min^(-1),以pH 1.2盐酸溶液、pH
4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液及水为溶出介质,体积900 mL,采用HPLC法测定溶出量,用f 2因子法评价溶出曲线的相似性,并结合含量、有关物质、硬度、晶型、结晶度及稳定性等相关因素分析。
结果:有3家企业产品的溶出行为
与参比一致,其余产品与参比的溶出行为差异显著,表现出较低的溶出速率,该部分产品与原料药相比均存在转晶现象,且结晶度不佳。
结论:盐酸左氧氟沙星片的生产工
艺对晶型影响较大,多晶型本身的表观溶解度和溶解速率差异,对制剂的溶出产生滞
后影响,提示相关企业应合理优化工艺、重点关注其转晶行为。
【总页数】5页(P115-119)
【作者】吴静萍
【作者单位】福建省食品药品质量检验研究院
【正文语种】中文
【中图分类】R927.11
【相关文献】
1.多条溶出曲线评价盐酸二甲双胍片的溶出行为
2.硫唑嘌呤片溶出度检测方法的改进研究及溶出行为的评价
3.高效液相色谱法测定芦丁片的溶出度及溶出行为评价
4.黄杨宁片溶出度测定方法研究及溶出行为评价
5.复方对乙酰氨基酚片溶出度方法研究及溶出行为评价
因版权原因,仅展示原文概要,查看原文内容请购买。
54China Pharmaceuticals2013年3月20日第22卷第6期Vol.22,No.6,March 20,2013左氧氟沙星为第3代氟喹诺酮类药物[1],是氧氟沙星的左旋体,抗菌效力是右旋体的8 128倍,是氧氟沙星的2倍,且不良反应明显小于右旋体,临床应用广泛[2]。
盐酸左氧氟沙星片剂是目前临床常用药品,已被2010年版《中国药典(一部)》收载[3],在国内、外有多个厂家生产。
为考察其质量,现选取国内、外4个厂家共12批片剂样品,对其有关物质、溶出度、异构体及含量等进行考察并比较。
1仪器与试药岛津LC -10A 型及LC -20A 型高效液相色谱仪(日本岛津公司);溶出仪(Hanson 公司)。
左氧氟沙星对照品(批号为130455-200905,含量为97.3%)、氧氟沙星对照品(批号为130454-200905,含量为98.8%)均由中国药品生物制品检定所提供;左氧氟沙星片(规格为0.1g )、盐酸左氧氟沙星片(规格为0.1g )分别来自4个厂家(A ,B ,C ,D ),共12个批号(每个厂家3个批号,分别以A1,A2,A3,B1,B2,B3,C1,C2,C3,D1,D2,D3表示);甲醇、乙腈均为色谱纯,其余试剂均为分析纯。
2方法与结果2.1有关物质检测取本品片剂10片,研细,取适量,精密称定,用流动相溶解并稀释成每1mL 中约含1.0mg 的溶液,摇匀,作为供试品溶液;精密量取适量,加流动相稀释成每1mL 中含左氧氟沙星5μg 的溶液,作为对照溶液。
照含量测定项下的色谱条件,取对照溶液10μL 注入液相色谱仪,调节仪器的灵敏度,使主成分色谱峰的峰高约为满量程的50%,再精密量取对照溶液和供试品溶液各10μL ,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
按照外标法,以峰面积计算供试品溶液中杂质A ,B ,C (相对于保留时间约为0.74,1.08,2.57处)和其他各杂质的量,结果见表1。
对4厂家12批样品有关物质含量结果进行比较,发现4个厂的样品中已知杂质均未检出,而均检出未知杂质。
不同厂家之间检出的未知杂质的含量均有所不同。
同一厂家不同批号之间有关物质的水平相当。
这说明不同厂家从合成原料药到制备制剂,再经贮藏、运输方法有所不同,进而在此期间所产生的有关物质也有所不同,从试验结果可以看出A 厂家的产品质量优于其他3个厂家。
左氧氟沙星见光不稳定,容易产生降解。
本次有关物质的测定方法是采用能很好的分离两个光降解产物的色谱系统(分离度在1.5以上)。
以A 厂家样品为例,其有关物质高效液相色谱见图1。
2.2溶出度测定取本品,照溶出度测定法[2010年版《中国药典(一部)》附录ⅩC 第一法],以盐酸溶液(9→1000)为溶剂,转速为100r /min ,依法操作。
经45min 时,取溶液适量,滤过,精密量取续滤液适量,加盐酸溶液(9→1000)稀释成每1mL 约含左氧氟沙星5.5μg 的溶液,作为供试品溶液;另精密称取左氧氟沙星对照品适量,加盐酸溶液(9→1000)溶解并稀释成每1mL 中约含9μg 的溶液,作为对照品溶液,取上述两种溶液,照紫外-可见分光光度法(附录不同厂家盐酸左氧氟沙星片的质量考察王丽荣,王俊秋,周立春(北京市药品检验所抗生素室,北京100035)摘要:目的比较不同厂家盐酸左氧氟沙星片的质量。
方法对国内、外4个厂家盐酸左氧氟沙星片产品的主要检测项目如有关物质、溶出度、异构体及含量等进行测定。
结果所有被测产品各项指标均符合国家标准要求,但不同厂家之间各指标结果存在差异。
结论测定结果可为产品质量标准提高提供参考。
关键词:盐酸左氧氟沙星片;检测;质量;比较中图分类号:R927.2;R978.69文献标识码:A文章编号:1006-4931(2013)06-0054-02Investigation on Quality of Levofloxacin Hydrochloride Tablets from Different ManufacturersWang Lirong ,Wang Junqiu ,Zhou Lichun(Beijing Municipal Institute for Drug Control ,Beijing ,China100035)Abstract :Objective To compare the quality of Levofloxacin Hydrochloride Tablets from different manufactories.Methods The determi-nation of Levofloxacin Hydrochloride Tablets produced by 4different manufacturers from inland and abroad was performed on several aspects :the related substance ,dissolution ,isomer content and content of levofloxacin.ResultsThe determined indexes of all products ofLevofloxacin Hydrochloride Tablets produced by 4different manufacturers were all in line with the specification of the China Pharma-copoeia ,but the differences existed in the detection results of various indexes among different manufacturers.Conclusion The detectionresults can provide the reference for increasing the quality of this product.Key words :Levofloxacin Hydrochloride Tablets ;determination ;quality ;comparison本试验建立了简便可行、结果可靠的齐墩果酸高效液相色谱测定方法,可以更好地控制制剂的质量,保障用药安全有效。
作者简介:杨智慧(1980-),女,主管药师,主要从事药物分析工作,(电子信箱)814120942@qq.com 。
参考文献:[1]国家药典委员会.中华人民共和国药典(一部)[M ].北京:中国医药科技出版社,2010:698-699.[2]李祖论,石圣洪,陈红.川牛膝多糖的免疫活性研究[J ].中药材,1998,21(2):90.[3]王奇,芦柏震.齐墩果酸的研究进展[J ].中国药房,2008,19(9):711-712.(收稿日期:2012-07-11)檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨檨·药物鉴定·Drug Identification55China Pharmaceuticals2013年3月20日第22卷第6期Vol.22,No.6,March 20,2013A.空白辅料溶液B.对照溶液C.供试品溶液图1A 厂家产品的有关物质图谱ⅣA ),在294nm 波长处分别测定吸光度,按二者吸光度的比值计算每片的溶出量。
结果见表1。
不同厂家的盐酸左氧氟沙星片的溶出度良好,这表明各厂家在控制制剂溶出度方面十分重视,数据之间无显著性差异。
2.3异构体含量测定用十八烷基硅烷键合硅胶为填充剂;以硫酸铜D -苯丙氨酸溶液(取D -苯丙氨酸1.32g 与硫酸铜1g ,加水1000mL 溶解后,用氢氧化钠试液调pH 至3.5)-甲醇(82ʒ18)为流动相;柱温40ħ;流速为1mL /min ;检测波长为293nm 。
取氧氟沙星适量,用流动相溶解并稀释成每1mL 中分别约含0.2mg 的溶液,取20μL 注入液相色谱仪,记录色谱图。
取本品适量,用流动相溶解并稀释成每1mL 中约含1.0mg 的溶液,作为供试品溶液,精密量取适量,加流动相制成每1mL 中含左氧氟沙星10μg 的溶液,作为对照品溶液。
再精密量取对照品溶液和供试品溶液各20μL ,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算供试品中左氧氟沙星的含量。
结果见表1。
从试验数据来看,A ,C 厂家的产品好于B ,D 厂家产品。
D 厂家光学异构体含量为最高。
以D 厂家产品为例,异构体色谱见图2。
2.4左氧氟沙星含量测定用十八烷基硅烷键和硅胶为填充剂;以己烷磺酸钠溶液(取己烷磺酸钠0.98g ,加磷酸盐缓冲液(取磷酸二氢钾6.8g ,加水溶解并稀释至1000mL ,加0.05mol /L 磷酸约500mL ,使pH 为2.4)-甲醇(3ʒ1)为流动相;柱温40ħ;流速1mL /min ;检测波长为293nm 。
取左氧氟沙星对照品水溶液(1→1000)10mL 于一无色试管中,用日光灯(3500lx )照射3h ,取该溶液10μL 注入液相色谱仪,记录色谱图,相对于色谱主峰保留时间约为1.1min 和1.2min 处应均能检测出色谱峰。
取本品约50mg ,置50mL 量瓶中,加盐酸溶液(0.03mol /L )溶解并稀释至刻度,摇匀,滤过,精密量取续滤液5mL ,置另一50mL 量瓶中,用流动相稀释至刻度,摇匀,再精密量取10μL 注入色谱仪,记录色谱图。
另取左氧氟沙星对照品适量,同法测定,按外标法以峰面积计算出供试品中左氧氟沙星(C 18H 20FN 3O 4)的含量。
测定结果见表1。
从测定结果来看,A ,B 厂家产品含量约为100%,C 厂家产品含量测定结果偏低,D 厂家产品含量测定结果偏高。
这可能由系统误差或厂家投料所致。
3讨论本试验通过对4厂家12批盐酸左氧氟沙星片的质量比对,所有产品的检查项均符合2010年版《中国药典(二部)》的要求,但不同厂家的产品在有关物质和异构体的含量方面存在较大差异。
提示有必要在盐酸左氧氟沙星片剂的质量标准中增订异构体检查项,也提示由左氧氟沙星导致的临床不良反应可能与有关物质和光学异构体有关。
参考文献:[1]景士云,张君颖.紫外分光光度法测定盐酸左氧氟沙星片的含量[J ].药学进展.2008,32(7):323.[2]赵环宇,王昕,王靓.盐酸左氧氟沙星注射液质量评价[J ].中国药事,2007,21(8):618.[3]国家药典委员会.中华人民共和国药典(二部)[M ].北京:中国医药科技出版社,2010:652.(收稿日期:2012-07-28)A150100500010203040CB150100500010203040150100500010203040t /mint /mint /min未知杂质(%)立药含量(标示量的%)异构体(标示量的%)溶出度(标示量的%)厂家批号表1各厂家产品指标检测结果ABCDA1A2A3X B1B2B3X C1C2C3X D1D2D3X最大单杂0.030.020.030.030.040.040.050.040.110.090.110.100.050.050.060.05总杂0.030.030.030.030.060.060.060.060.110.100.120.110.110.110.110.11100.8100.199.2100.0101.1102.2100.5101.398.899.097.698.5103.4102.1102.5102.70.100.060.050.070.210.150.170.180.110.080.050.080.220.190.240.2299.599.299.099.2100.1101.2100.9100.796.597.998.197.5103.1104.6102.9103.5·药物鉴定·Drug IdentificationmAUmAU 5.02.50051015202530BA.对照品溶液B.供试品溶液图2D 厂家原料药的异构体图谱mAU mAU 5.02.50051015202530mAU A。