KH_FN原理讲解
- 格式:pptx
- 大小:2.59 MB
- 文档页数:10

knoevenagel反应机理Knoevenagel 反应是一种羰基化合物与二碳有机化合物在存在碱催化剂下发生的加成反应。
这个反应的机理涉及到羰基化合物发生偶极化,并与碱性中间体形成共轭加成产物。
本文将通过分析 Knoevenagel 反应机理的不同阶段,来解释整个反应的详细过程。
第一步:激活羰基化合物Knoevenagel 反应通常使用羰基化合物作为反应物之一。
在反应开始时,羰基化合物必须通过双键将其激活。
此时,羰基化合物中的羰基碳原子与相邻的氧化物形成了亲核共振结构,使得羰基碳原子上的α-氢离子化。
这个过程会将羰基化合物变成更容易被攻击的亲电性。
第二步:亲核试剂的加成在羰基化合物激活之后,亲核试剂便会与其形成共轭加成产物。
亲核试剂通常是一个二碳有机化合物。
在反应的初期,亲核试剂会攻击羰基化合物中激活后的α-碳原子,形成了一个稳定的共轭碳阴离子。
在形成碳阴离子的第二步反应过程中,羰基化合物原本激活的α-碳原子上的氢离子化,通过形成碳阴离子而被剥离。
这个反应是可逆的,并且亲核试剂与羰基化合物中产生的碳阴离子的反应速度是相当快的。
因此,亲核试剂的加成会导致形成的碳阴离子再次活化羰基化合物中的α-碳原子。
第四步:酮化经过上述的反应过程之后,产生的稳定碳阴离子会被质子化。
这个过程会引起一个非常重要的副反应,即酮化反应。
在酮化反应中,羰基化合物中的羰基碳原子上的羰基离子发生了质子化,形成了一个加成产物。
这个产物是一种重要的有机合成中间体,可以通过进一步的反应来制备一系列有用的有机化合物。

过硫酸氢钾复合盐稳定剂作用-概述说明以及解释1.引言1.1 概述概述部分的内容:概述部分是对整篇文章进行简要介绍和概括的部分,旨在引起读者的兴趣并提供基本背景信息。
本文的主题是过硫酸氢钾复合盐的稳定剂作用,通过深入探讨其定义、特性、优点和应用前景,来展示这种化学物质在实际应用中的价值和重要性。
过硫酸氢钾复合盐是一种常见的化学品,其化学式为KHSO5。
它具有高活性的氧化性,能在低温下释放出活性氧,因此广泛应用于许多领域,如化学工业、制药业、纺织业等。
过硫酸氢钾复合盐的稳定剂作用指的是其在化学反应中起到稳定反应物和产物的作用,延缓反应速度,使反应过程更加平稳可控。
本文将首先详细介绍硫酸氢钾复合盐的定义和特性,包括其化学结构、物理性质以及在不同环境条件下的稳定性等方面。
然后,重点探讨过硫酸氢钾复合盐作为稳定剂的作用机制和效果。
通过理论推导和实验研究,我们将揭示其如何通过稳定反应物和产物的氧化还原态,抑制副反应的生成,并提高反应体系的催化效率和产物纯度。
最后,本文将总结硫酸氢钾复合盐作为稳定剂的优点和应用前景。
这种化学物质具有较好的稳定性和催化活性,能够在许多领域发挥重要作用。
未来的研究和应用方向包括改进合成方法、提高催化效率以及探索更广泛的应用领域等。
通过对过硫酸氢钾复合盐稳定剂作用的深入研究,我们可以更好地了解其在化学反应中的作用机制和效果,为相关领域的科学家和工程师提供有益的指导和借鉴,推动该领域的发展和应用。
本文将提供一个全面而系统的观点,希望能对读者有所启发和帮助。
1.2 文章结构文章结构部分的内容如下:文章结构部分旨在简要介绍本文的组织结构,使读者了解文章的内容安排和各个部分的主要内容。
本文的结构分为引言、正文和结论三个部分。
引言部分将对过硫酸氢钾复合盐的稳定剂作用进行介绍。
首先,本部分将概述过硫酸氢钾复合盐的定义和特性,以引发读者的兴趣和理解。
随后,介绍文章的结构和各个部分的内容。
最后,明确本文的目的,即通过对过硫酸氢钾复合盐稳定剂作用的探讨,揭示其优点和应用前景。


亨利定律常数kh你有没有过这种体验:夏天拿着可乐瓶子,刚打开一瞬间,咕噜咕噜的声音响起来,然后气泡就开始往外冒。
等你喝下去的时候,那些气泡在嘴里跳来跳去,像是跳舞似的。
这种现象,其实和一个叫“亨利定律”的东西有关系。
亨利定律常数,简单点说就是描述气体溶解在液体里的一个参数。
就是说,气体在液体里的溶解度到底有多大,取决于气体的压力和溶液的温度。
如果气体的压力高,气体就容易溶解在液体里,反之则不容易。
要知道,这个定律可不是某个科学家为了搞个难懂的公式来逗我们笑而发明的,它其实解释了好多日常生活中常见的现象。
说到这儿,我就不由得想起前阵子和朋友去钓鱼的事。
那天阳光明媚,湖面上波光粼粼。
我们把船划到一个比较安静的地方,带着啤酒和小零食,准备享受一天的悠闲时光。
刚坐下不久,我朋友就递给我一瓶冰啤酒,我打开后,还没来得及喝,啤酒瓶口就冒出了好多气泡,咕噜咕噜地发出声音。
这一瞬间,我忽然想到了亨利定律。
我记得当时我朋友还问我:“你说这个气泡为什么一直冒呢?”我笑了笑,跟他解释了一下。
其实,啤酒瓶里的气泡就是二氧化碳气体溶解在啤酒液体里的结果。
刚打开瓶盖时,外面的压力一下子降了,气体就不再容易保持在液体里了,于是它们就开始“逃跑”,通过冒泡的形式跑出来了。
这种现象其实就是亨利定律在工作:气体溶解度和气体的压力有直接关系。
更有趣的是,啤酒刚开封时,二氧化碳会以极快的速度从液体中释放出来,形成大量的气泡,这也就是为什么你刚倒出一杯啤酒,泡沫总是那么丰富。
随着时间的推移,啤酒表面的泡沫会逐渐减少,直到你喝完为止。
这个过程其实就是亨利定律“演绎”的一部分——气体在液体中的溶解度因为外界压力变化而发生改变。
当时我们边钓鱼边喝啤酒,偶尔也聊起了一些关于气体和液体溶解的问题。
我朋友特别好奇,这些气泡是不是对我们喝起来有影响。
我当时就笑着说:“其实泡沫也是一个很有趣的物理现象,它让喝啤酒的体验更加丰富,喝起来的感觉也不一样。
你看,那些泡泡一跳一跳的,给人一种轻松愉快的感觉,不是吗?”其实,气泡多不多,跟温度也有关系。

高二工业合成氨知识点工业合成氨是指通过工业化方法生产氨气的过程。
这种生产方法广泛应用于农业、化工、制药等领域。
本文将介绍高二学生在学习工业合成氨时需要了解的相关知识点。
一、氨的制备方法1. 氨的工业制备主要采用哈-博斯曼法和氰胺法。
2. 哈-博斯曼法是由德国科学家哈-博斯曼于1908年提出的,主要通过氮气与氢气在高温高压下经催化剂反应生成氨气。
3. 氰胺法是指氨气由氰氨酸水解制得,其特点是原料使用方便,反应条件较温和。
二、反应原理1. 哈-博斯曼法的反应原理是氨气的合成反应。
该反应的化学方程式可表示为:N2 + 3H2 → 2NH3。
2. 氰胺法的反应原理是氰胺酸的加水分解反应。
反应方程式为:CH4N2O + 2H2O → CO2 + 2NH3。
三、反应条件1. 哈-博斯曼法需要高温高压下进行反应,通常反应温度为400-500℃,反应压力为100-200 atm。
2. 氰胺法的反应条件较温和,通常反应温度为150-200℃,反应压力为10-20 atm。
四、反应催化剂1. 哈-博斯曼法中常用的催化剂是铁、钴和铁钴合金等过渡金属催化剂。
2. 氰胺法中的催化剂包括钯、铂等贵金属催化剂。
五、反应装置1. 哈-博斯曼法需要使用高压装置和催化剂床。
2. 氰胺法一般采用立式氨合成塔。
六、应用领域1. 工业合成氨广泛应用于农业领域,用于生产化肥,如尿素、硝酸铵等。
2. 工业合成氨也用于制药工业,作为制备药物的原料。
3. 除此之外,氨还可以用于金属加工、电子行业等各个领域。
七、安全注意事项1. 氨是一种有毒气体,具有刺激性气味。
在操作过程中,必须注意防护措施,加强通风排气,佩戴防护装备。
2. 高温高压下的氨合成反应需要高强度的反应容器和安全措施,以确保操作人员的安全。
3. 操作过程中应避免与氧化剂、酸、其他可燃物质等接触,以防止火灾或爆炸事故的发生。
总结:工业合成氨是一项重要的工艺,具有广泛的应用领域。
了解氨的制备方法、反应原理、反应条件、催化剂、装置以及应用领域等知识点对于高二学生学习工业化学课程至关重要。

kh-570用于涂层的原理以KH-570用于涂层的原理为标题,我们将从以下几个方面来详细解析。
我们需要了解KH-570是一种什么样的物质。
KH-570,全名是3-(甲氧基硅基)丙基三甲氧基硅烷,它是一种有机硅化合物,具有较高的亲水性和亲油性。
这种化合物在涂层行业中被广泛应用,用于增加涂层材料的附着力和抗水性。
KH-570的原理主要包括两个方面:一是通过其亲水性增加涂层材料与基材的粘附力,二是通过其亲油性提高涂层材料的耐水性。
KH-570的亲水性使其能够与水分子发生作用,与基材表面形成氢键,从而增加涂层材料与基材的粘附力。
在涂层制备过程中,KH-570可以与基材表面的活性基团发生反应,形成化学键或物理吸附,从而牢固地将涂层与基材结合在一起。
这种增加的粘附力可以提高涂层的耐久性和抗剥落性,使涂层能够长时间保持在基材表面。
KH-570的亲油性使其能够与涂层材料中的有机成分相容,提高涂层材料的耐水性。
在涂层中加入KH-570可以改善涂层材料的亲水性,从而减少涂层材料与水分子的相互作用,提高涂层的耐水性能。
这是因为KH-570分子中的有机基团能够与涂层材料中的有机成分相互作用,形成一层保护膜,阻隔水分的渗透。
这种保护膜可以有效地防止涂层材料与水分子的接触,从而延长涂层的使用寿命。
除了以上两个方面,KH-570还具有一些其他的优点。
例如,KH-570可以改善涂层材料的流变性能,使其更易于加工和涂覆;同时,KH-570还可以提高涂层材料的耐化学性和耐热性,使涂层能够在恶劣环境下保持良好的性能。
在实际应用中,KH-570通常需要与其他助剂一起使用,以进一步改善涂层材料的性能。
例如,可以与交联剂一起使用,以增加涂层的硬度和耐磨性;也可以与填料一起使用,以增加涂层的光滑度和润滑性。
总结起来,KH-570用于涂层的原理主要包括增加涂层与基材的粘附力和提高涂层的耐水性。
通过其亲水性和亲油性,KH-570可以与基材和涂层材料相互作用,形成稳定的界面,从而提高涂层的性能。

水解常数kh的h1. 什么是水解常数kh?水解常数kh是描述溶液中酸或碱的强弱程度的一个重要物理化学参数。
它表示单位时间内溶液中酸或碱分子发生水解反应的速率。
水解常数kh通常用K表示,其单位为mol/L。
在溶液中,酸和碱会与水分子发生水解反应,产生氢离子(H+)和羟基离子(OH-)。
酸的水解反应可以表示为HA + H2O ⇌ H3O+ + A-,碱的水解反应可以表示为BOH + H2O ⇌ B+ + OH-。
其中,HA代表酸分子,A-代表酸根离子,BOH代表碱分子,B+代表碱根离子。
在一定条件下,溶液中酸和碱的水解反应达到动态平衡。
此时,酸根离子和羟基离子浓度之积与未水解物质浓度之积成正比。
根据动态平衡原理可得到以下方程:[A-][H3O+] / [HA] = K1 和 [B+][OH-] / [BOH] = K2。
其中K1和K2分别为酸和碱的水解常数。
2. 水解常数kh的计算方法水解常数kh可以通过实验方法或理论计算方法进行确定。
下面将介绍几种常用的计算方法。
2.1 pH计法pH指示剂是一种能够根据溶液中氢离子浓度变化而改变颜色的物质。
通过测量溶液的pH值,可以间接得到水解常数kh。
具体步骤如下:1.准备一定浓度的酸或碱溶液。
2.使用pH电极或试纸测量溶液的pH值。
3.根据所使用酸或碱的化学方程式,确定酸根离子和羟基离子的浓度。
4.利用动态平衡原理和水解反应方程式,计算出水解常数kh。
2.2 离子强度法离子强度是描述溶液中离子总浓度和电荷密度的一个参数。
根据离子强度对水解常数kh的影响规律,可以通过实验测定溶液中各组分离子浓度,进而计算出水解常数kh。
1.测定溶液中各组分离子浓度:可使用电导率仪、离子选择性电极等实验方法。
2.根据测定得到的离子浓度,利用离子强度公式计算出溶液的总离子强度。
3.根据水解反应方程式和动态平衡原理,计算出水解常数kh。
2.3 理论计算法理论计算法是通过分子模拟、量子化学方法等理论手段,根据溶液中各组分的结构和性质来预测水解常数kh。

khp和naoh反应方程式
Khp与Naoh反应是一种重要的化学反应,有着重要的应用。
它是由一系列化
学反应而形成的,该反应的反应方程式是Khp+Naoh=K2O+H2O,它属于化学中的可
逆反应。
Khp和Naoh反应是有机化学中常用的反应,它们是重要的原料,在合成有机
化合物方面有着重要的作用。
Khp与Naoh反应属于常温化学反应,其放热较小,
反应温度较低。
Khp和Naoh反应产生的产物具有重要的化学特性,如酸碱性,正
电荷,负电荷等,既可以作为有机分子的构建材料,也能够用作催化剂或有机交联剂。
Khp和Naoh反应有着重要的应用,它们能够用于生产大量的多种有机化合物,如:精细化工产品、涂料、医药、农药以及用于技术工业方面,以及金属处理;还可用来生产植物提取物,而且Khp与Naoh反应还可用于分析学实验,如体液,血
液成分的测定等。
总的来说,Khp和Naoh反应在化学领域有着重要的意义,它提供了一种低成本、高灵敏度的制备有机物的新途径,同时也与环境保护有着紧密的联系,对于实验室科研、工业生产和环境监测等都具有重要的作用,为人类社会的发展做出了重要的贡献。
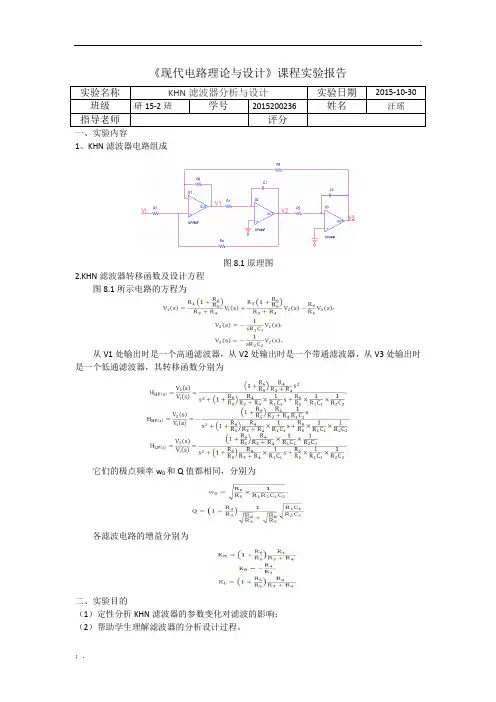
《现代电路理论与设计》课程实验报告实验名称KHN滤波器分析与设计实验日期2015-10-30 班级研15-2班学号2015200236 姓名汪瑶指导老师评分1、KHN滤波器电路组成图8.1原理图2.KHN滤波器转移函数及设计方程图8.1所示电路的方程为从V1处输出时是一个高通滤波器,从V2处输出时是一个带通滤波器,从V3处输出时是一个低通滤波器,其转移函数分别为它们的极点频率w0和Q值都相同,分别为各滤波电路的增益分别为二、实验目的(1)定性分析KHN滤波器的参数变化对滤波的影响;(2)帮助学生理解滤波器的分析设计过程。
三、实验过程1、理论计算为了方便分析计算①取C1=C2=C=10nF,R1=R2=R3=R4=R5=R6=R=100k。
②由计算公式求得,wp=1000rad/s,Q=1,2、仿真步骤(1)按照电路图,选好元器件,并按理论计算设定元件值,搭建好仿真电路。
如下图8.2所示:图8.2仿真电路图(2)设置仿真参数,如下图8.3所示:图8.3仿真参数设置运行仿真,得到如下图8.4所示:图8.4 V1,V2和V3输出波形图(3)改变C1值。
采用参数扫描方式,让C1的值从6n到14n,每2n取一次值。
设置参数扫描后的波形如图8.5所示,图8.5改变参数C1的波形变化(4)改变C2值。
采用参数扫描方式,让C2的值从6n到14n,每2n取一次值。
设置参数扫描后的波形如图8.6所示图8.6改变参数C2的波形变化(5)改变R1值。
采用参数扫描方式,让R1的值60k到140k,每20k取一次值。
设置参数扫描后的波形如图8.7所示图8.7改变参数R1的波形变化(6)改变R2值。
采用参数扫描方式,让R2的值从60k到140k,每20k取一次值。
设置参数扫描后的波形如图8.8所示图8.8改变参数R2的波形变化(7)改变R3值。
采用参数扫描方式,让R3的值从60k到140k,每20k取一次值设置参数扫描后的波形如下图8.9所示图8.9改变参数R3的波形变化(8)改变R4值。

naoh和khs反应-回复NaOH和KHS反应,化学式为NaOH + KHS →NaSH + KOH。
一、介绍NaOH和KHS反应NaOH,全称为氢氧化钠,是一种强碱,广泛应用于化学实验和工业生产中。
KHS,全称为硫代硫酸钾,是一种硫酸酯,通常用于邻硫醇保护试剂。
NaOH和KHS反应是一种酸碱中和反应,产生NaSH和KOH。
NaSH是一种硫化钠化合物,KOH是一种氢氧化钾化合物。
二、反应机理NaOH是一种强碱,KHS是一种氢硫酸盐。
在反应中,NaOH的氢氧根离子(OH-)会与KHS中的氢硫酸盐的氢离子(H+)发生反应。
化学方程式为:NaOH + KHS →NaSH + KOH在反应中,NaOH提供了氢氧根离子(OH-),KHS提供了氢离子(H+)。
氢氧根离子(OH-)与氢离子(H+)结合形成水分子(H2O),同时产生NaSH和KOH。
三、实验步骤以下是进行NaOH和KHS反应的实验步骤:1. 准备实验所需的试剂和设备,包括NaOH固体、KHS固体、蒸馏水、反应容器、玻璃杯、搅拌棒等。
2. 将一定质量的NaOH固体称量到一个玻璃杯中。
3. 将一定质量的KHS固体称量到另一个玻璃杯中。
4. 将一定容积的蒸馏水加入到NaOH固体所在的玻璃杯中,用搅拌棒搅拌均匀,直到NaOH溶解。
5. 将NaOH溶液缓慢倒入KHS固体所在的玻璃杯中,同时用搅拌棒搅拌均匀。
6. 观察反应混合物的变化,注意观察有无气体产生、溶液颜色变化等。
7. 静置一段时间,等待反应结束。
8. 过滤产物,得到固体产物NaSH和KOH。
9. 对固体产物进行干燥,可以使用低温烘箱或者气流干燥器。
10. 称量固体产物的质量,并记录结果。
四、反应结果通过此实验,我们可以得到固体产物NaSH和KOH。
NaSH是一种白色或淡黄色的固体物质,它具有强烈的恶臭气味。
KOH是一种白色的固体物质,常用于实验室和工业生产中。
五、应用和意义NaOH和KHS反应在实验和工业上有着重要的应用和意义。
hoffman反应机理Hoffman反应机理引言:Hoffman反应是一种重要的有机合成反应,常用于合成氨基酸和醇胺等化合物。
该反应以底物的氨基取代基为起始,通过重排反应将其转化为对应的胺化合物。
本文将详细介绍Hoffman反应的机理及其应用。
一、Hoffman反应的机理Hoffman反应的机理主要涉及两个关键步骤:底物的氨基取代基的脱离和氨基重排。
1. 底物的氨基取代基的脱离Hoffman反应一般以氯化胺为底物,首先经过亲核取代反应,底物的氨基取代基(通常是氯或溴原子)会被亲核试剂(如氢氧化钠或氢氧化钾)攻击,从而脱离出底物,形成相应的亲核试剂盐。
2. 氨基重排脱离的氨基取代基会发生重排反应。
这个过程中,氨基的位置会发生改变,通常是通过中间产物的环化、开环或重排等方式实现。
重排反应的具体机理取决于底物的结构和反应条件,常见的机理包括Hofmann消除、Hofmann重排和Hofmann交换等。
二、Hoffman反应的应用Hoffman反应在有机合成中有着广泛的应用。
以下是一些典型的应用示例:1. 氨基酸的合成Hoffman反应可以用于合成氨基酸。
通过选择合适的底物和反应条件,可以将底物中的氨基取代基脱离并发生重排,从而得到目标氨基酸。
2. 醇胺的合成Hoffman反应也可以用于合成醇胺。
通过选择适当的底物和反应条件,可以将底物中的氨基取代基脱离并发生重排,最终得到目标醇胺。
3. 药物合成Hoffman反应在药物合成中也有广泛的应用。
例如,一些抗癌药物的合成中常常涉及到氨基取代基的脱离和重排,Hoffman反应可以有效地实现这些步骤,从而合成所需的药物。
4. 功能性化合物的合成Hoffman反应还可以用于合成各种具有特定功能的化合物,如配体、催化剂和功能性高分子等。
通过选择不同的底物和反应条件,可以实现底物中特定位置的氨基取代基的脱离和重排,从而引入所需的功能基团。
结论:Hoffman反应是一种重要的有机合成反应,通过底物中氨基取代基的脱离和重排,可以合成各种氨基酸、醇胺和其他功能性化合物。
实验一多种信号音及铃流发生器实验一、实验目的1、了解电话通信中常用的几种音信号和铃流信号的电路组成与产生方法。
2、熟悉这些音信号在传送控制过程中的技术要求和实现方法。
二、预习要求预习有关拨号音,忙音,空号音,捆塞音,回铃音,铃流等有关内容。
三、实验仪器仪表1、程控交换系统实验箱一台2、电话机一台台3、20MHz示波器一台4、万用表一台四、电路工作过程我们知道,在用户话机与电信网的交换机之间的线路上,要沿两上方向传递语言信息。
但是,为了接通一个电话,除了上述情况外,还必须沿两个方向传送所需的控制信号。
比如,当用户想要通话时,必须首先向控制交换机提供一个信号,能让交换机识别并使之准备好有关设备,此外,还要把指明呼叫的目的地的信号(被叫)发往交换机。
当用户想要结束通话时,也必须向电信局交换机提供一个信号,以释放通话期间所使用的设备。
除了用户要向交换机传送信号外,还需要传送相反方向的信号,如交换机要向用户传送关于交换机设备状况,以及被叫用户状态的信号。
由此可见,一个完整的电话通信系统,除了交换系统和传输系统外,还应有信号系统。
下面是本实验系统的传送信号流程,见图1-1所示。
用户向电信局交换机发送的信号有用户状态信号(一般为直流信号)和号码信号(址址信号),它们的详细说明分别见实验二和实验三。
交换机向用户发送的信号有各种可闻信号与振铃信号(铃流)两种方式。
a、各种可闻信号:一般采用频率为450Hz的交流信号,例如:拨号音:(Dial tone)连续发送的信号。
回铃音:(Ringing tone)1秒送,4秒断的5秒断续信号,与振铃一致。
忙音:(busy tone)0.35秒送,0.35秒断的0.7秒断续信号。
空号音:0.6秒送,0.2秒断,0.2秒送,0.2秒断,0.2秒送,0.6秒断的2秒不等间隔断续信号。
拥塞音:0.7秒送,0.7秒断的1.4秒断续信号。
b、振铃信号(铃流):一般采用频率为25Hz,幅度为75V±15V的交流电压,以1秒送,4秒断的5秒断续方式发送。
第26讲弱电解质的电离平衡考纲要求 1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.理解弱电解质在水中的电离平衡,能利用电离平衡常数(K a、K b)进行相关计算。
考点一弱电解质的电离平衡1.弱电解质(1)概念(2)与化合物类型的关系强电解质主要是大部分离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
2.弱电解质的电离概念(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的建立与特征①开始时,v(电离)最大,而v(结合)为0。
②平衡的建立过程中,v(电离)>v(结合)。
③当v(电离)=v(结合)时,电离过程达到平衡状态。
3.外因对电离平衡的影响(1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电离。
(2)温度:温度越高,电离程度越大。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
(4)化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
(1)强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子(√)(2)氨气溶于水,当NH3·H2O电离出的c(OH-)=c(NH+4)时,表明NH3·H2O电离处于平衡状态(×)(3)室温下,由0.1 mol·L-1一元碱BOH的pH=10,可知溶液中存在BOH===B++OH-(×)(4)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大(×)(5)稀释弱电解质溶液时,所有粒子浓度都一定会减小(×)(6)电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡(×)解析(2)NH3+H2O NH3·H2O NH+4+OH-,NH3·H2O电离出的c(OH-)与c(NH+4)永远相等,不能表明NH3·H2O电离处于平衡状态。
进口氢氧氮分析仪原理
进口氢氧氮分析仪的主要原理是根据气体的激发灯的发射光的强度来分析不同组分气体的浓度。
激发灯采用电离发射镧灯,向气体发射高能的电离辐射。
当电离辐射被气体吸收时,气体产生产生电子激发和发射出各种波长的光子,其中水分子的激发发射的波长是420nm的紫外线,强度被用来测量水分子含量;碳氢化物的激发发射的波长是366nm的紫外线,强度被用来测量碳氢化物含量;氮气的激发发射的波长是227nm的紫外线,强度被用来测量氮气含量;氧气的激发发射的波长是760nm的紫外线,强度被用来测量氧气含量。
将激发发射的光信号由探头直接传输到主控电路中,放大和处理并显示,它就是进口氢氧氮分析仪的原理。