铬副族元素和锰副族元素
- 格式:ppt
- 大小:2.20 MB
- 文档页数:176

无机化合物颜色表(彩色版)含部分元素化合物常温下物态、颜色、形态等物理化学性质(字体颜色仅供参考和方便记忆,标准颜色还请参照实物。
白色和无色均以标准字体表示,黑色表示为加粗体)卤族(英VIIA):Solid:I2紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3橙;I2O5白; I2O4黄(离子晶体);I4O9黄(离子晶体).Liquid:Br2红棕;BrF3浅黄绿;IBr3棕;Cl2O6暗红;Cl2O7无色油状;HClO4无色粘稠状;(SCN)2黄色油状.Gas:F2浅黄;(CN)2无色;Cl2黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2黄色;Br2O 深棕;(SCN)n 砖红色固体.氧族(英VIA):Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;CuS 黑↓;Na2S2O3白;Na2S2O4白; SeO2白,易挥发;SeBr2红;SeBr4黄;TeO2白加热变黄;H2TeO3白;TeBr2棕;TeBr4橙;TeI4 灰黑;PoO2低温黄(面心立方),高温红(四方);SO3无色;SeO3无色易潮解;TeO3橙色;H6TeO6无色.Liquid:H2O 无色;纯H2O2淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4无色油状;SO32-(aq) 无色;SO42-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红.Gas:O2无色;O3低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2无色;H2Se 无色;H2Te 无色.卤化硫(未注明者均为无色):Liquid:SF6;S2F10;SCl4淡黄;SCl2樱桃红;S2Cl2 金黄色;S2Br2红.Gas:SF4;SF2;S2F2.卤砜、卤化亚砜、卤磺酸:Liquid:SOCl2白色透明;SO2Cl2无色发烟.氮族(英VA):Solid:铵盐无色晶体;氮化金属白;N2O3蓝色(低温);N2O5白;P 白,红,黑;P2O3白;P2O5白;PBr3黄;PI3红;PCl5无色;P4S x黄;P2S3灰黄;P2S5淡黄;H4P2O7无色玻璃状;H3PO2白;As 灰;As2O3白;As2O5白;AsI3红;As4S4红(雄黄);As4S6黄(雌黄);As2S5淡黄;Sb 银白;Sb(OH)3白↓;Sb2O3白(锑白,颜料);Sb2O5淡黄;SbX3(X<>I) 白;SbI3红;Sb2S3橘红↓;Sb2S5橙黄;Bi 银白略显红;Bi2O3淡黄;Bi2O5红棕;BiF3灰白;BiCl3白;BiBr3黄;BiI3黑↓;Bi2S3棕黑.Liquid:N2H4无色;HN3无色;NH2OH 无色;发烟硝酸红棕;NO3-无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3无色;纯H3PO4无色粘稠状;AsX3(X<>I) 无色;.Gas:N2无色;NH3无色;N2O 无色甜味;NO 无色;NO2红棕;PH3无色;P2H6无色;AsH3无色;SbH3无色;BiH3无色.卤化氮(未注明者均为无色):Solid:NBr3•(NH3)6紫,爆炸性;NI3•(NH3)6黑,爆炸性;Liquid:NCl3;无色Gas:NF3;无色碳族(英IVA):Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2无色透明;H2SiO3无色透明胶状↓;Na2SiF6白晶;GeO 黑;GeO2白;SnO 黑;SnO2白;Sn(OH)2白↓;PbO黄或黄红;Pb2O3橙;Pb3O4红;PbO2棕;CBr4淡黄;CI4淡红;GeI2橙;GeBr2黄;GeF4白;GeBr4灰白;GeI4黄;SnF2白;SnCl2白;SnBr2淡黄;SnI2橙;SnF4白;SnBr4无色;SnI4红;PbF2无色↓;PbCl2白↓;PbBr2白;PbI2金黄;PbF4无色;GeS 红;GeS2白;SnS 棕↓;SnS2金黄(俗称“金粉”)↓;PbS 黑↓;PbS2红褐;Pb(NO3)2无色;Pb(Ac)2•H2O 无色晶体;PbSO4白↓;PbCO3白↓;Pb(OH)2白↓;Pb3(CO3)2(OH)2铅白↓;PbCrO4亮黄↓.Liquid:CCl4无色;CS2无色;GeCl4无色;SnCl4无色;PbCl4无色.Gas:CO CO2 CH4 CF4 SiF4 SiH4均为无色.硼族(英IIIA):Solid:B(无定型) 棕色粉末;B(晶体) 黑灰;Al 银白;Ga 银白(易液化);In 银灰;Tl 银灰;B2O3玻璃状;H3BO3无色片状;BN 白;Na2B4O7•10H2O 白色晶体;Cu(BO2)2蓝↓;Ni(BO2)2绿↓;NaBO2•Co(BO2)2蓝↓;NaBO2•H2O 无色晶体;无水NaBO2黄晶;Al2O3白晶;AlF3无色;AlCl3白;AlBr3白;AlI3 棕;Al(OH)3白↓;Ga2O3白↓Ga(OH)3白↓;GaBr3白;GaI3黄;In2O3黄;InBr3白;InI3黄;TlOH 黄;Tl2O 黑;Tl2O3棕黑;TlCl 白↓;TlBr 浅黄↓;TlI 黄↓(与银相似);TlBr3黄;TlI3黑.Liquid:BCl3无色发烟.Gas:硼烷无色;BF3无色(有窒息气味).碱土(英IIA):单质:银白焰色:Ca 砖红;Sr 洋红;Ba 绿.氧化物:均为白色固体.氢氧化物:白色固体 Be(OH)2↓,Mg(OH)2↓.盐:多为无色或白色晶体;BeCl2浅黄;BaCrO4黄↓;CaF2白↓.碱金属(英IA):单质:银白焰色:Li 红;Na 黄;K 紫;Rb 紫红;Cs 紫红.氧化物、过氧化物、超氧化物、臭氧化物:Li2O 白;Na2O 白;K2O 淡黄;Rb2O 亮黄;Cs2O 橙红;Na2O2淡黄;KO2橙黄;RbO2深棕;CsO2深黄;KO3橘红.氢氧化物:白色,LiOH白↓.盐:多为无色或白色晶体且易溶于水.不溶盐↓(未注明者皆为白色晶体):LiF Li2CO3Li3PO4LiKFeIO6Na[Sb(OH)6] NaZn(UO2)3(Ac)9•H2O 黄绿;M=K,Rb,Cs M3[Co(NO2)6] 亮黄;MBPh4 MClO4M2PtCl6淡黄;CsAuCl4.铜副族(英IB):单质:Cu 紫红或暗红;Ag 银白;Au 金黄.铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr黄↓;CuI 棕黄↓;CuCN 白↓;Cu2O 暗红;Cu2S 黑;CuF2白;CuCl2棕黄(溶液黄绿);CuBr2棕;Cu(CN)2棕黄;CuO 黑↓;CuS黑↓;CuSO4无色;CuSO4•H2O 蓝;Cu(OH)2淡蓝↓;Cu(OH)2•CuCO3墨绿;[Cu(H2O)4]2+蓝;[Cu(OH)4]2-蓝紫;[Cu(NH3)4]2+深蓝;[CuCl4]2-黄;[Cu(en)2]2+深蓝紫;Cu2[Fe(CN)6] 棕红;炔铜红↓.银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6] 白↓;Ag3[Fe(CN)6] 白↓;Ag+,[Ag(NH3)2]+,[Ag(S2O3)2]3-,[Ag(CN)2]-无色.金化合物:HAuCl4•H2O 亮黄晶体;KAuCl4•.5H2O 无色片状晶体;Au2O3黑;H[Au(NO3)4]•H2O 黄色晶体;AuBr 灰黄↓;AuI 柠檬黄↓.锌副族(英IIB):单质:均为银白,Hg在水溶液中的沉淀为黑色.锌化合物:ZnO 白(锌白颜料)↓;ZnI2无色;ZnS 白↓;ZnCl2白色晶体(溶解度极大,水溶液酸性);K3Zn3[Fe(CN)6] 白;Zn3[Fe(CN)6]2黄褐.镉化合物:CdO 棕灰↓;CdI2黄;CdS 黄(镉黄颜料)↓;HgCl2(升汞) 白色;HgNH2Cl 白↓;Hg2Cl2(甘汞)白↓.汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2红或黄(微溶);HgS 黑或红↓;Hg2NI•2O 红↓(奈斯勒试剂);Hg2(NO3)2无色晶体.ZnS荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钪副族(英IIIB):略.钛副族(英IVB):钛化合物:Ti3+紫红; [TiO(H2O2)2]2+橘黄;H2TiO3白色↓;TiO2白(钛白颜料)或桃红(金红石)↓;(NH4)2TiCl6黄色晶体;[Ti(H2O)6]Cl3紫色晶体;[Ti(H2O)5Cl]Cl2•2O 绿色晶体;TiCl4无色发烟液体.锆、铪:MO2,MCl4白.钒副族(英VB):钒化合物:V2+紫;V3+绿;VO2+蓝;V(OH)4- 黄;VO43-黄;VO 黑;V2O3灰黑;V2S3棕黑;VO2蓝色固体;VF4绿色固体;VCl4暗棕色液体;VBr4洋红色液体;V2O5黄或砖红;水合V2O5棕红;饱和V2O5溶液(微溶) 淡黄;[VO2(O2)2]3- 黄;[V(O2)3]3-红棕.钒酸根缩聚:随着钒氧原子数之比的减少的,由浅黄~深红~淡黄.铌、钽:略.铬副族(英VIB):铬化合物:Cr2+蓝;Cr3+紫;Cr2O72-橙红;CrO42-黄;Cr(OH)4-亮绿;Cr(OH)3灰蓝;Cr2O3绿;CrO3暗红色针状;[CrO(O2)2]OEt2蓝;CrO2Cl2深红色液体;Na2Cr2O7,K2CrO7 橙红;Ag2CrO4砖红↓;BaCrO4黄↓;PbCrO4黄↓.紫红Cr2(SO4)3•8H2O——〉绿色Cr2(SO4)3•H2O——〉桃红Cr2(SO4)3暗绿[Cr(H2O)4Cl2]Cl—冷却HCl—〉紫色[Cr(H2O)6]Cl3—〉乙醚HCl —〉淡绿[Cr(H2O)5Cl]Cl2[Cr(H2O)6]3+紫;[Cr(H2O)4(NH3)2]3+紫红;[Cr(H2O)3(NH3)3]3+浅红;[Cr(H2O)2(NH3)4]3+橙红;[Cr(NH3)5H2O]3+橙黄;[Cr(NH3)6]3+黄.钼、钨:MoO3白;棕色MoCl3;绿色MoCl5;MoS3棕色↓;(NH4)3[P(Mo12O40)]•H2O 黄色晶状↓;WO3深黄;H2WO4•H2O 白色胶体.锰副族(英VIIB):锰化合物:Mn2+肉红;Mn3+紫红;MnO42-绿;MnO4-紫;MnO3+亮绿;Mn(OH)2白↓;MnO(OH)2棕↓;MnO2黑↓;无水锰盐(MnSO4) 白色晶体;六水合锰盐(MnX2•H2O, X=卤素,NO3,ClO4) 粉红;MnS•H2O 肉红↓;无水MnS 深绿;MnCO3白↓;Mn3(PO4)2白↓;KMnO4紫红;K2MnO4绿;K2[MnF6] 金黄色晶体;Mn2O7棕色油状液体.锝、铼:略.铁系(第四周期VIII族):铁化合物:Fe2+浅绿;[Fe(H2O)6]3+浅紫;[Fe(OH)(H2O)5]2+黄;FeO42-紫红;FeO 黑;Fe2O3 暗红;Fe(OH)2白↓;Fe(OH)3棕红↓;FeCl3棕红晶体;无水FeSO4白;FeSO4•H2O 绿;K4[Fe(CN)6](黄血盐)黄色晶体;K3[Fe(CN)6](赤血盐) 红色晶体;Fe2[Fe(CN)6] 普鲁士蓝↓;Fe[Fe(CN)6] 黑↓;Fe(C5H5)2(二茂铁) 橙黄色晶体;M2Fe6(SO4)4(OH)12(黄铁矾,M=NH4,Na,K) 浅黄色晶体;Fe(CO)5黄色液体.钴化合物:Co2+粉红;CoO 灰绿;Co3O4黑;Co(OH)3棕↓;Co(OH)2粉红↓;Co(CN)2红;K4[Co(CN)6]紫色晶体;Co2(CO)8黄色晶体;[Co(SCN)6]4-紫;氯化钴脱水变色:粉红CoCl2•H2O—325K—〉紫红CoCl2•H2O—3l3K—〉蓝紫CoCl2•H2O—393K—〉蓝CoCl2. 镍化合物:Ni2+亮绿;[Ni(NH3)6]2+紫;Ni(OH)2绿↓;Ni(OH)3黑↓;无水Ni(II)盐黄;Na2[Ni(CN)4]黄;K2[Ni(CN)4] 橙;Ni(CO)4无色液体.铂系元素(第五、六周期VIII族):Os 蓝灰色易挥发固体;Pd↓(aq) 黑;OsO4无色有特殊气味气体;H2PtCl6橙红色晶体;Na2PtCl6橙黄色晶体;M2PtCl6(M=K,Rb,Cs,NH4) 黄色↓.镧系锕系元素:暂无.稀有气体元素:单质:He、Ne、Ar、Kr、Xe、Rn 无色,微溶于水;氪化合物:KrF2无色,25℃分解;氙化合物:XeF2,XeF4,XeF6无色,熔沸点依次降低;XeOF4,XeO2F2,XeO2无色;XeO3黄色,0℃爆炸;氙-金属配合物:XeF[RuF6],[Xe2F3][AsF6],XeF3[SbF6],XeF3[Sb2F11] 黄绿色固;XeF[Sb2F11]黄;XeF5[AsF6] 白固;XeF5[RuF6] 绿固原版作者佚名Fly.Ai修订排版修订主要参考资料高教版《无机化学下册》如有疏漏,请联系**********************************************。

无机颜色表(含部分元素化合物常温下物态、颜色、形态等物理化学性质)卤族(英VIIA):Solid : I2 紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICI 3 橙;12Q 白;I 2。
黄(离子晶体);I 4。
9黄(离子晶体).Liquid : Br2红棕;BrF s浅黄绿;IBr 3棕;CI2C6暗红;CI2O无色油状;H CIO无色粘稠状;(SCN)2黄色油状.Gas : F2 浅黄;(CN)2 无色;CI2 黄绿;l2(g)紫;BrF 红棕;BrCI 红;CI2 O黄红;CIO2黄色;Br2O深棕;(SCN)n砖红色固体.氧族(英VIA):Solid : S淡黄;Se灰,褐;Te无色金属光泽;Na2S,(NH)2SKS,BaS白, 可溶;ZnS 白J; MnS肉红J; FeS 黑J; PbS 黑J; CdS 黄J; Sb$ 橘红SnS褐色J; HgS黑(沉淀),红(朱砂);Ag2S黑J; CuS黑J; NaSO白;Na S2Q白;SeO2白,易挥发;SeBr2红;SeBr4黄;TeQ白(加热变黄);HTeO白;TeBr2棕;TeBr4橙;Teh灰黑;PoO低温黄(面心立方),高温红(四方);SO 无色;SeO无色易潮解;TeO橙色;H b TeO无色.Liquid : H2O无色;纯HQ淡蓝色粘稠;CrO(Q)2(aq)蓝;纯"SO无色油状;SO2-(aq)无色;SO2-(aq)无色;SeO(l)橙;TeO(l)深红.Gas : Q无色;O低浓度无色,高浓度淡蓝(鱼腥味);S2(g)黄,上浅下深;H 2S无色;SO无色;H?Se无色;H?Te无色.卤化硫(未注明者均为无色):Liquid : SF5,S2F IO,SCI4淡黄;SCI2 红;SCb 无色;S2BH 红.Gas : SF 4 ; SF2 ; S 2F2 .Liquid : SOC2白色透明;SOCb无色发烟.氮族(央VA):SoIid :铵盐无色晶体;氮化金属白;蓝色(低温);NO白;P白,红,黑;P2Q 白;P2Q 白;PBr3 黄;PI3 红;PCI5 无色;P4S x 黄;P2S3 灰黄;P2S5 淡黄;HRO 无色玻璃状;HPO白;As灰;AS2C3白;A&Q白;Ash红;As4 S4红(雄黄);A&S黄(雌黄);AsS淡黄;Sb银白;Sb(OH)B白J;SbO 白(锑白,颜料);SbQ淡黄;SbX3(X<>I)白;Sbb红;SbS橘红J; SbS橙黄;B i银白略显红;Bi2Q淡黄;Bi2Q红棕;BiF3灰白;BiCI 3白;BiBr3黄;BiI 3 黑J; Bi2S3棕黑.Liquid : NH 无色;HN无色;NHOH无色;发烟硝酸红棕;NO-(I )无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液)蓝;PX无色;纯HPQ无色粘稠状;AsX3(X<>I)无色;.Gas : 2无色;NH无色;MO无色甜味;NO无色;NO红棕;PH无色;R Hs无色;AsH无色;SbH无色;BiH3无色.卤化氮(未注明者均为无色):SoIid : NBr3?(NH)6 紫,爆炸性;Nl3?(Nf)6 黑,爆炸性;Liquid : NCb;无色Gas : NF 3;无色碳族(英IVA):Solid :C(金刚石)无色透明;C(石墨)黑色金属光泽;Si灰黑色金属光泽;Ge灰白;Sn银白;Pb暗灰;Si02无色透明;H2SiO3无色透明胶状J; Na2Si F6白晶;GeO黑;GeO2白;SnO黑;SnO白;Sn(OH》白J;PbO黄或黄红;PbO 橙;PbO 红;PbO 棕;CBr4 淡黄;CI4 淡红;Geb 橙;GeBi2 黄;GeF 白;GeBr4 灰白;Geb 黄;SnE 白;SnCI2 白;SnBr2 淡黄;Sn"橙;SnR 白;SnBr4 无色;SnI4 红;PbE 无色J;PbCb 白J;PbBr2 白;Pbb 金黄;PbR 无色;GeS红;GeS白;SnS棕J; SnS金黄(俗称“金粉”)J; PbS黑J; PbS 红褐;Pb(NO)2 无色;Pb(Ac)2?3HO 无色晶体;PbSO 白J; PbCO 白J; Pb(OH) 白J; Pb(CQ)2(OH)2 铅白J; PbCrQ亮黄J.Liquid : CCb无色;CS无色;GeC4无色;SnCI4无色;PbCb无色.Gas : CO COCI4 CF4 SiF 4 SiH 4 均为无色.硼族(英IIIA) : Solid : B(无定型)棕色粉末;B(晶体)黑灰;AI银白;G a 银白(易液化);In银灰;TI银灰;BO 玻璃状;HBO无色片状;BN白;NaBOPIOHO 白色晶体;Cu(BO)2 蓝J; Ni(BO2)2 绿J; NaBO2?Co(BO2)2蓝J; NaBO2?4H2Oc色晶体;无水NaBO2黄晶;AI2O3白晶;AIF3无色;AICI 3白;AIBr3 白;AII 3 棕;AI(OH)3 白J; GaO 白J; Ga(OH)3 白J; GaBr3 白;GaI 3 黄;"2Q 黄;InBz 白;Ini 3 黄;TIOH 黄;TI2O 黑;TI2O 棕黑;TICI 白J;TIBr浅黄J; TII黄J (与银相似);TIBr3黄;TII 3黑.Liquid : BCb无色发烟.Gas :硼烷无色;BF3无色(有窒息气味).碱土(英IIA):单质:银白焰色:Ca砖红;Sr洋红;Ba绿.氧化物:均为白色固体.氢氧化物:白色固体Be(OH)2J ,Mg(OH)2J.盐:多为无色或白色晶体;BeCI2浅黄;BaCrQ黄J;CaF白J.碱金属(英IA): 单质:银白焰色:Li红;Na黄;K紫;Rb紫红;Cs紫红.氧化物、过氧化物、超氧化物、臭氧化物:Li 2O白;NaO白;K2O淡黄;Rb2O亮黄;CsO橙红;NaO2淡黄;KO橙黄;RbO深棕;CsO深黄;KO橘红.氢氧化物:白色,LiOH白J.盐:多为无色或白色晶体且易溶于水.不溶盐J (未注明者皆为白色晶体):L iF Li 2CO Li 3PQ LiKFeIO 6 Na[Sb(OH) 6 NaZn(UO2) 3(Ac) 9?6HO 黄绿;M=K,Rb,Cs M[C O(NQ)6]亮黄;MBPhMCIQ M2PQI6 淡黄;CsAuC4.铜副族(英IB): 单质:Cu紫红或暗红;Ag银白;Au金黄.铜化合物:焰色绿;CuF红;CuCI白J; CuBr 黄J; CuI棕黄J; CuCN 白J ; Cu2O 暗红;Ci2S黑;CuF白;CuCb棕黄(溶液黄绿);CuBr^棕;Cu(C N)2 棕黄;CuO 黑J; CuS黑J; CuSO无色;CuSO?5HO 蓝;Cu(OH)淡蓝J;2+ 2 2+Cu(OHy?CuCO 墨绿;[C U(H2O)4]蓝;[Cu(OH)4]-蓝紫;[C U(NH3)4]深蓝;[C uCh]2-黄;[Cu(en) 2]2+深蓝紫;Cs[Fe(CN)6]棕红;炔铜红J.银化合物:AgOH 白(常温分解);AgO 黑;新制AgOH 棕黄(混有AgO);蛋白 银(AgNO 滴手上)黑J; AgF 白;AgCl 白J; AgBr 淡黄J; AgI 黄J (胶体); AgS 黑J; Ag[Fe(CN)习 白 J; Ag[Fe(CN)6〕白 J; Ag + ,[Ag(NH 3)2]+ ,[Ag(S 2Q) 2]3- ,[Ag(CN) 2]-无色.金化合物:HAuC 4?3HO 亮黄晶体;KAuC 4?1.5H 2O 无色片状晶体;AuO 黑; H[Au(NO) 4]?3H 2O 黄色晶体;AuBr 灰黄J; AuI 柠檬黄J.锌副族(I 英IB):单质:均为银白,Hg 在水溶液中的沉淀为黑色.锌化合物:ZnO 白(锌白颜料)J; Zn I 2无色;ZnS 白J; Zn CI 2白色晶体(溶 解度极大,水溶液酸性);KZn a [Fe(CN) 6]白;Zn 3【Fe(CN )6] 2黄褐.镉化合物:CdO 棕灰J; Cdl 2 黄; CdS 黄(镉黄颜料)J; HgC b (升汞)白色; HgNbCl 白J ; HgCb(甘汞)白J.汞化合物:HgO 红(大晶粒)或黄(小晶粒)J; HgI 2红或黄(微溶);HgS 黑 或红J; HgNI?H 2O 红J; Hg(NQ)2无色晶体.ZnS 荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钪副族(英IIIB):略.钛副族(英IVB):钛化合物:Ti 3+紫红;[TiO(H 2Q)2] 2+橘黄;HTiO s 白色J; TiO ?白(钛白 颜料)或桃红(金红石)J; (NH )2TiCl 6黄色晶体;[Ti(H 2O )6]CI 3紫色晶体;[Ti (H 2O )5CI]CI 2?HO 绿色晶体;TiCI 4无色发烟液体.锆、铪:MOMCh 白. 钒副族(英VB):钒化合物:V ”紫;L 绿;vO + 蓝;V(OH )4-黄;VO 3-黄;VO 黑;VO 灰 黑;MS 棕黑;VO 蓝色固体;VR 绿色固体;VCb 暗棕色液体;VBr 4洋红色液 体; V 2O 黄或砖红;水合VO 棕红;饱和V 2O 溶液(微溶)淡黄;[VQ(O 2)2]3- 黄; [V(O 2)3]3-红棕. 钒酸根缩聚:随着钒氧原子数之比的减少的,由浅黄一 深红一淡黄•铌、钽:略•铬副族(英VIB):铬化合物:Cr 2+ 蓝;Cr 3+ 紫;WO 2-橙红;CrO 42-黄;Cr(OH )4 亮绿;Cr(O H )3灰蓝;C 2O 绿;CrQ 暗红色针状;[CrO(O 2)2]OEt 2蓝;CrQCL 深红色液体; NaCwOK z CrQ 橙红;AgCrQ 砖红J; BaCrO 黄J ; PbCrQ 黄J .紫红 Cr 2(SQ )3 ?18HO ;绿色Cr 2(SO )3?6HO;桃红 Cr 2(SO )3;暗绿[Cr(H 2O )4Cl 2]CI ;紫色[Cr(H2O )6]CI 3;淡绿[Cr(H 2O)s CI]CI 2; [Cr(H 2O )6]3+ 紫;[Cr(H 2O )4(NH )2]3+ 紫红;[Cr(H26]钼、钨:MoO 白;棕色 MoC 3;绿色 MoC 5; MoS 棕色J; (NH4)3[P(Mo i2Oo )]?6H 2O 黄色晶状J; WO 深黄;"WdxfO 白色胶体.锰副族(英VIIB):锰化合物:Mn +肉红;Mn +紫红;MnO 绿;MnO 紫;MnO 亮绿;Mn(OH) 2白J; Mn O(OH)棕J; MnO 黑无水锰盐(MnSG)白色晶体;六水合锰盐(M n%?6HO, X=卤素,NQ,CIO" 粉红;MnS?niO 肉红J;无水 MnS 深绿;MnCO 白 J ; Mn(PO )2白J ; O)3(NH3)3]3+ 浅红;[Cr(H2O)2(NH3)4] 橙红;[Cr(NH3)5H2O]3+ 橙黄;[Cr(NH 3)KMnO紫红;KMnO绿;K2[MnF]金黄色晶体;MnO棕色油状液体•锝、铼:略.铁系(第四周期VHI族):铁化合物:Fe2+浅绿;[Fe(H2O)6]3+浅紫;[Fe(OH)(H2O)5]2+黄;FeQ2-紫红;FeO黑;F Q Q暗红;Fe(OH)2白J; Fe(OH)a棕红J; FeCb棕红晶体;无水F eSQ 白;FeSO?7HO 绿;K^[Fe(CN) 6](黄血盐)黄色晶体;K3[Fe(CN) 6](赤血盐)红色晶体;Fe2[Fe(CN)6]普鲁士蓝J;Fe[Fe(CN)6]黑J;Fe(C s H5)2(二茂铁)橙黄色晶体;MFe6(SO) 4(OH)i2(黄铁矶,M=NH,Na,K)浅黄色晶体;Fe(CO)5黄色液体•钻化合物:CcT粉红;CoO灰绿;C Q Q黑;Co(OH) 棕J; Co(OH»粉红J;Co(CN"红;&[C O(CN)6]紫色晶体;C Q(CO)8黄色晶体;[C O(SCN)6]4-紫;氯化钻脱水变色:粉红CoCl2?6HO(325K);紫红CoCl2?2HO(3l3K);蓝紫CoCl2?HO(393K);蓝CoCl2.镍化合物:Ni2+亮绿;[Ni(NH3)6]2+紫;Ni(OH)2 绿J;Ni(OH)3 黑J;无水Ni(II) 盐黄;Na[Ni(CN) 4]黄;K^[Ni(CN) 4]橙;Ni(CO)4 无色液体.铂系元素(第五、六周期VHI族):Os 蓝灰色易挥发固体;PdJ (aq)黑;OsQ无色有特殊气味气体;HPtCl 6 橙红色晶体;NaPtCb橙黄色晶体;MPtCI 6(M=K,Rb,Cs,NH)黄色J.镧系锕系元素:暂无.稀有气体元素:单质:He 氪化合物:Ne Ar、Kr、Xe、Rn无色,微溶于水;KrF2无色,25 E分解;氙化合物:XeF,XeF4,XeF6无色,熔沸点依次降低;XeO^XeO^XeQ无色;XeO黄色,0C爆炸;氙-金属配合物:XeF[RuF^],[Xe 2F3][AsF 6],XeF 3[SbF6],XeF 3[Sb2F ii]黄绿色固;XeF[SbF ii]黄;Xe辰[A S F6]白固;Xe辰[RuF e]绿固。








元素周期表相关知识点元素周期表相关知识点我们从初三开始接触化学,第一个知识就是元素周期表的学习,以下是店铺为大家准备好的元素周期表相关知识点,欢迎大家阅读参考!元素周期表相关知识点篇1元素周期表共分18纵行,其中第1、2、13、14、15、16、17七个纵行依次为ⅠA族、ⅡA族、ⅢA族、ⅣA族、ⅤA族、ⅥA族、ⅦA族(纵行序号的个位数与主族序数相等);第3、4、5、6、7、11、12七个纵行依次为ⅢB族、ⅣB族、ⅤB族、ⅥB族、ⅦB族、ⅠB族、ⅡB族(纵行序号个位数与副族序数相等);第8、9、10三个纵行为合称为Ⅷ族;第18纵行称为0族。
ⅠA族称为碱金属元素(氢除外);ⅡA族称为碱土金属元素;ⅢA族称为铝族元素;ⅣA族称为碳族元素;ⅤA族称为氮族元素;ⅥA族称为氧族元素;ⅦA族称为卤族元素。
元素周期表共有七个横行,称为七个周期,其中第一(2种元素)、二(8种元素)、三(8种元素)周期为短周期(只有主族元素);第四(18种元素)、五(18种元素)、六(32种元素)周期为长周期(既有主族元素,又有过渡元素);第七周期(目前已排26种元素)为不完全周期。
在元素周期表中,越在左下部的元素,其金属性越强;越在右上部的元素(惰性气体除外),其非金属性越强。
金属性最强的稳定性元素是铯,非金属性最强的元素是氟。
在元素周期表中位于金属与非金属分界处的金属元素,其氧化物或氢氧化物一般具有两性,如Be、Al等。
主族元素的价电子是指其最外层电子;过渡元素的价电子是指其最外层电子和次外层的部分电子;镧系、锕系元素的价电子是指其最外层电子和倒数第三层的部分电子。
在目前的112种元素中,只有22种非金属元素(包括6种稀有气体元素),其余90种都是金属元素;过渡元素全部是金属元素。
在元素周期表中,位置靠近的元素性质相近。
一般在周期表的右上部的元素用于合成新农药;金属与非金属分界处的元素用于制造半导体材料;过渡元素用于制造催化剂和耐高温、耐腐蚀的合金材料等等。
副族元素性质范文副族元素,也称为过渡元素,是指元素周期表中3d,4d,5d,和6d区的元素,也就是处于d轨道上的元素。
副族元素包括了钪(Sc)、钛(Ti)、钒(V)、铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、铜(Cu)、锌(Zn)、银(Ag)、钯(Pd)、铋(Cd)、铳(In)、锡(Sn)、锑(Sb)、碲(Te)、碘(I)、铼(Re)、铉(Xe)、钨(W)、铅(Pb)、铂(Pt)、金(Au)等共有38个元素。
副族元素的性质具有一定的特点,但也因原子序数增大而出现一定的规律性变化。
下面将从电子结构、化学性质以及物理性质三个方面来介绍副族元素的性质。
1.电子结构特点副族元素的电子结构具有共同的特点,即具有不满的d轨道电子。
副族元素中的第一周期元素钪(Sc)有3个d电子,第二周期的钛(Ti)有2个d电子,第三周期的钒(V)有1个d电子,而第四周期的铬(Cr)则具有4个d电子,以此类推。
这种不满的d轨道电子对化学性质有很大影响。
2.化学性质特点副族元素的化学性质表现出明显的变化规律。
在同一周期内,副族元素的电负性逐渐增加。
例如,钛的电负性较低,而铑的电负性较高。
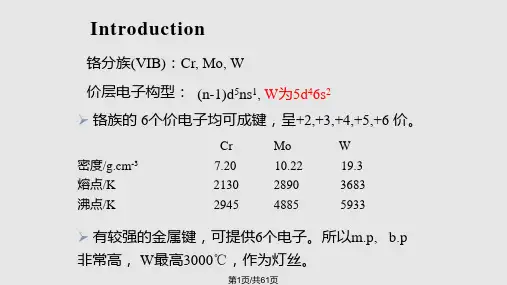
不同副族元素的金属性和非金属性也有差异,有的副族元素主要呈现金属性,如钪、钛、铁等;而有的副族元素则呈现非金属性,如锰、铬、镉等。
此外,副族元素的物理性质与其化学性质有密切关系,如导电性、热导性等。
3.物理性质特点副族元素的物理性质主要表现为熔点和沸点的逐渐增加。
随着原子序数的增加,副族元素的熔点和沸点逐渐增高。
例如,从锌(Zn)到铯(Cs),熔点从419℃升高到281℃;从铜(Cu)到铁(Fe),熔点从1083℃升高到1535℃。
副族元素的密度也呈现出一定的规律性变化,总体上呈现上升趋势。
副族元素性质的变化规律是由于元素的原子结构和元素间的相互作用所决定的。
副族元素的电子结构决定了其化学性质,而原子的大小、电子云的形状、电子排布等则决定了副族元素的物理性质。
硝酸锰(50%溶液)硝酸锰(50%溶液)描述硝酸锰(50%水溶液)-Manganese(II)nitrate 50%water solution分子式:Mn(NO3)2分子量:178.95性状:玫瑰红色单斜晶系结晶。
相对密度1.82.熔点25.8℃。
沸点129.4℃。
易溶于水、微溶于醇。
微酸性,能与水,醇相混溶。
加热析出二氧化锰并放出氧化氮,有氧化性,有腐蚀性,有毒,吸入蒸汽有害。
硫酸钴硫酸钴产品简介分子式:CoSO4·7H2O分子量:281.10性状:带棕黄色的红色结晶体,溶于水和甲醇,微溶于乙醇,空气中容易风化。
用途:用于制造钴盐、油漆催干剂、钴颜料、碱性蓄电池的添加剂及电镀等。
包装:25/750Kg编织袋包装。
氧化钴产品简介分子式:XCo2O3·YCo3O4性状:黑灰色粉末用途:主要用于磁性材料、电子元件材料、硬质合金材料、搪瓷瓷釉、陶瓷瓷彩、玻璃、钴催化剂及其它钴盐氢氧化钴氢氧化钴产品简介氢氧化钴分子式:Co(OH)2分子量:92.94性状:浅红色粉末,比重3.597,溶于酸及铵盐溶液,不溶于水和碱,与有机酸反应生九水硝酸铬描述分子式:Cr(NO3)3·9H2O分子量:400.15性状:紫红色结晶,有潮解性,加热到125.5℃时分解,熔点60℃。
易溶于水,溶于乙醇,丙酮和无机酸。
其水溶液加热时呈绿色,冷却后又迅速变为红紫色。
有腐蚀性,能引起灼伤。
与易燃物品接触能引起燃烧。
硫酸氧钒(医药级,USP28)硫酸氧钒(医药级,USP28)产品简介硫酸氧钒(医药级,USP24,出口级)英文名称:vanadyl sulfate含量(以干基计):97.0%以上,外观为蓝色结晶,溶于水,流动性良好,在湿空气中极易潮解。
氧化铬酸酐氧化铬、铬酸酐产品简介工业铬酸酐:(紫红色片状物)分子式:CrO3比重:2.7(结晶)氧化铬绿产品简介氧化铬绿又名:铬绿、三氧化二铬分子式:Cr2O3分子量:151.99产品性状:本品为六方晶系列或无定形橄榄绿色粉末,有金属光泽。