氨基酸、多肽与蛋白质7年制
- 格式:ppt
- 大小:3.17 MB
- 文档页数:136





蛋白质制备多肽的研究概况摘要:近几年来,众多学者致力于此方面的研究,开发出了多种动植物蛋白资源多肽食品。
多肽具有多种重要的生理功能:营养平衡作用、抗溃疡、抗风湿、类胰岛素作用、降血脂、调节血压、提高免疫、抗菌、抗病毒、抗衰老等作用。
目前利用天然蛋白水解法生产活性肽应用广泛。
本文论述了不同来源的蛋白质水解制备肽的研究应用进展。
关键词:蛋白质;多肽;应用;功能蛋白质是人体必需的营养成分之一,FAO/WHO规定每人每天应摄入蛋白质70~75 g,而我国人民实际摄入量只有65 g,在我国人民的膳食结构中,碳水化合物所占比重较大,而蛋白质所占比重较小,因此开发食品蛋白资源,改善人民膳食结构,提高我国人民蛋白质摄入数量和质量是一项十分紧迫的任务。
将难于被人体吸收的食品蛋白质水解成易于被吸收的多肽是完成上述任务的关键。
多肽具有以下特点。
首先,多肽是信息的使者,可引起多种生理活动和调节生化反应。
其次,生物活性高, 1×l0-7mol/L就可发挥活性。
其三,分子小,结构易于改造,较易人工化学合成。
其四,透过多肽的片断可以深入研究蛋白质的性质,并且为改变和合成新的蛋白质提供基础材料。
多肽功能是多方面的:营养平衡作用、抗溃疡、抗风湿、类胰岛素作用、降血脂、调节血压、提高免疫、抗菌、抗病毒、抗衰老等作用。
由于多肽具有多种重要的生理功能,因此人们一直热衷于多肽的结构和功能研究,研究方法也是层出不穷。
1 蛋白质水解肽的制备蛋白水解方式主要有化学水解和酶水解。
化学水解是利用强酸强碱水解蛋白,虽然简单价廉,但由于反应条件剧烈,生产过程中氨基酸受损严重,L-氨基酸易转化成D-氨基酸,形成氯丙醇等有毒物质,且难以按规定的水解程度控制水解过程,故较少采用;而生物酶水解是在较温和的条件下进行的,能在一定条件下定位水解分裂蛋白质产生特定的肽,且易于控制水解进程,能够较好的满足肽生产的需要。
反应产物与原料蛋白具有相同的氨基酸组成,并具有特殊的理化性能与生理功能,成为蛋白制品的发展方向[1-2]。

多肽到蛋白质发生的变化
多肽到蛋白质发生的变化可以概括为以下几个步骤:
1. 氨基酸连接:多肽和蛋白质都由氨基酸组成,多肽是由少量氨基酸连接而成,而蛋白质则由较长的氨基酸序列连接而成。
在转化过程中,多肽的氨基酸序列会经过蛋白质合成机制中的翻译过程,氨基酸通过肽键连接起来,形成较长的氨基酸序列。
2. 折叠与构象变化:在蛋白质的转化过程中,氨基酸序列会逐渐折叠成特定的三维结构。
这种折叠是由非共价相互作用力(如氢键、离子键、疏水相互作用)和共价连接(如二硫键)共同作用形成的。
折叠后的蛋白质具有特定的构象,这决定了其功能和活性。
3. 翻译后修饰:除了氨基酸连接和折叠外,蛋白质转化过程中还可能发生其他修饰。
这包括翻译后修饰,如磷酸化、醋酸化、甲基化等,以及修饰后的切割,如蛋白质酶的切割。
4. 蛋白质功能:蛋白质的转化不仅仅是指其从多肽到蛋白质的过程,还包括其功能的发挥。
蛋白质的多样性功能基于其特定的氨基酸序列和结构。
蛋白质可以发挥催化酶、抗体、结构支持、传导信号等多种功能。
总之,多肽到蛋白质的转化过程是一个复杂且精确的过程,它涉及多个步骤,包括氨基酸连接、折叠与构象变化、修饰及蛋白质功能的发挥。
这些步骤都对蛋白质的最终结构和功能产生重要影响。


食品与药品 Food and Drug 2011年第13卷第05期 219中国药典2010年版生化药物简介黄思玲1,边 玲2(1. 山东福瑞达生物医药有限公司,山东 济南 250101;2. 山东福瑞达医药集团公司,山东 济南 250101)摘 要:通过学习中国药典2010年版及相关资料,简要介绍中国药典2010年版生化药物情况。
关键词:生化药物;中国药典·药学教育与药典·中国药典2010年版[1]于2010年10月起执行,生化药物包括氨基酸类、多肽与蛋白质类、酶与辅酶类、核酸类、多糖类、脂质类等。
本文在参考其他相关资料[2]的基础上,汇总了各类生化药物中国药典2010年版新增和2005年版收载的原有并保留品种和标准,对2010年版药典新增的品种进行了基本性质、临床用途等方面的说明。
1 氨基酸类氨基酸是组成蛋白质结构的基本单位。
在医药工业中,氨基酸可用于肽及蛋白质的人工合成;多种氨基酸按适当比例配成人体营养液,可用于低蛋白血症等;氨基酸还可用于治疗疾病、维持人体正常发育等[3]。
1.1 品种和标准中国药典2010年版收载氨基酸类药物29个品种,51个标准。
见表1。
1.2 新增品种和标准氨基酸类药物新增品种和标准包括:乙酰谷酰胺(原料、注射液)、谷丙甘氨酸胶囊、胱氨酸片、甲硫氨酸片、乙酰半胱氨酸颗粒。
1.2.1 乙酰谷酰胺 乙酰谷酰胺为谷氨酰胺的乙酰化合物,是一种精神振奋药,有改善神经细胞代谢,维持神经应激能力及降低血氨的作用。
用于脑外伤昏迷、肝昏迷、偏瘫、高位截瘫、小儿麻痹后遗症、神经性头痛等[4]。
收稿日期:2011-04-15作者简介:黄思玲(1981-),女,山东临沂人,工程师,从事生化药物研究 E-mail:huangsl@Introduction to Biochemical Drugs in Chinese Pharmacopoeia 2010 EditionHUANG Si-ling 1, BIAN Ling 2(1. Shandong Freda Biopharm Co., Ltd., Jinan 250101, China; 2. Shandong Freda Pharmaceutical Group Co., Jinan250101, China )Abstract: Make a brief introduction to the biochemical drugs in Chinese Pharmacopoeia (2010 Edition) by studying the pharmacopoeia and pertinent literature.Key Words: biochemical drug; Chinese Pharmacopoeia编号品种名称标 准1牛磺酸原料、片、散剂、颗粒、胶囊、滴眼液2精氨酸原料3盐酸精氨酸原料、片、注射液4色氨酸原料5谷氨酸原料、片、谷氨酸钠注射液、谷氨酸钾注射液6谷氨酸钠原料、谷氨酸钠注射液(与上项谷氨酸钠注射液为同一标准)7组氨酸原料8盐酸组氨酸原料9脯氨酸原料10酪氨酸原料11丝氨酸原料12异亮氨酸原料13亮氨酸原料14盐酸赖氨酸原料15醋酸赖氨酸原料16苄达赖氨酸原料、滴眼液17缬氨酸原料18门冬酰胺原料、片19门冬氨酸原料20甘氨酸原料、冲洗液21胱氨酸原料、片*22盐酸半胱氨酸原料23丙氨酸原料24甲硫氨酸原料、片*25苏氨酸原料26苯丙氨酸原料27乙酰半胱氨酸原料、喷雾用、颗粒*28羧甲司坦原料、口服溶液、片、颗粒29乙酰谷酰胺#原料*、注射液*30谷丙甘氨酸胶囊*表1 氨基酸品种和标准#新增品种,*新增标准。


氨基酸、多肽第三章氨基酸多肽与蛋白质第一节蛋白质概论Proteins are polymers(多聚体) of amino acids.(氨酸)p-20 amino acids (氨基酸) millions of proteins with different properties and activities.Protein structures are studied at primary, secondary, tertiary and quaternary levels.-αhelix, βsheets, globular, complexes, denaturation and folding. Proteins have widely diverse forms and functions.-enzymes(酶), hormones(激素,荷尔蒙), antibodies(抗体),transporters(转运蛋白),muscle(肌肉),lens protein of eyes(眼睛晶状体),spider webs(蜘蛛网),rhinoceros horn(犀牛角),antibiotics(抗生素),mushroom poisons(蘑菇毒素).)antibiotics()mushroom poisons()一、蛋白质的化学组成与分类1、元素组成碳50%氢7%氧23%氮16%硫0-3%微量的磷、铁、铜、碘、锌、钼。
氮平均含16%。
凯氏定氮:粗蛋白质含量=蛋白氮×6.252、氨基酸组成蛋白质是由20种L-型α氨基酸组成的长链分子The earliest studies of proteins focused on the free amino acids derived from these proteins.•The 1st amino acid (asparagine) was discovered in 1806 from asparagus (芦笋) (a green vegetable).•The last (threonine) was not identified until 1938!•All the amino acids were given a trivial (common) name. Glutamate from wheat gluten (面筋) (sticky). Tyrosine from cheese (“tyros” in Greek).3、分类(1)按组成:简单蛋白:结合蛋白:核蛋白,糖蛋白,脂蛋白,色蛋白,磷蛋白,黄素蛋白,金属蛋白(2)、按分子外形的对称程度:球状蛋白质纤维状蛋白质、膜蛋白质)按功能分(3)、按功能分:酶、运输蛋白、营养和贮存蛋白、激素、受体蛋白、运动蛋白、结构蛋白、防御蛋白。
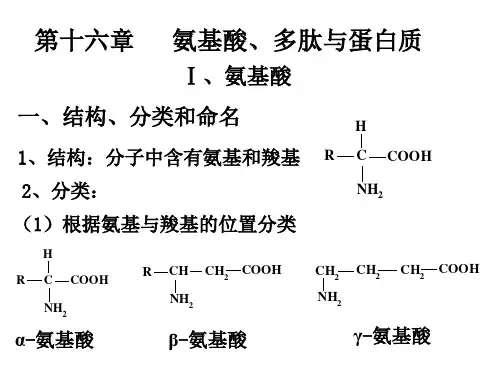
氨基酸、多肽和蛋白质1氨基酸1.1结构特征标准氨基酸:至少有一羧基(carboxyl )和一氨基连接在同一个碳原子上(该碳原子称为α-碳原子)。
注意,脯氨酸含亚氨基。
构成蛋白质的氨基酸是 20 种标准氨基酸(可能含有非标准氨基酸,标准氨基酸经修饰而形成的)。
最近又发现了两种标准氨基酸。
标准氨基酸中, 1806 年发现第一种氨基酸——天冬酰胺,1938年发现最后一种——苏氨酸。
3α-碳是手性中心(大多数情况下,只有α-碳是手性中心;甘氨酸无手性,因R 基为 H)。
其绝对构型采用 D,L 系统,建立在L- 甘油醛( L-glyceraldehydes)和 D- 甘油醛的结构之上。
D 、 L 构型与其实际的旋光性无关。
到目前为止在蛋白质中发现的氨基酸都是L 的(酶的活性位点是不对称的,即酶促反应是在手性环境下进行的), D 仅存在于细菌细胞壁上的短肽和抗生素小肽。
1.2分类非标准氨基酸是标准氨基酸的衍生物(derivative )。
根据 R 基的不同性质将氨基酸进行分类,按其极性或在生理pH (近 7.0 )下与水相互作用的趋势分为 5 类:非极性脂肪族、芳香族、极性不带电、带正电(碱性)、带负电(酸性)。
非极性脂肪族:甘氨酸、丙氨酸、缬氨酸、亮氨酸、甲硫氨酸、异亮氨酸。
(衣架凉鞋饼干=异亮、甲硫、亮、缬、丙、甘)芳香族:苯丙氨酸、酪氨酸、色氨酸。
(食老本(粤语)=色、酪、苯丙)极性不带电:丝氨酸、苏氨酸、半胱氨酸、脯氨酸、天冬酰胺、谷胺酰胺。
(诗书伴琴谱=丝、书、半胱、脯;天冻先安谷=天冬、酰胺、谷)带正电:赖氨酸、精氨酸、组氨酸。
(组队来京晋见=组、赖、精、碱性)带负电:天冬氨酸、谷氨酸。
(天上的谷子很酸=天、谷、酸性、都是氨酸)酪氨酸苯环上有羟基;丝氨酸和苏氨酸有羟基;半胱氨酸有巯基可成对形成二硫键;组氨酸是唯一一个具接近的 pK a值电离侧链的氨基酸,常作为质子供体和受体;天冬氨酸和谷氨酸都有两个羧基。
蛋白质的表现形式:小分子肽、多肽与氨基酸小分子肽与多肽都是蛋白质的一种表现形式,肽,就是小分子的蛋白质,无论小分子肽还是多肽,只是是分子量和肽键的组合方式不同.多肽的一种分类.分子量段一般在180--1000之间,也称作小肽,寡肽,低聚肽,或称为活性小分子肽,一般由2--6个氨基酸组成,超过的就称为多肽,氨基酸为50多个以上的多肽称为蛋白质。
与其他肽的区别是,在人体不需消化,即可直接吸收。
氨基酸是蛋白质最小组成单位,由二个氨基酸组成的肽称为二肽,以次类推。
10肽以下称为寡肽,11肽以上称为多肽。
小分子活性肽是介于氨基酸与蛋白质之间一种生化物质,它比蛋白质分子量小,又比氨基酸分子量大,是一个蛋白质的片段。
1、两个以上的氨基酸之间以肽键相连,形成的“氨基酸链”或“氨基酸串”就叫做肽。
其中,10个以上氨基酸组成的肽被称为多肽,而由2至9个氨基酸组成的就叫做寡肽,由2至4个氨基酸组成的就叫做小分子肽或小肽。
多肽与氨基酸的区别与联系结构:氨基酸是组成多肽和蛋白质的基本单位,两个或则两个以上氨基酸组成一个肽链,因此多肽的分子比氨基酸分子大。
什么是多肽多肽是氨基酸以肽键连接在一起而形成的化合物,它也是蛋白质水解的中间产物。
由两个氨基酸分子脱水缩合而成的化合物叫做二肽,同理类推还有三肽、四肽、五肽等。
通常由三个或三个以上氨基酸分子脱水缩合而成的化合物都可以成为叫多肽。
一般人们将多于100个肽键相联接的氨基酸称作蛋白质,3个以上100个以下肽键相联接的氨基酸称作多肽。
由此可见,多肽的本质仍是氨基酸,仍具有氨基酸的一系列作用。
普通的蛋白质材料,如大豆蛋白,如动物蛋白以及类似的有机肥料,在施用后仍要降解为小分子如多肽和氨基酸才能被植物吸收利用。
多肽的分子结构大于氨基酸,这就决定了多肽在吸收时,每次吸收的不仅仅是一个而是多个氨基酸,其吸收利用率大大提高,二是分子结构小于蛋白质,可以不降解而直接吸收。
多肽有什么特点1、多肽的吸收速度很快有人说,多肽的吸收速度像火箭一样快,这是由于其本身的结构所决定的。
(完整版)生物技术制药复习资料《生物技术制药》复习资料(Biotechnological Pharmaceutics)第一章绪论一、概述1.概念:生物药物(生物制药)是泛指包括生物制品在内的生物体的初级和次级代谢产物或生物体的某一组成部分,甚至整个生物体用作诊断和治疗疾病的医药品。
|采用现代生物技术人为地创造一些条件,借助某些微生物、植物或动物来生产所需的医药品,叫做生物技术制药。
2.技术范畴:基因工程、细胞工程、酶工程、发酵工程、生化工程以及后来衍生出来的第二代、第三代的蛋白质工程、抗体工程、糖链工程和海洋生物技术等。
3.相关学科:有生物学(含微生物学、分子生物学、遗传学等)、化学、工程学(化学工程、电子工程等)、医学、药学、农学等。
但从基础学科来讲,生物学、化学和工程学是其主要的学科。
4.应用范围:(1)医药;(2)农业;(3)食品;(4)工业;(5)环境净化;(6)能源。
二、生物技术的发展简史1.传统生物技术阶段主要产品:乳酸、酒精、丙酮、丁酸、柠檬酸、淀粉酶。
生产的特点:过程简单,大多属兼气发酵或表面培养,生产设备要求不高,产品化学结构简单,属初级代谢产物。
2.近代生物技术阶段主要产品:抗生素、维生素、甾体、氨基酸;食品工业的工业酶制剂、食用氨基酸、酵母、啤酒;化工业的酒精、丙酮、丁醇、沼气;农林业的农药;环境保护业的生物治理污染。
生物技术的特点:(1)产品类型多,初级(氨基酸、酶、有机酸)、次级(抗生素)、生物转化(甾体);(2)生物技术要求高,纯种、无菌、通气,产品质量要求也高;(3)生产设备规模大;(4)技术发展速度快。
3.现代生物技术主要产品:胰岛素、干扰素、生长激素等。
生物技术的内容包括:(1)重组DNA技术及其它转基因技术(基因工程);(2)细胞和原生质体融合技术(细胞工程);(3)酶或细胞的固定化技术(酶工程);(4)植物脱毒和快速繁殖技术;(5)动物细胞大量培养技术;(6)动物胚胎工程技术;(7)现代发酵技术;(8)现代生物反应工程和分离工程技术;(9)蛋白质工程技术;(10)海洋生物技术。