最新动物生物化学教案张厚锋
- 格式:doc
- 大小:2.93 MB
- 文档页数:34

动物生物化学说课稿说课流程:本课程的目标通过理论和实践学习,使学生认识生命有机体的化学基础和基本特征,掌握动物机体的化学组成,认识蛋白质、核酸和生物膜在动物机体中的作用。
清楚认识和掌握机体的中间代谢过程。
掌握遗传大分子核酸的功能。
练习和掌握生物化学的基本实验技能,熟悉常用生化仪器的原理和使用方法,培养理论联系实际的学风和分析解决问题的能力。
课程定位《动物生物化学》是一门理论性、实践性和应用性很强的技术基础课程。
也是高职高专院校畜牧兽医专业不可缺少的一门必修基础课,是学习“兽医病理学”、“动物传染病学”、“动物繁殖学、动物营养与饲料学”等后继课程必需的先修课程,也是相关专业专升本入学考试的必考课程专业的培养目标适应2l世纪社会主义现代化建设需要,培养德、智、体、美全面发展的、能直接在生产一线从事动物疫病防控、动物疾病诊治、保障动物性食品安全、关爱动物及保障养殖业生产,动物医学管理等的生产、管理、服务、建设的高素质技能型专门人才。
课程主要内容:内容选取依据:理论遵循必需、够用的原则,淡化生化原理的分析,突出了基础知识和实用内容的讲解。
实践教学环节针对高职教育“以应用为目的,以就业为导向”的特点,加强实践教学力度,突出动手能力的培养。
本课程的知识模块顺序及对应的学时如下:绪论 2蛋白质化学 2核酸的化学 2生物膜与物质运输2酶与维生素 6生物氧化 5糖代谢 3脂类代谢 3核酸降解与核苷酸代谢 3蛋白质的分解代谢 4核酸与蛋白质的生物合成4抗生素 2物质代谢的调节与物质代谢之间的联系2重点难点的处理:课堂教学采用讲练结合的方法;将理论教学与实验实训教学有机结合;将老师知识讲授与学生自主学习相结合;利用多媒体、实训与模型进行辅助教学。
课程定位及内容生物大分子结构与功能生物机体的物质代谢及调节现代生物化学技术和基本技能教材及参考资料根据(教高[2006]16号)《关于全面提高高等职业教育教学质量的若干意见》的精神,教材要紧紧围绕培养高等技术应用性专门人才开展工作。

动物生物化学教案张厚锋第一章:动物生物化学概述教学目标:1. 理解动物生物化学的概念和研究对象。
2. 掌握动物生物化学的研究方法和应用领域。
3. 了解动物生物化学的发展历程和现状。
教学内容:1. 动物生物化学的定义和研究对象。
2. 动物生物化学的研究方法:光谱分析、色谱分析、电泳分析等。
3. 动物生物化学的应用领域:药物分析、食品安全、生物技术等。
4. 动物生物化学的发展历程和现状。
教学活动:1. 引入动物生物化学的概念,引导学生思考其研究对象。
2. 通过实物或图片展示,让学生了解动物生物化学的研究方法。
3. 组织学生进行小组讨论,探讨动物生物化学的应用领域。
4. 讲解动物生物化学的发展历程和现状,引导学生关注其在现实生活中的应用。
第二章:动物生物化学分子基础教学目标:1. 了解动物生物化学的基本分子组成和结构。
2. 掌握动物生物化学分子的功能和相互作用。
3. 理解动物生物化学分子在生命过程中的重要性。
教学内容:1. 动物生物化学的基本分子组成:蛋白质、核酸、碳水化合物、脂质等。
2. 动物生物化学分子的结构特点和功能:氨基酸、核苷酸、糖类、脂肪酸等。
3. 动物生物化学分子之间的相互作用:酶促反应、信号传导、基因表达等。
4. 动物生物化学分子在生命过程中的重要性:代谢调控、遗传变异、免疫应答等。
教学活动:1. 通过图片或模型展示,让学生了解动物生物化学的基本分子组成。
2. 讲解氨基酸、核苷酸、糖类、脂肪酸的结构和功能,引导学生理解其重要性。
3. 组织学生进行小组讨论,探讨动物生物化学分子之间的相互作用。
4. 通过实例讲解,让学生了解动物生物化学分子在生命过程中的作用。
第三章:动物生物化学代谢教学目标:1. 理解动物生物化学代谢的基本过程和途径。
2. 掌握动物生物化学代谢的调控机制。
3. 了解动物生物化学代谢与健康的关系。
教学内容:1. 动物生物化学代谢的基本过程:糖代谢、脂肪代谢、蛋白质代谢等。
2. 动物生物化学代谢的调控机制:激素调控、酶调控、信号传导等。

动物的化学现象教案教案标题:探索动物的化学现象教学目标:1. 了解动物体内的化学反应和化学现象。
2. 掌握动物体内化学反应的基本原理。
3. 培养学生的观察力和实验技能。
4. 培养学生的合作意识和团队合作能力。
教学内容:1. 动物体内的化学反应:呼吸作用、消化作用、新陈代谢等。
2. 动物体内的化学现象:骨骼的成分、毛发的生长、血液的循环等。
教学步骤:引入活动:1. 引导学生回忆动物的基本特征,引发对动物体内化学反应和化学现象的好奇心。
探究活动:2. 分组讨论:将学生分成小组,每个小组选择一个动物进行研究,并讨论该动物体内的化学反应和化学现象。
3. 学生实验:每个小组选择一个动物体内的化学反应或化学现象进行实验观察,记录实验过程和结果。
4. 实验结果分享:小组成员分享实验结果,讨论并总结各种动物体内的化学反应和化学现象。
概念讲解:5. 教师讲解动物体内化学反应和化学现象的基本原理,引导学生理解其中的化学过程和原理。
拓展活动:6. 学生小组合作设计一个实验,探究动物体内其他未涉及的化学反应或化学现象。
7. 学生展示实验设计和结果,进行交流和讨论。
总结活动:8. 教师总结本节课的内容,强调动物体内的化学反应和化学现象对动物生命活动的重要性。
9. 学生思考并回答与课程目标相关的问题,巩固所学知识。
评估方法:1. 学生实验记录和实验结果的准确性和完整性。
2. 学生参与讨论和展示的积极性和合作性。
3. 学生对于动物体内化学反应和化学现象的理解程度。
教学资源:1. 动物标本或图片。
2. 实验器材和化学试剂。
3. 实验记录表格和笔记本。
教学延伸:1. 邀请专业人士或相关领域的研究者进行讲座或分享,加深学生对动物体内化学现象的理解。
2. 安排学生进行更深入的研究和探索,撰写科研报告或参加科学竞赛。
备注:教案的具体内容和步骤可根据教育阶段和学生的实际情况进行调整和修改。


动物生物化学教案第一章绪论1.生物化学的概念介绍生物化学的概念、动物生物化学的概念。
2.生物化学的发展介绍生物化学的起源;获得的重大成果;我国的成果及展望。
3.生物化学与畜牧和兽医介绍生物化学与畜牧和兽医的关系。
第二章蛋白质的结构与功能第一节蛋白质在生命活动中的重要作用举例说明各种蛋白质的生理功能,例如酶、激素蛋白、血红蛋白、免疫球蛋白等,综合说明蛋白质是生命活动的体现者。
:第二节蛋白质的化学组成1.蛋白质的元素组成强调氮是蛋白质独特元素,氮的含量为16%是蛋白质含量测定的依据。
2.蛋白质的基本结构单位和其它组分强调氨基酸是蛋白质的构件分子。
3.氨基酸氨基酸的基本结构;构型;氨基酸的分类表;其他氨基酸;氨基酸的主要性质。
第三节蛋白质的化学结构1氨基酸构成蛋白质的氨基酸有二十种。
2.肽键和肽链的概念肽键、肽链的概念;肽键形成图。
3.蛋白质的一级结构蛋白质一级结构的基本概念;蛋白质一级结构的表示;蛋白质一级结构测定的基本步骤。
第四节蛋白质的高级结构1.蛋白质的结构层次包括蛋白质一级、二级、超二级结构、.结构域、.三级、.四级结构,用图表示。
2.肽单位平面结构和二面角肽单位、肽单位平面、二面角概念及图示。
3.维持蛋白质分子构象的化学键以图介绍,包括氢键、疏水键、二硫键、范德华引力、离子键等。
4.二级结构概念及图示。
主要介绍. á-螺旋、ß-折迭ß-.转角等结构。
.5.超二级结构概念及图示。
6.结构域概念及图示。
7.三级结构概念及肌红蛋白结构图示。
强调三级结构是天然蛋白质存在的形式。
8.四级结构概念及血红蛋白结构图示。
强调四级结构存在亚基及亚基的概念。
第五节多肽、蛋白质结构与功能的关系1.多肽结构与功能的关系:讲明其在动物体内的表现状态.,附图。
2.同功能蛋白质的种属特异性与保守性以胰岛素和细胞色素C为例讲解,并附表。
3.蛋白质的前体激活以胰岛素原、胰蛋白酶原的激活过程为例讲解,并附图。

初中化学动物细胞教案教学目标:1. 了解动物细胞的基本结构及其功能。
2. 掌握动物细胞的分裂过程。
3. 能够运用所学的知识解释生活中的一些现象。
教学重点:1. 动物细胞的基本结构。
2. 动物细胞的分裂过程。
教学难点:1. 动物细胞分裂过程中染色体的变化。
教学准备:1. 图片:动物细胞结构图、动物细胞分裂过程图。
2. 实验材料:显微镜、载玻片、盖玻片、染色剂。
教学过程:一、导入(5分钟)1. 引导学生观察周围的环境,提问:你们注意到没有,我们周围的各种生物都是由细胞构成的?2. 学生回答,教师总结:是的,细胞是生物的基本单位。
那么,你们知道动物细胞的基本结构吗?二、自主学习(10分钟)1. 学生根据教材,自主学习动物细胞的基本结构及其功能。
2. 学生分享学习成果,教师点评并总结。
三、课堂讲解(15分钟)1. 教师讲解动物细胞的基本结构,包括细胞膜、细胞质、细胞核等。
2. 教师讲解动物细胞的分裂过程,包括有丝分裂和无丝分裂。
四、实验观察(15分钟)1. 教师引导学生使用显微镜观察动物细胞切片。
2. 学生观察并描述动物细胞的基本结构。
3. 教师引导学生观察动物细胞分裂过程的切片。
4. 学生观察并描述动物细胞分裂过程中的变化。
五、课堂练习(10分钟)1. 学生根据所学内容,完成课堂练习题。
2. 教师点评并解答学生的问题。
六、总结与反思(5分钟)1. 教师引导学生总结本节课所学内容。
2. 学生分享自己的学习心得。
教学延伸:1. 邀请生物学专家进行专题讲座,加深学生对动物细胞的了解。
2. 组织学生参观实验室,亲身体验动物细胞的观察和实验操作。
教学反思:本节课通过讲解、实验观察和练习等方式,使学生了解了动物细胞的基本结构和功能,掌握了动物细胞的分裂过程。
但在教学过程中,要注意引导学生主动参与,提高学生的实践操作能力。
同时,要关注学生的个体差异,因材施教,使每个学生都能在课堂上得到充分的锻炼和发展。
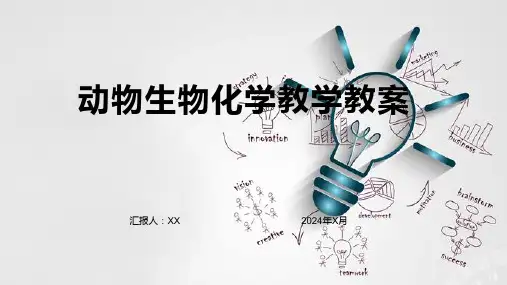


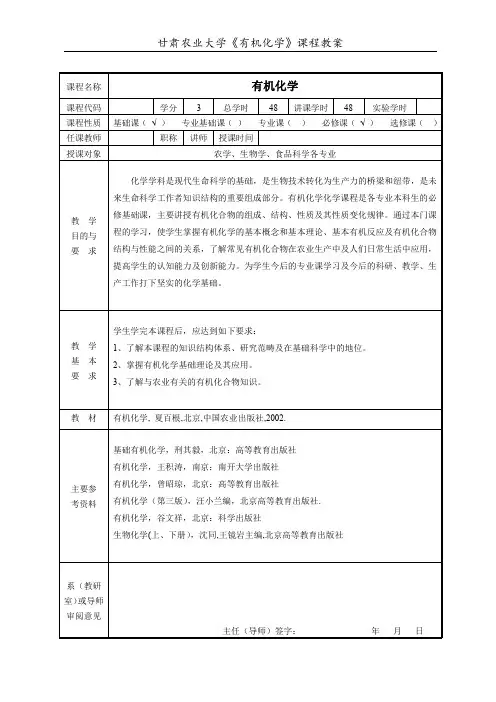
课程名称有机化学课程代码学分3总学时48讲课学时48实验学时课程性质基础课(√)专业基础课()专业课()必修课(√)选修课()任课教师职称讲师授课时间授课对象农学、生物学、食品科学各专业教学目的与要求化学学科是现代生命科学的基础,是生物技术转化为生产力的桥梁和纽带,是未来生命科学工作者知识结构的重要组成部分。
有机化学化学课程是各专业本科生的必修基础课,主要讲授有机化合物的组成、结构、性质及其性质变化规律。
通过本门课程的学习,使学生掌握有机化学的基本概念和基本理论、基本有机反应及有机化合物结构与性能之间的关系,了解常见有机化合物在农业生产中及人们日常生活中应用,提高学生的认知能力及创新能力。
为学生今后的专业课学习及今后的科研、教学、生产工作打下坚实的化学基础。
教学基本要求学生学完本课程后,应达到如下要求:1、了解本课程的知识结构体系、研究范畴及在基础科学中的地位。
2、掌握有机化学基础理论及其应用。
3、了解与农业有关的有机化合物知识。
教材有机化学,夏百根,北京,中国农业出版社,2002.主要参考资料基础有机化学,刑其毅,北京:高等教育出版社有机化学,王积涛,南京:南开大学出版社有机化学,曾昭琼,北京:高等教育出版社有机化学(第三版),汪小兰编,北京高等教育出版社.有机化学,谷文祥,北京:科学出版社生物化学(上、下册),沈同,王镜岩主编,北京高等教育出版社系(教研室)或导师审阅意见主任(导师)签字:年月日教学内容与学时分配教学时数讲课实验小计备注教学内容绪论2学时独立开课烷烃和环烷烃4学时烯烃、炔烃和二烯烃5学时芳香烃4学时旋光异构3学时1学时(习题课)卤代烃3学时醇、酚、醚4学时醛、酮、醌4学时1学时(习题课)羧酸、取代酸及衍生物5学时含氮和含磷有机物4学时杂环化合物3学时1学时(习题课)油脂和类脂﹡自学内容碳水化合物2学时氨基酸、蛋白质和核酸1学时1学时(习题课)波谱知识简介﹡自学内容总计44学时4学时计划教学进程节次授课内容(章节)学时2 1 1.1有机化学的发展;1.2有机化学和有机化合物;1.3有机化合物的特点;1.4有机化学的结构理论;1.4有机化学的酸碱理论;1.5有机化合物的分类;1.6有机化学与农业科学的关系。
动物生物化学教案1. 引言动物生物化学是研究动物体内生物分子及其转化的学科。
本教案旨在通过对动物生物化学的基本概念、重要分子和相关反应的介绍,帮助学生全面了解动物体内的生物化学过程,加深对动物体内分子组成和功能的理解。
2. 基本概念在开始学习动物生物化学之前,我们先来了解一些基本概念。
•生物化学:生物化学是研究生物体内化学反应和机制的学科。
它探讨了生物分子的结构、功能和相互作用,以及生物体内的代谢过程。
•动物生物化学:动物生物化学是生物化学的一个分支,主要研究动物体内的生物分子、代谢途径和相关生物化学反应。
3. 重要分子3.1 蛋白质蛋白质是动物体内最重要的生物分子之一。
它们由氨基酸经肽键连接而成,在动物体内具有多种功能,如构成细胞结构、催化化学反应和参与信号传导等。
3.2 碳水化合物碳水化合物是动物体内的重要能源来源。
它们由碳、氢和氧元素组成,通过细胞呼吸过程将葡萄糖等碳水化合物转化为能量。
3.3 脂类脂类是动物体内的主要存储能量的形式。
它们包括脂肪、磷脂和固醇等。
脂类在动物体内起到绝缘、保护和代谢调节等重要功能。
3.4 核酸核酸是动物体内的遗传物质,包括DNA和RNA。
它们通过碱基配对的方式存储和传递遗传信息,在蛋白质合成和基因调控等方面发挥重要作用。
4. 代谢途径4.1 糖代谢糖代谢是动物体内碳水化合物转化为能量的过程。
它主要包括糖原的合成和分解、糖酵解和柠檬酸循环等反应。
4.2 脂质代谢脂质代谢是动物体内脂类转化的过程。
它涉及脂肪的合成和分解、胆固醇的合成和降解等反应。
4.3 蛋白质代谢蛋白质代谢是动物体内蛋白质的合成和分解过程。
它包括蛋白质的翻译和转录等过程,以及蛋白质的降解和回收等反应。
4.4 核酸代谢核酸代谢是动物体内核酸的合成和降解过程。
它包括DNA的复制和修复、RNA的合成和降解等反应。
5. 实验示范为了进一步理解动物生物化学,我们将进行一些与生物分子和代谢途径相关的实验示范,如:•蛋白质琼脂糖凝胶电泳•酶活性测定实验•DNA提取实验6. 总结动物生物化学是研究动物体内生物分子及其转化的学科。
动物生物化学教案张厚锋附件2:教案模板(电子版)教案2010 ~201 1 学年第 1 学期课程名称动物生物化学系(院、部) 动物科学系教研室(实验室) 基础教研室授课班级09.1班、09.2班、10.3班主讲教师张厚锋职称副教授使用教材《动物生物化学》主编:邹思湘菏泽学院教务处制二○一零年九月教案(首页)动物生物化学课程教案2. 课次为授课次序,填1、2、3……等。
3. 方法及手段如:举例讲解、多媒体讲解、模型讲解、实物讲解、挂图讲解、音像讲解等。
一、蛋白质的元素组成蛋白质主要元素组成:C、H、O、N、S 及 P、Fe、Cu、Zn、Mo、I、Se 等微量元素。
蛋白质平均含N量为16%,这是凯氏定氮法测蛋白质含量的理论依据:蛋白质含量=蛋白质含N量×6.25。
二、蛋白质的基本结构单位──氨基酸组成蛋白质氨基酸的特点:蛋白质经酸、碱、酶彻底水解,可以得到许多种氨基酸的混合物,氨基酸是构成蛋白质的基本单位。
组成蛋白质的基本氨基酸(标准氨基酸)有20种。
大部分属于L-α氨基酸,其中脯氨酸属于L-α亚氨基酸,甘氨酸属于α-氨基酸。
1.氨基酸的基本结构αα•(1)α-氨基酸所有氨基酸的氨基(-NH2)都在α碳原子上(用Cα表示)。
故称为α-氨基酸。
脯氨酸为α-亚氨基酸(2)旋光性除甘氨酸外,所有天然α-氨基酸都有不对称碳原子(手性碳原子),因此所有天然氨基酸都具有旋光性。
(1)不对称碳原子——碳原子连接的四个基团都不相同。
(2)光→滤光片→偏振光(单色光)→氨基酸的溶液→偏振光向左(逆时针)或向右旋转(顺时针)。
右旋体(+)左旋体(-)•L型、D型氨基酸:是氨基酸立体异构体的表示方法。
将羧基写在上方,邻近羧基的α-氨基写在右边为D-氨基酸,写在左边的为L-氨基酸,天然蛋白质中为L-型氨基酸(左旋体)。
2.二十种常见蛋白质氨基酸的分类、结构及三字符号据R基团极性分类非极性R基团AA(8种)——不溶于水,具有疏水性。
不带电荷(7种)——侧链中含有-OH、-SH、CONH2等极性集团,带电荷带正电荷(3种)(碱性AA)组、赖、精。
带负电荷(2种)(酸性AA)、天冬、谷。
极性R基团AA中性溶液中电离填表说明:1. 每项页面大小可自行添减,一节或一次课写一份上述格式教案。
2. 课次为授课次序,填1、2、3……等。
3. 方法及手段如:举例讲解、多媒体讲解、模型讲解、实物讲解、挂图讲解、音像讲解等。
课程教案第四节蛋白质的化学结构一、蛋白质分子中氨基酸的连接方式●在蛋白质分子中,氨基酸之间是以肽键(peptide bond)相连的。
●肽键形成——肽键就是一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合形成的键。
如下图:二.肽与多肽链●肽——氨基酸之间通过肽键联结起来的化合物称为肽。
●二肽——两个氨基酸形成的肽叫二肽,三个氨基酸形成的肽叫三肽……,十个氨基酸形成的肽叫十肽。
●寡肽——一般将十肽以下称为寡肽。
●多肽链——十肽以上者称多肽或称多肽链。
五十肽以上成为蛋白质。
●N末端、C末端——在多肽链中,肽链的一端保留着一个α-氨基,另一端保留一个α-羧基,带α-氨基的末端称氨基末端(N端);带α-羧基的末端称羧基末端(C端)。
氨基酸残基——组成多肽链的氨基酸在相互结合时,失去了一分子水,因此把多肽中的氨基酸单位称为氨基酸残基。
三.肽链书写●一般自N末端向C末端书写,书写多肽链时可用略号,N端写于左侧,用H表示,C端于右侧用OH表示。
肽详细命名时为某某酰某某酰……某某酸。
如上图中的多肽链中文名称为:苏氨酰甘氨酰酪氨酰丙氨酰亮氨酸;中文名称缩写为:苏—甘—酪—丙—亮;英文三字母表示为:Thy·Gly·Tyr·Ala·Leu ;英文单字母表示为:T·G·Y·A·L 。
四.动物体内重要的活性肽1. 谷胱甘肽——谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸三个氨基酸所组成的三肽,全名是γ-谷氨酰半胱氨酰甘氨酸,简称谷胱甘肽(glutachione,简写GSH)。
其中N 末端的谷氨酸是通过γ-羧基与半胱氨酸的氨基相连。
谷胱甘肽的主要功能1.谷胱甘肽作为还原剂保护蛋白质或酶的巯基免遭氧化。
2.作为还原剂,清除体内H2O23.保护蛋白质、核酸免遭毒物损害五、蛋白质的一级结构多肽链中氨基酸的排列顺序,包括二硫键的位置称为蛋白质的一级结构(primarystruc主键:肽键、二硫键。
一级结构是由DNA 决定的。
H 2O 22H 2O2GSHG-S-S-GNADPNADPH+H +苏氨酸 甘氨酸 酪氨酸 丙氨酸 亮氨酸一级结构蛋白质最基本的结构,它决定蛋白质高级结构和生物功能。
一级结构的走向规定为N-端 C-端。
●蛋白质的一级结构要点●1)一定来源的蛋白质分子中氨基酸种类、数目、排列顺序是一定的。
现有1000多种蛋白质的顺序已确定。
如胰岛素,胰核糖核酸酶、胰蛋白酶等。
●2)一级结构包括从N-端到C-端的氨基酸的排列顺序和二硫键在分子中的位置。
●3)一级结构是由基因上遗传密码的排列顺序所决定的。
●4)蛋白质的一级结构决定了蛋白质的二级、三级等高级结构。
第五节、蛋白质的高级结构☼二级结构—多肽链主链骨架原子的局部空间结构;☼超二级结构——是指二级结构的组合。
☼结构域——多肽链上致密的、相对独立的球状区域。
☼三级结构——多肽链上所有原子和基团的空间排布。
☼四级结构——几条肽链构成。
一级氨酸串成链,二级折叠有螺旋.三级盘旋更复杂,四级多链抱成团.蛋白质的二级、三级和四级结构见下图:二.蛋白质空间结构有关的化学键1)氢键:肽键羰基上的氧与亚胺基上的氢之间。
(电负性较强的原子和H原子形成的化学结合力)。
键能较低,易被破坏。
2)二硫键:分之中半胱氨酸的巯基之间脱氢而形成的化学键。
二硫键键能较强,蛋白质中二硫键越多蛋白质越稳定对外界的抵抗力越强。
3)盐键:蛋白质在一定的情况下其氨基或羧基以正、负离子状态存在,即可形成盐4)疏水键:蛋白质分子中疏水性较强的侧链基团避水而互相凝集,对蛋白质稳定起重要作用。
5)范德华力:分子之间的静电引力,表现在基团之间。
极性分子——极性分子→取向力极性分子——非极性分子→诱导力非极性分子——非极性分子→色散力6)酯键:羟基氨基酸与二羧基氨基酸形成酯键。
7)金属键:主要参与三、四级结构形成。
键。
结合力强,易被酸碱破坏。
三、肽平面和二面角1.肽键中的C-N键长0.132nm,比相邻的N-C单键(0.146nm)短,而较一般C=N 双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之间,具有部分双键的性质,因而不能旋转,固定在一个平面之内。
2.肽键平面(肽酰平面)——六个原子(-Cα—CO—NH—Cα-)处于一个平面上,这就是肽键平面。
Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X线衍射分析,得出下图所示结构。
3.二面角两相邻酰胺平面之间,能以共同的Cα为定点而旋转,绕Cα-N键旋转的角度称φ角,绕C-Cα键旋转的角度称ψ角。
φ和ψ称作二面角,亦称构象角四、蛋白质的二级结构蛋白质的二级结构(secondary structure)指肽链主链原子不同区段形成的局部空间结构,不包括侧链R基团的构象。
主要有以下类型:α-螺旋(α-helix)•β-折叠(β-pleated sheet)•β-转角(β-turn)•无规则卷曲(nonregular coil)1.α-螺旋(α-helix)Pauling等人对α-角蛋白(α-keratin)进行了X线衍射分析,从衍射图中看到有0.5~0.55nm的重复单位,故推测蛋白质分子中有重复性结构,后来把这种重复性结构称为α-螺旋结构(1951年提出)。
特征:1、以肽键平面为单位,以α碳原子为转折盘旋的右手螺旋。
2、每隔3.6个AA残基螺旋上升一圈,螺距0.54nm;3 、主链原子构成螺旋主体,侧链在其外部。
4、第一个氨基酸残基的>N-H与第四个氨基酸残基的>C=0形成氢键。
氢键的方向与中心轴大致平行,是维持α螺旋的主要力量。
多态性:多数为右手(较稳定),亦有少数左手螺旋存在(不稳定)2.β-折叠(β-pleated sheet)●Astbury等人曾对β-角蛋白进行X线衍射分析,发现具有0.7nm的重复单位。
●两段或两段以上多肽链并列排列时,折叠成锯齿状的肽链,通过氢键相连而平行成片层状的结构称为β-折叠(β-pleated sheet结构或称β-片层)●β-折叠结构如下图:●β-折叠结构特点是:(1)相邻肽链平面的夹角110°,成锯齿状排列,氨基酸残基的R侧链在锯齿的上方或下方。
(2)多条(2-5条)肽段平行排列时,肽段之间可以是顺向平行(均为N→C),也可以是反平行的。
两条链从“N端”到“C端”是同方向的叫平行β-折叠结构,反方向的叫反平行β-折叠结构。
(3)由氢键维持稳定,其方向与折叠的长轴垂直。
β-折叠结构存在于β-丝蛋白中例如:鸟类的羽毛、两栖类的鳞片;蚕丝的丝心蛋白(韧性,柔软不能拉长),蜘蛛网。
3.β-转角(β-turn)(1)肽链出现180°的回折,折角处的构象就是β-转角(β-turn或β-bend)甘氨酸、脯氨酸存在时易形成β-转角。
(2)β-转角中,第一个氨基酸残基的C=O与第四个残基的H形成氢键,从而使结构稳定。
肽链在脯氨酸存在时发生β-转角。
β-转角结构图如下:4.无规则卷曲没有确定规律性的肽链构象。
肽链中肽键平面不规则排列,属于松散的无规卷曲(random coil)。
在整个肽段起到活节的作用。
有利于整条肽链盘旋折叠。
五、蛋白质的超二级结构(模体)蛋白质分子中两个或三个具有二级结构的肽段在空间相互靠近,形成特殊的空间构象,称为蛋白质的超二级结构——模体。
接。
因此在一定的条件下,四级结构的蛋白质可分离成亚基,而亚基本身构象仍可不变。
4.一种蛋白质四级结构中,若亚基结构相同,称为同聚体。
例如:烟草斑纹病毒的外壳蛋白是由2200个相同的亚基形成的多聚体。
5.一种蛋白质四级结构中,亚基结构若不相同,称为异聚体。
例如;正常血红蛋白是两个α亚基与两个β亚基形成的四聚体。
同源蛋白质序列的氨基酸差异数目与物种差异成比例,亲缘关系越近,氨基酸序列差异越小。
3.一级结构的细微变化可直接影响其功能。
分子病——由于遗传基因突变,导致蛋白质分子结构的改变或缺失所引起的疾病。
胰岛素分子病:B链 24位苯丙AA→亮AA活性降低。
膀胱癌:P21蛋白(分子量21000)12位甘AA→缬AA•重点讨论镰刀状红细胞性贫血症分子病•最早被认识的一种分子病。
•由于遗传基因的突变导致血红蛋白分子中氨基酸残基被更换所造成。