二氧化碳与氢氧化钠溶液反应考题归类解析
- 格式:doc
- 大小:150.00 KB
- 文档页数:7
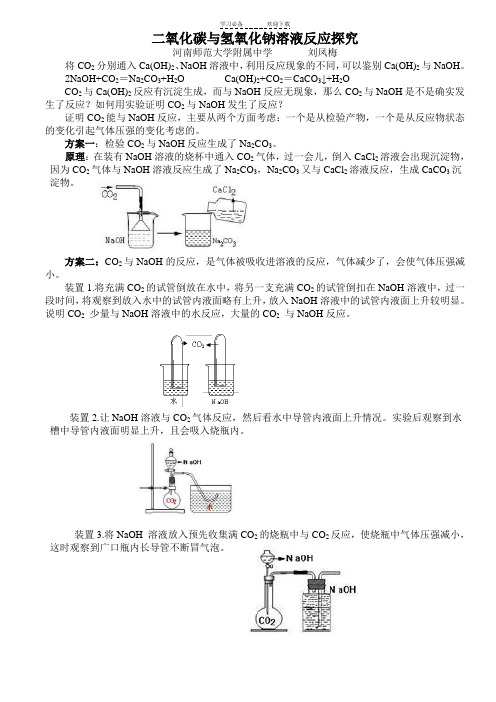
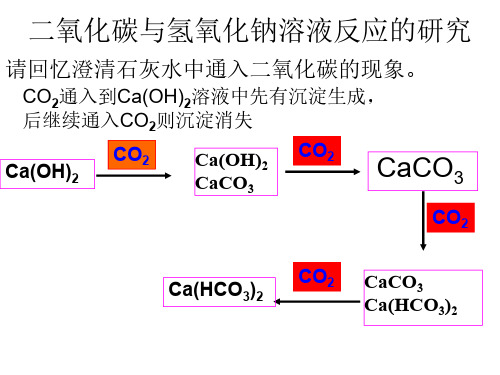
二氧化碳与氢氧化钠溶液反应探究河南师范大学附属中学刘凤梅将CO2分别通入Ca(OH)2、NaOH溶液中,利用反应现象的不同,可以鉴别Ca(OH)2与NaOH。
2NaOH+CO2=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2OCO2与Ca(OH)2反应有沉淀生成,而与NaOH反应无现象,那么CO2与NaOH是不是确实发生了反应?如何用实验证明CO2与NaOH发生了反应?证明CO2能与NaOH反应,主要从两个方面考虑:一个是从检验产物,一个是从反应物状态的变化引起气体压强的变化考虑的。
方案一:检验CO2与NaOH反应生成了Na2CO3。
原理:在装有NaOH溶液的烧杯中通入CO2气体,过一会儿,倒入CaCl2溶液会出现沉淀物,因为CO2气体与NaOH溶液反应生成了Na2CO3,Na2CO3又与CaCl2溶液反应,生成CaCO3沉淀物。
方案二:CO2与NaOH的反应,是气体被吸收进溶液的反应,气体减少了,会使气体压强减小。
装置1.将充满CO2的试管倒放在水中,将另一支充满CO2的试管倒扣在NaOH溶液中,过一段时间,将观察到放入水中的试管内液面略有上升,放入NaOH溶液中的试管内液面上升较明显。
说明CO2少量与NaOH溶液中的水反应,大量的CO2与NaOH反应。
装置2.让NaOH溶液与CO2气体反应,然后看水中导管内液面上升情况。
实验后观察到水槽中导管内液面明显上升,且会吸入烧瓶内。
装置3.将NaOH 溶液放入预先收集满CO2的烧瓶中与CO2反应,使烧瓶中气体压强减小,这时观察到广口瓶内长导管不断冒气泡。
装置4.在两个容器中装满NaOH 溶液,向A 中充入CO 2 气体,会看到A 中长导管管口有气泡产生,但B 瓶中长导管不会冒气泡。
因为CO 2 与A 中NaOH 溶液反应后,没有CO 2 进入B 瓶,若CO 2 不与NaOH 溶液反应,则B 中长导管一定会冒气泡。
装置5:在集气瓶中收集满CO 2,迅速地倒入NaOH 溶液,用一个带有U型管的橡皮塞塞紧(装置如右图所示),如果U 型管中的液面发生变化,证明CO 2与NaOH 发生了反应。
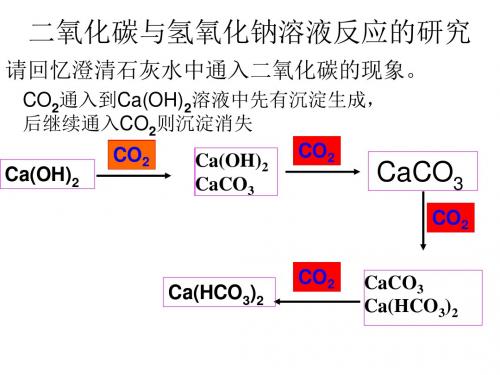
二氧化碳与氢氧化钠反应例1下列验证“CO2与NaOH溶液反应”的装置中不能观察到明显现象的是(装置气密性均良好)( )解析A中通入二氧化碳时,虽然氢氧化钠溶液能和二氧化碳反应生成碳酸钠和水,但是无明显现象;B实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致试管中气压减小,从而导致液体在试管中上升;C实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致气球膨胀;D实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致烧杯中的水流入锥形瓶中。
答案 A例2氢氧化钠溶液和二氧化碳反应没有明显现象,为验证CO2与NaOH能够发生反应,某同学右图组装实验装置,并进行实验。
(1)有时药品滴加顺序会影响实验现象。
如果观察到的现象是“气球先膨胀,后变瘪”,则加入试剂的顺序应该是________(填序号)。
A.先加入盐酸,再加入氢氧化钠溶液B.先加入氢氧化钠溶液,再加入盐酸(2)请解释气球“先膨胀”的原因:________________。
(3)写出气体“后变瘪”的化学方程式________________。
解析(1)如果先加入氢氧化钠溶液,再加入盐酸,加入氢氧化钠溶液时,二氧化碳被氢氧化钠溶液吸收,导致瓶内气压减小,能够观察到气球先膨胀,后变瘪。
(2)气球“先膨胀”的原因是二氧化碳被氢氧化钠溶液吸收,导致瓶内气压减小。
(3)气体“后变瘪”,是因为碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,导致瓶内气压增大,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
答案(1)B (2)二氧化碳被氢氧化钠溶液吸收,导致瓶内气压减小(3) Na2CO3+2HCl═2NaCl+H2O+CO2↑例3某化学兴趣小组的同学在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的试管中,没有观察到现象,小组同学对氢氧化钠和二氧化碳是否发生反应产生了兴趣,他们又做了如图所示两组实验。

探究二氧化碳与氢氧化钠的反应例1某兴趣小组同学欲探究NaOH溶液与CO2气体的反应,设计如图所示实验装置:(1)若导管a与b连接,将分液漏斗中的NaOH溶液注入锥形瓶,关闭分液漏斗上的活塞,振荡,然后打开导管上的活塞,观察到的实验现象是________________,CO2与NaOH反应的化学方程式是____________________;(2)探究反应后锥形瓶内溶液中溶质的成分:已知Na2CO3+H2O+CO2═2NaHCO3NaHCO3+NaOH═Na2CO3+H2O【提出猜想】Ⅰ.NaOH和Na2CO3;Ⅱ. __________;Ⅲ.NaHCO3;Ⅳ.Na2CO3和NaHCO3。
【查阅资料】①Ca(OH)2与Na2CO3、NaHCO3均能反应且有白色沉淀生成;②CaCl2与Na2CO3能反应且有白色沉淀生成,与NaHCO3不反应;③NaHCO3溶液显碱性,可与酸反应生成CO2气体。
【设计实验】限选试剂:Ca(OH)2溶液、CaCl2溶液、稀盐酸、酚酞试液。
实验操作实验现象实验结论1.取少量反应后溶液于试管中,加入足量的_______________ 猜想Ⅲ不成立_______________振荡2.将操作Ⅰ所得混合物过滤,向滤液中加入足_______________ 猜想Ⅳ成立量的_______________,振荡【拓展应用】联想到空气中有CO2,所以实验室中的氢氧化钠溶液应___________保存。
解析(1)二氧化碳和氢氧化钠反应后气压会减小,烧杯内的水流入锥形瓶中,CO2与NaOH反应生成碳酸钠和水。
(2)【提出猜想】二氧化碳和氢氧化钠反应时,如果氢氧化钠过量,则溶质是氢氧化钠和碳酸钠;如果二氧化碳过量,但是不能完全消耗生成的碳酸钠,则溶质是碳酸钠和碳酸氢钠;如果氢氧化钠和二氧化碳恰好完全反应,则溶质是碳酸钠;如果二氧化碳过量,并且把碳酸钠完全消耗,则溶质是碳酸氢钠,所以猜想II是Na2CO3。
基于CO2和NaOH反应考点分析江苏省兴化市周庄初级中学樊茂225711氢氧化钠作为一种常见的碱,它的性质之一是能与二氧化碳的反应,该反应常常作为中考命题的热门素材,其考点主要在这几个方面:考点一、验证CO2和NaOH是否发生了化学反应由于该反应没有现象,只能通过实验间接证明,一般是通过溶液NaOH与CO2发生反应,使容器内气压降低,所出现的现象,或者通过证明产物有Na2CO3的方法来证明CO2和NaOH发生了化学反应。
例1.某兴趣小组同学将CO2分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象。
(1)写出上述澄清石灰水变浑浊的化学方程式。
(2)为探究CO2和NaOH是否发生了化学反应,王强设计了如图所示的A、B实验,验证CO2与NaOH溶液发生了化学反应。
实验现象为:A中试管内液面上升;B中气球胀大。
①王强认为上述实验是可行的,其共同原理是。
②李莉提出质疑,她认为上述实验不严谨,其理由是。
要得到科学严谨的结论,仍利用该装置,补做的对比实验是。
③杨红通过检验生成物:向B实验后的溶液中加入,观察到_________________现象,从而也证明CO2与NaOH发生了反应。
④你认为两实验中存在安全隐患的是(填代号),理由是。
解析:(1)CO2+C a(OH)2=CaCO3↓+H2O(2)①氢氧化钠溶液与CO2发生反应,使容器内气压降低② CO2能溶于水,也能使容器内气压降低,将氢氧化钠溶液换成等体积的水③稀盐酸有气泡产生(或加氯化钙溶液有沉淀生成其他合理答案均可)④ A 氢氧化钠有腐蚀性,易伤到手考点二、氢氧化钠变质的检验氢氧化钠暴露在空气中,会与空气中的二氧化碳反应而变质,如何检验是否变质。
方法是检验样品中有CO2和NaOH反应的产物Na2CO3,具体方法有这几种:(1)向样品中加入稀HCl或稀H2SO4,产生气泡,则NaOH变质。
(2)向样品溶液中加入Ca(OH)2溶液或Ba(OH)2溶液,产生白色沉淀则NaOH变质,若加入适量Ca(OH)2溶液还可以除去其中的Na2CO3。
深度解析CO2与NaOH溶液的反应题目向浓度相等、体积均为50 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100 mL。
1.在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①____________,②____________,③____________,④____________。
2.在稀释后的溶液中逐滴加入0.1 mol ·L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如下图所示:①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是________mL(标准状况)。
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________③原NaOH溶液的物质的量浓度为_______________解析1.CO2气体通入NaOH溶液中,依次发生下列反应CO2+2NaOH = Na2CO3+H2O ①CO2+Na2CO3+H2O = 2NaHCO3 ②合并上述①②CO2+NaOH = NaHCO3 ③随着反应物用量的变化,产物发生变化,溶液中溶质也不同,当二者物质的量之比不同时产物分析如下:当n(CO2):n(NaOH)=1:2时只发生上述反应①;当n(CO2):n(NaOH)=1:1时只发生上述反应③;当1:2<n(CO2):n(NaOH)<1:1时,同时发生上述反应①②。
在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH和Na2CO3 ②Na2CO3 ③Na2CO3 和NaHCO3 ④NaHCO3相同类型的化学反应还有:①CO2与Ca(OH)2 溶液的反应CO2 +Ca(OH)2 =CaCO3 ↓+H2OCO2 +CaCO3 +H2O=Ca(HCO3)2CO2 +Ca(OH)2 =Ca(HCO3)2②SO2与KOH溶液的反应SO2+ 2 KOH=K2SO3+H2OSO2+K2SO3+H2O=2KHSO3SO2+KOH=KHSO3③H2S与KOH溶液的反应H2S + 2 KOH=K2S+H2OH2S +K2S = 2KHS2.在NaOH溶液中通入CO2反应后的溶液中,再逐滴加入盐酸时可能发生的反应依次是:NaOH+HCl =NaCl+H2O ①Na2CO3+HCl =NaCl+NaHCO3 ②NaHCO3 +HCl=NaCl+H2O+CO2↑③注意:上述反应中只有第③个反应产生CO2 气体。
二氧化碳与氢氧化钠溶液反应考题归类解析湖北罗明奎近年来各地区的化学化学中考题中,出现了一些有关二氧化碳与水反应、氢氧化钠溶液反应探究考题,成为中考命题的一个热点。
为了使同学们对这种题型有所熟悉和运用,现将此类考题归类如下,希望同学们对学习本单元有所帮助。
1、化学课上,老师将CO2分别通入澄清石灰水和氢氧化钠溶液中,我们观察到前者变浑,后者没有明显现象,CO2和 NaOH是否发生了化学反应呢?甲、乙两同学设计了右图所示的A、B两个实验来验证,观察到现象是:装置A软塑料变扁,装置B活塞向上运动。
(1)甲同学认为这两个实验都可行,其反应原理都可以用化学方程式表示为。
(2)乙同学提出了质疑,他认为这两个实验都不能证明使容器内压强变小的原因是CO2与反应,还是CO2溶于水,甲同学认为可以补充一个实验来回答该问题,该实验是。
(只利用A装置――矿泉水瓶进行)2、某化学实验小组在探究CO2和NaOH是否发生反应时,小明设计出下列三种装置进行实验:请回答以下几个问题:(1)写出上图中标有字母的仪器名称:a ,b 。
(2)以上三个实验中,①③有明显现象,请你帮小明记录他观察到的实验现象:实验①。
实验③。
(3)实验②因选用仪器不当导致未能观察到明显现象,请你帮小明寻找一种物品替代该装置中的广口瓶,以使实验取得成功,你将选用的物品是,改进后能看到的实验现象是。
(4)小余同学提出了质疑,他认为小明实验还不足以证明CO2与NaOH确实发生了反应,其理由是。
(5)小余同学又补充了设计如下实验方案来进一步证明,我来帮他完成:(6)请你再设计一个与上述实验不同原理的实验来证明并检验CO2和NaOH溶液反应生成了Na2CO3,并将有关的实验操作、现象、结论填入下表:3.有些化学反应有明显的现象,有些化学反应必须借助一定的装置来判断反应是否发生。
在探究CO2和NaOH 是否发生化学变化时,某校化学探究小组的同学设计了以下四种实验装置。
二氧化碳与氢氧化钠溶液反应考题归类解析湖北罗明奎近年来各地区的化学化学中考题中,出现了一些有关二氧化碳与水反应、氢氧化钠溶液反应探究考题,成为中考命题的一个热点。
为了使同学们对这种题型有所熟悉和运用,现将此类考题归类如下,希望同学们对学习本单元有所帮助。
1、化学课上,老师将CO分别通入澄清石灰水和氢氧化钠溶液中,我们观察到前者变浑,后者没有明显现象,2和 NaOH是否发生了化学反应呢?甲、乙两同学设计了右图所示的A、B两个实验来验证,观察到现象是:装CO2置A软塑料变扁,装置B活塞向上运动。
(1)甲同学认为这两个实验都可行,其反应原理都可以用化学方程式表示为。
与反应,还(2)乙同学提出了质疑,他认为这两个实验都不能证明使容器内压强变小的原因是CO2溶于水,甲同学认为可以补充一个实验来回答该问题,该实验是。
是CO2(只利用A装置――矿泉水瓶进行)2、某化学实验小组在探究CO和NaOH是否发生反应时,小明设计出下列三种装置进行实验:2请回答以下几个问题:(1)写出上图中标有字母的仪器名称:a ,b 。
(2)以上三个实验中,①③有明显现象,请你帮小明记录他观察到的实验现象:实验①。
实验③。
(3)实验②因选用仪器不当导致未能观察到明显现象,请你帮小明寻找一种物品替代该装置中的广口瓶,以使实验取得成功,你将选用的物品是,改进后能看到的实验现象是。
与NaOH确实发生了反应,其理由(4)小余同学提出了质疑,他认为小明实验还不足以证明CO2是。
(5)小余同学又补充了设计如下实验方案来进一步证明,我来帮他完成:(6)请你再设计一个与上述实验不同原理的实验来证明并检验CO 2和NaOH 溶液反应生成了Na 2CO 3,并将有关的实验操作、现象、结论填入下表:3.有些化学反应有明显的现象,有些化学反应必须借助一定的装置来判断反应是否发生。
在探究CO 2和NaOH 是否发生化学变化时,某校化学探究小组的同学设计了以下四种实验装置。
回答下列问题:(1)请简单描述上述四种装置中的实验现象:A_____________________________________________________________B_____________________________________________________________C_____________________________________________________________D_____________________________________________________________(2)上述四种实验设计所依据的共同原理是_________________________________4、常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化。
某研究小组设计了下列实验装置 (所有装置的气密性良好) ,试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。
⑵若再分别向A、B装置的烧杯中滴入少量氯化钙溶液,将会看到的现象是:A:;B:。
与NaOH溶液的反应没有明显的现象。
为了通过一些现象说明5.化学反应往往伴随着一些现象发生,但CO2CO与NaOH发生了反应,某班同学分两组作了如下探究实验:2(1)第一组同学把一支收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中(如右图所示),看到试管内液面上升。
这种现象是因为试管内外产生()A.温度差 B.重力差 C.压强差 D.浮力差(2)第二组同学从中得到启发,也设计了如下实验装置进行探究:A现象为,B现象为,C现象为。
(3)同学们经过分析讨论,认为第一组的实验中产生液面上升现象的原因可能有两种。
一种是因为CO2与溶液中的NaOH反应,消耗了CO2,你认为另一种原因是。
(4)为了进一步证实CO2与NaOH溶液已经发生了反应,他们设计了如下方案:取上述实验后的溶液,第一组同学滴加 ,现象为;第二组同学滴加 ,现象为。
他们虽然看到的现象不同,但都可以证实CO2与NaOH 溶液已经发生了反应。
6.为了探究二氧化碳能与水发生反应生成具有酸性的物质,A、B两同学分别设计了探究实验的方案。
A同学的实验方案是将二氧化碳通入紫色石蕊试液中,观察溶液的颜色变化,如图甲所示。
B同学的实验方案是取四朵用石蕊试液染成紫色的干燥的小花,按图乙进行实验,观察小花颜色变化。
请你对A、B两同学的实验探究方案进行评价:①哪个同学的方案更合理:______________,方案合理的理由是 ______________。
②图甲实验中的化学方程式是。
③图乙中第(Ⅰ)(Ⅱ)步骤的目的是说明:。
④图乙中步骤(Ⅲ)的现象是:。
⑤若将图乙步骤(Ⅳ)已经变色的小花从集气瓶中取出,再放到装有浓硫酸的烧杯中有空塑料板上(如右图),一段时间后,现象是:。
参考答案1.(1) CO2+2NaOH=Na2CO3+H2O(2)或做个对比实验:取两个同样大的矿泉水瓶充满CO2后,注入同体积的水和NaOH溶液盖上瓶盖振荡,比较两矿泉水瓶变瘪的程度等;(也可图示)2.(1)a烧杯;b胶头滴管(或滴管)(2)实验①试管内液面逐渐上升,形成水柱;实验③小气球胀大(3)矿泉水瓶(或其它合理答案);矿泉水瓶变瘪或向内凹进(4)NaOH溶液中有水,CO2又能溶于水且和水会反应,究竟是CO2溶于水或和水会反应使气压减小的结果?还是CO2与NaOH反应使气压减小的结果?(5)有气泡产生(实验步骤方法:取反应后的溶液少许于试管中,再逐滴加入稀盐酸)(6)在反应后的溶液中(将CO2通入NaOH溶液后)滴入CaCl2溶液(或石灰水Ca(OH)2溶液或BaCl2溶液或Ba(OH)2溶液……);或在反应后的溶液中滴入稀盐酸;表明CO2与NaOH反应生成了Na2CO33、(1)A:溶液进入试管内 B:反应后烧杯内的水会倒吸到锥形瓶中 C:挤压滴管内的氢氧化钠溶液后,小气球会胀大 D:挤压滴管内的氢氧化钠溶液后,会形成喷泉。
(2)因二氧化碳被吸收,盛有二氧化碳的容器内的压强减小,与外界大气压形成压强差。
(3)取少量反应后的溶液于试管中,滴入稀盐酸,若有气泡产生,说明有碳酸盐存在,证明二氧化碳同氢氧化钠溶液发生了化学反应。
4.⑴B.试管内的液面明显上升;C.水槽中的水倒吸入烧瓶中;D.盛氢氧化钠溶液的试剂瓶内的长导管口有气泡产生;E.烧瓶内形成喷泉。
F.瓶内小气球会胀大。
⑵A:无明显的现象变化;B:产生白色沉淀。
5.(1)C (2)A现象:塑料瓶变瘪了,B现象:鸡蛋进入(或部分进入)瓶中,C现象:气球胀大。
(3)CO2溶于水(或与水反应),消耗了CO2;(4)稀酸,冒气泡;CaCl2溶液(含Ca2+或Ba2+的溶液均可),产生白色沉淀。
(两种方法不分先后)6.(1)B同学的方案合理;(2)B同学进行了几个对比实验,通过观察小花颜色的变化可以说明:紫色石蕊变红不是水的作用,也不是二氧化碳的作用,而是二氧化碳与水反应生成酸的结果。
用好碳酸钠巧解化学题湖北郑群碳酸钠(Na2CO3)由Na+和CO32-构成,属于强碱弱酸盐类物质,其水溶液显碱性,故而俗称“纯碱”,由于它含碳酸根离子,可以与酸类物质(都含H+)反应生成二氧化碳气体,也可以与含钙或钡等离子物质反应生成沉淀(CaCO3),且沉淀加硝酸后能溶解。
由于碳酸钠既与酸反应,也能与碱(Ca(OH)2、Ba(OH)2等)反应,还能与盐(CaCl2、Ba(NO3)2等)反应,且其溶液还显碱性,故而涉及酸碱盐考题多与碳酸钠有关。
1、鉴别题利用碳酸钠鉴别其它物质,如“用一种试剂,鉴别氢氧化钙溶液、氢氧化钠溶液、稀盐酸”。
分析:被鉴别物质有两种碱和一种酸,所加试剂一定能够把两种碱鉴别出来,同时还能鉴别出酸,两种碱中一种含钙离子,酸中含氢离子,故而利用碳酸钠比较合适,实验后出现三种典型现象:产生气体、产生沉淀、无明显变化。
也可以利用类似性质鉴别含碳酸钠的多种物质,如“用一种试剂鉴别碳酸钠溶液、氢氧化钠溶液、硝酸银溶液”。
分析:被鉴别物质中含碳酸钠,所加试剂一般用含钙钡离子或酸来鉴别,由于另外物质中含硝酸银,故而选择盐酸比较合适,实验后产生三种典型现象:产生沉淀、产生气体、无明显变化。
2、除杂题利用碳酸钠除去其它含钙钡离子的物质,如“除去氯化钠溶液中的氯化钙”。
分析:除去氯化钠溶液中的氯化钙,实质上是要除去钙离子,所加试剂中含碳酸根离子比较合适,所以可以选择碳酸钠,与氯化钙反应生成碳酸钙与氯化钠,过滤除去碳酸钙后得到比较纯净的氯化钠。
利用含钙钡离子物质除去碳酸根离子,如“除去硝酸钠溶液中的碳酸钠”。
分析:除去硝酸钠中碳酸钠,实质是除去碳酸根离子,一般加含钙钡离子的硝酸盐比较合适(硝酸钙或硝酸钡),然后过滤除去碳酸钙或碳酸钡沉淀,得到比较纯净的硝酸钠溶液。
此类型习题也可以加硝酸直接反应,不需要再过滤而直接得到硝酸钠溶液。
3、制取物质问题利用碳酸钠制取其它物质,由于碳酸钠在自然界能够存在且在局部地区含量比较高,所以可以制取含钠的物质或含碳酸根的物质,如“制取少量氢氧化钠”。
分析:由于碳酸钠含钠离子,能够与钙离子的碱(Ca(OH)2)反应而生成氢氧化钠。
4、证明题证明某物质里含碳酸钠,一般情况是证明含碳酸根离子,如“证明氢氧化钠里是否变质产生碳酸钠”,或“氢氧化钠是否能够与二氧化碳发生反应”。
分析:氢氧化钠与碳酸钠都显碱性,故而主要证明碳酸钠里含碳酸根,一般加入含钙钡离子或酸证明(一般产生沉淀或气体)。
5、推断题证明某些物质里是否含有碳酸根的物质(或碳酸钠),除了加入钙钡离子化合物外,还要注意加入硝酸等确定碳酸根离子,如“有一种白色固体粉未,可能含碳酸钠、硫酸钠、氯化钠、硫酸铜、硝酸钡五种物质中的一种或几种,加入水中得到无色浑浊液体;澄清后向沉淀中加入稀硝酸,沉淀全部溶解,则原固体物质中一定含什么物质?一定不含什么物质?可能含什么物质?”分析:加水得到无色浑浊液体,证明一定不含硫酸铜,能够产生白色沉淀可能是碳酸钡或硫酸钡,加入稀硝酸后沉淀全部溶解,证明全部是碳酸钡而没有硫酸钡,故而原固体一定不含硫酸钠,一定含碳酸钠和硝酸钡,最后综合考虑确定可能含氯化钠。
6、科学探究综合利用碳酸钠的特性完成除杂、证明等比较复杂问题,如“一名同学在做向氢氧化钠溶液里加入盐酸的实验时,发现溶液里产生气泡,他认为氢氧化钠变质产生碳酸钠,他想知道氢氧化钠是否全部变质为碳酸钠,请你帮助他用实验证明”。
分析:证明氢氧化钠是否全部变成碳酸钠,实质上证明碳酸钠溶液里含氢氧化钠。
由于初中课程里没有详细规定氢氧根离子与碳酸根离子的区别,教材里也没有详细介绍,所以这个问题对初中学生有一定难度。
学生一般容易直接证明氢氧根离子(如加酚酞试剂或加二氧化碳或加硫酸铜),这些方法都因为碳酸钠溶液属于强碱弱酸盐显碱性而不能使用(都变红或都与二氧化碳反应或都硫酸铜反应等)!正确方法是除去碳酸根离子后再证明氢氧根离子,把问题转化为先除去溶液中的碳酸钠,然后再证明溶液中是否含有氢氧化钠,在这种正确思路下,设计实验为:向溶液里加入过量氯化钙或氯化钡等溶液(不能加入氢氧化钙等碱溶液),充分反应后过滤,再向溶液里加入酚酞或测溶液的PH值或加硫酸铜等证明氢氧化钠溶液。