阿奇霉素片方法验证
- 格式:docx
- 大小:34.05 KB
- 文档页数:12

阿奇霉素片质量标准阿奇霉素片是一种广泛应用于临床的抗生素药物,其质量标准的制定对于保障药物的安全有效使用具有重要意义。
根据国家药典及相关法规,阿奇霉素片的质量标准应当符合一系列的指标要求,包括外观、理化性质、含量测定、溶出度、微生物限度等方面。
本文将对阿奇霉素片的质量标准进行详细介绍,以便于相关生产企业和医药行业人士了解和遵守相关规定。
首先,阿奇霉素片的外观要求应符合国家药典规定,应为白色或类白色片状固体,无明显异物。
其次,理化性质方面,阿奇霉素片应具有特定的熔点、红外光谱和紫外光谱等特征,以确保其为纯品。
同时,含量测定和溶出度的指标要求也是保证药物有效性的重要方面,应符合国家药典中的规定,保证每片药物中有效成分的含量和释放速度符合标准。
此外,阿奇霉素片的微生物限度也是至关重要的,应符合国家药典中对于细菌、真菌和大肠杆菌等微生物的限定要求,以确保药物的无菌状态。
以上这些指标要求都是为了保证阿奇霉素片的质量稳定、安全有效,符合药物生产和使用的规范要求。
在生产过程中,生产企业应当严格按照国家药典和相关法规的要求,建立健全的质量管理体系,加强原辅料的采购和检验,严格控制生产工艺,确保产品质量稳定可靠。
同时,药品监管部门也应加强对阿奇霉素片生产企业的监督检查,确保其生产的药品符合质量标准,保障患者用药安全。
总之,阿奇霉素片作为一种常用的抗生素药物,其质量标准的制定和执行对于保障患者用药安全和疗效具有重要意义。
生产企业和医药行业人士应当严格遵守国家药典和相关法规,确保阿奇霉素片的质量符合标准要求,为患者提供安全、有效的药物治疗。
同时,药品监管部门也应加强对阿奇霉素片的质量监管,保障公众用药安全,促进医药行业的健康发展。

目的:规范原辅料的检验方法和操作程序。
范围:阿奇霉素。
责任:质检员。
程序:1 性状1.1 外观检验:取样品5g,放于洁净的白瓷盘中,检查其色泽、气、味,露置30分钟后观察变化。
1.2检查本品在甲醇、丙酮、氯仿、无水乙醇、稀盐酸、水中的溶解情况。
1.3 比旋度:取样品1g,精密称定,置50ml容量瓶中,加无水乙醇溶解并定量稀释至刻度,依法测定(附录V IE),记录旋光度数据并计算比旋度。
2鉴别2.1 取本品0.25g,精密称定,置50ml定量瓶中,加无水乙醇适量溶解,再用无水乙醇稀释至刻度,摇匀,作为供试品溶液。
另取阿奇霉素标准品精密称定,置50ml定量瓶中,加无水乙醇适量溶解,再用无水乙醇稀释至刻度,摇匀,作为标准品溶液。
照3.3项下标准操作检测。
最后比较供试品溶液所显主斑点的颜色和位置分别与阿奇霉素标准品溶液的主斑点的颜色和位置。
2.2 取本品按《药品红外光谱集》722图规定的制备方法制备,最后比较本品的红外光吸收图谱与对照的图谱(图谱集722图)的异同情况。
3检查3.1结晶性取本品粉未少许,置载玻片上,依法检查(附录IXD),记录检查结果。
3.2碱度:取样品0.1g于烧杯中,加甲醇25ml,摇匀使溶解,再加水25ml,摇匀,依法测定(附录VIH),记录PH值。
3.3有关物质:取本品0.2g,精密称定,置10ml定量瓶中,加无水乙醇溶解,再阿奇霉素检验标准操作程序第2页用无水乙醇稀释至刻度,摇匀,作为供试品溶液;精密量取供试品溶液1.5ml,并取红霉素标准品30mg,置同一50ml量瓶中,另精密量取供试品溶液1.0ml、0.5ml,分别置50ml量瓶中,均用无水乙醇稀释至刻度,摇匀,作为对照溶液(1)、(2)、(3);精密量取对照溶液(3)1ml,置10ml量瓶中,用无水乙醇稀释至刻度,摇匀,作为对照溶液(4)。
照薄层色谱法(附录VB)试验。
精密吸取上述溶液各2µl,分别点于同一硅胶G薄层板上,以醋酸乙酯——正已烷——二乙胺(10:10:2)为展开剂,展开后,晾干。

UPLC法测定阿奇霉素分散片的含量王宇驰;唐克慧;张春然;张静霞;李喆宇;徐明琴;邓思思;丁文宇【摘要】目的建立超高效液相色谱法(UPLC)测定阿奇霉素分散片的含量.方法采用Agilent XDB-C18(50mm×4.6mm,1.8μm)色谱柱,流动相为磷酸盐缓冲液(取0.05mol/L磷酸氢二钾溶液,用20%磷酸溶液调pH至8.2)-乙腈(50∶50),流速为1.0mL/rmin,检测波长为210nm,柱温35℃.结果本法具有良好的专属性;在0.504~1.507mg/mL范围内,浓度与峰面积呈良好的线性关系(R2=0.9998);平均回收率为99.78%,RSD为0.81%(n=9).结论所用方法准确、可靠、耐用性强,可用于阿奇霉素分散片的含量测定.【期刊名称】《中国抗生素杂志》【年(卷),期】2015(040)010【总页数】4页(P756-759)【关键词】超高效液相色谱法;阿奇霉素分散片;含量测定【作者】王宇驰;唐克慧;张春然;张静霞;李喆宇;徐明琴;邓思思;丁文宇【作者单位】成都大学四川抗菌素工业研究所,成都610052;成都大学四川抗菌素工业研究所,成都610052;成都大学四川抗菌素工业研究所,成都610052;成都大学四川抗菌素工业研究所,成都610052;成都大学四川抗菌素工业研究所,成都610052;成都大学四川抗菌素工业研究所,成都610052;成都大学四川抗菌素工业研究所,成都610052;成都大学四川抗菌素工业研究所,成都610052【正文语种】中文【中图分类】R978.1阿奇霉素(9A-甲基-9-脱氧-9A-氮杂-9A-红霉素A)为新一代的大环内酯类药物,主要用于呼吸道感染、软组织感染、泌尿系统感染和皮肤感染等,较其他抗生素具有给药次数少、疗程短、副作用少的优点,因此在临床广泛应用于混合感染的治疗[1]。
目前,美国药典、欧洲药典、中国药典均已收载该品种,已有报道多采用HPLC法或微生物检定法测定阿奇霉素的含量[2-4],但采用超高效液相色谱法(UPLC)检测阿奇霉素的含量未见报道。


阿奇霉素片的含量检测【摘要】目的:阿奇霉素是阿奇霉素片中最重要的有效成分,所以建立一套有效的含量检测方法非常重要。
方法:采用C18柱,以pH值4.0的磷酸二氢钾-乙腈(73B27)为流动相,流速1.0mL#min-1,柱温40℃,检测波长210nm。
结果在20~1000μg·mL-1范围内,浓度与峰面积线性关系良好(r=0.9999),阿奇霉素的平均回收率100.7%,精密度RSD0.50%(n=6)。
结论:该方式比较准确,并且操作比较简便,数据灵敏度较好,并且具有很好的重现性。
【关键词】阿奇霉素 ; 含量测定; 高效液相色谱法随着时代的发展,医疗事业也得到了很大的进步,抗生素的使用范围也越来越广,阿奇霉素是具有15员氮杂内脂环的抗生素,其作为新一代的抗生素,经过了化学结构修饰,所以具有很多优势。
举例来说,其抗菌谱更为广泛,在酸性环境中稳定性更强,吸收效果更为出色,所以具有很高的生物利用度。
该药品成分具有较强的半衰期,由于感染部位细胞浓度较高,所以可以向病灶进行定向转运,毒性较低,并且具有较强的耐受性。
关于这种药物含量分析的方法,在美国药典和我国的官修药典中都已经有所收录,在美国药典中,其采用的方式为反向氧化铝柱以及安培电检测,但是该方法所需的设备对于当前国内的水平来说仍然十分复杂,条件是非常苛刻的,这给推广带来了很大的难度,推广十分困难,我国官修药典中,其含量分析的方式为微生物法。
本文结合安曲霉素自身的特点,建立了C18柱的高效液相色谱法的测定方式。
一、仪器与试剂(一)仪器日本岛津LC-10A高效液相色谱系列:LC-10AD泵,SPD-10A紫外检测器,CTO-10A柱温箱,南京千谱HW-2000色谱工作站;KQ-50DE超声波清洗器。
(二)试药与试剂阿奇霉素标准品(946U#mg-1,130352-200304,中国药品生物制品检定所);阿奇霉素片(商品名:希舒美,辉瑞制药有限公司生产,批号:35864024,35864026,35864030);阿奇霉素片(商品名:明齐欣,四川明欣药业有限责任公司生产,批号:030901);甲醇和乙腈为色谱纯,其余均为分析纯,水为重蒸馏水(武汉大学中南医院制剂室提供)。




阿奇霉素分散片制备及其质量检查一、目的与要求1、熟练正交设计法进行分散片处方工艺的筛选和分散片的制备方法。
2、熟练运用分散片的质量检查。
3、了解阿奇霉素分散片制备与质量检查。
二、实验原理分散片(dispersibletablets)又称水分散片(waterdispersibletablets) ,系指遇水迅速崩解形成均匀混悬液的一种片剂。
它在l9℃~ 2l℃水中 3min 即可崩解,崩解后形成可通过 7101 J. m 孔径筛的均匀黏性水分散体。
阿奇霉素属于大环内酯类抗生素栏目菌素。
对各种葡萄球菌、链球菌、肺炎球菌的抗菌作用比红霉素略差,肠球菌属对本品耐药;但本品对某些革兰阴性菌的作用比红霉素强,如对流感杆菌包括产β内酰胺酶菌株的 MIC比红霉素低 8倍,约0.06~1mg/L。
对摩拉卡他菌的 MIC为 0.03mg/L,对消化球菌、消化链球菌、类杆菌属和脆弱类杆菌的抗菌作用与红霉素相似或略差。
对细胞内的病原体如支原体、衣原体、军团菌等的作用也与红霉素相似。
一般对分散片质量检查的要求是:崩解时限、分散均匀性检查、溶出度检查、脆碎度。
三、仪器与材料仪器:乳钵,托盘天平,分析天平,尼龙筛(16目),烧杯,烘箱,压片机,片剂崩解仪,溶出仪,量筒,微孔滤膜等。
材料:阿奇霉素,糖精钠、聚乙烯吡咯烷酮、羟丙基纤维素、微晶纤维素、乳糖交联聚乙烯吡咯烷酮、微粉硅胶、硬脂酸镁、羧甲基淀粉钠、乙醇、蒸馏水等。
四、实验内容(一)阿奇霉素分散片的制备1. 正交试验设计根据生产实际情况,选择微晶纤维素、交联聚乙烯吡咯烷酮、乳糖、乙醇用量 ( 占处方总量的百分比)为考察因素,每个考察因素设立3个水平 ( 见表1) 。
选取崩解时限、硬度、外观为考察指标,外观分为4个等级,最好的记为1,最次的记为4。
不考虑交互作用,选用表3安排试验,试验结果详见表 2 。
综合以上试验结果优选出工艺条件:2.处方与制法分别称取阿奇霉素 ( 效价 955. 6 u ‘ mg 一 ) 262.2 g 、糖精钠 3.1 g 、聚乙烯吡咯烷酮4.6 g、羟丙基纤维素适量(保证处方总量为460g即1000片)、微晶纤维素及乳糖,混合均匀后加乙醇2250ml过4O目筛制粒。
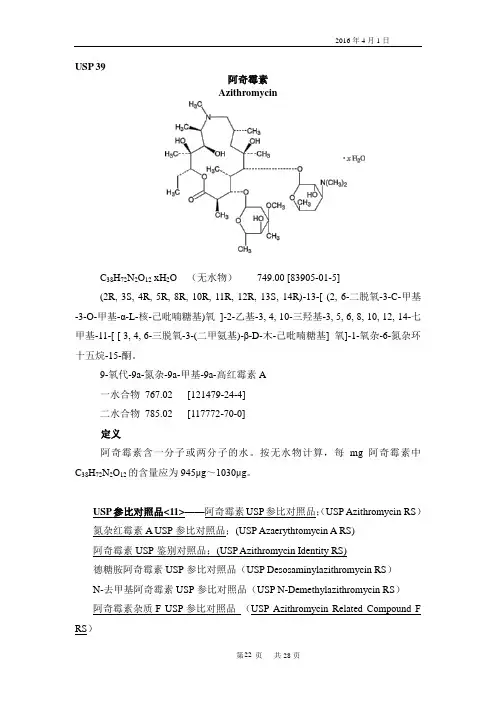
USP 39阿奇霉素AzithromycinC38H72N2O12 xH2O (无水物)749.00 [83905-01-5](2R, 3S, 4R, 5R, 8R, 10R, 11R, 12R, 13S, 14R)-13-[ (2, 6-二脱氧-3-C-甲基-3-O-甲基-α-L-核-己吡喃糖基)氧]-2-乙基-3, 4, 10-三羟基-3, 5, 6, 8, 10, 12, 14-七甲基-11-[ [ 3, 4, 6-三脱氧-3-(二甲氨基)-β-D-木-己吡喃糖基] 氧]-1-氧杂-6-氮杂环十五烷-15-酮。
9-氧代-9a-氮杂-9a-甲基-9a-高红霉素A一水合物767.02 [121479-24-4]二水合物785.02 [117772-70-0]定义阿奇霉素含一分子或两分子的水。
按无水物计算,每mg阿奇霉素中C38H72N2O12的含量应为945μg~1030μg。
USP参比对照品<11>——阿奇霉素USP参比对照品;(USP Azithromycin RS)氮杂红霉素A USP参比对照品;(USP Azaerythtomycin A RS)阿奇霉素USP鉴别对照品;(USP Azithromycin Identity RS)德糖胺阿奇霉素USP参比对照品(USP Desosaminylazithromycin RS)N-去甲基阿奇霉素USP参比对照品(USP N-Demethylazithromycin RS)阿奇霉素杂质F USP参比对照品(USP Azithromycin Related Compound F RS)【鉴别】——A:红外吸收<197K>。
(如果样品的红外谱图与标准谱图不同时,用相同体积的甲醇溶解等量的样品和对照品,在真空条件下,水浴加热至80,持续30分钟,挥干溶剂。
用残渣再做检测。
)B:在含量测定项下记录的色谱图中,供试样品溶液中阿奇霉素峰的保留时间应与对照品溶液中阿奇霉素峰的保留时间一致。
阿奇霉素胶囊2015年新版药典微生物限度检查法的建立及方法学验证摘要】目的:建立阿奇霉素胶囊微生物限度检查法并进行方法学验证。
方法:按《中国药典》2015年版四部制剂通则1105、1106项下要求进行试验。
结果:需氧菌总数检查采用薄膜过滤法(1:100供试液,冲洗量为700ml),霉菌和酵母菌检查采用培养基稀释法(1:20供试液,1ml/皿),大肠埃希菌采用薄膜过滤法(1:10供试液,分8膜,冲洗量为700ml)。
结论:该方法不影响污染微生物的生长,适用于阿奇霉素胶囊的微生物限度检查。
【关键词】阿奇霉素胶囊;微生物限度;培养基稀释法;薄膜过滤法;中和剂;方法学验证【中图分类号】R927.2 【文献标识码】A 【文章编号】2095-1752(2018)21-0339-02阿奇霉素为半合成的十五元环大环内酯类抗生素[1]。
其作用机理是通过与敏感微生物的50s核糖体的亚单位结合,从而干扰其蛋白质的合成。
抗菌谱广,对流感杆菌、淋球菌、化脓性链球菌等细菌具有显著的抗菌效果[2],因此对多种常见细菌感染病具有良好的抗菌作用[3]。
临床上主要用于敏感微生物所致的呼吸道、皮肤和软组织感染。
由于其抗菌疗效显著,近年来在国内得到了广泛应用,为使临床用药更加安全有效,实施微生物限度检查是确保药品卫生质量的有效途径[4]。
本文通过参考《中国药典》2015年版四部方法建立阿奇霉素胶囊微生物限度检查方法并进行验证,证明采用的方法适用于相应检测要求。
1.仪器与材料1.1 仪器隔水式电热恒温培养箱(型号:GSP-9160MBE,上海博迅实业有限公司),生化培养箱(型号:LRH-150,上海一恒科学仪器有限公司),匀浆仪(型号:JT-C,漯河海德实验设备有限公司),二级生物安全柜(型号:BSC-1100ⅡB2-X,济南鑫贝西生物技术有限公司)1.2 材料HTY-反复使用全封闭薄膜过滤器、微孔滤膜(尼龙,尺寸:Φ50mm,孔径:0.45μm),一次性泵管。
分光光度法测定阿奇霉素片的含量【摘要】目的:建立紫外可见分光光度法准确快速测定阿奇霉素片的含量。
方法:参考阿奇霉素片溶出度的测定方法,以乙醇和0.1 mol/L盐酸为溶剂,75→100硫酸溶液为显色剂,在室温显色30 min,然后于482 nm波长处测定显色后溶液的吸收度,与显色后的标准品溶液相比较计算阿奇霉素片的含量,并与微生物测定方法相比较。
结果:阿奇霉素在7.5~52.5 μg/mL的浓度范围内吸收度A和浓度C之间成线性相关,回归方程A=0.0201C-0.1059,r=0.9999;回收率(99.7±0.31)%,RSD=0.3 %,样品测定结果与微生物方法相一致。
结论:本方法简便、准确,适用于阿奇霉素片的含量控制。
【关键词】阿奇霉素;分光光度法;含量;测定阿奇霉素(Azithromycin)为15元环大环内酯类抗生素,抗菌谱与红霉素相类似,对化脓性链球菌、肺炎链球菌以及流感杆菌有杀菌作用,对部分葡萄球菌属具有抑菌作用,临床主要用于呼吸道、皮肤软组织感染和沙眼衣原体引起的尿道炎和宫颈炎等感染性疾病的治疗[1]。
片剂为阿奇霉素常见的剂型,2005版《中国药典》的含量检测方法是微生物法[2]。
该方法操作繁琐,检验周期长,影响因素多,不适合样品的快速分析。
另外,阿奇霉素的化学结构上无共轭双键,在紫外光区无特征吸收,无法直接用紫外分光光度法对其质量进行测定。
笔者参考阿奇霉素片溶出度的测定方法[2],并参考同类药物罗红霉素胶囊的测定方法[3],建立了用分光光度法快速检测阿奇霉素片含量的方法,现将结果报道如下。
1 仪器与试药1.1 仪器760CRT紫外可见分光光度计(上海精密科学仪器有限公司);精天FA2004A分析天平(上海良平仪器仪表有限公司)。
1.2 试药阿奇霉素原料(含量95.3%,批号:20060607)为郑州永和制药有限公司惠赠,阿奇霉素对照品(952 u/mg)购自中国药品生物制品检定所,阿奇霉素片(河南辅仁堂制药有限公司,批号:20060703、20060905、20061014)购自药店,其他试剂均为分析纯。
生产工艺验证方案——阿奇霉素(编码:PV-21102P)方案制订:七车间:日期:方案审核:QA:日期:方案批准:总工程师:日期:验证小组成员:目录页号1. 背景 32. 验证目的 33. 新老工艺的对比及优势 34. 验证范围 45. 工艺描述 4 5.1 简介 45.2 工艺流程图 66. 验证方法8 6.1 工艺验证目标8 6.2 操作方法8 6.3 产品及其生产质量管理文件8 6.4 原料9 6.5 设施和设备106.5.1主要生产设备106.5.2主要公用系统126.5.3主要检测仪器12 6.6 关键工艺参数13 6.7 关键中间控制及成品质量13 6.8 取样13 6.9 稳定性考察14 8. 验证的的执行14阿奇霉素原料药车间位于袍江厂区14号建筑,为专用车间。
阿奇霉素原料药已于2004年11月通过国家GMP认证检查,原来与罗红霉素共用车间,为了防止产品在生产过程的混淆,现新建了阿奇霉素原料药车间。
为了降低成本,提高收率,提高产品质量,对原工艺进行了优化,故对阿奇霉素生产工艺进行再验证。
在此之前,已对主要设备、空气净化系统、水系统及设备进行了安装确认。
在此基础上,公司制订了该验证方案。
此验证方案的设计有助于证明阿奇霉素原料药生产过程的稳定性及生产系统的可靠性。
2. 验证目的为评价阿奇霉素原料药生产系统要素和生产过程中可能影响产品质量的各种生产工艺变化因素,提供系统的验证计划。
以建立适当的文件事实证明,袍江厂区阿奇霉素的生产工艺能够持续生产出符合中国药典2010年版二部及公司内控要求的规格和质量特征。
3.新老工艺的对比及优势3.1红霉素A亚胺醚的制备3.1.1新工艺弃用对甲苯磺酰氯丙酮溶液和碳酸钠水溶液,改用甲基磺酰氯。
提高了产品的质量。
3.1.2新工艺弃用二氯甲烷。
革除了原工艺反应后的萃取、洗涤、浓缩等提纯步骤,提高了收率。
3.1.3新工艺不采用干燥,减少了干燥过程中的损失。
3.2阿奇霉素粗品制备3.2.1还原反应3.2.1.1新工艺用水代替乙二醇、甲醇的混合溶剂使用。
阿奇霉素分散片微生物限度检查方法验证
李秋菲;赵玉绒;裴小龙;高飞
【期刊名称】《中国药业》
【年(卷),期】2008(17)19
【摘要】目的建立阿奇霉素分散片的微生物限度检查方法.方法人工加入5种阳性对照菌,测定其回收率.结果根据回收率试验结果,判定阿奇霉素分散片对细菌的抑菌作用强.结论必须采用离心集菌薄膜法才能清除样品的押菌作用,该法可用于阿奇霉素分散片的微生物限度检查.
【总页数】2页(P15-16)
【作者】李秋菲;赵玉绒;裴小龙;高飞
【作者单位】陕西省食品药品检验所,陕西,西安,710061;陕西省新药评审中心,陕西,西安,710061;陕西省食品药品检验所,陕西,西安,710061;陕西省榆林市药品检验所,陕西,榆林,719000
【正文语种】中文
【中图分类】R927.11;R978.1+5
【相关文献】
1.微生物限度和无菌检查方法验证中存在的问题 [J], 郭焕君
2.3种不同抑菌性的耳用制剂微生物限度检查方法验证及应用 [J], 金文丽;王艳;隆旭红;刘光斌;谢静
3.复方青香胶囊微生物限度检查方法的建立和验证 [J], 郝媛;姚敏娜;王昱锦
4.20种医院制剂微生物限度检查方法验证及应用 [J], 金文丽;王艳;隆旭红;刘光斌;
谢静;董玉兰
5.五花解毒颗粒微生物限度检查方法验证 [J], 谢宁;蔡妮娜
因版权原因,仅展示原文概要,查看原文内容请购买。
阿奇霉素分散片溶出度试验
许文祥;金雪勇
【期刊名称】《中国药业》
【年(卷),期】2005(14)2
【摘要】目的:建立一种阿奇霉素分散片溶出度的测定方法及验证分散片的体外释药特性.方法:以pH=6.0的磷酸盐缓冲液为溶剂,以硫酸显色分光光度法测定阿奇霉素分散片的溶出度.结果:在20~30 min内硫酸显色完全,稳定性好,平均回收率为100.08%,RSD为0.66%;阿奇霉素分散片在3 min时溶出率可达85%以上.结论:分光光度法简便、快捷、稳定、准确,可用于控制该产品的质量;分散片具有良好的体外释药特性.
【总页数】2页(P45-46)
【作者】许文祥;金雪勇
【作者单位】正大青春宝药业有限公司,浙江,杭州,310023;正大青春宝药业有限公司,浙江,杭州,310023
【正文语种】中文
【中图分类】TQ460.7+2;R978.1+9
【相关文献】
1.阿奇霉素分散片溶出度测定方法研究 [J], 孙军红
2.阿奇霉素分散片与其普通片溶出度比较考察 [J], 汪涛;姚荧;徐正强;邓丽琴
3.阿奇霉素分散片溶出度方法的改进 [J], 高秀珊;杨洪贤;卜笑非
4.阿奇霉素分散片的制备与溶出度测定 [J], 张丽娥;诸葛中淅
5.盐酸氨溴索胶囊体外溶出度试验和生物等效性研究 [J], 毕德忠
因版权原因,仅展示原文概要,查看原文内容请购买。
一.概述1 有关物质1.1照高效液相色谱法(通则0512)测定1.2色谱条件十八烷基硅烷键合硅胶为填充剂;流动相A为磷酸盐缓冲液(取0.05mol/L磷酸氢二钾溶液,用20%的磷酸溶液调节pH值至8.2)-乙腈(45∶55),流动相B为甲醇,柱温为30℃(必要时适当调整);按下表进行线性梯度洗脱;流速为每分钟1.0ml,检测波长为210nm。
取杂质S和杂质A对照品各适量,加上述稀释液溶解并稀释制成每1ml中各约含0.05mg的溶液,作为杂质S和杂质A对照品溶液;另取阿奇霉素系统适用性对照品(含杂质R、杂质Q、杂质J、杂质I、杂质H、阿奇霉素和杂质B)适量,加上述对照品溶液溶解并稀释制成每1ml中约含10mg的溶液,作为系统适用性溶液;精密量取对照溶液10ml,置50ml量瓶中,用稀释液稀释至刻度,摇匀,作为灵敏度溶液,取系统适用性溶液和灵敏度溶液各50μl,分别注入液相色谱仪,灵敏度溶液主成分峰峰高的信噪比应大于10,系统适用性溶液色谱图中各峰之间的分离度均应大于1.2,阿奇霉素峰的保留时间35 95 564 95 565 75 251.3测定法取本品细粉适量,加稀释液[磷酸二氢铵溶液(称取磷酸二氢铵1.73g,加水溶解并稀释至1000ml,用氨试液调节P H值至10.0±0.05)-甲醇-乙腈(7:7:6)]使阿奇霉素溶解并稀释制成每1ml中含阿奇霉素10mg的溶液,滤过,取续滤液作为供试品溶液;精密量取1 ml,置200 ml量瓶中,加稀释液稀释至刻度,摇匀,作为对照溶液。
精密量取供试品溶液和对照溶液各50μl,分别注入液相色谱图仪,记录色谱图。
供试品溶液色谱图中如有杂质峰,杂质B峰面积不得大于对照溶液主峰面积的4倍(2.0%),杂质H与杂质Q按校正后的峰面积计算(分别乘以校正因子0.1、0.4)不得大于对照溶液主峰面积的2倍(1.0%),其他单个杂质峰面积不得大于对照溶液主峰面积的2倍(1.0%),各杂质峰面积的和按校正后的峰面积计算不得大于对照溶液主峰面积的8倍(4.0%)。
2溶出度2.1照溶出度与释放度测定法(通则0931第二法)测定。
2.2取本品,以磷酸盐缓冲液(pH6.0)(0.1mol/L磷酸氢二钠溶液6000ml,加盐酸约40ml,调节PH值至6.0±0.05)900ml为溶出介质,转速为每分钟100转,依法操作,经45分钟时,取溶液适量,滤过,精密量取续滤液适量,用溶出介质定量稀释制成每1ml中约含阿奇霉素0.2mg的溶液,作为供试品溶液;另取阿奇霉素对照品适量,精密称定,加适量乙醇(每2mg约加乙醇1ml)使溶解,用溶出介质定量稀释制成每1ml中约含0.2mg的溶液,作为对照品溶液。
照含量测定项下的方法测定,按外标法以峰面积计算每片的溶出量。
限度为标示量的75%,应符合规定。
3含量3.1照高效液相色谱法(通则0512)测定。
3.2色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取0.05mol/L磷酸氢二钾溶液,用20%的磷酸溶液调节pH值至8.2)-乙腈(45∶55)为流动相;检测波长为210nm。
取阿奇霉素系统适用性试验对照品适量,加乙腈溶解并稀释制成每1ml中含10mg的溶液,取50μl注入液相色谱仪,记录的色谱图应与标准图谱一致。
3.3测定法取本品10片,精密称定,研细,精密称取适量(约相当于阿奇霉素0.1g),加乙腈溶解并定量稀释制成每1ml中约含阿奇霉素1mg的溶液,滤过,取续滤液作为供试品溶液,精密量取50μl注入液相色谱仪,记录色谱图;另取阿奇霉素对照品适量,同法测定。
按外标法以峰面积计算,即得。
4.工艺处方组成5、仪器基本情况:6.相关术语:6.1准确度系指采用该方法测定的结果与真实值或参考值接近的程度。
一般用回收率(%)表示。
回收率限度应在98%~102%之间。
6.2精密度系指在规定的条件下同一份均匀的供试品,经多次取样测定所得结果之间的接近程度。
精密度一般用偏差、标准偏差或相对标准偏差表示。
6.3线性系指在设计的测定范围内,测定结果与试样中被测物的浓度直接呈比例关系的程度。
6.4范围系指分析方法能达到一定精密度、准确度和线性要求时的高低限浓度或量的区间。
6.5检测限系指试样中被测物能被检测出的最低量。
6.6耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度。
二.验证目的通过验证以确认所采用的方法适合于阿奇霉素片的测定。
根据样品特性制订检验方法和检验条件,按制定的方法进行试验,根据验证结果判断是否符合验证标准。
若符合,按验证的方法和条件进行阿奇霉素片检查;若不符合,重新建立制订检验方法和检验条件,再进行验证,直至验证结果符合设立的验证标准。
三.验证依据中国药典2015年版二部中国药典2015年版四部9101《药品质量标准分析方法验证指导原则》四.参考文件1、验证管理规程2、验证总计划3、SIL-20A高效液相色谱仪操作维护保养规程5、变更控制规程6、偏差控制规程五.验证职责六.验证步骤1. 阿奇霉素片含量分析方法验证1.1系统适应性试验1.1.1色谱条件①固定相:十八烷基硅烷键合硅胶色谱柱(C18);②检测器:紫外检测器,检测波长210nm;③流动相:磷酸盐缓冲液(0.05mol/L 磷酸氢二钾溶液,用20%磷酸溶液调节PH值至8.2)-乙腈=(45:55)④流速:1.0mL/min。
⑤柱温:30℃⑥进样量:50μL。
照高效液相色谱法(通则0512)测定。
1.1.2系统适用性试验溶液:取阿奇霉素系统适用性对照品约20mg加乙腈2ml溶解,制成每1ml中含10mg的溶液,作为系统适用性试验溶液。
1.1.3取系统适用性试验溶液50μL注入液相色谱仪。
1.1.4判定标准:记录的色谱图应与标准图谱一致。
1.2阿奇霉素片含量分析方法线性验证1.2.1溶液配制1.2.1流动相配制以磷酸盐缓冲液(取0.05mol/L磷酸氢二钾溶液,用20%的磷酸溶液调节pH值至8.2)-乙腈(45∶55)为流动相1.2.2处方量辅料配制精密称定糊精约200mg、低取代羟丙纤维素约250mg、微晶纤维素约695mg、羧甲淀粉钠200mg、硬脂酸镁80mg、聚维酮K30 80mg 混合。
此混合辅料约为10片阿奇霉素片(2.5g)所需的辅料共约1505 mg。
1.2.3样品溶液配制精密称取阿奇霉素对照品约8mg 、9mg 、10mg 、11mg,12 mg,置10ml量瓶中,乙腈溶解并稀释至刻度,摇匀,作为对照品溶液。
按80%、90%、100%、110%、120%的倍数稀释,加乙腈配置成浓度为0.8mg /ml、0.9mg /ml、1mg/ml、1.1mg /ml、1.2mg /ml 的溶液。
1.2.4测定精密量取经微孔滤膜过滤后各不同浓度稀释液50μl,注入液相色谱仪,每个样品进样2次,记录色谱图。
1.2.5判定标准:阿奇霉素在0.8 mg /ml至1.2mg /ml的浓度范围内,阿奇霉素峰面积成线性且相关系数R≥99.8%。
1.3阿奇霉素片含量分析方法精密度验证1.3.1流动相配制见阿奇霉素片含量分析方法线性验证项下。
1.3.2样品溶液配制取阿奇霉素片(XXXX生产)10片,研细,精密称取样品适量(约相当于阿奇霉素0.1g )置100ml量瓶中,加乙腈溶解并定量稀释制成每1ml中约含阿奇霉素1mg的溶液,滤过,取续滤液作为供试品溶液;1.3.3 测定精密量取50μl注入液相色谱仪,记录色谱图,连续6次,得到拉呋替丁峰面积。
1.3.4判定标准:峰面积的S rel≤2.0%。
1.4阿奇霉素片含量分析方法准确度验证1.4.1流动相配制、处方量辅料配制见阿奇霉素片含量分析方法线性验证项下。
1.4.2样品溶液配制精密称取阿奇霉素对照品约8mg 、10mg 、12 mg,置10ml量瓶中,乙腈溶解并稀释至刻度,摇匀,作为对照品溶液。
按80%、100%、120%的倍数稀释,加乙腈配置成浓度为0.8mg /ml、1mg/ml、1.2mg /ml的溶液。
1.4.3测定精密量取50μl注入液相色谱仪,记录色谱图,得到阿奇霉素峰面积。
通过线性方程计算阿奇霉素浓度。
用测得浓度和实际浓度之比计算回收率。
1.4.4判定标准:回收率限度应在98%-102%之间,回收率的S rel≤2.0%。
1.5阿奇霉素片含量分析方法范围验证1.5.1数据记录及结果计算依据1.2线性,1.3精密度,1.4准确度,确定高效液相色谱法符合《中国药典》2015版阿奇霉素峰含量的范围一般为测定浓度的范围。
1.5.2判定标准:含量的范围一般为测定浓度的 80%〜120%。
1.6阿奇霉素片含量分析方法专属性验证1.6.1流动相配制、处方量辅料配制见阿奇霉素片含量分析方法线性验证项下。
1.6.2溶液配制1.6.2.1供试品溶液:取阿奇霉素片(XXXX生产)10片,研细,精密称取样品适量(约相当于阿奇霉素0.1g )置100ml量瓶中,加乙腈溶解并定量稀释制成每1ml中约含阿奇霉素1mg的溶液,滤过,取续滤液作为供试品溶液;1.6.2.2精密称取阿奇霉素对照品(约25mg),置25ml量瓶中,乙腈溶解并稀释至刻度,摇匀,作为对照品溶液。
1.6.2.3空白溶液:取乙腈作为空白溶液。
1.6.2.4阴性溶液:按照阿奇霉素片配方,加入处方量混合辅料60.2mg,置100ml量瓶中,加乙腈溶解并稀释至刻度,摇匀,滤过(0.45um微孔滤膜),滤过,续滤液,作为阴性溶液。
1.6.3测定精密量取经微孔滤膜过滤后的供试品溶液、对照品溶液、空白溶液、阴性溶液各50μl,注入液相色谱仪,每个样品进样2次,记录色谱图。
1.6.4判定标准:阿奇霉素对照品溶液与样品溶液主峰保留时间一致,空白溶液与阴性溶液在主峰保留时间处应为平直基线,无吸收峰。
1.7阿奇霉素片含量分析方法耐用性验证1.7.1改变流动相比例1.7.1.1色谱条件①固定相:十八烷基硅烷键合硅胶色谱柱(C18);②检测器:紫外检测器,检测波长210nm;③流动相:磷酸盐缓冲液(0.05mol/L 磷酸氢二钾溶液,用20%磷酸溶液调节PH值至8.2)-乙腈=(40:60)④流速:1.0mL/min。
⑤柱温:30℃⑥进样量:50μL。
照高效液相色谱法(通则0512)测定。
1.7.1.2系统适用性试验溶液:取阿奇霉素系统适用性对照品约20mg 加乙腈2ml溶解,制成每1ml中含10mg的溶液,作为系统适用性试验溶液。
1.7.1.3取系统适用性试验溶液50μL注入液相色谱仪。
1.7.1.4判定标准:在改变流动相比例后,记录的色谱图应与标准图谱一致。
2. 阿奇霉素片溶出度分析方法验证2.1阿奇霉素片溶出度分析方法线性验证照溶出度与释放度测定法 (通则0931第二法及高效液相色谱法测定法测定)2.1.1溶液配制2.1.1.1取磷酸盐缓冲液(pH6.0)(0.1mol/L磷酸氢二钠溶液6000ml,加盐酸约40ml,调节PH值至(6.0±0.05)900ml为溶出介质。