华东理工大学物理化学考研试题
- 格式:doc
- 大小:216.00 KB
- 文档页数:4

2021年华东理工考研真题一、填空1、甲苯燃烧反应,C7H8(l) + 9O2(g) = 7CO2(g) + 4H2O(l),求(Q V–Q p)/RT=_______________)T=________________2、求范德华气体的(ðUðV3、绝热恒容容器中发生H2 + 1/2O2 = 1/2H2O(l)的反应,则过程的ΔH_____0,ΔS____0。
4、理想气体的焓是温度的函数,在常温下,H m = A + BT,单原子理想气休的B/R = _____5、1 mol单原子理想气体在恒容条件下从T1变到T2,过程的ΔS = 12.3 J·K-1,若该过程为恒压过程,则ΔS =________ J·K-1。
6、在298.15 K时,纯B的摩尔体积大于B溶解在A里的偏摩尔体积,则随着压力的增加,B的溶解度___________7、A,B形成理想液态混合物,p A* = 90 kPa,p B* = 60 kPa。
在气相中,A,B的分压相同,则混合物的液相组成x B = __________8、在298.15 K时,纯A的饱和蒸气压为68.9 kPa,在1 mol A中加入10 g非挥发性溶质B后,A的蒸气分压下降到62.6 kPa,则B的摩尔质量为_______kg·mol-19、A(s)与H2O(l)可形成A·H2O(s)、A·2H2O(s)和A·5H2O(s)三种水合物,则在298.15 K时,与A的水溶液、冰平衡共存的水合物最多有_____种。
10、700 K时,Ag2O(s) 2Ag + 1/2O2(g)的Δr G mө = 15.36 kJ·mol-1,则700 K时Ag2O的分解压是__________kPa。
11、某药物在298.15 K时每天分解0.06%,在323.15 K时每天分解0.5%,且分解速率和浓度成正比。


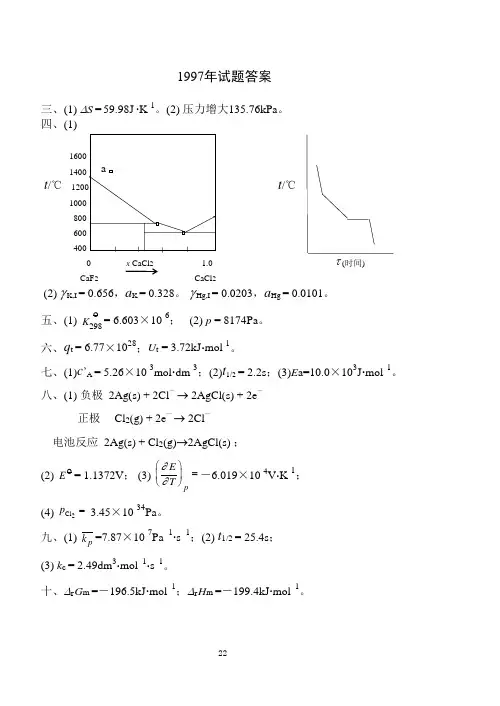
三、(1) ∆S = 59.98J ∙K -1。
(2) 压力增大135.76kPa 。
四、(1)1600 1400 t /℃ 1200 t /℃ 1000 800 600 400 0 x CaCl 2 1.0 τ (时间) CaF 2 CaCl 2(2) γ K,I = 0.656,a K = 0.328。
γ Hg,I = 0.0203,a Hg = 0.0101。
五、(1) K 298o= 6.603×10-6; (2) p = 8174Pa 。
六、q t = 6.77×1028;U t = 3.72kJ ∙mol -1。
七、(1)c ’A = 5.26×10-3mol ∙dm -3;(2)t 1/2 = 2.2s ;(3)E a=10.0×103J ∙mol-1。
八、(1) 负极 2Ag(s) + 2Cl — → 2AgCl(s) + 2e —正极 Cl 2(g) + 2e —→ 2Cl —电池反应 2Ag(s) + Cl 2(g)→2AgCl(s) ; (2)E o= 1.1372V ; (3) ∂∂E T p⎛⎝⎫⎭⎪=-6.019×10-4V ∙K -1; (4) p Cl 2= 3.45×10-34Pa 。
九、(1) k p =7.87×10-7Pa -1∙s -1;(2) t 1/2 = 25.4s ; (3) k c = 2.49dm 3∙mol -1∙s -1。
十、∆rG m =-196.5kJ ∙mol -1;∆rH m =-199.4kJ ∙mol -1。
- - a- -- -二、(1)质量百分数:2.81%。
(2) p总= 85.50kPa,V O2= 59.70cm3。
三、∆r o mH,1000=-21.73kJ∙mol-1。
四、V2 = 2.80dm3;T2 = 134.7K;∆U = -1.68kJ;∆H = -2.80kJ;∆S = -20.17J∙K-1;W = 2240J。

2000年华东理工大学物理化学考研真题答案物理化学作为化学学科的重要分支,对于深入理解化学现象和过程具有关键意义。
以下是 2000 年华东理工大学物理化学考研真题的答案及相关解析。
一、选择题1、理想气体在绝热可逆膨胀过程中()A 温度不变B 熵不变C 内能不变D 焓不变答案:B解析:绝热可逆过程熵不变。
理想气体绝热可逆膨胀时,对外做功,内能降低,温度下降,焓也降低。
2、对于封闭体系,在指定始终态间的绝热可逆途径可以有()A 一条B 二条C 三条D 无限多条答案:A解析:绝热可逆过程中熵不变,对于给定的始终态,熵值确定,所以只有一条绝热可逆途径。
3、 1mol 理想气体经一等温可逆压缩过程,则()A ΔG >ΔAB ΔG <ΔAC ΔG =ΔAD 无法比较答案:C解析:对于等温可逆过程,ΔG =ΔA 。
4、已知反应 A + B = C + D 的速率方程为 r = kAB²,则该反应()A 一定是基元反应B 一定是非基元反应C 不能确定是否为基元反应D 为二级反应答案:C解析:速率方程不能直接确定反应是否为基元反应。
该反应为三级反应。
5、某反应的活化能为 80 kJ·mol⁻¹,当反应温度由 293K 升高到303K 时,其反应速率常数约为原来的()A 2 倍B 3 倍C 4 倍D 5 倍答案:B解析:根据阿仑尼乌斯公式 k₂/k₁= expEa/R(1/T₁ 1/T₂) ,计算可得约为 3 倍。
二、填空题1、在恒温恒压下,纯物质的化学势μ 随温度 T 的变化率为 S。
2、某理想气体在绝热条件下向真空膨胀,其ΔU = 0 ,ΔH = 0 。
3、克劳修斯不等式的表达式为:∫(δQ/T) ≤ 0 。
4、电池反应 Ag⁺+ Cl⁻= AgCl(s) 的标准电动势 E⁰= 02223 V 。
5、朗缪尔吸附等温式为:θ = bp/(1 + bp) ,其中 b 为吸附系数。
三、简答题1、简述热力学第二定律的两种表述。

1997年物化试题一、(16分)(1) 理想气体温度计以 为测温性质。
(2) 实际气体的压缩因子Z 。
( ①不会等于1;②可以大于、等于、小于1。
) (3) 已知1mol CO 2气体分子的已占体积 b = 0.0427×10-3m 3mol -1。
若气体可视为van der Waals 流体,则1mol CO 2气体分子本身的体积为 。
(4) 在两个不同温度热源间运转着两个可逆热机,其工作介质分别为水和理想气体,则这两个可逆热机的效率 。
(相同,不相同)(5) 一绝热、密闭容器中的氢气和氧气经点燃后迅速化合成水,其熵变∆S 0。
(>,=,<)(6) 如下两个偏导数,何者是偏摩尔量。
( )①∂∂G n T V ni j [i]⎛⎝ ⎫⎭⎪,, ; ②∂∂H n T p ni j [i]⎛⎝ ⎫⎭⎪,,(7) 对于化学反应0=∑νB BB ,其化学平衡条件为 。
(8) 若化学反应系统可视为理想溶液,则o K K x 。
(>,=,<) (9) 系统存在弯曲界面时的力平衡条件通式为 。
(10) 气体在固体表面上吸附的BET 理论与兰缪尔理论,它们最显著的不同是 。
(11) 在相同温度下移动子、线型刚体转子、单维简谐振子,何者的配分函数最大。
。
(12) 能量标度零点设在基态能级上的电子配分函数q 0 e 与电子基态能级的简并度g e 0之间的关系为 。
(13) 正反应放热的对峙反应的基本特征是 。
(14) 过渡状态理论认为,双分子基元反应的模式为_________________________ 。
(15) 已知25℃时,在无限稀释水溶液中 Na + 和21SO 42—的摩尔电导率分别为50.1×10 -4S ∙m -2∙mol -1和79.8×10 -4S ∙m -2∙mol -1,则 Na 2SO 4 的___________m =Λ∞。
(16) 电池 Ag, AgCl(s) |Cl — ¦ ¦A g + | Ag 应该用 做盐桥。

2021年华东理工考研物理化学真题一、填空1、甲苯燃烧反应,C7H8(l) + 9O2(g) = 7CO2(g) + 4H2O(l),求(Q V–Q p)/RT=_______________2、求范德华气体的________________3、绝热恒容容器中发生H2 + 1/2O2 = 1/2H2O(l)的反应,则过程的ΔH_____0,ΔS____0。
4、理想气体的焓是温度的函数,在常温下,H m = A + BT,单原子理想气休的B/R = _____5、1 mol单原子理想气体在恒容条件下从T1变到T2,过程的ΔS = 12.3 J·K-1,若该过程为恒压过程,则ΔS =________ J·K-1。
6、在298.15 K时,纯B的摩尔体积大于B溶解在A里的偏摩尔体积,则随着压力的增加,B的溶解度___________7、A,B形成理想液态混合物,p A* = 90 kPa,p B* = 60 kPa。
在气相中,A,B的分压相同,则混合物的液相组成x B = __________8、在298.15 K时,纯A的饱和蒸气压为68.9 kPa,在1 mol A中加入10 g非挥发性溶质B后,A的蒸气分压下降到62.6 kPa,则B的摩尔质量为_______kg·mol-19、A(s)与H2O(l)可形成A·H2O(s)、A·2H2O(s)和A·5H2O(s)三种水合物,则在298.15 K时,与A的水溶液、冰平衡共存的水合物最多有_____种。
10、700 K时,Ag2O(s) → 2Ag + 1/2O2(g)的Δr G mө = 15.36 kJ·mol-1,则700 K时Ag2O的分解压是__________kPa。
11、某药物在298.15 K时每天分解0.06%,在323.15 K时每天分解0.5%,且分解速率和浓度成正比。