《分子间作用力和氢键》
- 格式:pdf
- 大小:2.18 MB
- 文档页数:13


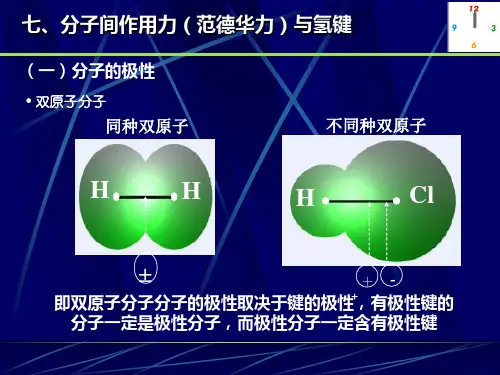



氢键和分子间作用力
氢键是一种分子间作用力,通常以“H”表示。
它是由一个极性分子中的一个部分和另一个极性分子中的一个部分之间的反向电荷
吸引力。
这种作用力比分子间力更强,因此分子之间的距离更近。
氢键常常在生物分子中发现,如DNA和蛋白质。
DNA的双螺旋结构是通过氢键形成的。
在蛋白质中,氢键会影响蛋白质的三维结构,因此影响它们的功能。
氢键也在化学反应中发挥着重要作用。
例如,在酸碱反应中,氢键是质子转移的关键。
在酸碱反应中,酸中的氢离子(H+)从酸分子中转移到碱分子中,形成水分子。
这种转移是通过氢键实现的。
总之,氢键是一种重要的分子间作用力,它们在生物和化学领域都发挥着重要作用。
了解氢键的性质和作用可帮助我们更好地理解分子之间的相互作用,进而为我们的科学研究和工作提供基础。
- 1 -。



必修2第一章第三节化学键第三课时【学习目的】1、掌握分子间作用力含义与氢键的判断2、强化离子键和共价键的知识【学习重点】分子间作用力、氢键的应用【学习难点】氢键的判断【新知学习】一、化学键:1、定义:使离子或原子相结合的作用力称为化学键。
2、分类:、、3、离子键和共价键的比较:4、化学反应的实质:旧键的和新键的。
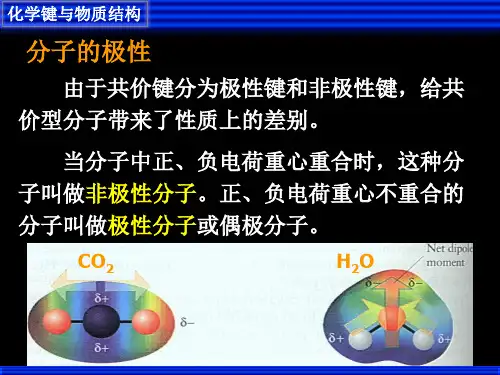
二、分子间作用力①概念:分子之间存在着一种把分子叫做分子间作用力,又称。
②强弱:分子间作用力比化学键,它主要影响物质的、等物理性质,化学键属分子内作用力,主要影响物质的化学性质。
③规律:一般来说,对于组成和结构相似的物质,越大,分子间作用力,物质的熔点、沸点也越。
④存在:分子间作用力只存在于由分子组成的共价化合物、共价单质和稀有气体的分子之间。
在离子化合物、金属单质、金刚石、晶体硅、二氧化硅等物质中只有化学键,没有分子间作用力。
三、氢键①概念:像、、这样分子之间存在着一种比的相互作用,使它们只能在较高的温度下才能汽化,这种相互作用叫做氢键。
②对物质性质的影响:分子间形成的氢键会使物质的熔点和沸点,这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗更多的能量。
【注意】分子间作用力和氢键由于作用力较弱,都不属于化学键!四、知识整理1、离子键:使阴、阳离子结合成化合物的静电作用叫做离子键由离子键结合在一起的化合物叫离子化合物【离子键的存在范围】(1)、活泼金属与活泼非金属形成的化合物;(2)、活泼金属阳离子(或NH4+)与酸根离子之间;(3)、活泼金属阳离子与OH—之间;2、电子式:在元素符号周围用小黑点或小叉表示最外层电子数的式子叫电子式掌握NaCl/MgO/K2O/CaCl2/Na2O2/NH4Cl/NaOH 电子式的写法3、共价键:原子之间通过共用电子对所形成的相互作用,叫做共价键掌握NH3,CH4,CO2,N2,O2,HClO,H2O2电子式的写法4、极性键与非极性键同种非金属元素原子之间形成非极性共价键(非极性键,可存在于非金属单质和化合物中)不同种非金属元素原子之间形成极性共价键(极性键,只存在与化合物中)(1)、含有离子键的化合物一定是离子化合物(2)、含有共价键的化合物不一定是共价化合物注意离子化合物的形成过程与共价化合物的形成过程写法的不同。

高中化学选修3分子间作用力和氢键知识点总结一.分子间作用力1.定义:分子间存在着将分子聚集在一起的作用力,称分子间作用力。
分子间作用力也叫范德华力.2.实质:一种电性的吸引力.3.影响因素:分子间作用力随着分子极性.相对分子质量的增大而增大.分子间作用力的大小对物质的熔点.沸点和溶解度都有影响.一般来说.对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越强,物质的熔沸点也越高.4.只存在于由共价键形成的多数化合物,绝大多数非金属单质分子和分子之间.化学键是分子中原子和原子之间的一种强烈的作用力,它是决定物质化学性质的主要因素。
但对处于一定聚集状态的物质而言,单凭化学键,还不足以说明它的整体性质,分子和分子之间还存在较弱的作用力。
物质熔化或汽化要克服分子间的作用力,气体凝结成液体和固体也是靠这种作用力。
除此以外,分子间的作用力还是影响物质的汽化热、熔化热、溶解黏度等物理性质的主要因素。
分子间的作用力包括分子间作用力(俗称范德华力)和氢键(一种特殊的分子间作用力)。
分子间作用力约为十几至几十千焦,比化学键小得多。
分子间作用力包括三个部分:取向力、诱导力和色散力。
其中色散力随分子间的距离增大而急剧减小,一般说来,组成和结构相似的物质,分子量越大,分子间距越大,分子间作用力减小,物质熔化或汽化所克服的分子间作用力减小,所以物质的溶沸点升高。
化学键与分子间作用力比较化学键分子间作用力概念相邻的原子间强烈的相互作用物质分子间存在的微弱的相互作用能量较大很弱性质影响主要影响物质的化学性质主要影响物质的物理性质二.氢键-特殊的分子间作用力1.概念:氢键是指与非金属性很强的元素(主要指N、O、F)相结合的氢原子与另一个分子中非金属性极强的原子间所产生的引力而形成的.必须是含氢化合物,否则就谈不上氢键。
2.实质:氢键不是化学键,属于分子间作用力的范畴.但比普通分子间作用力要强得多.3.存在:水.冰.氨.无机酸.醇等物质能形成氢键.4.分类:分子内氢键和分子间氢键5.影响:分子间氢键的形成除使物质的熔沸点升高外,对物质的溶解度.硬度等也都有影响.6.表示法:用"X—H…Y"表示,且三原子要在一条直线上.X、Y与H构成分子。
《分子间作用力和氢键》教学设计晓妹昌河中学一、教材分析“分子间作用力和氢键”是人教版化学新教材“必修2”第一章第三节中“科学视野”栏目的教学容,主要是为了开拓学生视野,拓展知识面,提高学生学习兴趣而设置的。
对于此类容的教学,教师可作机动处理,因而在实际教学中,许多教师把它放弃或只作为学生课后阅读。
笔者认为应根据各校学生的实际状况,引导学生结合生活经验,生活实例和已掌握的知识,通过查阅有关资料,真正感悟分子间作用力和氢键的存在及其对物质物理性质的影响,同时要把握好难度,体现新教材的教学要求。
这正是新课程改革的精髓所在。
二、教学目标1 . 了解分子间作用力的概念及对物质的熔点、沸点等物性的影响。
2 .常识性介绍氢键及其对物质性质的影响。
三、重点、难点分子间作用力、氢键对物质的熔点、沸点等物性的影响三、教学过程【提问】Cl2、HCl是以什么键结合的?什么是极性键?什么是非极性键?用电子式表示其形成过程。
4么是分学?有哪些社员?水蒸气为什么会变成液态,液态水会变成冰?【讲述】分子间距离缩短,由无规则运动变有规则排列,说明分子间存在着作用力。
【板书】一、分子间作用力【板书】i.定义:把分子聚集在一起的作用力叫分子间作用力,乂称德华力【思考】在一盛有氢气的集气瓶中是否存在分子间作用力?【板书】2.由分子构成的物质分子间都存在着作用力,不同物质分子间作用力也不同。
【讲述】如:M沸点一196C、Q沸点一183C,即固态变气态所需能虽不同、分子间作用力越大,熔、沸点越高。
【设问】F2、Cl 2、、Brz、、I2的熔沸点如何变化?【板书】3.对组成相似的物质,相对分子质虽越大,分子间作用力越大,物质的熔沸点越高。
【思考】对于四氟化碳、四氯化碳、四漠化碳、四碘化碳,其熔沸点如 何变化?【板书】4.分子间作用力比化学键弱得多,不是化学键,所以由分子间作用力结合的物质熔点较底。
............ ..................................... ;、 ,/ • • rI 7 '—» / ▼ - — — — — ____ — - r I 7 I I / , r / r 7 ; 7 7 ▼ r / — ,-隹O如H — Cl 键能为431 kJ /mol ,而HCl 分子间作用力为 21 kJ*萋%1化学键的键能为 120—800kJ/mol ,分子间作用力每摩尔约几千 /mol【投影】 【练习】列物质受热熔化时,不需要破坏化学键的是(A.ISil 孝H 嘲好的思质,随福辅叩/勺号强,熔、沸点升高 (学生作出、"仁'任小3ANH 山 T 八、、- 应为一170C 以下)【讲述】【设问】【板书】 【板书】【讲述】氢键的形成增加了分子间作用力,所以沸点升高。