第三章物质构成的奥秘课题2元素
- 格式:doc
- 大小:45.00 KB
- 文档页数:3


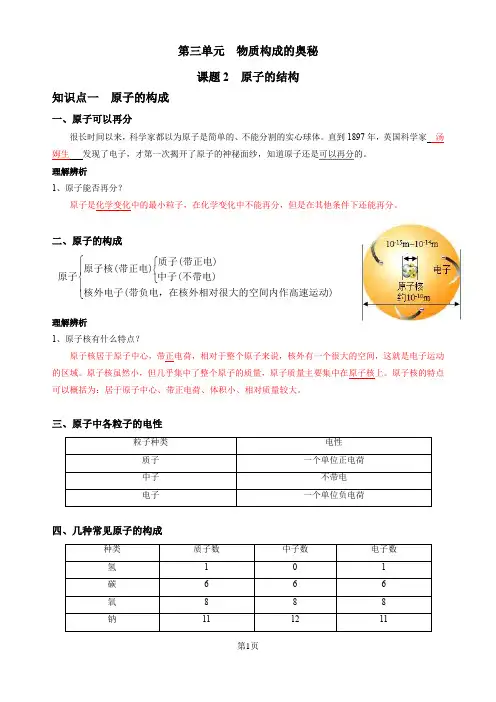
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。


第三单元物质构成的奥秘课题1 分子和原子【知识目标】1.了解物质是由分子、原子等微观粒子构成的。
2.知道分子和原子的概念,了解分子和原子之间的区别和联系。
3.能用微观粒子的性质解释生产、生活中的一些常见现象。
4.能从微观角度认识物质的变化、物质的分类。
【素养目标】1.保持和增强对化学现象的好奇心和探究欲,培养抽象思维能力、微观想象能力和分析推理能力。
2.建立“静止是相对,运动是永恒的”的辩证唯物主义认识观。
【教学重点】认识物质的微粒性;能用微粒的观点解释日常生活中的问题。
【教学难点】形成物质的微粒性的观点;认识化学反应的实质。
一、导入新课【导入1】[教师]多媒体展示《梅花》(墙角数枝梅,凌寒独自开,遥知不是雪,为有暗香来),这是同学们非常熟悉的诗,同学们对其诗意已有所了解,不知道大家是否从化学角度思考过“为有暗香来”是什么原因?【导入2】教师事先在教室前面喷香水,让学生闻到香味。
[演示]往水中加入白糖,用玻璃棒搅拌至溶解。
(改用热水,缩短实验时间)[学生思考]多媒体展示问题,讨论,提出合理的猜想:物质是由一些微小的粒子构成的。
二、探究新知探究一、物质由微观粒子构成[演示]实验3 - 1现象:品红在水中扩散。
[图片展示]分子的图片。
显微镜下苯分子的图像(一)分子是真实存在的(二)分子的特点[分析]一滴水(以20滴水为1 mL计)中大约有1.67×1021个水分子。
假如有人问你:“一个人每口喝下一亿个水分子,每秒钟喝一口,需要多久才能把一滴水中的水分子全部喝到肚子里去?”说出来一定吓你一跳。
原来,按照上面所说的喝水速度,喝完一滴水,竟需要五十万年!1.分子的质量和体积都很小。
[演示]已知酚酞和氨气都是由分子构成的物质,它们溶于水可分别得到酚酞溶液和氨水。
(1)取一小烧杯A,加入水,再加入酚酞溶液,搅拌,观察颜色。
(2)取少量上述溶液置于试管中,向其中慢慢滴入浓氨水,观察颜色变化。
(3)另取一个小烧杯B加入浓氨水,用大烧杯罩住A、B两个小烧杯(如图)。





第三单元物质构成的奥秘课题3 元素导学过程导学任务教师引领学生自主、合作学习、展示巩固点拨释疑、鼓励评价一、创设情景导入新课在生活中,我们经常见到药品或商品贴有标签,不知你注意过没有,标签上都写有什么?根据生活的常识,积极思考。
分组讨论、交流,从标签上获取的信息从生活中熟悉的内容入手,使学生认识“元素”这个名词。
学习目标1、理解元素的概念,初步认识化学反应中元素的种类是否发生改变。
2、元素符号的书写和意义3、了解生活中的元素4、了解元素的分类。
一、元素的定义设问:物质都是由元素组成的,那么什么叫元素呢?提问:(1)回忆原子的构成。
(2)什么是相对原子质量?其中一种碳原子是指哪种碳原子?你认为有没有其它的碳原子?展示:质子数6,中子数7碳原子质子数6,中子数6质子数8,中子数8质子数8,中子数9;质子数8,中子数10提问:上述每组原子在结构上有何共同点?指出:这些碳原子都属于碳元素,这些氧原子都属于氧元素。
提问:(1)根据以上内容,你们能试着说说什么叫元素吗?(2)不同元素的本质区别是什么?(3)元素与原子之间有什么区别和联系?小组讨论:(1)(2)原子与元素的区别和联系回忆并回答。
碳原子是指碳12原子(质子数6,中子数6的碳原子)。
猜想:有、不确定、可能有。
观察两组原子。
回答:每组原子的质子数相同。
倾听,观看,注意变化。
交流,试着说出元素的定义。
分小组讨论①联系:具有相同核电荷数(即质子数)的一类原子的总称。
区别:元素为宏观概念,只讲种类不讲个数原子为微观概念,既讲种类又讲个数理解记忆元素的概念。
从已有知识入手,自然且便于理解。
培养观察力,分析能力。
在对比中让学生感悟元素的特点。
让学生在琢磨中加深理解。
使学生形成“世界是物质的,物质是由元素组成的”认识观。
运用对比的方法来学习。
建立正确的理论观。
氧原子元素分类:金属元素、非金属元素(固、液、气)稀有气体元素四、元素周期表展示门捷列夫头像和元素周期表,简介元素周期表的形成史。
第三单元课题2 元素
一、学习目标
1、理解元素的概念,统一对物质的宏观组成与微观结构的认识。
2、知道元素符号所表示的意义,学会元素符号的正确写法,
逐步记住一些常见的元素符号。
二、重点:元素及元素符号。
难点:元素的概念及元素符号的意义。
三、复习反馈
1、电解水的实验说明水是由什么元素组成的?(个人思考,组内交流)
2、什么是相对原子质量?其中“一种碳原子”是指哪一种碳原子? 有没有别的碳原子呢?(个人思考,组内交流)
四、合作探究
(一)元素
【自主学习】
1、观察、比较下表中两种碳原子和三种氢原子在结构上有何共同点?几种原子的构成
2、你能试着说说什么叫元素吗?(同桌交流)
3、阅读课本73页,进一步理解元素的概念。
填空:地壳中含量居前四位的元素是:_____、_____ 、_____ 、_____。
生物细胞中居前四位的元素是:_____ 、_____、_____、_____。
【交流学习】
1、讨论课本73页的问题,思考:物质是由元素组成的,物质在发生化学变化时,元素会不会发生变化呢?
2、我们在看电视的时候,经常看到为健康劝人们“补铁”、“补钙”、“补锌”、“加碘”的广告,这里的“铁”、“钙”、“锌”、“碘”指的是什么?
3、元素与原子的区别与联系
(二)元素符号
【自主学习】
阅读课本74页—76页,完成下列问题:
为什么要使用元素符号?国际上对元素符号是怎样规定的?
1、识记课本75页常见的元素名称和符号。
写一写记住了几个。
2、书写元素符号时应注意什么?
3、一个元素符号能表示几个涵义?
元素可分为几类?你能通过元素名称确定氧、铁、硫、氦四种元素分别属于哪一类吗?
【思考交流】1、P、5P分别表示什么意义?
2、下列两组符号能组成几种元素的符号?
Ⅰ:A B C M N Ⅱ:a u e l g
(三)元素周期表简介
【自主学习】
阅读课本76页,完成下列填空:
1、元素周期表共有7个横行,18个纵行。
每个横行叫做一个__________,每一个纵行叫
做一个____________。
2、元素周期表按元素原子核电荷数递增的顺序给元素编了号,叫做_________, ________
与元素原子核电荷数在数值上相同。
阅读小故事“门捷列夫和元素周期表”。
【交流学习】
完成课本76页“活动与探究”中的内容。
【交流研讨】
同桌互相检查元素符号的记忆情况。
五、达标测试
1.表示4个氢原子的符号是()
A. 4H2 B 4H C. 2H2 D.H4
2.“博士伦”隐形眼镜洗液的主要成分是H202(双氧水),下列说法正确的是()
A.H202是由氢气和氧气组成的
B.H202是由氢元素和氧元素组成的
C.H202是由氢分子和氧分子构成的 D.H202是由两个氢元素和两个氧元素构成的
3.“H-2”的说法中,正确的是()
A.属于一种新元素
B.跟氢原子相同的原子
C.是氢元素的另一种原子
D.与氢元素不同类的原子
4.将右列与左列对应的字母填入括号内
⑴纯净物A.由同种元素组成(1)---()
⑵混合物B.由不同种物质组成(2)---()
⑶化合物C.分子中含有不同种元素的原子(3)---()
⑷单质 D.由一种物质组成(4)---()
⑸氧化物E.由两种元素组成,其中一种是氧元素(5)---()
5、下列各组元素符号的第一个字母相同的是()
A.铁、锌、钠
B.钙、铝、铜
C.铝、银、镁
D.碳、钙、氯
6、大多矿泉水瓶的标签上印有如下字样:Ca≥4.0mg/L、Mg≥0.5mg/L、K≥0.35mg/L、Na
≥0.8mg/L等,这里的Ca、Mg、K、Na是指( )
A.元素
B.分子
C.原子
D.都不是
7、(用元素符号填空)地壳中含量最多的元素;地壳中含量最多的金属元素;
地壳中含量最多的非金属元素空气中含量最多的元素生物细胞中含量最多的元素。
六、归纳小结
通过本节课的学习,你有哪些收获?还有哪些迷惑的问题?。