物质的简单分类
- 格式:ppt
- 大小:2.16 MB
- 文档页数:18



专题1:物质的简单分类一、单选题1.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,每百引入粉面二三斤,久则凝淀如石,浣衣发面,甚获利也”。
这里的“石碱”是指()A.KOHB.KAl(SO4)2C.KHCO3D.K2CO32.胶体是日常生活中常见的分散系。
下列分散系属于胶体的是()A.矿泉水B.稀鸡蛋清水溶液C.生理盐水D.葡萄糖溶液3.下列说法正确的是()A.金属氧化物都是碱性氧化物B.盐中不一定有金属元素C.由同种元素组成的物质一定是单质D.非金属氧化物都是酸性氧化物4.下列属于电解质的是()A.氯化钠B.蔗糖C.氯气D.铁5.下列有关混合物、纯净物、电解质、非电解质的正确组合为()纯净物混合物电解质非电解质A.纯盐酸水煤气硫酸干冰B.蒸馏水蔗糖溶液氧化铝二氧化硫C.胆矾氢氧化铁胶体铁碳酸钙D.水银澄清石灰水氯化铜碳酸钠A.AB.BC.CD.D6.下列判断全部正确的一组是:()A B C D强电解质NaCl H2SO4CaF2石墨弱电解质HF BaSO4HClO NH-H2O非电解质Cl2CS2CCl4蔗糖A.AB.BC.CD.D7.秋冬季节往往会出现大雾天气。
雾属于下列分散系中的()A.溶液B.悬浊液C.乳浊液D.胶体8.下列关于分散系的叙述不正确的是()A.分散系的分类:B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分C.把FeCl3饱和溶液滴入到氢氧化钠溶液中,以制取Fe(OH)3胶体D.如图显示的是树林的晨曦,该现象与丁达尔效应有关9.下列说法正确的是()A.液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质C.一束光线分别通过溶液和胶体时,前者会出现光亮的通路,后者则没有D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液10.下列有关物质分类的说法正确的是()A.二氧化碳、二氧化硅、一氧化碳均为酸性氧化物B.雾、稀豆浆、氯化铁溶液均为胶体C.烧碱、冰醋酸、稀硫酸均属于电解质D.分子中含有两个氢原子的酸不一定是二元酸11.化学与生活生产息息相关,下列说法错误的是()A.用可见光束照射能区别溶液和胶体B.小苏打可用作焙制糕点的发酵粉C.盐碱地(含较多Na2CO3,)不利于作物生长,可施加熟石灰进行改良D.将废铁屑加入FeCI,溶液中可用于除去工业废气中的Cl212.下列关于氧化物的叙述正确的是()A.金属氧化物一定是碱性氧化物B.CO2是碱性氧化物C.碱性氧化物都能与碱反应D.氧化铜是碱性氧化物,但不与水反应二、填空题13.下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。

高高一年级化学学科共案时间:星期:【教学主题】物质的分类【教学目标】1、了解分类的方法:交叉分类法和树状分类法;2、学会对常见的化学物质以及化学反应进行分类。
【知识梳理】一、简单分类法及其应用 :1、物质的分类⑴交叉分类法:对同一物质按不同的标准分类。
例一:交叉分类法: Na2SO4含氧酸盐K2SO4无氧酸盐NaCl 钠盐BaSO4硫酸盐⑵树状分类法: 树状分类法:按照一定的标准对同类事物进行再分类,如根据物质的组成对物质分类:例二:固固:粗盐混合物(多种成分)液液:水与酒精气气:空气金属单质:Fe物质(1)单质(3)非金属单质:P一元酸 HCl酸(5)二元酸 H2SO4纯净物(2)三元酸 H3PO4难溶碱 Fe(OH)3化合物(4)碱 (6)易溶碱 NaOH正盐 NaCl盐酸式盐 NaHCO3碱式盐 Cu2(OH)2CO3金属氧化物 CaO氧化物(2)非金属氧化物 CO2 SO22、化学反应的基本类型:根据化学反应的特征,我们将化学反应分成四种基本类型:反应类型实例A+B=AB 化合反应2H2+O22H2OAB=A+B 分解反应CaCO3CaO+CO2↑AB+C=A+CB 置换反应H2+CuO Cu+H2OAB+CD=AD+CB 复分解反应NaOH+HCl=NaCl+H2O[课堂练习1]把以下物质分类:H2,CaO,Ba(OH)2, Fe2O3,Al,浑浊的河水,CH3CH2OH,NH3·H2O,Ar,NaHSO4,Cu(OH)2,HCl,HNO3,H2SO4,CO2,H3PO4,NaOH, CuSO4,Cu2(OH)2CO3,NaHCO3,空气,盐酸,CO,CH4,H2CO3,MgCl2,MgSO4(1)属于单质的是:________________;(2)属于金属单质的是:_________;(3)属于非金属单质的是:_________;(4)属于稀有气体的是:__________;(5)属于有机化合物的是:_________;(6)属于氧化物:____________;(7)属于酸: ____________;(8)属于碱:_____________________;(9)属于盐:_______________________;(10)属于混合物:___________。
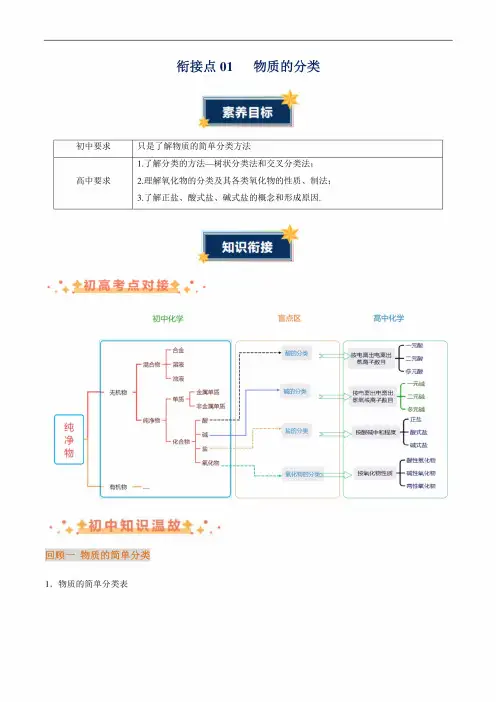
衔接点01 物质的分类初中要求只是了解物质的简单分类方法高中要求1. 了解分类的方法一树状分类法和交叉分类法;2. 理解氧化物的分类及其各类氧化物的性质、制法;3. 了解正盐、酸式盐、碱式盐的概念和形成原因.• 初高考点对接七初中化学盲点区 高中化学纯净物[-谜-混合物-一溶液_浊液无机物-厂金属单质一单质~\L ■非金属单质1-纯净物-「酸-化欲-碱-盐碱的分类_______■氧化物的分凳L —元酸ng 出一二元酸I 多元酸----、按电菠出电离出 __息。
基氧根高球目 一 一兀例L 多元碱「皿: 按酸碱中和费——稣盐「酸性氧化物A 按氧化物性质——碱性氧化物j 两性氧化物-酸的分类wA 盐的分类 W•••♦,初中知识温故tA-回顾一物质的简单分类1.物质的简单分类表「混合物'金属单质单质,非金属单质、稀有气体物质<纯净物<化合物,厂酸碱无机化合物〈盐氧化物I有机化合物回顾二几组重要概念1.混合物和纯净物混合物纯净物宏观由不同种物质组成由一种物质组成微观由不同种分子构成由同种分子构成性质没有固定的组成,各组分保持各自的化学性质。
没有固定的熔点和沸点具有固定的组成,具有固定的熔点、沸点;具有固定的化学性质例如空气是混合物,由氧气、二氧化碳、氮气等组成,含有N2、。
2、C02、田0等不同种分子水是纯净物,由水(H2。
)分子构成;氧气是纯净物,由氧(。
2)分子构成【易错提醒】(1)不要被“洁净、混合”等字眼迷惑,洁净物不一定是纯净物,例如:洁净的空气、干净的矿泉水就是混合物。
(2)不要被物质的名称迷惑,例如:二氧化碳是物质的名称,“氧”“碳”指组成物质的元素,不是两种物质,二氧化碳是纯净物,不是混合物。
2.单质、化合物和氧化物类别单质化合物氧化物概念由回种元素组成的纯净物由不同种元素组成的纯净物由两种元素组成,且其中一种元素是氧元素的化合物判断方法必须是纯净物;只含一种元素必须是纯净物;含两种或两种以上元素必须是化合物举例氮气(N2)、氢气(田)、氧气(02)、铁(Fe)和碳水(H2。
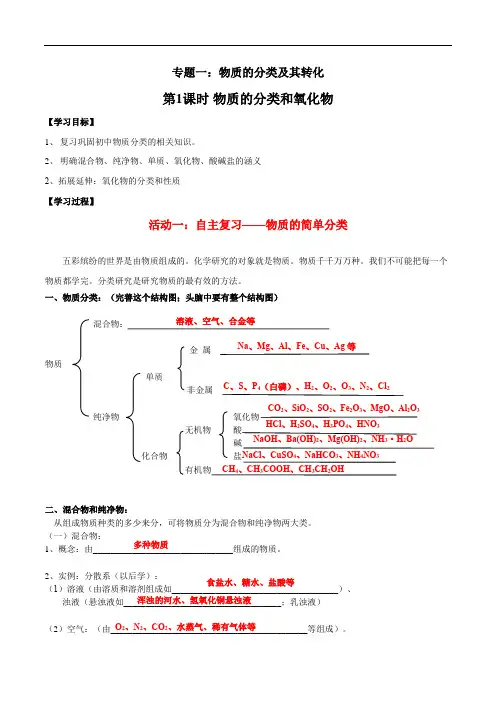
多种物质 食盐水、糖水、盐酸等 浑浊的河水、氢氧化铜悬浊液 O 2、N 2、CO 2、水蒸气、稀有气体等 专题一:物质的分类及其转化第1课时 物质的分类和氧化物【学习目标】1、 复习巩固初中物质分类的相关知识。
2、 明确混合物、纯净物、单质、氧化物、酸碱盐的涵义2、拓展延伸:氧化物的分类和性质【学习过程】活动一:自主复习——物质的简单分类五彩缤纷的世界是由物质组成的。
化学研究的对象就是物质。
物质千千万万种。
我们不可能把每一个物质都学完。
分类研究是研究物质的最有效的方法。
一、物质分类:(完善这个结构图;头脑中要有整个结构图)金 属 物质单质纯净物 化合物二、混合物和纯净物:从组成物质种类的多少来分,可将物质分为混合物和纯净物两大类。
(一)混合物: 1、概念:由________________________________组成的物质。
2、实例:分散系(以后学): (1)溶液(由溶质和溶剂组成如______________________________________)、浊液(悬浊液如____________________________________;乳浊液)(2)空气:(由_____________________________________________等组成)。
由两种元素组成,其中一种是氧元素的化合物 O 2、Au 、CuO 、SO 2、HNO 2、Fe(OH)3、NaI 、NH 3、C 2H 4 一种物质 CO 2、SiO 2、SO 2、Fe 2O 3、MgO 、Al 2O 3 CO 2、SiO 2、SO 2Fe 2O 3、MgOAl 2O 3 碱 盐和水 CO 2+H 2O=H 2CO 3 SO 2+H 2O=H 2SO 3CO 2+2NaOH=Na 2CO 3+H 2O SO 2+2NaOH=Na 2SO 3+H 2O(3)胶体(以后学)。
比如:豆浆、血液、蛋白质溶液、淀粉溶液、烟、雾等(二)纯净物:1、概念:由_____________________________组成的物质。
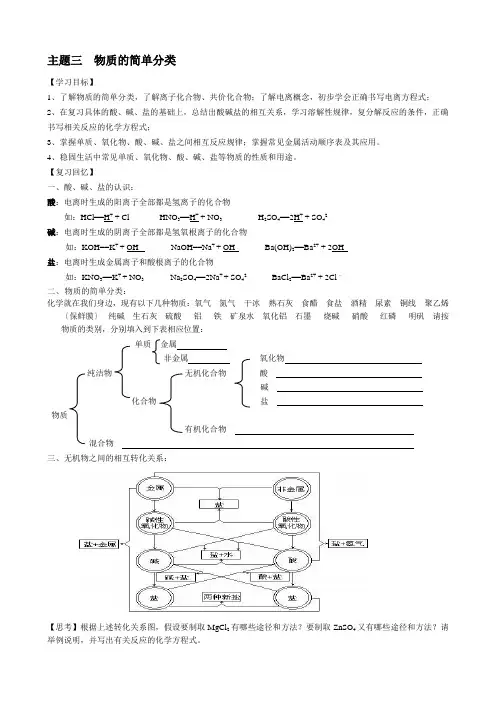
主题三物质的简单分类【学习目标】1、了解物质的简单分类,了解离子化合物、共价化合物;了解电离概念,初步学会正确书写电离方程式;2、在复习具体的酸、碱、盐的基础上,总结出酸碱盐的相互关系,学习溶解性规律,复分解反应的条件,正确书写相关反应的化学方程式;3、掌握单质、氧化物、酸、碱、盐之间相互反应规律;掌握常见金属活动顺序表及其应用。
4、稳固生活中常见单质、氧化物、酸、碱、盐等物质的性质和用途。
【复习回忆】一、酸、碱、盐的认识:酸:电离时生成的阳离子全部都是氢离子的化合物如:HCl==H+ + Cl - HNO3==H+ + NO3- H2SO4==2H+ + SO42-碱:电离时生成的阴离子全部都是氢氧根离子的化合物如:KOH==K+ + OH - NaOH==Na+ + OH - Ba(OH)2==Ba2+ + 2OH -盐:电离时生成金属离子和酸根离子的化合物如:KNO3==K+ + NO3- Na2SO4==2Na+ + SO42- BaCl2==Ba2+ + 2Cl –二、物质的简单分类:化学就在我们身边,现有以下几种物质:氧气氮气干冰熟石灰食醋食盐酒精尿素铜线聚乙烯〔保鲜膜〕纯碱生石灰硫酸铝铁矿泉水氧化铝石墨烧碱硝酸红磷明矾请按物质的类别,分别填入到下表相应位置:单质金属非金属氧化物纯洁物无机化合物酸碱化合物盐物质有机化合物混合物三、无机物之间的相互转化关系:【思考】根据上述转化关系图,假设要制取MgCl2有哪些途径和方法?要制取ZnSO4又有哪些途径和方法?请举例说明,并写出有关反应的化学方程式。
四、金属活动性顺序表:〔钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金〕 五、常见物质及其性质:元素化合物知识内容较多,在复习时要善于归纳与总结,要以重要物质的性质为核心,注意性质与结构、用途、制法、检验等的内在联系;注意对相关知识进行归纳比较,既要重视同类物质的共性,又要抓住个别物质的特性,从分析推理中找出各类物质相互反应的规律和转化关系,在理解的基础上归纳、记忆,并不断提高分析、归纳、概括能力和实际应用能力。

第一节⎪⎪ 物质的分类第一课时简单分类法及其应用[课标要求]1.了解物质分类的方法和依据。
2.认识分类方法的应用。
3.感受分类方法对化学学科研究和化学学习的重要应用。
1.交叉分类法(1)含义:根据不同的分类标准,对同一事物进行多种分类的一种分类方法。
(2)举例Ⅰ.碳酸钠的交叉分类:分类标准 所属类别 组成的阳离子 钠盐 组成的阴离子 碳酸盐 溶解性可溶性盐1.常用的分类方法有交叉分类法和树状分类法。
2.物质可分为纯净物和混合物,纯净物又分为单质和化合物,常见的化合物有氧化物、酸、碱、盐。
3.四种基本反应类型有化合反应、分解反应、置换反应和复分解反应。
4.非金属氧化物不一定是酸性氧化物,酸性氧化物也不一定是非金属氧化物。
5.金属氧化物不一定是碱性氧化物,碱性氧化物一定是金属氧化物。
物质的分类方法Ⅱ.在不同的物质和它所属的类别之间进行连线:①K2SO4②K2CO3③Na2CO3④Na2SO4a.钾盐b.钠盐c.硫酸盐d.碳酸盐提示:①—a、c②—a、d③—b、d④—b、c2.树状分类法(1)含义:对同类事物按照某些属性进行再分类的分类方法,即对同类事物进行再分类。
(2)举例[特别提醒]物质的分类标准不同,同一种物质可能有不同的归类。
第二课时分散系及其分类[课标要求]1.了解分散系的概念及分散系的种类。
2.知道胶体是一种常见的分散系。
3.了解胶体的介稳性和丁达尔效应。
1.三种分散系:溶液、胶体、浊液。
2.一个本质:胶体与溶液、浊液的本质区别在于胶粒大小(胶粒的直径在1~100 nm之间)。
3.一个特性:丁达尔效应是胶体的特性。
4.三种方法(使胶体聚沉的三种方法):一是加热,二是加入电解质溶液,三是加入胶粒带相反电荷的胶体。
1.概念把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。
2.组成3.分类(1)按照分散系组成部分的状态分类以分散质和分散剂所处的状态为标准,共有9种组合:(2)按照分散质粒子大小分类分散系间的本质区别是分散质粒子的大小不同。

物质的简单分类混合物、纯净物、单质、化合物的概念:(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。
从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:(1)混合物:由两种或多种物质混合而成的物质混合物没有固定的组成,一般没有固定的熔沸点常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质(1)金属单质:如Fe、Al、Cu等(2)非金属单质:如Cl2、O2、S等(4)化合物:由不同种元素组成的纯净物。
从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物①酸:电离理论认为电解质电离出阳离子全部是H+的化合物常见的强酸:HClO4 H2SO4 HCl HNO3等常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物常见强碱:NaOH KOH Ba(OH)2Ca(OH)2等常见弱碱:NH3·H2O Al(OH)3Fe(OH)3等③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐a正盐:Na2SO4 Na2CO3(NH4)2SO4等b酸式盐:NaHCO3NaHSO4NaH2PO4Na2HPO4等c碱式盐:Cu(OH)2CO3Mg(OH)2CO3等d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等(6)氧化物:由两种元素组成,其中一种元素是氧的化合物①按组成分:金属氧化物:Na2O Al2O3Fe3O4等非金属氧化物:NO2SO2CO2等②按性质分:不成盐氧化物:CO NO等酸性氧化物:CO2SO2等碱性氧化物:Na2O CuO等两性氧化物:Al2O3ZnO等过氧化物:Na2O2H2O2等超氧化物:KO2等特殊例子提醒:(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。

第一节物质的分类第1课时简单分类法及其应用学习目标:1.学会从多角度,依据不同标准对物质进行分类;了解“交叉分类法”和“树状分类法”,感受分类是学习和研究化学物质及其变化的一种重要科学方法。
2.掌握用不同的方法对化学物质及其化学反应进行分类。
3.初步了解分散系的概念和分类。
学习重点:学会根据物质的组成和性质对物质进行分类,初步了解分散系的概念。
学习难点:分类法的应用及常见化学物质及其化学反应的分类方法。
教学过程:一、导入新课[引入]我们知道分类如果从不同角度入手就会有很多不同方法,例如,人类按照年龄分可以分为老年、中年、青年、少年、儿童;按性别分分为男性和女性;按职业分为教师、医生、工程师等等。
同样的道理,化学物质从不同角度有很多不同的分类方法。
[板书]第二章化学物质及变化第一节物质的分类(一)二、推进新课教学环节一:简单分类法及其应用[板书]一、简单分类法及其应用[思考与交流]请尝试对HCl、SO2、CaO、KOH、Na2SO4、H2SO3进行分类。
(氧化物:SO2、CaO 酸:HCl、H2SO3碱:KOH 盐:Na2SO4 )(固体:CaO、KOH、Na2SO4 气体:HCl、SO2液体:H2SO3 )[讲解]在分类的标准确定之后,同类中的事物在某些方面的相似性可以帮助我们做到举一反三;对于不同事物的了解使我们有可能做到由此及彼。
所以,分类法是一种行之有效、简单易行的科学方法。
运用分类的方法不仅能使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,发现物质及其变化的规律。
[提问]对于Na2CO3,如果从其阳离子来看,它属于什么盐?从阴离子来看,又属于什么盐?( 从阳离子来看,属于钠盐,从阴离子来看,属于碳酸盐。
)[讲解]由于一种分类方法所依据的标准有一定局限,所能提供的信息较少,因此,人们在认识事物的时候往往采取多种分类方法,比如交叉分类法,就像我们刚才举的Na2CO3的例子。
[板书]1.交叉分类法Na2CO3钠盐Na2SO4钾盐K2SO4硫酸盐K2CO3碳酸盐[讲解](1)将事物进行分类时,按照不同的分类标准进行分类会产生不同的分类结果。
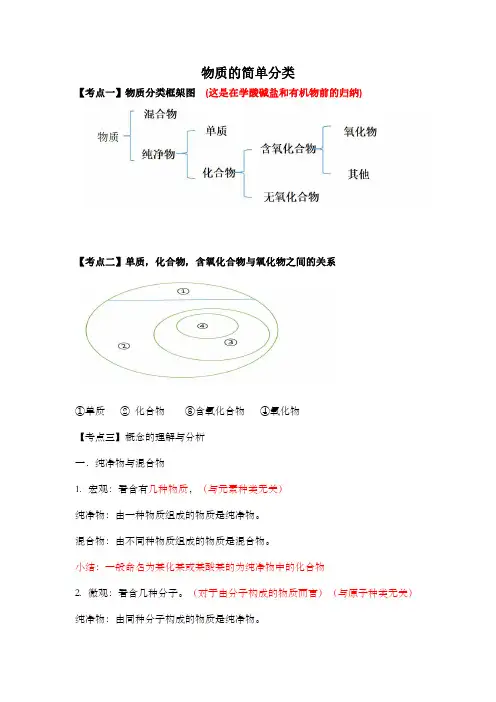
物质的简单分类【考点一】物质分类框架图(这是在学酸碱盐和有机物前的归纳)【考点二】单质,化合物,含氧化合物与氧化物之间的关系①单质②化合物③含氧化合物④氧化物【考点三】概念的理解与分析一.纯净物与混合物1.宏观:看含有几种物质,(与元素种类无关)纯净物:由一种物质组成的物质是纯净物。
混合物:由不同种物质组成的物质是混合物。
小结:一般命名为某化某或某酸某的为纯净物中的化合物2.微观:看含几种分子。
(对于由分子构成的物质而言)(与原子种类无关)纯净物:由同种分子构成的物质是纯净物。
混合物:由不同种分子构成的物质是混合物。
二.单质与化合物宏观:看组成中有几种元素,但首先一定为纯净物1.单质:由同种元素组成的纯净物叫单质。
2.化合物:由不同种元素组成的纯净物叫化合物。
(必须满足两个条件)微观:看分子构成中有几种原子(对于由分子构成物质而言)1.单质:其分子由同种原子构成的物质为单质。
2.化合物:其分子由不同种原子构成的物质为化合物。
三.含氧化合物与氧化物含氧化合物:含有氧元素的化合物叫含氧化合物。
(两个条件)氧化物:由两种元素组成,且其中有一种元素为氧元素的纯净物叫氧化物(三个条件)小结:含氧化合物包括氧化物【典型习题分析】1.下列说法正确的是()A.由一种元素组成的物质一定是单质B.由不同种元素组成的物质一定是混合物C.由不同种元素组成的物质叫化合物D.空气是由几种单质和几种化合物组成的混合物【解析】:由一种元素组成的纯净物才一定是单质。
A错误混合物是看其由几种物质组成,而不是看其由几种元素组成。
B错误由不同种元素组成的纯净物叫化合物。
C错误空气中有氮气和氧气单质,还有二氧化碳和水等化合物。
D正确故答案:D2.经分析知道某物质只含有一种元素,则该物质()A.不可能是混合物B.一定是纯净物C.一定是单质D.不可能是化合物【解析】氧气和臭氧混合只含一种元素,但含两种物质,是混合物,A错误氧气和臭氧混合只含一种元素,但含两种物质,不是纯净物,更不是单质。
根据物质的组成和性质分类知识衔接◆初中化学对物质的简单分类1 元素与物质分类的关系(1)任何物质都是由元素组成的,根据元素组成对物质进行分类是化学研究的基础。
(2)每一种元素都可以形成单质。
绝大多数元素都能与其他元素形成化合物。
(3)同素异形体①定义:由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
由同一种元素组成的物质不一定是单质,还可能是几种同素异形体的混合物,如O2和O3的混合物②举例:金刚石、石墨和C60是碳元素的同素异形体;氧气和臭氧(O3)是氧元素的同素异形体;白磷和红磷是磷元素的同素异形体。
2 分类(1)概念分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的科学方法。
(2)意义名师提醒(1)分类有一定的标准。
对若干事物进行分类时,首先,要通过分析比较,研究各个事物之间的相同点和不同点,确定分类的标准,然后,按照标准进行分类。
如超市物品、实验室仪器及药品等的分类。
(2)在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视角,体现了宏观和微观的联系。
(3)分类是化学学习的重要方法。
目前人类发现和合成的物质已超过1亿种,如果逐一研究它们的结构、性质是无法完成的,必须按类别去学习和研究。
3 常见分类法知识衔接◆由金属元素和氧元素组成的氧化物是金属氧化物,如Fe2O3、CaO等。
由非金属元素和氧元素组成的氧化物是非金属氧化物,如CO2、NO2等。
(1)树状分类法①含义:按照同一标准(采用树状形式)对同类事物进行再分类的一种方法。
②特点:同一层次的物质类别间一般是相互独立、没有交叉的。
③举例:a.物质的分类(根据物质的组成)b.物质的分类(根据物质的性质)名师提醒(1)部分酸性氧化物能与水反应生成相应的酸,如SO3+H2O===H2SO4等;酸性氧化物通常能与碱性氧化物反应生成相应的盐,如SO2+CaO===CaSO3等。
物质的分类【要点梳理】要点一、简单分类法1.分类法的涵义:分类是根据对象的共同点和差异性,将对象区分为不同的种类,并且形成有一定从属关系的不同等级的系统的逻辑方法。
它也是研究和学习化学物质及其变化的一种常用的科学方法。
分类能帮助人们迅速找到所需要的物品或信息,是人们最熟悉、也是最方便的方便的工作方法。
在社会生活、经营管理和科学技术中得到广泛应用;在化学研究领域,运用分类的方法不仅能使化学物质及其变化的知识系统化,还可以通过分门别类的研究,发现物质及其变化的规律。
2.分类的方法:分类根据不同的标准,可以有不同的分类方法。
交叉分类法和树状分类法是两种常用的、具体的分类方法。
要点诠释:分类中要注意的问题(1).确定分类的标准当分类的标准确定后,同类事物在某些方面的相似性可以帮助我们举一反三;对不同类事物的了解使我们有可能做到由此及彼。
(2).认识事物时往往需要采用多种分类方法(如“交叉分类”法),以弥补单一分类法的不足,提供关于事物的更多方面的信息。
例如,利用交叉分类法,Na2CO3既可以是钠盐,也可以是碳酸盐。
又如,以下四种酸的交叉分类见下图:(3).对同类事物进行再分类,即采用“树状分类”法。
树状分类法:确定更细的标准,对同一类物质进行再分类。
这种分类法便于系统认识物质,强调了不同类别物质的内在联系,每一类物质之间没有交叉关系,培养了思维的系统性和严谨性。
要点二、化学物质的树状分类法要点诠释:【高清课堂:物质的分类】1.氧化物:(1)氧化物的分类从组成元素分:金属氧化物,如CuO、Al2O3;非金属氧化物,如CO、CO2;从性质上分:(2)注意:①.非金属氧化物不一定是酸性氧化物,如CO 、H2O属不成盐氧化物;②. 金属氧化物不一定是碱性氧化物,如Mn2O7属酸性氧化物;③. 酸性氧化物不一定是非金属氧化物,Mn2O7属金属氧化物;④. 碱性氧化物一定是金属氧化物。
2.酸:按酸是否含氧元素,可分为H2SO4按照上面的分类可以是二元酸、强酸、稳定性酸、难挥发性酸。
物质的分类一、简单分类法及其应用1.交叉分类法Na2CO3钠盐Na2SO4钾盐K 2SO4硫酸盐K 2CO3碳酸盐2、树状分类法二、分散系( dispersion system)及其分类1、分散系(1) 分散系:将一种或几种物质以粒子形式分散到另一种物质里所形成的混合物,称为分散系。
(2) 分散质和分散剂:分散系中分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(3)分类:常见的分散系有溶液、悬浊液、乳浊液、胶体等。
一般地说,溶液分散质粒子小于1nm,浊液中离子通常大于100nm,介于1nm~100nm的为胶体。
常见的分散系及其特征分散质分散剂实例气气空气液气云、雾固气烟灰尘气液泡沫液液牛奶、酒精的水溶液固液糖水、油漆气固泡沫塑料液固珍珠(包藏着水的碳酸钙)固固有色玻璃、合金分散系溶液胶体粗分散系粒子大小<1 nm 1-100nm >100nm例子盐水硫酸铜溶液淀粉溶胶氢氧化铁胶体泥水油水能否透过半透膜能不能不能能否透过滤纸能能不能丁达尔效应没有没有有三、胶体( colloid )1、胶体的分类2、胶体的制备:FeCl3+3H2O Fe(OH)3(胶体) +3HCl四、胶体的性质1.丁达尔效应:光束通过胶体,形成光亮的“通路”的现象叫丁达尔效应。
2.布朗运动:胶体分散质粒子作不停的、无秩序的运动,这种现象叫做布朗运动。
3.电泳:在外加电场作用下,胶体粒子在分散剂里向电极作定向移动的现象4.胶体的聚沉:分散质粒子相互聚集而下沉的现象,称为胶体的聚沉。
方法:加电解质溶液;加带相反电荷的胶粒。
5、胶体的应用(1)工业除杂、除尘(2).土壤的保肥作用(5)豆腐的制作原理(4)江河入海口处形成三角洲(3)明矾的净水作用一、胶体的分类(1)、根据分散质微粒组成的状况分类:如:F e(O H)3胶体胶粒是由许多F e(O H)3等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。