工业盐酸杂质测定标准
- 格式:docx
- 大小:33.30 KB
- 文档页数:6

工业盐酸杂质分析发表时间:2019-06-17T09:11:37.673Z 来源:《当代电力文化》2019年第03期作者:王巍巍[导读] 通过工业盐酸氧化性、还原性分析描述,提出对盐酸质量造成影响的两种杂质分析必要性。
山东东明石化集团 274500【摘要】通过工业盐酸氧化性、还原性分析描述,提出对盐酸质量造成影响的两种杂质分析必要性,对于工业应用、质量控制,具有非常重要的意义。
【关键词】工业盐酸;氧化;还原;杂质;分析0.概述工业盐酸是一种常用的、重要的化学药品,在很多化工企业都被广泛使用。
假如工业盐酸不合格,含有氧化性物质(如次氯酸钠)和还原性物质(如亚硫酸钠),除了直接损失外,还会造成不可估计的间接损失。
长时间用氧化性强的盐酸再生树脂,会造成树脂的快速变质和老化,严重减少树脂的使用寿命。
树脂中若含有还原性物质亚硫酸盐,再生时会挥发出大量的SO2气体,不但对再生操作人员的身体造成危害,还会造成设备的酸性腐蚀。
1.氧化性物质的分析在对入厂工业盐酸进行取样化验时,通常用甲基橙做指示剂,用氢氧化钠溶液滴定,通过消耗氢氧化钠的量来计算盐酸的浓度。
某日取样化验,按规定加入2滴甲基橙指示剂后,本来遇酸显红色的甲基橙居然没有颜色,这引起了我的注意,随即重新取样,加入指示剂后仍然没有颜色。
是什么物质会使本该显红色的物质褪色呢?甲基橙是酸碱指示剂,在溶液PH小于3.1时显红色,大于4.4时显黄色,通常用于测定水的碱度。
天然水中的常见离子如Na+,Ca2+,NO3-,SO42-等都不会使甲基橙褪色。
说到测定碱度,突然让我想起循环水常用次氯酸钠来杀死水中有机物,以减少有机物对系统的污堵。
有一次杀菌结束后取循环水测定碱度,加入甲基橙后也是不显颜色,这是不是同样的原因造成的呢,难道是水中含有氧化性物质次氯酸钠使甲基橙褪色了吗?而工业盐酸中会有次氯酸钠吗?这些都只是疑问。
事实还需要进一步验证。
联想到工业盐酸的生产过程中不可避免的会接触到残余的氯气,氯气与水反应就会生成强氧化性物质次氯酸。

盐酸美法仑质量标准1. 性状美法仑为白色或类白色结晶性粉末,无臭,味苦。
美法仑在甲醇、乙醇或丙酮中易溶,在水中溶解,在己烷中不溶。
2. 鉴别在美法仑的鉴别试验中,可以采用红外光谱法、紫外光谱法、薄层色谱法等。
红外光谱法可以确定美法仑的化学结构;紫外光谱法可以确定美法仑的分子量和分子式;薄层色谱法可以分离和鉴定美法仑中的杂质和溶剂残留。
3. 酸度美法仑的酸度应该符合一定的要求。
通过测定美法仑的pH值,可以控制美法仑的质量。
一般而言,美法仑的pH值应该在3.0-5.0之间。
4. 溶液澄清度美法仑的溶液应该澄清透明,无杂质。
在制备美法仑溶液时,应该控制溶液的浓度和温度,以保证溶液的澄清度。
5. 干燥失重通过干燥失重试验,可以测定美法仑中的水分和其他可挥发性物质的含量。
一般来说,美法仑的干燥失重应该小于0.5%。
6. 炽灼残渣炽灼残渣试验可以测定美法仑中杂质的含量。
一般来说,美法仑的炽灼残渣应该小于0.1%。
7. 有关物质在美法仑的有关物质试验中,可以采用高效液相色谱法、气相色谱法等。
高效液相色谱法可以分离和测定美法仑中的杂质;气相色谱法可以测定美法仑中的有机溶剂残留。
8. 含量测定通过滴定法、高效液相色谱法等含量测定方法,可以控制美法仑的质量。
其中滴定法需要使用标准物质进行滴定,而高效液相色谱法则可以同时测定美法仑的含量和有关物质的含量。
9. 微生物限度在美法仑的质量标准中,微生物限度是一项重要的指标。
通过微生物限度试验,可以控制美法仑的微生物污染程度。
一般来说,美法仑的微生物限度应该符合药典要求。

目前国内已有很多企业采用曼海姆法生产硫酸钾,该工艺生产副产品盐酸的技术指标和GB320—1993(《工业用合成盐酸》)规定的要求有所不同,主要是硫酸盐和氧化物两项指标,副产成品盐酸中硫酸盐含量大约0.07 ~O.10 ,远远超过GB320规定的一级品0.03 标准,氧化物指标也很难达到标准规定的优级品要求,GB320对此要求十分严格。
目前我国尚无副产盐酸的标准,其生产、检测和销售工作只能采用GB320,这给盐酸的销售带来的很多麻烦。
我公司从1994年到现在已经建成10 kt/a 曼海姆硫酸钾生产线6条,按每生产1t硫酸钾产出副产品盐酸1.2t计算,每年有7.2万t 的产量,这些盐酸由于上述两项指标超标的原因无法在市场上取得主动,只能低价销售。
今年初公司将这一课题作为攻坚计划开展起来,我们经过广泛的探讨、求证和试验终于找到了两项指标的超标原因和解决办 1.造成盐酸颜色变黄的原因和解决办法长期以来我公司将盐酸从第一级硫酸气洗涤塔开始分离成AB两档,酸浓(HC1 ≥31.0 )都达到标准要求的值,但A档盐酸含杂质指标相对较少,而B档盐酸颜色偏黄、杂质含量高,低价销售给钢铁除锈等要求不高的企业。
我们在生产和检测中发现,颜色偏黄的原因主要不在于含铁离子,检测铁离子含量很低,同时我们还发现A档酸颜色很清,几乎不呈现黄色,但是在进入空气并放置一段时间后颜色就变黄了,检测其氧化物含量高,这一点说明盐酸中氧化物(GB32O中规定以Cl 计)和颜色有一定的关系。
通过分析和探讨我们以为,盐酸中的氧化物无非是有氧化态的卤素单质和它们的氧化物存在的缘故,曼海姆不是氧化还原反应,浓H。
SO 也不足以氧化KC1中的Cl,必须有更强的氧化物或在催化作用下才能完成,盐酸呈现黄色不是氯单质(C12)与水反应所致。
从原料KCl来源上分析,KCl 24 化工科技市场第29卷第10期一般都是从盐湖、海水或岩矿中采用浮选、冷结晶等办法生产,这其中均含有较多量的Br 、少量的I一和F ,因KC1生产中可能处理不净而最终不可避免地被带入到曼海姆炉中,Br 和I都能够被浓硫酸氧化成它们的单质反应式如:H 2SO4+ 2H Br—S02+ 2H2O+ Br2 Br2+ H 2O ,~ 'H Br+ H BrO I一的还原性更强,甚至能被空气中的O 氧化:4HI+ Oz-- 2HzO+ 2Iz 生成的I 与I一离子结合成棕色的I 离子,Br 和I 在含量较低的情况下呈现黄色,因此盐酸在空气存在的情况下放置一定的时间会慢慢变黄。
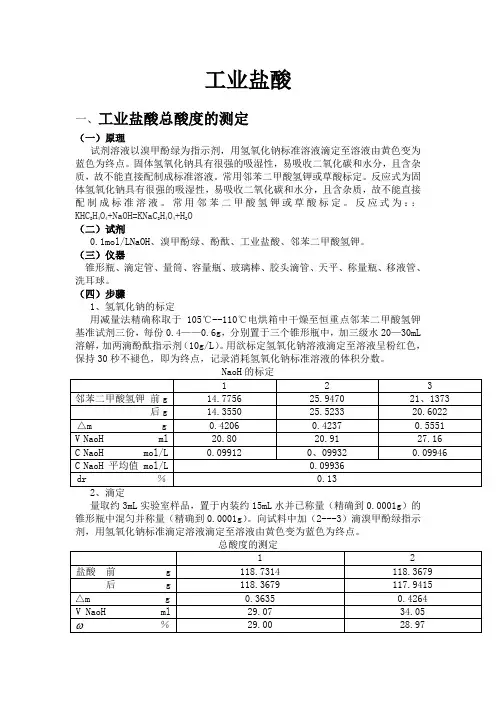
工业盐酸一、工业盐酸总酸度的测定(一)原理试剂溶液以溴甲酚绿为指示剂,用氢氧化钠标准溶液滴定至溶液由黄色变为蓝色为终点。
固体氢氧化钠具有很强的吸湿性,易吸收二氧化碳和水分,且含杂质,故不能直接配制成标准溶液。
常用邻苯二甲酸氢钾或草酸标定。
反应式为固体氢氧化钠具有很强的吸湿性,易吸收二氧化碳和水分,且含杂质,故不能直接配制成标准溶液。
常用邻苯二甲酸氢钾或草酸标定。
反应式为::KHC8H4O4+NaOH=KNaC8H4O4+H2O(二)试剂0.1mol/LNaOH、溴甲酚绿、酚酞、工业盐酸、邻苯二甲酸氢钾。
(三)仪器锥形瓶、滴定管、量筒、容量瓶、玻璃棒、胶头滴管、天平、称量瓶、移液管、洗耳球。
(四)步骤1、氢氧化钠的标定用减量法精确称取于105℃--110℃电烘箱中干燥至恒重点邻苯二甲酸氢钾基准试剂三份,每份0.4——0.6g,分别置于三个锥形瓶中,加三级水20—30mL溶解,加两滴酚酞指示剂(10g/L)。
用欲标定氢氧化钠溶液滴定至溶液呈粉红色,保持30秒不褪色,即为终点,记录消耗氢氧化钠标准溶液的体积分数。
NaoH的标定1 2 3邻苯二甲酸氢钾前g 14.7756 25.9470 21、1373 后g 14.3550 25.5233 20.6022 △m g 0.4206 0.4237 0.5551 V NaoH ml 20.80 20.91 27.16 C NaoH mol/L 0.09912 0、09932 0.09946 C NaoH 平均值 mol/L 0.09936dr %0.132、滴定量取约3mL实验室样品,置于内装约15mL水并已称量(精确到0.0001g)的锥形瓶中混匀并称量(精确到0.0001g)。
向试料中加(2---3)滴溴甲酚绿指示剂,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
总酸度的测定1 2盐酸前 g 118.7314 118.3679 后 g 118.3679 117.9415△m g 0.3635 0.4264V NaoH ml 29.07 34.05%29.00 28.97平均值%28.99允差%0.03二、工业盐酸中灼烧残渣的测定(一)原理蒸发好一份称好的试料,用硫酸处理,使盐类转变为硫酸盐,在(800±50)℃下灼烧后,称量。

工业用合成盐酸检测标准1 范围本规范规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本规范适用于由氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
2 规范性引用文件下列文件中的条款通过本规范的引用而成为本规范的条款。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 190 危险货物包装标志GB/T 191 包装储运图示标志(GB/T 191_2000,eqv ISO780:1997)GB/T 601 化学试剂规范滴定溶液的制备GB/T 602 化学试剂杂质测定用规范溶液的制备(GB/T603-2002,ISO 6353-1982,NEO)GB/T 1250 极限数值的表示方法和判定方法GB/T 6678 化工产品采样总则(GB/T 6678—1986,neq ASTM E300:1983)GB/T 6680 液体化工产品采样通则(GB/T 6680_1986,neq BS5309:1976)GB/T 6682 分析实验室用水规格和试验方法(GB/T 6682—1992,eqv ISO 3696:1987)GB 320-2006 工业用合成盐酸3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应符合表 1 给出的指标要求。
表1 盐酸技术指标指标项目优等品一等品总酸度(以HCl 计)的质量分数,% ≥31铁(以Fe 计)的质量分数,% ≤0.002 ≤0.008灼烧残渣的质量分数,% ≤0.05 ≤0.10游离氯(以Cl 计)的质量分数,% ≤0.004 ≤0.008砷的质量分数,% ≤0.0001硫酸盐(以SO42-计)的质量分数,% ≤0.005 ≤0.03 注:砷指标强制。
4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。

工业盐酸标准工业盐酸,又称氯化氢酸,是一种常用的化工原料,广泛应用于化工、冶金、纺织、医药等行业。
作为一种重要的化学品,工业盐酸的质量标准显得尤为重要。
本文将对工业盐酸的标准进行详细介绍,以便相关行业人士了解和参考。
首先,工业盐酸的外观应为无色透明液体,不得有悬浮物和杂质。
在储存和运输过程中,应避免与有机物、还原剂、碱类等物质接触,以免发生危险反应。
同时,工业盐酸应储存在阴凉、干燥、通风良好的库房中,远离火种和热源。
其次,工业盐酸的主要成分为盐酸和水,其含量应符合国家标准。
盐酸的纯度要求在30%以上,水含量不得超过70%。
此外,工业盐酸的PH值应在1.2-1.5之间,酸度要符合相关标准,以确保其在生产和应用过程中的稳定性和可靠性。
另外,工业盐酸在生产和使用过程中,应符合相关的环保要求。
生产企业在排放废气、废水和固体废物时,必须符合国家和地方的环保法规,做到零排放或者达标排放。
同时,在使用工业盐酸时,应采取相应的防护措施,避免对环境和人体造成危害。
最后,工业盐酸的包装和运输也需要符合相关标准。
包装容器应采用耐腐蚀的材料,密封性良好,防止泄漏和挥发。
在运输过程中,应注意避免剧烈震动和高温,以免影响产品质量。
综上所述,工业盐酸的标准涉及到产品的外观、成分、质量、环保和安全等方面,相关企业和生产单位应严格按照国家和行业标准进行生产和使用,以确保产品质量和安全性。
同时,监管部门也应加强对工业盐酸产品的监督检查,促进行业的健康发展和可持续发展。
希望本文的介绍能够对相关行业人士有所帮助,谢谢阅读。

HPLC-MS法测定盐酸二甲双胍片中毒性杂质 N-亚硝基二甲胺( NDMA)的含量重庆国舒制药有限公司重庆 401338重庆国泰康宁制药有限责任公司重庆 401520摘要:目的建立HPLC-MS法检测盐酸二甲双胍片中毒性杂质N-亚硝基二甲胺的含测定方法。
方法以ACE EXCEL3 C18-AR 4.6mm×100mm,3.0μm为色谱柱,流动相为流动相A:0.1%甲酸溶液流动相B:0.1%甲酸甲醇溶液,柱温40℃,检测波长258nm,流速为0.55ml/min,采用APCI+:MRM扫描模式,定量离子对75.0→43.0 m/z。
结果:该方专属性强,NDMA在0.985ng/ml~98.5ng/ml范围内浓度与峰面积呈良好线性,线性方程为y =8×104 x–1.88×104,相关系数r为0.9999,该方法的回收率在98.58%~101.45%之间,9份溶液平均回收率为99.9%,RSD为0.9%,准确度良好。
结论:该HPLC-MS法能准确检出盐酸二甲双胍片中毒性杂质N-亚硝基二甲胺的含量。
关键词:HPLC-MS法;盐酸二甲双胍片;N-亚硝基二甲胺;含量盐酸二甲双胍片在临床上主要用于单纯饮食控制不满意的II型糖尿病病人,尤其是肥胖和伴高胰岛素血症者,用本药不但有降血糖作用,还可能有减轻体重和高胰岛素血症的效果[1]。
国外报道盐酸二甲双胍片中检出NDMA杂质。
目前所知,NDMA杂质可能通过亚硝化机理生成。
即在一定条件下,胺类化合物尤其是仲胺,)或其他亚硝化试剂反应产生亚硝胺类杂质。
盐酸二甲双胍片与亚硝酸钠(NaNO2中NDMA来源分析:(1)原料引入:盐酸二甲双胍合成起始物料分别是二甲胺和双氰胺,原料药二甲胺本身均含有仲胺结果,但整个合成工艺中均未使用或添加)或其他亚硝化试剂(亚硝酰卤化物、亚硝酸酯、三氧化二氮和亚硝酸钠(NaNO2四氧化二氮),也未使用或添加酰胺类溶剂(如N,N-二甲基甲酰胺、N-甲基吡咯烷酮等),所以引入亚硝胺类杂质的风险很低。

盐酸质量标准
盐酸是一种常用的化学品,广泛应用于化工、医药、冶金等领域。
盐酸的质量标准对于保障产品质量、生产安全至关重要。
本文将围绕盐酸的质量标准展开讨论,以期为相关行业提供参考。
首先,盐酸的外观应为无色透明液体,无悬浮物和杂质。
在质量标准中,通常会对外观进行详细描述,如无色度、透明度等指标要求,以确保产品外观符合要求。
其次,盐酸的纯度是至关重要的指标之一。
通常情况下,盐酸的纯度要求在工业标准中有详细规定,如工业级盐酸的纯度要求在30%以上,而实验室级盐酸的纯度要求更高,达到36%以上。
纯度的高低直接影响着盐酸的化学性质和使用效果,因此在生产和使用过程中必须严格控制。
此外,盐酸的酸度也是一个重要的质量指标。
酸度的大小直接关系到盐酸的化学反应性和腐蚀性,因此在使用过程中需要根据具体需求选择合适酸度的盐酸产品。
工业上一般会通过测定盐酸的酸度来评估产品的质量,并根据具体用途制定相应的标准。
此外,盐酸的铁含量也是一个重要的质量指标。
铁离子的存在会影响盐酸的颜色和纯度,因此工业标准中通常会对盐酸的铁含量进行严格限制,以保证产品的质量和稳定性。
最后,盐酸的储存和包装也是影响产品质量的重要因素。
盐酸是一种腐蚀性较强的化学品,因此在储存和包装过程中需要采取相应的防护措施,确保产品不受外界环境的影响,保持稳定的质量。
总的来说,盐酸的质量标准涉及外观、纯度、酸度、铁含量以及储存包装等多个方面。
在生产和使用过程中,需要严格按照相关标准进行控制,以确保产品质量和生产安全。
希望本文对相关行业有所帮助,谢谢阅读。

工业盐酸1、含量(1)试剂①混合指示剂(溴甲酚绿-甲基红混合指示剂)②氢氧化钠标准溶液L(配制见标准溶液的配制)(2)测定步骤取盐酸1-2mL(V)于250mL锥形瓶中,用蒸馏水稀释至100mL左右,再加2-3滴混合指示剂,用L(a)氢氧化钠标准滴定溶液滴定到溶液呈亮绿色为止,记下消耗的体积V1。
(3)计算C=×100%C————盐酸的含量,%a————氢氧化钠标准溶液的浓度,mol/LV1————消耗氢氧化钠标准溶液的体积,mLV————吸取盐酸的体积,mLM————盐酸的摩尔质量,g/mol2、盐酸中杂质的测定盐酸中硫酸盐、亚硫酸盐的测定方法一:比浊法硫酸盐取本品25g(21ml),加碳酸钠试液2滴,置水浴上蒸干;残渣加水20ml溶解后,依法检查(附录ⅧB),与标准硫酸钾溶液制成的对照液比较,不得更浓(%)。
亚硫酸盐取新沸过的冷水50m1,加碘化钾1g、碘滴定液(L)与淀粉指示液,摇匀;另取本品5ml,加新沸过的冷水50ml稀释后,加至上述溶液中,摇匀,溶液的蓝色不得完全消失。
方法二:离子色谱法用离子色谱仪测定蒸干稀释后测硫酸盐、亚硫酸盐的含量,具体操作方法见离子色谱仪的操作规程。
方法三:分光光度法(只限于硫酸盐)本方法规定了用比浊法测定工业用合成盐酸中硫酸盐含量,适用于各级工业用合成盐酸。
1) 方法原理将工业用合成盐酸样品蒸发至干,用盐酸溶解残渣,用甘油—乙醇混合液做稳定剂,加入氯化钡制得硫酸钡悬浮液,用分光光度计测定悬浮液的浊度。
2) 试剂和材料a二水氯化钡(GB 652)b甘油(GB 687)—乙醇混合液:1+2溶液c硫酸盐标准溶液:L溶液,按GB 602配制d盐酸(GB 622):L溶液,按GB 602配制3)仪器一般实验室仪器和分光光度计和水浴锅4) 样品a 实验室样品按本标准采样法采样。
b试样试样与实验室样品相同。
5) 分析步骤a 试样称取约20g试样,精确至。
置于蒸发皿中,在沸水浴上蒸发至干,冷却至室温,加3mL盐酸溶液溶解残留物,全部移入50mL容量瓶中,加5mL甘油—乙醇混合液,稀释至刻度,混匀。

盐酸标准溶液标定及碱灰中总碱度的测定孟欣昱,2012级化学生物学01班摘要:本实验是配制约为0.1mol·L-1HCL溶液,并对其进行标定。
以无水Na2CO3为基准物,以甲基橙为指示剂标定盐酸标准溶液的浓度。
用此标准溶液以甲基橙为指示剂,滴定碱灰,测定碱灰中的总碱度。
该测定结果是碱的总量,通常以Na2O的质量分数来表示,并用Q检验法对实验结果进行分析,测定的碱灰的总碱度为:48.89±0.16%关键词:标定;盐酸;碱灰;总碱度Standardization of Hydrochloric acid standard titration solution and measurethe total alkalinity of industrial sodaMeng Xinyu 20123004Abstract: This experiment the Hydrochloric acid into about 0.1mol﹒L-1and standardized it. Using anhydrous sodium carbonate as primary standard substance and methyl orange as indicator to standardize the Hydrochloric acid.Then using methyl orange as indicator and titrated industrial soda by using this standard solution.We get total alkalinity.Generally we used the mass fraction of Na2O to express the total alkalinity.We used Q test and the content of the industrial soda was 48.89±0.16% Keywords: standardize; Hydrochloric acid; industrial soda total alkalinity;1 引言标定酸的标准浓度是化学实验中的基础实验,所运用的基准物质有很多种,本实验采用的是无水碳酸钠。
工业用合成盐酸操作规程山东康泰化工有限公司年月日文件名称工业用盐酸检验操作规程编码SOP-YL005-01编制部门制订者审核者批准者编制日期审核日期批准日期制作备份版本号执行日期颁发部门发送部门目的:建立一个规范的工业用盐酸检验操作规程。
范围:本规程适用于本场进场原料工业用三甲胺检验操作的管理。
职责:QC员负责本规程的实施。
内容:1.采样1.1 采样工具三酸采样器、塑料瓶或磨口玻璃瓶(500ml)1.2采样流程采样人员穿戴好劳保防护用品(防酸服,护目镜,防毒口罩,耐酸手套等),带着洁净干燥的取样器及取样瓶去现场取样。
取样前先用样品置换采样瓶三次,然后自槽车上中下三处采取等量有代表性的样品,将采取的样品混匀,装于洁净,干燥的塑料瓶或具磨口塞的玻璃瓶中,密封,样品两不少于500ml。
样品瓶上贴上标签,著名生产厂家,产品名称、批号、采样时间及采样人等。
2.检验2.1 性状目视观察应为无色或浅黄色透明液体。
2.2 总酸度的测定2.2.1原理样品溶液以溴甲酚绿为指示剂,用氢氧化钠标准滴定液滴定至溶液由黄色变为蓝色为终点。
2.2.2 试剂a.氢氧化钠标准滴定液,C(NaOH)=1.000mol/Lb. 溴甲酚绿乙醇溶液,1g/L。
2.2.3 仪器A.天平(万分之一)B.量筒,50mlC.锥形瓶,100ml具磨口塞D.碱式滴定管,50mlE.吸量管,5ml2.2.4 分析步骤量取3ml实验室样品,置于内装15ml水并以称重(精确到0.0001g)的锥形瓶中,混匀并称量(精确到0.0001g)。
加入2-3滴溴甲酚绿指示剂,用氢氧化钠标准溶液滴定至溶液由黄色变为蓝色为终点。
2.2.5 结果计算总酸度以氯化氢的质量分数计,数值以%计(≥31.0%)(V/1000)cM VcMω1= *100 =m0 10m0式中:V—氢氧化钠标准滴定液的体积,mlC—氢氧化钠标准滴定液的浓度,mol/Lm0—样品的质量,gM—氯化氢的摩尔质量,g/mol(M=36.461)2.2.6 允许误差两次平行测定结果之差不大于0.2%,取其算术平均值为报告结果2.3铁含量的测定邻菲啰啉分光光度法2.3.1 原理用盐酸羟胺将样品中的三价铁还原成二价铁,在PH为4.5的缓冲溶液体系中,二价铁与邻菲啰林反应生成橙红色络合物,用分光光度计测定吸光度。
工业盐酸中氧化性和还原性杂质的分析【摘要】介绍了工业盐酸中氧化性物质和还原性物质的发现过程和检测方法,简要分析了这些物质对生产所造成的危害,为工业盐酸的入厂检验把好关,延长了设备的使用寿命,节约了企业的生产成本。
【关键词】工业盐酸;氧化性;还原性一. 工业盐酸是化学上常用的药品之一,常用于树脂的再生。
目前在我厂化水车间的水处理、精处理和弱酸处理岗位总共有16台混床和10台双流阳床。
每台混床和双流阳床的再生都需要几吨的工业盐酸。
一台混床的再生周期平均是15天,一台双流阳床的再生的周期平均是4天。
可以说工业盐酸的用量是化水车间的生产成本的不可忽视的一部分。
假如工业盐酸不合格,含有氧化性物质(如次氯酸钠)和还原性物质(如亚硫酸钠),除了直接损失外,还会造成不可估计的间接损失。
长时间用氧化性强的盐酸再生树脂,会造成树脂的快速变质和老化,严重减少树脂的使用寿命。
树脂中若含有还原性物质亚硫酸盐,再生时会挥发出大量的SO2气体,不但对再生操作人员的身体造成危害,还会造成设备的酸性腐蚀。
二. 氧化性物质的分析在对入厂工业盐酸进行取样化验时,通常用甲基橙做指示剂,用氢氧化钠溶液滴定,通过消耗氢氧化钠的量来计算盐酸的浓度。
某日取样化验,按规定加入2滴甲基橙指示剂后,本来遇酸显红色的甲基橙居然没有颜色,这引起了我的注意,随即重新取样,加入指示剂后仍然没有颜色。
是什么物质会使本该显红色的物质褪色呢?甲基橙是酸碱指示剂,在溶液PH小于3.1时显红色,大于4.4时显黄色,通常用于测定水的碱度。
天然水中的常见离子如Na+,Ca2+,NO3-,SO42-等都不会使甲基橙褪色。
说到测定碱度,突然想起循环水常用次氯酸钠来杀死水中有机物,以减少有机物对系统的污堵。
有一次杀菌结束后取循环水测定碱度,加入甲基橙后也是不显颜色,这是不是同样的原因造成的呢,难道是水中含有氧化性物质次氯酸钠使甲基橙褪色了吗?而工业盐酸中会有次氯酸钠吗?这些都只是疑问。
盐酸溶液的参考标准
盐酸溶液的参考标准是由国家质量监督检验检疫局(AQSIQ)发布的《化学试剂工业产品规范》(GB/T 601-2018)中规定的。
该标准规定了盐酸溶液的化学性质、外观和纯度等方面的要求。
根据该标准,盐酸溶液的化学性质应符合以下要求:
1. 盐酸溶液的化学式为HCl,其有效成分含量应在36-38%之间。
2. 盐酸溶液的酸度(pH值)应在1.0-0.5之间。
3. 盐酸溶液应无色透明,无悬浮物和沉淀。
盐酸溶液的外观要求:
1. 盐酸溶液应为无色透明液体,不应有浑浊、沉淀等异常情况。
2. 盐酸溶液应无异味。
盐酸溶液的纯度要求:
1. 盐酸溶液中不得含有有机杂质、重金属离子等有害物质。
2. 盐酸溶液的总不纯物质含量不得超过规定的限量。
需要注意的是,以上为一般情况下盐酸溶液的参考标准,具体应根据产品的用途和要求确定相应的标准。
对于特定用途的盐酸溶液,可能会有额外的标准和要求。
因此,在实际应用中应参考相关产品标准和法规要求。
工业合成盐酸标准工业合成盐酸。
工业合成盐酸是一种重要的化工原料,广泛应用于冶金、化工、制药、农药等领域。
盐酸是一种无机酸,化学式为HCl,是氯化氢气体在水中的溶液。
它是一种常见的无机酸,具有强酸性和腐蚀性。
工业合成盐酸的生产主要是通过氯化氢气体和水的反应得到的。
氯化氢气体通入冷却水中,生成盐酸溶液。
这个过程需要在恰当的温度和压力条件下进行,同时要控制反应的速度和产物的纯度。
在工业生产中,盐酸的质量是非常重要的。
优质的盐酸应该具有高纯度、无杂质、无色无味、稳定性好等特点。
因此,在生产过程中,需要严格控制原料的质量、反应条件的控制以及产物的提纯过程,以确保生产出符合标准的盐酸产品。
工业合成盐酸的标准主要包括以下几个方面:一、外观要求,优质的盐酸应该是无色透明的液体,不应该有悬浮物和沉淀物,无异物和机械杂质。
二、化学成分,盐酸的主要成分是氯化氢和水,其含量应该符合国家标准要求,且不能含有其他杂质。
三、酸度,盐酸的酸度是衡量其强酸性的重要指标,应该符合国家标准要求,以确保其在工业应用中的稳定性和可靠性。
四、密度,盐酸的密度也是一个重要的物理指标,应该符合国家标准要求,以保证其在储运和使用过程中的方便性和稳定性。
五、腐蚀性,盐酸具有很强的腐蚀性,因此在生产、储存和运输过程中,需要采取相应的措施,确保安全生产和使用。
工业合成盐酸的标准不仅仅是为了保证产品质量,更是为了保障生产安全、环境保护和人身安全。
只有严格按照标准要求生产,才能生产出优质的盐酸产品,为各行业的生产和应用提供可靠的保障。
总之,工业合成盐酸是一种重要的化工原料,其标准化生产对于保障产品质量、生产安全和环境保护具有重要意义。
只有严格按照标准要求进行生产,才能生产出符合要求的盐酸产品,为各行业的生产和应用提供可靠的保障。
工业盐酸中微量氟的测定摘要:本文介绍了一种测定工业盐酸中微量氟含量的方法。
该方法利用离子选择性电极测定氟离子浓度,采用标准加入法进行定量分析。
通过对标准溶液的测定,确定了分析方法的准确性和精密度。
最终,该方法应用于实际工业盐酸中微量氟的测定,结果表明该方法简便可行、准确可靠。
关键词:工业盐酸、微量氟、离子选择性电极、标准加入法、定量分析引言工业盐酸是一种广泛应用的化学品,主要用于金属表面处理、清洗、制药等领域。
然而,由于制造过程中的杂质和污染物,工业盐酸中可能会含有微量的有害物质,如氟化物。
氟化物是一种对人体有害的物质,对人的骨骼、牙齿、肌肉和神经系统都有一定的危害。
因此,对工业盐酸中微量氟的测定具有重要的意义。
目的本文的目的是研究一种测定工业盐酸中微量氟含量的方法,并通过实验验证该方法的准确性和精密度。
实验方法仪器和试剂1.氟离子选择性电极2.磷酸二氢钾3.标准氟化物溶液4.工业盐酸样品测定方法1.样品的制备取一定量的工业盐酸样品,加入适量的磷酸二氢钾,使其pH值在4.5~5.5之间,使得氟化物离子在溶液中呈现出最佳的电极响应。
在此之后,加入适量的标准氟化物溶液,使其浓度为5、10、15、20、25 mg/L。
2.测定将离子选择性电极插入样品中,调节电位计至稳定,记录电位值。
再将标准氟化物溶液逐一加入样品中,每加入一次,记录一次电位值。
重复上述步骤,直到所加入的标准氟化物溶液浓度达到25 mg/L。
并记录每次加入标准溶液后的电位值。
将记录的电位值制成曲线,通过曲线拟合计算出样品中微量氟的含量。
结果与讨论通过实验测定标准氟化物溶液,计算出了标准氟化物溶液的浓度和离子选择性电极的响应值。
在加入标准氟化物溶液的过程中,离子选择性电极的响应值随着标准溶液浓度的增加而增加。
通过对实验数据进行处理,得到了样品中微量氟的含量。
实验结果表明,该方法测定工业盐酸中微量氟的含量准确可靠、稳定性好。
同时,该方法具有操作简单、快速、精密度高等优点。
工业盐酸
1、含量
(1)试剂
①混合指示剂(溴甲酚绿-甲基红混合指示剂)② 氢氧化钠标准溶液1.0mol/L
(配制见标准溶液的配制)
(2)测定步骤
取盐酸1-2mL( V)于250mL锥形瓶中,用蒸馏水稀释至100mL左右,再加2-3 滴混合指示剂,用1.0mol/L ( a)氢氧化钠标准滴定溶液滴定到溶液呈亮绿色为止,记下消耗的体积VI。
(3)计算
C= 错误!未找到引用源。
X 100%
C ------ 盐酸的含量,%
a ------ 氢氧化钠标准溶液的浓度,mol/L
V1 ------ 消耗氢氧化钠标准溶液的体积,mL
V ------ 吸取盐酸的体积,mL
M ------ 盐酸的摩尔质量,g/mol
2、盐酸中杂质的测定
2.1盐酸中硫酸盐、亚硫酸盐的测定
方法一:比浊法
硫酸盐取本品25g (21ml),加碳酸钠试液 2滴,置水浴上蒸干;残渣加水 20ml溶解后,依法检查(附录
忸B),与标准硫酸钾溶液 1.25ml制成的对照液比较,不得更浓( 0.0005 %)。
亚硫酸盐取新沸过的冷水50m1加碘化钾1g、碘滴定液(0.01mol/L ) 0.15ml与淀粉指示
液1.5m1,摇匀;另取本品5ml,加新沸过的冷水50ml稀释后,加至上述溶液中,摇匀,溶液的蓝色不得完全消失。
方法二:离子色谱法
用离子色谱仪测定蒸干稀释后测硫酸盐、亚硫酸盐的含量,具体操作方法见离子色谱仪的操作规程。
方法三:分光光度法(只限于硫酸盐)
本方法规定了用比浊法测定工业用合成盐酸中硫酸盐含量,适用于各级工业用合成盐酸。
1)方法原理
将工业用合成盐酸样品蒸发至干,用盐酸溶解残渣,用甘油一乙醇混合液做稳定剂,加入氯化钡制得硫酸钡悬浮液,用分光光度计测定悬浮液的浊度。
2)试剂和材料
a二水氯化钡(GB 652)
b甘油(GB 687)—乙醇混合液:1+2溶液
c硫酸盐标准溶液:0.1000g/L溶液,按GB 602配制
d 盐酸(GB 622):1.000mol/L 溶液,按 GB 602配制
3)仪器
一般实验室仪器和分光光度计和水浴锅
4)样品
a实验室样品
按本标准采样法采样。
b试样
试样与实验室样品相同。
5)分析步骤
a试样
称取约20g试样,精确至O.OIg。
置于蒸发皿中,在沸水浴上蒸发至干,冷却至室温,加3mL盐酸溶液溶解残留物,全部移入50mL容量瓶中,加5mL甘油一乙醇混合液,稀释至刻度,混匀。
b空白试验
不加试样,采用与测定试样完全相同的分析步骤,试剂和用量进行空白试验。
c测定
将试样溶液小心地移入盛有0.3g氯化钡的干燥烧杯中,以每秒两转的速度摇动2min,在21 〜25°C下,静置 10min。
用3cm比色皿,在波长450nm处,以空白溶液调整分光光度计吸光度为零,测出试样溶液的吸光度。
d工作曲线的绘制
按表2要求吸取硫酸盐标准溶液分别置于七只 50mL容量瓶中。
表2
向每个容量瓶中分别加入3mL 盐酸溶液、5mL 甘油一乙醇混合液,用水稀释至刻 度,混匀。
按测定步骤,测定各溶液相应的吸光度,以硫酸盐含量为横坐标,对应的 吸光度为纵坐标绘制工作曲线。
6)分析结果的表述
硫酸盐百分含量(X i )按下式计算:
式中:m —试样质量,g ;
m i —由工作曲线查得的试样中硫酸盐的质量, mg 7)允许差
两次平行测定结果之差不大于0.001%,取其算术平均值为报告结果。
3 •游离氯或溴的测定
游离氯或溴
取本品10g (8.5ml ),加水稀释至20m1冷却,加含锌碘化钾淀
粉指示液0.2ml ,10分钟内溶液不得显蓝色。
即为游离氯或溴合格
4.铁和砷的测定
方法一:邻菲罗啉分光光度法测铁 (1)方法概要
本方法基于在pH4〜5的条件下,用盐酸羟胺把高铁(三价铁)还原成亚铁(二价 铁),亚铁与邻菲罗啉生成桔红色络合物,用分光光度法测定,其反应式如下:
X !
——四
100
m o 1000
Fh+独H芯二[FKGKNJJ
(2)试剂
①盐酸羟胺溶液(质/容)10%:称取10g盐酸羟胺,加少量二级试剂水,待溶解后用二级试剂水稀释至100mL摇匀贮于棕色瓶中。
②邻菲罗啉溶液(质/容)0.1% :称取1.0g邻菲罗啉(Ci2fZ • HO)溶于100mL无水乙醇中,用二级试剂水稀释至1L,摇匀贮于棕色瓶中(存放在冰箱中)。
③乙酸铵缓冲溶液:称取100g乙酸铵(分析纯)溶于100mL二级试剂水中,加200mL 冰乙酸,用二级试剂水稀释至1L,摇匀。
④铁标准溶液(1mL含0.01mg铁):按GB60—77《杂质标准溶液制备方法》配制,使用时稀释至1/10原浓度。
⑤氢氧化氨1+1溶液:按GB631-89《化学试剂氨水》配制。
(3)仪器
分光光度计:1cm的比色皿。
(4)分析步骤
①标准曲线的绘制
根据试样铁含量按表1取铁工作溶液注入一组50mL容量瓶中,加二级试剂水20 mL。
表1铁工作曲线的制作1 mL溶液中含0.01 mgFe
②于上述容量瓶中,加1mL盐酸羟胺溶液,摇匀静置5min,加5mL邻菲罗啉溶液,摇匀后,慢慢滴加氨水(氢氧化氨溶液)至刚果红试纸由蓝色变为紫红色(pH3.8〜4.1)。
再加5mL 乙酸-乙酸铵缓冲溶液(2.3),摇匀,用35C 左右的二级试剂水稀释至满刻 度,摇匀。
放置15min 后,在波长510nm 处用1cm 或2cm )比色皿,以空白溶液为参 比,测定各显色液的吸光度值。
以所测吸光度值和相应的铁含量绘制工作曲线。
③ 用带线性回归的计算器对吸光度值与铁含量的数据作回归处理。
以铁含量作自变 量,相应的吸光度值作因变量,输入计算器,就可得到吸光度值 程。
④ 试样的测定
吸取8.0mL 试样,用相对密度换算成质量或称重。
移入内装 50mL 二级试剂水的
100mL 容量瓶中,稀释至满刻度,摇匀。
从中吸取
10mL 试液于50mL 容量瓶中(事先加
少量的温度为35E 左右的二级试剂水),按4.1.2条进行显色并测定吸光度值,根据标 准曲线(4.1.1)查出试样含铁的毫克数。
⑤ 可根据试样吸光度值,从回归方程求出相应的铁含量 m ?
(5 )计算及允许误差
①铁的含量x (以质量百分数表示)按下式计算:
式中 m ---- 试样铁含量,mg
m --- 试样质量,g ;
1
一二 mg 换算为g 时的换算系数 允许误差
铁的含量平行测定的允许误差不大于 0.0005%. 方法二:电感耦合等离子体质谱仪测金属离子
-铁含量的线性回归方 X1OO% =
^%
m。