循环伏安法标定电极
- 格式:pdf
- 大小:195.98 KB
- 文档页数:2


循环伏安法判断电极过程实验报告循环伏安法判断电极过程实验报告引言:循环伏安法是一种常用的电化学测试方法,用于研究电极材料的电化学行为。
本实验旨在通过循环伏安法测定电极材料的氧化还原反应特性,并分析实验结果,探讨其在电化学领域的应用前景。
实验材料与方法:实验所用材料为铂电极和铜电极,实验仪器为循环伏安仪。
首先,将铂电极和铜电极分别清洗并抛光,以确保电极表面的纯净度和光滑度。
然后,将电极插入电解质溶液中,并设置循环伏安仪的扫描速度和电位范围。
接下来,进行循环伏安法测试,记录电流与电位之间的关系曲线。
实验结果与分析:通过循环伏安法测试,我们得到了铂电极和铜电极的电流-电位曲线。
根据曲线的形状和特点,我们可以得到以下结论和分析:1. 铂电极的电流-电位曲线呈现出典型的双电极峰形状,其中一个峰对应氧化反应,另一个峰对应还原反应。
这说明铂电极在测试条件下发生了氧化还原反应,具有良好的电化学活性。
这一特性使得铂电极在催化剂、电池等领域有着广泛的应用前景。
2. 铜电极的电流-电位曲线呈现出单峰形状,没有出现双电极峰。
这说明铜电极在测试条件下只发生了一种氧化还原反应,具有较低的电化学活性。
然而,铜电极在电化学合成、电镀等领域仍然有着重要的应用,其特殊的电化学行为可以被利用。
3. 通过对电流-电位曲线的分析,我们可以得到电极反应的动力学参数,如峰电位、峰电流等。
这些参数可以进一步用于计算电极的表面积、电荷转移速率等重要参数,为电极材料的性能评价提供参考。
结论:本实验通过循环伏安法测试了铂电极和铜电极的电流-电位曲线,并对实验结果进行了分析。
通过曲线的形状和特征,我们可以了解电极材料的氧化还原反应特性和电化学活性。
这对于电化学领域的研究和应用具有重要意义。
循环伏安法作为一种常用的电化学测试方法,具有广泛的应用前景,可以用于研究各种电极材料的性能,并为相关领域的发展提供支持。
总结:循环伏安法是一种重要的电化学测试方法,通过测定电流-电位曲线,可以研究电极材料的氧化还原反应特性和电化学活性。
![《仪器分析实验》(循环伏安法判断电极过程)[详细讲解]](https://img.taocdn.com/s1/m/e2ce933b7275a417866fb84ae45c3b3566ecdd5f.png)
一、实验目的1、了解电化学工作站的基本构造和使用方法。
2、理解并掌握循环伏安法判断电极过程的原理和方法。
二、实验原理
1、 峰电流方程式:
c
v K i p ⋅⋅=21 c
i p ∝ 21
v i p ∝
2、 可逆性判断?①1≈pc pa
i i ②mV n
pc pa p 56=-=∆ϕϕϕ
三、仪器设备
1、 电化学分析仪:
(LK2005A ,连接到计算
机)。
2、 三电极系统:以铂电极为对电极,Ag|AgCl 电极(或甘汞电极)为参比电极,玻碳电极为工作电极构成三电极系统。
四、实验步骤
1、 电极的预处理。
2、 不同扫描速率下K 3Fe(CN)6溶液的循环伏安图。
3、 不同浓度的K 3Fe(CN)6溶液的循环伏安图。
五、数据处理
循环伏安图
六、思考题
1、为什么要使用三电极系统?
2、循环伏安法如何判断电极过程是否可逆?
附:电化学工作站基本操作
1、打开计算机的电源开关,打开LK2005A电化学工作站主机的电源开关。
2、在WindowsXP操作平台下运行“LK2005A.exe”,进入主界面。
3、方法选择。
4、参数设定。
5、开始实验。
6、保存数据。
7、数据处理。
8、关机。
附:快捷命令
附:三电极系统
目的:减少iR 降
W: 工作电极
R: 参比电极
C: 辅助电极
i : 由W 和C 电路获得 电路获得和由R W w :。
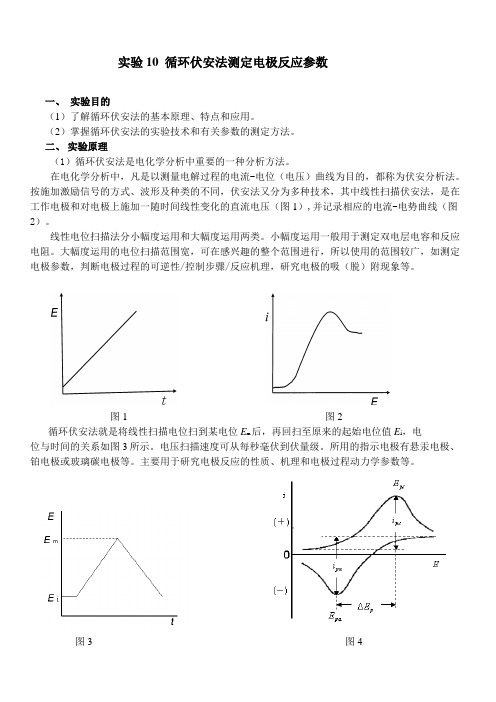
实验10 循环伏安法测定电极反应参数一、实验目的(1)了解循环伏安法的基本原理、特点和应用。
(2)掌握循环伏安法的实验技术和有关参数的测定方法。
二、实验原理(1)循环伏安法是电化学分析中重要的一种分析方法。
在电化学分析中,凡是以测量电解过程的电流-电位(电压)曲线为目的,都称为伏安分析法。
按施加激励信号的方式、波形及种类的不同,伏安法又分为多种技术,其中线性扫描伏安法,是在工作电极和对电极上施加一随时间线性变化的直流电压(图1),并记录相应的电流-电势曲线(图2)。
线性电位扫描法分小幅度运用和大幅度运用两类。
小幅度运用一般用于测定双电层电容和反应电阻。
大幅度运用的电位扫描范围宽,可在感兴趣的整个范围进行,所以使用的范围较广,如测定电极参数,判断电极过程的可逆性/控制步骤/反应机理,研究电极的吸(脱)附现象等。
图1 图2循环伏安法就是将线性扫描电位扫到某电位E m后,再回扫至原来的起始电位值E i,电位与时间的关系如图3所示。
电压扫描速度可从每秒毫伏到伏量级。
所用的指示电极有悬汞电极、铂电极或玻璃碳电极等。
主要用于研究电极反应的性质、机理和电极过程动力学参数等。
图3 图4当溶液中存在氧化态物质O 时,它在电极上可逆地还原生成还原态物质R ,O + ne → R当电位方向逆转时,在电极表面生成的R 则被可逆地氧化为O,R → O + ne一个三角波扫描,可以完成还原与氧化两个过程,记录出如图4所示的循环伏安曲线。
在循环伏安法中,阳极峰电流i P a 、阴极峰电流i P c 、阳极峰电位E pa 、阴极峰电位E P c 是最重要的参数,对可逆电极过程来说, 峰电位不随扫描速度变化,且 5763E E E mV n∆=pa pc -= (1) 即阳极峰电势(E pa )与阴极峰电势(E pc )之差为57/n 至63/n mV 之间,确切的值与扫描过阴极峰电势之后多少毫伏再回扫有关。
一般在过阴极峰电势之后有足够的毫伏数再回扫,△E P 值为58/n mV 。
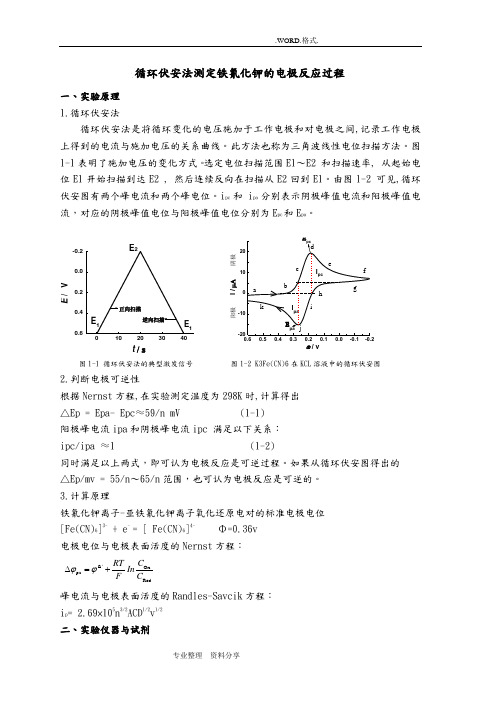
循环伏安法测定铁氰化钾的电极反应过程一、实验原理 1.循环伏安法循环伏安法是将循环变化的电压施加于工作电极和对电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
此方法也称为三角波线性电位扫描方法。
图1-1表明了施加电压的变化方式。
选定电位扫描范围E1~E2 和扫描速率, 从起始电位E1开始扫描到达E2 , 然后连续反向在扫描从E2回到E1。
由图1-2 可见,循环伏安图有两个峰电流和两个峰电位。
i pc 和 i pa 分别表示阴极峰值电流和阳极峰值电流,对应的阴极峰值电位与阳极峰值电位分别为E pc 和E pa 。
图1-1 循环伏安法的典型激发信号 图1-2 K3Fe(CN)6在KCL 溶液中的循环伏安图2.判断电极可逆性根据Nernst 方程,在实验测定温度为298K 时,计算得出 △Ep = Epa- Epc ≈59/n mV (1-1) 阳极峰电流ipa 和阴极峰电流ipc 满足以下关系: ipc/ipa ≈1 (1-2)同时满足以上两式,即可认为电极反应是可逆过程。
如果从循环伏安图得出的 △Ep/mv = 55/n ~65/n 范围,也可认为电极反应是可逆的。
3.计算原理铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位 [Fe(CN)6]3- + e - = [ Fe(CN)6]4- Φ=0.36v 电极电位与电极表面活度的Nernst 方程:峰电流与电极表面活度的Randles-Savcik 方程: i p = 2.69×105n 3/2ACD 1/2v 1/2 二、实验仪器与试剂0'Ox pa RedC RTIn F C ϕϕ∆=+E / Vt / s阳极 i / μA 阴极ϕ / v仪器: CHI660电化学工作站,电解池铂盘工作电极铂丝辅助电极Ag/AgCl参比电极。
试剂:铁氰化钾溶液:0.1mol/L;硝酸钾溶液:1.0mol/L三、实验步骤1.Pt工作电极预处理不同粒度的α-Al2O3粉,抛光,洗去表面污物,再超声水浴中清洗,每次2-3分钟,重复三次,得到平滑光洁和新鲜的电极表面。

循环伏安法测定电极反应参数一、实验目的1、学习循环伏安法测定电极反应参数的基本原理2、熟悉伏安法测量的实验技术二、实验原理循环伏安法(CV)是最重要的电化学分析研究方法之一。
在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。
CV方法是循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
如图:|——循环1——|——循环2—|循环伏安法典型激发信号三角波电位,转换电位为0.8V和-0.2V(vs.SCE)当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
如图:0.1mol/LKNO3电解质溶液中,0.006mol/LK3Fe(CN)6在Pt电极上的反应所得到的结果。
E/V(vs.SCE)扫描速度:50V/s 铂电极面积:2.54nm2其电极反应为:选择施加在a点的起始电位E i为0.8v然后沿负的电位即正向扫描,当电位负到能够将Fe(CN) 63-还原时,在工作电极上发生还原反应:Fe(CN) 63-+e=Fe(CN) 64-,阴极电流迅速增加(b-d),电流在d点达到最高峰,此后由于电极附近溶液中的Fe(CN)63-转变为Fe(CN) 64-而耗尽,电流迅速衰减(d-e);在f点电压沿正的方向扫描,当电位正到能够将Fe(CN) 64-氧化时,在工作电极表面聚集的将发生氧化反应:Fe(CN)64-e= Fe(CN)63-,阳极电流迅速增加(i-j),电流在j点达到最高峰,此后由于电极附近溶液中的Fe(CN) 64-转变为Fe(CN) 663-而耗尽,电流迅速衰减(j-k);当电压达到a点的起始电位E i时便完成了一个循环。
循环伏安图的几个重要参数为:阳极峰电流(i pa)、阴极峰电流(ipc)、阳极峰电位(Epa)、阴极峰电位(Epc)。
对可逆氧化还原反应E= (E pa+E pc)/2,对于可逆反应,阴阳极峰电位的值,△E=E pa-E pc≈0.056/n(1)峰电位与扫描速度无关,而峰电流i p=2.69×105n3/2AD1/2V1/2C,i p 为峰电流(A),n为电子转移数,A为电极面积(cm2),D为扩散系数(cm2/s),V为扫描速度(V/s),C为浓度(mol/L)。
循环伏安法测定电极反应一、实验目的1、学习循环伏安法测定电极反应的基本原理和方法。
2、熟悉电化学工作站的使用并根据所测数据验证并判断电极反应是否是可逆反应。
二、实验原理伏安分析法是在一定电位下测量体系的电流,得到伏安特性曲线。
根据伏安特性曲线进行定性定量分析。
循环伏安法是将对称的三角波扫描电压(如图一)施加于电解池的电极上,记录工作电极上的电流随电压变化的曲线。
在三角波的前半部分,电极上若发生还原反应(阴极过程),得到一个峰形的阴极波;而在三角波的后半部分,则得到一个峰形的阳极波。
一次三角波电压扫描,电极上完成一个氧化还原循环。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)做图,就得到了循环伏安图(如图二所示)。
图一图二E pc、E pa分别为阴极峰值电位与阳极峰值电位。
i pc、i pa分别为阴极峰值电流与阳极峰值电流。
这里p代表峰值,a代表阳极,c代表阴极。
[Fe(CN)6]3--[Fe(CN)6]4-体系氧化还原电对的标准电极电位为:[Fe(CN)6]3- + e- = [Fe(CN)6]4-φθ= 0.36V电极电位与电极表面活度的Nernst方程式为:φ=φθ+ nRT/Fln(αOx/αRed)。
若已知γ为活度系数,则αOx=γ•C Ox,αRed=γ•C Red。
在实验中,通常采用添加离子调节液(如KNO3溶液、Na2SO4溶液等)的方法来固定离子强度,此时γ可视为定值,则φ=φθ+ nRT/Fln(C Ox/C Red)。
用循环伏安法正扫时(由正向负的扫描)为阴极扫描,产生还原电流:Fe(CN)63- + e- = Fe(CN)64-反扫时(由负向正的扫描)为阳极扫描,产生氧化电流:Fe(CN)64- - e- = Fe(CN)63-两峰之间的电位差值为:(1)对于一个体系,循环伏安图中的阴极峰电流是由电极上吸附反应物的还原和溶液中反应物扩散到电极表面还原两部分组成。
实验4循环伏安法测定电极反应参数华南师范⼤学实验报告学⽣姓名:学号:专业:新能源材料与器件年级班级:17新能源1班课程名称:电化学基础实验实验项⽬:循环伏安法测定电极反应参数实验指导⽼师:吕东⽣实验时间:2019年3⽉25⽇⼀、实验⽬的1. 了解循环伏安法的基本原理及应⽤2. 掌握循环伏安法的实验技术和有关参数的测定⽅法。
⼆、实验原理循环伏安法(CV )是最重要的电分析化学研究⽅法之⼀。
该⽅法使⽤的仪器简单,操作⽅便,图谱解析直观,在电化学、⽆机化学、有机化学、⽣物化学等许多研究邻域被⼴泛应⽤。
循环伏安法通常采⽤三电极系统,⼀⽀⼯作电极,⼀⽀参⽐电极,⼀⽀对电极。
外加电压加在⼯作电极与辅助电极之间,反应电流通过⼯作电极与辅助电极。
循环伏安法加电压的⽅式如图a 所⽰。
对可逆电极过程,如⼀定条件下的3/46()Fe CN --氧化还原体系,当电压负向扫描时,36()Fe CN -在电极上还原,得到⼀个还原电流峰。
当电压正向扫描时,46()Fe CN -在电极上氧化,得到⼀个氧化电流峰。
所以,电压完成⼀次循环扫描后,将记录出⼀个如图b 所⽰的氧化还原曲线。
图a.循环伏安法加电压的⽅式图b.循环伏安法测得的氧化还原曲线在循环伏安法中,阳极峰电流i pa ,阴极峰电流pc i 、阳极峰电势pa E 、阴极峰电势pc E 以及a i p /c i p 、p pa pc -E E E ?()时最为重要的参数。
对于⼀个可逆过程:p pa pc -57~63/n m 25E E E ?≈()() V (℃)。
⼀般情况下,p E ?约为58/n mV (25℃),pa pc i /i 1≈。
正向扫描的峰电流p i 为:3115222p i =2.6910n v AD C ?从p i 的表达式看:p i 与12v 和C 都呈线性关系,对研究电极过程具有重要意义。
标准电极电势为:o pa pc =+/2E E E ()。
循环伏安法测定电极反应参数 PDF循环伏安法是一种常用的电化学测试方法,用于测定电极反应的动力学参数、化学反应的性质和热力学特性等,其原理是利用电压的周期性变化使电极表面的吸附物质进行氧化还原反应,通过测量电流和电位之间的关系,计算反应的动力学参数。
一、实验原理1.循环伏安法的原理:循环伏安法广泛应用于电化学催化、晶体生长、电化学传感器和电化学腐蚀等领域。
由于循环伏安法可以通过不同电极电位对反应进行调节,因此可以理解反应的动力学参数、化学反应的性质和热力学特性等。
二、实验材料1.铂片电极2.三角波电位发生器3.电化学工作站4.测试溶液:0.1mol/L H2SO4溶液三、实验步骤1.将铂片清洗干净,在0.1mol/L H2SO4溶液中进行电极阳极极化20分钟,使电极表面形成一层氧化铂;2.将阳极氧化铂放在电化学工作站上,连接三角波电位发生器;3.在电化学工作站上选择循环伏安法,设置三角波电位发生器的扫描速度和电位范围;4.在0.1mol/L H2SO4溶液中浸泡电极,打开电流计和电位计,开始测试;5.在测试结束后,将数据输入计算机中,通过分析数据得到循环伏安曲线。
四、实验结果通过循环伏安曲线,可以得到电极发生氧化还原反应的动力学参数、化学反应的性质和热力学特性等,一般包括以下几个方面:1.电极反应的电荷转移系数:通过计算循环伏安图中的正向峰和反向峰之间的峰电势差,可以计算出电荷转移系数。
2.电极反应的电流密度:通过测量所消耗的电流,并根据电化学理论和法拉第定律进行计算。
3.电极反应的控制类型:根据循环伏安曲线的形状,可以区分电极反应的控制类型,比如扩散控制型、电荷转移控制型、双层控制型等。
4.电极反应的动力学参数:通过循环伏安曲线中的谷值位置和峰电流大小以及电荷转移系数的信息,可以进一步计算出电极反应的动力学参数,比如转移系数、反应平衡常数等。
五、实验注意事项1.在进行实验前,应将电化学工作站和电极清洗干净;2.防止操作时盐酸喷洒,必要时戴好化学防护眼镜和手套;3.在测试过程中,尽量保持电位和电流稳定,测试结果会受到外部干扰波的影响。
循环伏安法【实验目的】学习和掌握循环伏安法的原理和实验技术。
了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。
【实验原理】循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。
从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。
与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。
一般对这类问题要根据固体电极材料不同而采取适当的方法。
对于碳电极,一般以Fe(CN)63-/4-的氧化还原行为作电化学探针。
首先,固体电极表面的第一步处理是进行机械研磨、抛光至镜面程度。
通常用于抛光电极的材料有金钢砂、CeO2、ZrO2、MgO和α-Al2O3粉及其抛光液。
抛光时总是按抛光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨后,再用一定粒度的α-Al2O3粉在抛光布上进行抛光。
抛光后先洗去表面污物,再移入超声水浴中清洗,每次2∼3分钟,重复三次,直至清洗干净。
最后用乙醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。
将处理好的碳图2:循环伏安曲线(i—E曲线)电极放入含一定浓度的K 3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。
如得到如图2所示的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc / i pa =1),峰峰电位差ΔE p 约为70 mV (理论值约59/n mV ),即说明电极表面已处理好,否则需重新抛光,直到达到要求。
有关电极有效表面积的计算,可根据Randles-Sevcik 公式: 在25°C 时,i p =(2.69×105)n 3/2AD o 1/2ν1/2C o其中A 为电极的有效面积(cm 2),D o 为反应物的扩散系数(cm 2/s),n 为电极反应的电子转移数,ν为扫速(V/s ),C o 为反应物的浓度(mol/cm 3),i p 为峰电流(A )。
仪器分析实验(电分析) 2004.02
注意事项:
1.电分析共四个实验:电位法测量水溶液的pH 值 (1.32)、氟离子选择电极测定饮用水中
的氟 (1.33) 、库仑滴定法测定砷 (1.35)以及循环伏安法 (本讲义);
2.组号为单数的同学第一周作1.32 和1.33; 双数的同学作1.35 及循环伏安法;
3.实验两人一组,自由组合;
循环伏安法
【目的】
学习和掌握循环伏安法的原理和实验技术。
了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。
【原理】
循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压,记录工作电极上得到的电流与施加电位的关系曲线,即循环伏安图。
从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。
与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。
一般对这类问题要根据固体电极材料不同而采取适当的方法。
对于碳电极,一般以Fe(CN)63-/4-的氧化还原行为作电化学探针。
首先,固体电极表面的第一步处理是进行机械研磨、抛光至镜面程度。
通常用于抛光电极的材料有金钢砂、CeO2、ZrO2、MgO和α-Al2O3粉及其抛光液。
抛光时总是按抛光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨后,再用一定粒度的α-Al2O3粉在抛光布上进行抛光。
抛光后先洗去表面污物,再移入超声水浴中清洗,每次2∼3分钟,重复三次,直至清洗干净。
最后用乙醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。
将处理好的碳电极放入含一定浓度的K3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。
如得到如图所示的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc / i pa=1),峰峰电位差∆E p约为70 mV(理论值约60 mV),即说明电极表面已处理好,否则需重新抛光,直到达到要求。
有关电极有效表面积的计算,可根据Randles-Sevcik公式:
在25°C时,i p=(2.69×105)n3/2AD o1/2ν1/2C o
其中A为电极的有效面积(cm2),D o为反应物的扩散系数(cm2/s),n为电极反应的电子转移数,ν为扫速(V/s),C o为反应物的浓度(mol/cm3),i p为峰电流(A)。
【仪器和试剂】
1.CHI 630A 电化学系统,玻碳电极(d = 4mm) 为工作电极,饱和甘汞电极为参比电极,
铂丝电极为辅助电极;
2.固体铁氰化钾、H2SO4溶液;
3.100mL 容量瓶、50 mL 烧杯、玻棒。
1.0×10-3 M K3Fe(CN)6, 0.1 M KCl, 0.05 V/s.
【实验内容】
1.配制5 mM K3Fe(CN)6 溶液(含0.5 M H2SO4),倒适量溶液至电解杯中;
2.将玻碳电极在麂皮上用抛光粉抛光后,再用蒸馏水清洗干净;
3.依次接上工作电极、参比电极和辅助电极;
4.开启电化学系统及计算机电源开关,启动电化学程序,在菜单中依次选择Setup、Technique、
CV、Parameter ,输入以下参数:
5.点击Run 开始扫描,将实验图存盘后,记录氧化还原峰电位E pc、E pa及峰电流I pc、I pa;
6.改变扫速为0.05、0.1 和0.2 V/s,分别作循环伏安图;
7.将4 个循环伏安图叠加,打印;
8.以氧化还原峰电流I pc、I pa分别与扫速的平方根ν1/2 作图,求算线性相关系数R。
9.根据I pc与扫速的平方根ν1/2 作图得到的线性回归方程,计算所使用的玻碳电极的有效面积。
(所用参数:电子转移数n=1,,K3Fe(CN)6的扩散系数D o=1×10-5 cm2/s)
Init E (V) 0.6 V Segment 2
High E (V) 0.6 V Smpl Interval (V) 0.001
Low E (V) −0.2 V Quiet Time (s) 2
Scan Rate (V/s) 0.02 V Sensitivity (A/V) 2e−5
【思考题】
1.如何理解电极过程的可逆性?
2.如何判断碳电极表面处理的程度?
参考文献
董绍俊,车广礼,谢远武,化学修饰电极,北京:科学出版社,1995。