酚的性质和应用
- 格式:doc
- 大小:55.00 KB
- 文档页数:5

酚的知识点总结高中在酚的结构中,苯环上的一个或多个氢原子被羟基(-OH)取代,形成了不同的酚类化合物。
酚的共轭芳香环结构和羟基的极性使得它具有物理性质和化学性质上的特殊性,因此酚在化学反应和应用中具有独特的作用。
本文将从酚的结构、性质、制备、应用等方面进行详细介绍。
一、酚的结构和性质1. 酚的结构酚的分子中,芳香环上的一个氢原子被羟基取代,得到一个与芳香环共平面的羟基苯环结构。
酚分子结构中的羟基提供了极性,使得酚具有一定的亲水性,同时酚分子中的芳香环结构使得它有着稳定的共轭结构,从而表现出了特殊的化学性质。
2. 酚的物理性质酚是一种无色至白色的固体,具有特殊的芳香气味。
它可以溶解在水中,并且在室温下有一定的挥发性。
酚的熔点和沸点较低,是一种易挥发的有机化合物。
3. 酚的化学性质酚具有一定的酸性,它可以与金属形成盐类,还可以发生酚醛缩合反应、酚醚化反应、酚酰胺反应等多种化学反应。
酚的化学性质与其分子结构密切相关,它在有机合成和材料科学中有着广泛的应用。
二、酚的制备1. 煤焦油提取法煤焦油中含有大量的酚类化合物,通过分馏和提取可以得到苯酚。
这是目前工业上主要的酚的制备方法之一。
2. 芳香烃的氧化法苯酚也可以通过对硝基苯或石脑油联产合成氢氧化苯,再进行还原反应得到。
这是有机合成中一种常见的制备方法。
3. 酚的合成除了以上两种方法外,实验室中还可以通过酚醛缩合反应、氢氧化反应等方法制备酚。
三、酚的应用1. 化学工业方面酚作为一种重要的有机化合物,在化工工业中有着广泛的应用。
它可以用作溶剂、合成材料、染料中间体等。
在合成树脂、塑料和橡胶等材料中,酚也是一种重要的原料。
2. 医药和医疗方面酚类化合物是许多药物的重要组成部分,如消毒剂、外用药品、镇痛剂等。
此外,酚类化合物还可以用于生产麻醉药和抗生素等药物。
3. 生活用品和日化产品酚的气味和性质使得它在香水、香料、肥皂等产品中有着广泛的应用。
此外,酚还可以用于生产防腐剂、抗氧化剂等化妆品原料。

酚酚(Phenol)酚,又称为苯酚,是一种有机化合物,化学式为C6H5OH。
它是一种无色液体,具有特殊的香气,可以在水中溶解并能和许多有机溶剂相混溶。
酚的熔点和沸点相对较低,因此在常温下它是液态的,但在较低的温度下可以凝固为固体。
酚在大气中能蒸汽化,并与空气中的氧气发生反应而燃烧。
早在19世纪,酚就被广泛应用于医药领域。
由于其抗菌性能,酚被用作防腐剂,可以防止药物在保存过程中受到微生物的污染。
酚也被用作麻醉剂,尽管现在已经有更安全的替代品。
除了医药领域,酚还被用于制造染料、树脂、农药以及许多其他化学品。
然而,尽管酚在许多领域都发挥着重要作用,但它也具有一定的危险性。
酚是一种有毒物质,对人体和环境都可能造成危害。
长期接触酚会引起皮肤刺激和烧伤,并可能导致中毒症状,例如头痛、恶心和呼吸困难。
此外,酚的燃烧会产生有毒的烟雾,可能导致中毒甚至死亡。
因此,在使用酚时,必须小心谨慎,并采取适当的安全措施。
在实验室中,需要戴上防护手套、护目镜和防护衣,并保持通风良好。
酚的储存也需要特别注意,应将其置于密闭容器中,并远离火源和氧化剂。
当处理酚废液时,应特别小心,避免其与其他物质发生反应,以免产生有害的化学物质。
为了减少酚对环境的影响,许多国家已经采取了措施限制酚的使用。
例如,一些国家对酚的排放进行了监管,并加强了相关工业的环境保护措施。
此外,一些替代品也被开发出来,以取代酚在某些领域的使用。
这些替代品具有相似的性质和功能,但对环境和人体更为安全。
在未来的发展中,人们需要进一步研究酚的性质和应用,以寻找更好的替代品或改进现有的生产和使用方式。
在化学领域,人们将继续努力,以确保化学品的安全性和可持续性。
只有在有效管理和使用化学物质的情况下,才能实现可持续发展的目标。
总结起来,酚作为一种有机化合物,在医药和化工领域中发挥着重要作用。
然而,由于其毒性和潜在的危险性,必须谨慎使用和妥善处理酚。
在未来,我们应该继续研究和发展替代品,以促进可持续的化学产业发展。




酚类知识点总结一、酚的性质1. 物理性质酚是一种无色至微黄色的液体,有时候也会呈现为白色结晶。
它的熔点为40.5°C,沸点为181.7°C。
酚的密度为1.07 g/cm3。
酚的水溶性很强,可以与水混溶。
2. 化学性质酚具有苯环和羟基官能团,因此它具有一系列特殊的化学性质。
酚可以与碱金属发生反应,生成酚基金属。
此外,酚还可以发生酚醛缩聚反应,生成酚醛树脂。
酚还可以和卤代烷发生亲核取代反应,生成酚基卤代烷。
二、酚的合成方法1. 氢氧化合成法最常见的合成酚的方法之一是氢氧化合成法。
这种方法是利用氯苯和氢氧化钠作用生成酚,反应式如下:C6H5Cl + NaOH → C6H5OH + NaCl2. 碱法或硫酸法合成碱法合成即苯的水合,将硫磺酸或氢氧化钠与煤焦油分馏液在高温条件下反应,生成含有苯环的酚:C6H5Cl + NaOH → C6H5OH + NaCl三、酚的重要用途1. 酚醛树脂的制备酚可以与醛类发生缩聚反应,生成酚醛树脂。
酚醛树脂是一种重要的合成树脂,具有很强的粘合力和耐磨性,可以用来制造木材粘合剂、涂料、绝缘材料等。
2. 医药用品的生产酚也是一种重要的药物合成原料,可以用来合成苯酚、萘磺酸和水杨酸等药物。
这些药物广泛用于制药工业,具有镇痛、抗炎、抗菌等作用。
3. 制备染料酚可以用作染料的合成原料,例如苯酚可以用于合成染料中间体。
染料是一种重要的工业产品,被广泛应用于纺织、皮革、印染等行业。
四、酚对人体的影响1. 酚的急性毒性酚对人体的急性毒性很强,如果吸入过量的酚蒸气或接触酚溶液,会引起头痛、头晕、恶心、呕吐等中毒症状。
如果中毒严重,还会导致呼吸困难、昏迷甚至死亡。
2. 长期接触酚的影响长期接触酚会对人体健康造成影响,比如会导致皮肤过敏、呼吸道疾病、神经系统损伤、肝肾功能损害等疾病。
因此,在生产过程中要采取有效的防护措施,减少酚对工人的影响。
结语酚是一种重要的有机化合物,具有很多重要的应用价值。



有机化学基础知识点整理酚的性质与反应酚的性质与反应酚是一类含有羟基(-OH)的有机化合物,常用的酚化合物有苯酚、萘酚等。
酚具有一系列独特的性质和反应,下面将对酚的性质和反应进行整理和讨论。
1. 酚的物理性质酚是无色液体或白色晶体,具有特殊的芳香味。
常见的苯酚为无色结晶状物质,能溶解于水和有机溶剂中。
酚分子中的羟基与苯环的共轭作用使得酚具有较强的氢键作用力,因此具有较高的沸点和相对较小的溶解度。
2. 酚的化学性质2.1 酚的酸碱性酚具有较强的酸性,可与碱反应生成相应的酚盐。
例如,苯酚与氢氧化钠反应可生成苯酚钠。
酚的酸碱性主要由其羟基的电子云密度决定,羟基中的氧原子带有负电荷,易将负电荷转移给碱性物质。
酚在酸性条件下容易发生缩合反应,形成酚醚、酚酯等具有较长碳链的有机化合物。
2.2 酚的氧化反应酚能够进行氧化反应,其中最常见的是与氧气反应生成酚醛或酚酮。
例如,苯酚在氧气存在下经过氧化反应生成苯醌。
2.3 酚的取代反应由于酚分子中的羟基具有较高的反应活性,酚容易发生取代反应。
常见的取代反应有卤代烃的取代反应和硝化反应。
酚与卤代烃反应时,羟基上的氢原子会被卤素原子所取代,生成相应的酚取代产物。
例如,苯酚与溴反应生成溴苯。
酚与硝酸或硝酸酯反应时,羟基上的氢原子会被硝基取代,生成相应的硝基酚。
例如,苯酚与硝酸反应生成硝基苯酚。
2.4 酚的烷基化反应酚可以进行烷基化反应,其中最常见的是与卤代烃反应生成烷基酚。
烷基酚具有较高的化学活性,可作为重要的合成中间体。
例如,苯酚与溴甲烷反应生成甲基苯酚。
3. 酚的醚化反应酚可以与醇发生醚化反应,生成酚醚。
酚醚是一类重要的溶剂和有机合成中间体,具有广泛的应用领域。
例如,苯酚可与甲醇反应生成甲基苯醚。
4. 酚的聚合反应酚分子中的羟基可以与羟基进行缩合反应,形成大分子量的聚合物。
聚酚是一类重要的高分子材料,常用于制备塑料、树脂等。
总结:酚是一类含有羟基的有机化合物,具有多种性质和反应。

酚的知识点归纳总结1. 酚的物理性质酚的物理性质包括外观、熔点、沸点、溶解度和密度等。
大多数酚为无色或微黄色的液体,在一定温度下会凝固为白色或浅黄色的结晶。
酚的熔点和沸点随着取代基的不同而有所变化,一般而言,取代基越多,熔点和沸点越高。
酚在水中的溶解度与分子大小及极性有关,一般而言,较小的酚分子更易溶解于水中。
此外,酚的密度较大,一般高于水,这使得酚可以在水上形成一层浮在表面的液体。
2. 酚的化学性质酚的化学性质主要包括羟基的反应性、取代基的影响、酚的酸碱性质以及氧化性等。
酚中的羟基是一个具有活性的亲核取代反应的官能团,可以与许多化合物发生取代反应。
取代基的数量和位置会影响酚的反应性,一般而言,取代基越多,反应性越低。
酚的酸碱性主要体现在其对碱的中和反应中,酚可以失去质子形成苯酚负离子。
此外,酚还具有一定的氧化性,可以被氧化剂氧化为酚醛、酚酮等。
3. 酚的合成方法酚的合成方法主要包括酚的氢化、醇的脱水、酚醛的催化加氢以及炔醇的土夫酮合成等。
其中,酚的氢化是较为常见的方法,通过催化剂的作用,醛和酮可以被还原成相应的醇,再经过氧化反应可生成酚。
此外,醇的脱水可以通过在酸性条件下加热使醇分子中的羟基脱去楼哈酸分子而得到酚。
酚醛的催化加氢则是利用钯、铂等金属催化剂催化醛分子中的羰基还原成羟基,生成酚。
而炔醇的土夫酮合成则是通过炔烃与甲醛在碱性条件下发生土夫酮反应生成酚。
4. 酚的应用领域酚作为一类重要的有机化合物,在医药、化工、日化等领域有着广泛的应用。
在医药领域,酚及其衍生物广泛应用于抗菌、抗炎、抗氧化等方面,并作为抗肿瘤药物的前体。
在化工领域,酚作为重要的有机合成原料,用于制备染料、香料、润滑剂等化工产品。
在日化领域,酚则广泛用于化妆品、香水、洗涤剂等产品中,具有抗氧化、消炎、抗菌的作用。
总之,酚作为一类重要的有机化合物,具有重要的理论和应用价值。
通过对酚的物理性质、化学性质、合成方法以及应用领域的综合了解,可以更好地认识和应用酚这一类化合物。
酚都是烃的含氧衍生物引言酚是一类含有羟基(-OH)的有机化合物。
它们通常被视为芳香烃的衍生物,由于其中的一个碳原子被一个羟基取代。
酚具有许多重要的应用,如医药、化妆品、染料和橡胶工业等。
本文将重点介绍酚的种类和它们的化学性质。
酚的种类根据官能团的位置和个数,酚可以分为单酚和多酚两种类型。
单酚单酚是指只含有一个羟基的酚化合物。
最常见的单酚是苯酚(C6H5OH),也被称为羟基苯。
苯酚是一种无色或微黄色的液体,具有特殊的酚香味。
它是一种溶于水的有机溶剂,也是一种中等强酸。
苯酚在医药领域广泛用于制备药物,如解热镇痛药物。
多酚多酚是指含有多个羟基的酚化合物。
最常见的多酚是邻苯二酚(C6H4(OH)2),它是苯环上邻位两个氢原子被羟基取代的化合物。
邻苯二酚是一种固体化合物,常见的结晶形态有无色针状晶体和白色结晶粉末。
邻苯二酚具有很强的氧化性,可以用作染料、消毒剂和橡胶防老剂等。
酚的化学性质1.酚具有亲电性,可以与脂肪酰卤(如氯化酰)发生酰化反应,生成酯。
2.酚具有取代反应性,可以通过烷基化反应和芳基化反应引入不同的基团,改变酚分子的性质。
3.酚具有氧化性,可以与氧气反应生成醛、酮和羧酸等。
4.酚具有酸碱性,可以与碱反应生成相应的盐。
酚的应用1.医药领域:许多药物中含有酚类成分,如解热镇痛药物对乙酰氨基酚。
2.化妆品领域:酚类物质可以用于制作洗发水、护肤品和香水等。
3.染料工业:邻苯二酚可以用作染料和颜料的原料。
4.橡胶工业:邻苯二酚可以用作橡胶抗老化剂。
5.农药领域:一些农药中含有酚类化合物,用于杀灭害虫和病菌。
总结酚是一类重要的有机化合物,在许多领域具有广泛的应用。
单酚和多酚是酚的两种基本类型,它们在化学性质上有所不同。
酚的化学性质使其成为许多化工和制药过程中的重要中间体。
我们对酚的研究和深入了解有助于更好地开发和利用这种有机化合物的潜力,并推动相关领域的发展。
参考文献:1.Smith, J. M. (2010). Phenols, alcohols, and ethers. In OrganicSynthesis: State of the Art 2011-2013 (pp. 33-35). Springer, Berlin, Heidelberg.2.Silverstein, R. M., Webster, F. X., & Kiemle, D. J. (2014).Spectrometric identification of organic compounds. John Wiley & Sons.。
酚的性质及应用教学建议酚是一种含有羟基(-OH)的有机化合物,也是一种官能团。
它具有一系列独特的性质和广泛的应用。
酚的性质:1. 物理性质:酚是无色或微黄色的固体,具有特殊的芳香气味。
它的沸点和熔点相对较高,表明酚具有较强的分子间作用力,如氢键。
2. 化学性质:a. 酚具有酸性:它能参与酸碱反应,与碱反应形成盐,并与金属反应生成金属酚盐。
b. 酚具有氧化性:酚能够被氧化剂氧气、过氧化氢等氧化,将酚氧化成醛、酮等化合物。
c. 酚具有亲电性:酚通过芳香性接受电子的效应,使得它具有亲电取代反应,如卤代烃的炔化反应等。
酚的应用:1. 制药工业:酚及其衍生物具有良好的抗菌和消毒能力,被广泛应用于制药工业中的抗生素、激素等药物的合成和防腐。
2. 化学工业:酚可以作为溶剂、中间体和催化剂,用于合成树脂、染料、塑料和橡胶等化学工业中的产品。
3. 化妆品工业:酚具有抗菌、防腐和抗氧化等功能,广泛应用于化妆品工业中的护肤品、香水和口红等产品。
4. 农业工业:酚是很多农药的重要成分之一,用于制造杀菌剂、杀虫剂和除草剂等农药。
5. 食品工业:酚可以用作食品防腐剂和抗氧化剂,延长食品的保质期和改善食品的质量。
6. 医疗领域:酚可以作为麻醉剂和消毒剂使用,具有很好的杀菌作用,广泛应用于手术消毒和医疗器械消毒等方面。
7. 能源领域:酚可以作为生物燃料的原料,通过气化或液化的方式转化为可燃烧的气体或液体燃料。
针对以上内容,针对高中化学教学,可以采取以下教学建议:1. 通过实验演示酚的性质:可以进行酚的溶解性实验,以及酚与碱的中和反应实验等,引导学生认识酚的性质和化学反应。
2. 给出具体的酚的应用案例:通过实际案例,介绍酚在不同行业的应用,使学生了解酚的广泛应用领域,培养学生的实际运用能力。
3. 制定探究性实验:鼓励学生自主设计和进行实验,探究酚的特性和应用,从实验中培养学生的实验操作能力和科学探究精神。
4. 引导学生进行讨论和交流:组织学生进行小组讨论或展示,分享各自的研究成果和观点,促进学生之间的合作学习和思维碰撞。
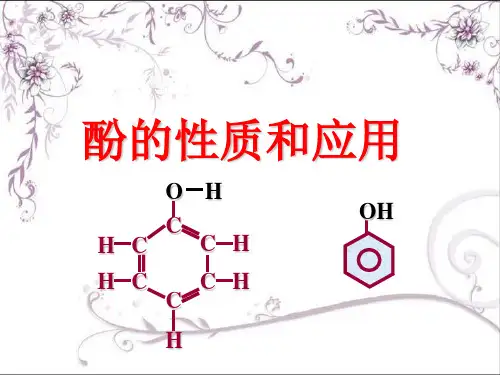
酚的性质和应用苯酚教学目的 1、掌握苯酚的结构式、性质用途等;2、掌握乙醇与苯酚的性质的对比,了解不同的烃基对同一官能团有不同的影响。
教学重难点 苯酚的结构及化学性质教具准备 【实验1、2、3、4、5】试剂、仪器教学过程一、酚――苯酚1、定义: 的化合物,叫酚。
(注意与醇的区别)【对比】 的化合物,叫芳香醇。
【提问】举例说明哪些物质属于芳香醇 。
2、最简单的酚: (结构简式: );所有原子 一个平面上。
二、物理性质【实验探究1、2、3、4】1、苯酚是 色的晶体,露置在空气(O 2)中,会因小部分发生氧化反应而呈 色。
※保存方法: 。
2、苯酚具有 的气味,熔点 ℃;3、常温下,在水中溶解度 ,高于 ℃时,则能与水 ;苯酚 溶于乙醇等有机溶剂;三、苯酚的结构特点:酚中的羟基和苯环相互影响1、羟基受苯环的影响而使羟基中的氢容易电离出H +,而表现出 性;2、羟基对苯环影响,使苯环上的邻、对位上的氢被激活,而容易发生 反应。
四、化学性质1、酸性(俗名: ):电离方程式: 。
浓溶液沾到皮肤上时,应立即用 洗涤。
不可以用NaOH 溶液洗涤,为什么? 。
(1)苯酚(H 2O )中滴加NaOH 溶液化学方程式 现象: ;(2)再通入足量的CO 2化学方程式 现象: ;【思考】如何使苯酚钠的澄清溶液变混浊? ; 【练习】(1与Na 反应 。
(2与Na 2CO 3溶液反应 。
通常的酸性顺序:HCl (H 2SO 4)>RCOOH 2、取代反应:【实验探究5】苯酚与浓溴水反应:实验现象 : 反应方程式: ;【注意】(1)这样的取代反应没有催化剂就反应了,也不必用液溴,用浓溴水即可反应,不象在前面的苯与液溴的反应,要在催化剂和液溴的条件下,才能进行,说明 ;(2)在反应中使用的是浓溴水,用稀的现象不明显,因为 ;【讨论】苯中有少量的苯酚,能否用溴水鉴别? ,为什么? ;【预测】苯酚与硝酸的反应: 。
3、显色反应:【实验探究6】苯酚与FeCl 3溶液反应反应方程式: ;现象: 。
【注意】(1)该反应发生后,酸性是 (填增强或减弱);(2)该反应可用于鉴别含有酚羟基的物质;(所显颜色不一定相同!)【提问】如何检验苯酚的存在?【实验探究7】p74【实验2】【实验探究8】p74【实验3】4、氧化反应:在空气中逐渐被氧化而显粉红色。
5、加成反应:与H 2加成(方程式) 。
五、用途苯酚是一种重要的化工原料,主要用于制造 (电木)等,还广泛用于合成纤维、医药、合成香料、染料、农药等。
苯酚 毒,有 性,若不慎沾到皮肤上,应立即用 洗涤。
苯酚的稀溶液可直接用作 剂和 剂,具有消毒、杀菌的功效,药皂中常含有少量的苯酚;六、制法:(1)工业上,从煤焦油中提炼;(2)氯苯碱性水解: 。
【课堂练习】(1)FeS 、C 、MnO 2、CuO (2)苯乙烯、苯、溴苯、乙醇(3)NaOH 、苯酚、AgNO 3、Na 2CO 3、KSCN2、丁香油酚的结构简式是,该物质不应有的化学性质是( ) ①可以燃烧;②可以跟溴加成;③可以使酸性KMnO 4溶液褪色;④可以跟NaHCO 3溶液反应;⑤可以跟NaOH 溶液反应;⑥可以在碱性条件下水解A 、①③B 、③⑥、④⑤ D 、④⑥ 3、白藜芦醇HO CH =CH -广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性。
能够跟1mol 该化合物起反应的Br 2或H 2的最大用量分别是( )A 、1mol ,1molB 、3.5mol ,7molC 、3.5mol ,6molD 、6mol ,7mol 5、如何将苯的同系物和的混合物分离出来。
2-CH =CH 2 3【课外练习】1、关于苯酚的说法中,错误的是A 、纯净苯酚是粉红色晶体B 、有特殊气味C 、易溶于乙醇、乙醚等有机溶剂,不易溶于水D 、苯酚有毒,沾到皮肤上,可用浓氢氧化钠溶液洗涤2、苯中混有少量苯酚,除去苯酚的操作正确的是A 、蒸馏B 、加水分液C 、加溴水过滤D 、加NaOH 溶液,分液3、可用于区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂为A 、浓溴水B 、石蕊试液C 、FeCl 3溶液D 、FeCl 2溶液4、下列物质中,既能使溴水褪色又能产生沉淀的是A 、乙烯B 、乙醇C 、苯酚D 、氢硫酸5、下列物质久置于空气中,颜色发生变化的是A 、Na 2SO 3B 、苯酚C 、Na 2O 2D 、CaO6、以苯为主要原料制取下列物质,不能一步反应达到的是A 、苯酚、溴苯 C 、硝基苯 D 、苯磺酸 7、漆酚是我国特产土漆的主要成分,生漆涂在物体表面,在空气中干燥时会产生黑色漆膜,则漆酚不应具有的化学性质是A 、可以与烧碱溶液反应B 、可以与溴水发生取代反应和加成反应C 、可使酸性高锰酸钾溶液褪色D 、可与NaHCO 3溶液反应8、乙醇、甘油和苯酚的共同点是A 、分子结构中都含有羟基B 、都能和NaOH 发生反应C 、与FeCl 3溶液反应呈紫色D 、都属于醇类化合物9、不能与溴水发生反应的物质是:①苯;②苯酚;③亚硫酸(H 2SO 3);④NaOH 溶液;⑤AgNO 3溶液;⑥裂化汽油;⑦己烷;⑧镁粉A 、①B 、①⑦C 、①⑦⑧D 、①②⑤⑦10、下列叙述正确的是A 、苯和苯酚都能和溴水发生取代反应B 、可用溴水作试剂除去苯中混有的少量苯酚C 、苯酚有毒,但药皂中却掺有少量D 、苯酚分子内有苯环和羟基的化合物一定是酚类11、下列叙述正确的是( )A 、苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去。
B 、将苯酚的晶体加入少量水中,加热时会部溶解,冷却到室温时形成悬浊液。
C 、苯酚的酸性很弱,不能使指示剂变色,但可以和NaHCO 3反应生成CO 2。
D 、苯酚也可与HNO 3进行硝化反应。
12、一定量的乙醇在氧气不足的情况下燃烧,得到CO 、CO 2和水的总质量为27.6 g ,若其中水的质量为10.8 g ,则CO 的质量是A 、1.4 gB 、2.2 gC 、4.4 gD 、在2.2g 和4.4g 之间13、如不慎将苯酚沾到皮肤上,正确的处理方法是( )A 、用水冲洗B 、用酒精洗C 、用NaOH 溶液洗D 、用纯碱溶液洗14、分子式为C 9H 12的芳香烃的一卤代烃衍生物的数目和分子式为C 7H 8O ,且遇FeCl 3溶液呈紫色的芳香族化合物数目分别为 ( )A 、7种和1种B 、8种和2种C 、42种和3种D 、56种和3种15、在苯和苯酚组成的混合物中,碳元素质量分数为90%,则混合物中氧元素质量分数是( )A 、2.5%B 、5%C 、6.5%D 、7.5%16、在下列各溶液中持续通入二氧化碳,最终不会有浑浊现象或固体析出的是( ) 15H 27A 、偏铝酸钠溶液B 、水玻璃C 、苯酚钠溶液D 、氯化钙溶液17、下列有关除杂所用试剂的叙述中,正确的是( )A 、除去乙烯中的乙炔,用酸性KMnO 4溶液B 、除去苯中的少量苯酚,用溴水C 、除去苯中的少量苯酚,用FeCl 3溶液D 、除去苯中的少量甲苯,先用酸性KMnO 4溶液,后用NaOH 处理18、欲从苯酚的乙醇溶液中回收苯酚,有下列操作:①蒸馏,②过滤,③分液,④加入足量金属钠,⑤通入过量的CO 2,⑥加入足量的NaOH 溶液,⑦加入足量的FeCl 3溶液,⑧加入醋酸与浓H 2SO 4的混合液,⑨加入适量盐酸。
合理的步骤是 ( )A 、④⑤⑩B 、⑥①⑤③C 、⑨②⑧①D 、⑦①③⑩19、某有机物的结构为:CH 2=CH —OCH 3 ,它不可能具有的性质是 ( ) ①易溶于水;②可以燃烧;③能使酸性KMnO 4溶液褪色;④能与KOH 溶液反应;⑤能与NaHCO 3溶液反应;⑥能与Na 反应;⑦能发生聚合反应A 、①⑤B 、①④C 、①④⑦D 、②③④⑥⑦20、现有①苯;②甲苯;③氯苯;④苯酚;⑤乙烯;⑥乙醇。
其中:(1)能和金属Na 反应放出H 2的有 ,(2)能和NaOH 反应的有 ,(3)常温下能和溴水反应的有 ,(4)可从煤焦油中提取的有 ,(5)少量掺在药皂中的有 ,(6)用于制取TNT 的是 ,(7)能使酸性的KMnO 4溶液褪色的是 。
21、将苯酚放入盛有冷水的试管中振荡后的现象是 ,若将试管在酒精灯上加热,其现象是 ,再将试管冷至室温,其现象是 。
若再向其中加入NaOH 溶液,其现象是 ,反应的离子方程式是 ;向加NaOH 溶液后的试管中再通入CO 2,其现象是 ,反应的离子方程式是 。
22、分离苯和苯酚,一般取混合物,向其中加入稍过量的浓NaOH 溶液,反应的离子方程式为 ;然后将混合物转移入分液漏斗中,振荡、静置后,溶液将出现 现象;然后分液,从分液漏斗上口倒出的是 ;再向获得的水溶液中通入 气体,反应的离子方程式是 ,此时溶液中出现的现象是 ;取下层液体加入到适量水中,若向此溶液中加入FeCl 3溶液,出现的现象是 ;若加入浓溴水,发生反应的方程式是 。
23、某种芳香烃衍生物的分子式为C 7H 8O ,根据实验现象确定其结构简式:(1)若此有机物不能跟金属钠反应,则其结构简式为 ;(2)若此有机物遇三氯化铁溶液显紫色,则其可能的结构简式为 ;(3)若此有机物遇三氯化铁溶液不显色,但能跟金属钠反应放出氢气,则其结构简式为 。
24、某环状有机物A 的化学式为C 6H 12O ,其官能团的性质与链烃的衍生物的官能团性质相似。
已知A 具有下列性质: (1)能跟卤化氢HX 作用;(2)A 不能使溴水褪色;(3)A B (化学式为C 6H 10O ); (4)A C ; (5 OH A 。
其中Ni 做催化剂。
根据上述性质推断有关物质的结构简式:A ,B ,C 。
25、某有机化合物A 含碳76.6%、氢6.4%、氧17%,它的相对分子质量约为甲烷的5.9倍,求该有机物的分子式。
在常温下,该有机物可与溴水反应生成白色沉淀,1mol 该有机物恰好与3molBr 2作用,据此确定该有机物的结构简式。
CuO 2△浓硫酸 △ Ni H 2△。