大学,分析化学, 酸碱溶液[H]浓度的计算
- 格式:ppt
- 大小:1.44 MB
- 文档页数:13

分析化学(第五版上册)(武汉大学主编)化学2012级第七周周一第三节图书馆L305第五章第三节 溶液中H +浓度的计算1. 一元强酸溶液中氢离子浓度的计算以HCl 为例:盐酸溶液的离解平衡: HCl → H + + Cl -H 2O ⇌ H + + OH -PBE 为: [H +] = [OH -] + C HCl(1)当 HCl 的浓度不很稀时,即C >> [OH -] (分析化学中计算溶液酸度时允许相对误差为 ± 5%,当C >>40 [OH -] 时)可忽略[OH -] ,一般只要HCl 溶液酸度C >>10-6 mol/L ,则可近似求解:[H +] ≈ C或 pH = -log [H +] =-log c (22)(2)当C 较小时(< 10-6 mol/L ), [OH -] 不可忽略][][][+-++=+=H Kw c OH c H (23) 0][][2=--++Kw H c H (24)24][2Kw c c H ++=+ (25) 2. 一元强碱溶液例:NaOH 溶液c ≥ 10-6 mol/L [OH -] ≈ cc < 10-6 mol/L 24][2Kw c c OH ++=- (26) 3. 一元弱酸溶液对于弱酸 HA ,其溶液的PBE 为:][][][][][OH Ka H cKa OH A H ++=+=+--+ (27) 或写成:Kw OH H c Ka H+--=-++])}[]([{][2 (28) 精确公式近似处理: (1)当K a 、c 均不太小时: K a·c ≥10K w ,忽略水的离解:KaH cKa H +≈++][][ (29) ])[(][2++-=H c Ka H24][2cKa Ka Ka H ++-≈+(30)近似式① (2)在K a 和c 均不太小时,且c ≥ K a 时:即K a·c ≥10K w , c /K a ≥ 100,不仅可以忽略水的离解,且弱酸的离解[H +]对其总浓度的影响也可以忽略即c - [H +] ≈ c ,所以: a cK H ≈][ (31)最简公式(3)当酸极弱(K a 很小)或溶液极稀(c )时, c · K a ≈K w(c ·K a<10K w),此式水的离解不能忽略,但由于K a 小,当c /K a ≥100时,c OH H c ≈---+])[]([Kw cKa H +=+][ (32)近似式②4. 一元弱碱溶液PBE 为: ][][][-++=+OH H HB同处理一元弱酸相似的方法,可得到相对应的一组公式,即(1) 当 K b ·c ≥10Kw , c /K b < 100,忽略水的离解:24][2b b b CK K K OH ++-≈- (33) 近似式① (2)在 K b ·c ≥10c w , c / K b ≥ 100时:b cK OH =-][ (34) 最简式(3)当 c K b <10Kw, c / K b ≥100时,Kw cK OH b +=-][ (35) 近似式②。








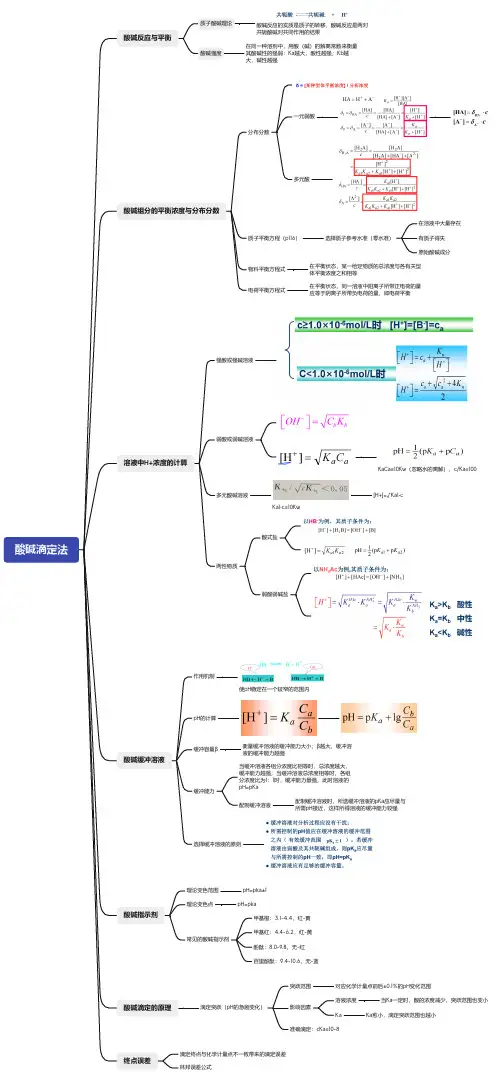
酸碱滴定法酸碱反应与平衡质子酸碱理论酸碱反应的实质是质子的转移,酸碱反应是两对共轭酸碱对共同作用的结果酸碱强度在同一种溶剂中,用酸(碱)的解离常数来衡量其酸碱性的强弱:Ka越大,酸性越强;Kb越大,碱性越强酸碱组分的平衡浓度与分布分数分布分数一元弱酸多元酸质子平衡方程(p116)选择质子参考水准(零水准)在溶液中大量存在有质子得失原始酸碱成分物料平衡方程式在平衡状态,某一给定物质的总浓度与各有关型体平衡浓度之和相等电荷平衡方程式在平衡状态,同一溶液中阳离子所带正电荷的量应等于阴离子所带负电荷的量,即电荷平衡溶液中H+浓度的计算强酸或强碱溶液弱酸或弱碱溶液K aCa≥10Kw(忽略水的离解),c/Ka≥100多元酸碱溶液K a1•c≥10Kw[H+]=√Ka1•c两性物质酸式盐弱酸弱碱盐酸碱缓冲溶液作用机制使pH稳定在一个较窄的范围内p H的计算缓冲容量β衡量缓冲溶液的缓冲能力大小;β越大,缓冲溶液的缓冲能力越强缓冲能力当缓冲溶液各组分浓度比相等时,总浓度越大,缓冲能力越强;当缓冲溶液总浓度相等时,各组分浓度比为1:1时,缓冲能力最强,此时溶液的p H=pKa配制缓冲溶液配制缓冲溶液时,所选缓冲溶液的pKa应尽量与所需pH接近,这样所得溶液的缓冲能力较强选择缓冲溶液的原则酸碱指示剂理论变色范围p H=pka±1理论变色点p H=pka常见的酸碱指示剂甲基橙:3.1-4.4,红-黄甲基红:4.4-6.2,红-黄酚酞:8.0-9.8,无-红百里酚酞:9.4-10.6,无-蓝酸碱滴定的原理滴定突跃(pH的急剧变化)突跃范围对应化学计量点前后±0.1%的pH变化范围影响因素溶液浓度当Ka一定时,酸的浓度减少,突跃范围也变小K a K a愈小,滴定突跃范围也越小准确滴定:cKa≥10-8终点误差滴定终点与化学计量点不一致带来的滴定误差林邦误差公式。

分析化学主要计算公式总结第二章误差和分析数据处理(1)误差绝对误差δ=x-μ相对误差=δ/μ*100%(2)绝对平均偏差:△=(│△1│+│△2│+……+│△n│)/n (△为平均绝对误差;△1、△2、……△n为各次测量的平均绝对误差)。
(3)标准偏差相对标准偏差(RSD)或称变异系数(CV) RSD=S/X*100% (4)平均值的置信区间:*真值落在μ±1σ区间的几率即置信度为68.3%*置信度——可靠程度*一定置信度下的置信区间——μ±1σ对于有限次数测定真值μ与平均值x之间有如下关系:s:为标准偏差n:为测定次数t:为选定的某一置信度下的几率系数(统计因子) (5)单个样本的t检验目的:比较样本均数所代表的未知总体均数μ和已知总体均数μ0。
计算公式:t统计量:自由度:v=n - 1适用条件:(1) 已知一个总体均数;(2) 可得到一个样本均数及该样本标准误;(3) 样本来自正态或近似正态总体。
例1 难产儿出生体重n=35, =3.42, S =0.40,一般婴儿出生体重μ0=3.30(大规模调查获得),问相同否?解:1.建立假设、确定检验水准αH0:μ = μ0(无效假设,null hypothesis)H1:(备择假设,alternative hypothesis,)双侧检验,检验水准:α=0.052.计算检验统计量,v=n-1=35-1=343.查相应界值表,确定P值,下结论查附表1,t0.05 / 2.34= 2.032,t< t0.05 / 2.34,P >0.05,按α=0.05水准,不拒绝H0,两者的差别无统计学意义(6)F检验法是英国统计学家Fisher提出的,主要通过比较两组数据的方差 S^2,以确定他们的精密度是否有显著性差异。
至于两组数据之间是否存在系统误差,则在进行F检验并确定它们的精密度没有显著性差异之后,再进行t 检验。
样本标准偏差的平方,即(“^2”是表示平方):S^2=∑(X-X平均)^2/(n-1)两组数据就能得到两个S^2值,S 大^2和S 小^2 F=S 大^2/S 小^2由表中f 大和f 小(f 为自由度n-1),查得F 表, 然后计算的F 值与查表得到的F 表值比较,如果 F < F 表 表明两组数据没有显著差异; F ≥ F 表 表明两组数据存在显著差异(7)可疑问值的取舍: G 检验法 G=Sxx -第4章 酸碱滴定法(1)共轭酸碱对Ka 与Kb 间的关系:KaKb=Kw(2)酸碱型体平衡浓度([ ]),分析浓度(c )和分布系数(δa )之间的关系(3)一元强酸溶液的pH 的计算 [H +]=24w2K c c ++ 精确式pH=-lg c 近似式 (4)一元弱酸溶液pH 的计算 [H +]=wa ]HA [K K + 精确式(5-11)(关于[H +]的一元三次方程)其中 [HA]=c [H +]/([H +]+K a )·若[A -]>20[OH -](即cK a >20K w ),可以忽略因水解离产生的H +PBE 简化为 [H +]≈[A -]∴ [H +]=a a])H [(]HA [K c K +-= (5-12)·若不但cK a >20K w ,而且c /K a >400(即c >20[A -]或c >20[H +]),也就是弱酸的解离度[A -]/c <0.05,就可以忽略因解离对弱酸浓度的影响,于是[HA]≈c∴ [H +]=acK最简式·若cK a >20K w ,c /K a <400,由式(5-12)可得[H +]=24a2a a cK K K ++- 近似式(1)·若cK a <20K w ,C/K a >400(适用于酸极弱、且浓度极小的情况,此时[HA]≈c ),由式(5-11)可得 [H +]=wa K cK +近似式(2)(5)多元酸溶液pH 的计算最简式 ][H A][H 1a 2cK c =∴≈+(6)两性物质(NaHA )溶液pH 的计算最简式][H 21a a K K =+(7)缓冲溶液pH 值的计算 最简式:[H+]=ca/cb*Ka第五章 络合滴定法 (1)酸效应系数:)(H Y α==][][][][][][][62'Y Y H Y H HY Y Y Y ++++= ==1/Y δ在副反应中分布分数Y δ与)(H Y α互为倒数⑴)(H Y α==621621211456][][][a a a a a a a a a K K K K K K H K K H K H ++++++++==1+4556][][][2a a a a K H K K H K H ++++++6534][aa a K K K H ++6534][a a a K K K H ++6534][a a a K K K H +(2)共存离子效应系数αY (N ))(N Y α==][][][Y NY Y + 因为[NY]==K NY [N][Y] 故:)(N Y α==1+ K NY [N](3)EDTA 与H+及N 同时发生副反应的总的副反应系数αY ,Y α==)(H Y α+1)(-N Y α(4)被测金属离子M 的副反应系数αM :][][][][][][][2')(M ML ML ML M M M n L M ++++==== α= 1+nn L L L ][][][221βββ+++若有P 个络合物与金属发生副反应,则:)(N Y α=)(1N Y α+)(2NY α+…+)(n N Y α-(n-1)化学计量点pM ’的计算 pM ’=1/2[p cM(sp)+lgK’MY](7)金属离子指示剂颜色转变点(变色点)pM t 值的计算 pM t =lgK MIn -lg αIn(H) (8)滴定终点误差%1001010',''⨯-==∆-∆MYSP M pM pM t KC E(9)直接准确滴定金属离子的可行性判据:6lg ',≥MYsp M KC第六章 氧化还原滴定法(1)氧化还原电对的电极电位——Nernst 方程式)Red ()Ox (lg0.059)Ox /Red ()Ox /Red (θa a n E E +=(2)以浓度替代活度,且考虑到副反应的影响,则电对在25C 时的条件电位lg059.0/OR RO n E Eαγαγθθ+=(3)氧化还原反应的条件平衡常数K ’(25C 时)059.0)n'E ' (E K' Lg 21︒-︒=(4)氧化还原滴定化学计量点时的电位值φsp212211sp n n 'E n 'E n E +︒+︒=(5)氧化还原滴定突跃范围计算式 φ2‘+0.59*3/n 2(V)—φ1‘+0.59*3/n 1(V) (6)氧化还原指示剂变色的电位范围 φ‘±0.059/n(V)第7章沉淀滴定法和重量滴定法主要计算公式(1)沉淀溶解积 pKsp=pAg+pX(2)化学计量点 pAg=pX+1/2pKsp(3)质量分数计算ω=(CV*M/1000)/m s*100%(4)1:1型的MA沉淀溶解度的计算S='Ksp=KspaMaA(4)化学因数(或称换算因数)Fm’=mF (m为称量形式的质量,m’为被测成分的质量) (6)被测成分的质量分数ωω=mF/me*100%第八章电位分析法及永停分析法主要计算公式(1)电池电动势: E电池=φ(+)-φ(-)(2)直接电位法测定溶液pHpH x=PH s+(E x-E s)/0.059(25C)(3)离子选择电极的电位φφ=K±2.303RT/F*lg ai= K’±2.303RT/F*lg ciK’=K±2.303RT/nF*lg(f i/a i)(5)离子选择电极两次测量法计算待测溶液中离子的浓度 Ex-Es=±2.303RT/nF*(lg cx -lg cs ) (6)标准加入法计算待测溶液的离子浓度XS E S X SS X V V V V C C ⋅⋅+=⇒∆10)(nFRTS 303.2)1()2(=-式,且令式(7)直接电位法测量误差的计算式 △c/c=nF/RT*△E ≈39n △E第9章 光学分析法概论 主要计算公式(1)光的波动性用波长λ,波数σ和频率υ作为表征 λ是在波的传播路线上具有相同振动相位的相邻两点之间的线性距离,常用nm 作为单位。
分析化学计算公式汇总分析化学是一门关于物质组成、结构和性质的研究科学,它广泛应用于实验室的定量和定性分析。
在分析化学中,有许多计算公式用于计算浓度、平衡常数、反应速率等参数,这些公式能够帮助分析化学家更准确地进行实验和数据处理。
下面将汇总一些常用的分析化学计算公式。
1. 莫尔定律(Beer-Lambert定律):A = εcl其中,A为吸光度,ε为摩尔吸光系数,c为溶液浓度,l为光程。
2. 布劳儿方程(Bouguer方程):I = I₀e^-εcl其中,I为透射光强,I₀为入射光强,ε为摩尔吸光系数,c为溶液浓度,l为光程。
3.洛伦兹-洛伦兹方程:n²-1=2Nα/3其中,n为折射率,N为物质的分子数,α为极化度。
4.亨利定律:p=Kc其中,p为气体的分压,K为亨利定数,c为气体在溶液中的浓度。
5.反应速率计算公式:反应速率=k[A]^m[B]^n其中,k为速率常数,[A]和[B]分别为反应物A和B的浓度,m和n为反应物的反应级数。
6.离子强度计算公式:I = 1/2∑ciZi²其中,I为离子强度,ci为各离子的浓度,Zi为各离子的电荷数。
7.pH计算公式:pH = -log[H⁺]其中,H⁺为溶液中的氢离子浓度。
8. 电动势计算公式(涉及Nernst方程):E = E° - (RT/nF)lnQ其中,E为电动势,E°为标准电动势,R为气体常数,T为温度,n为电子转移数,F为法拉第常数,Q为反应物的活度积。
9.酸碱滴定计算公式:V₁C₁=V₂C₂其中,V₁、C₁为滴定液的体积和浓度,V₂、C₂为被滴定物的体积和浓度。
10.质谱计算公式:m/z=(m+n)/z其中,m为母质离子的质量数,n为质谱仪中的分子离子的相对质量,z为带电离子的电荷数。
以上是一些常用的分析化学计算公式,应用于浓度、反应速率、离子强度等参数的计算。
分析化学计算公式的准确应用可以提高实验和数据处理的精确度,为科学研究和质量控制等领域提供了重要的工具。
酸碱溶液的浓度与稀释计算及酸碱中和反应的化学方程式酸碱溶液的浓度和稀释计算酸碱溶液的浓度是指溶液中酸性或碱性溶质的质量或摩尔浓度。
浓度的计算是化学实验和工业生产中经常遇到的重要问题。
一、酸碱溶液质量浓度的计算酸碱溶液质量浓度(C)是指溶液中单位体积(通常是1L)溶液所含溶质的质量。
计算公式如下:C = m/V其中,C表示浓度,单位是g/L;m表示溶质的质量,单位是g;V 表示溶液的体积,单位是L。
例如,某酸溶液中含有60g酸质量,溶解于1L溶液中,则该溶液的质量浓度为60g/L。
二、酸碱溶液摩尔浓度的计算酸碱溶液摩尔浓度(C)是指溶液中溶质的物质的摩尔数量与溶液体积的比值。
计算公式如下:C = n/V其中,C表示摩尔浓度,单位是mol/L;n表示溶质的物质的摩尔数量,单位是mol;V表示溶液的体积,单位是L。
例如,某碱溶液中含有0.1mol的碱质量,溶解于1L溶液中,则该溶液的摩尔浓度为0.1mol/L。
三、酸碱溶液的稀释计算稀释是指将浓度较高的溶液加入适量溶剂,使得溶液浓度降低。
酸碱溶液的稀释计算可使用以下公式:C1V1 = C2V2其中,C1为初始溶液的浓度,V1为初始溶液的体积;C2为稀释后溶液的浓度,V2为稀释后溶液的体积。
例如,有100mL浓度为1mol/L的酸溶液,要将其稀释为浓度为0.5mol/L的溶液,计算稀释所需的溶液体积为:(1mol/L) × (100mL) = (0.5mol/L) × V2解得 V2 = 200mL,即需要200mL的溶剂将初始溶液稀释为0.5mol/L的浓度。
酸碱中和反应的化学方程式酸碱中和反应是指酸性溶液与碱性溶液按摩尔比例发生完全反应并生成盐和水的化学反应。
这种反应符合酸碱中和的化学方程式。
一、强酸与强碱的酸碱中和反应强酸与强碱之间的酸碱中和反应可以用下列化学方程式来表示:酸 + 碱→ 盐 + 水例如,盐酸和氢氧化钠之间的酸碱中和反应的化学方程式为:HCl + NaOH → NaCl + H2O二、弱酸与弱碱的酸碱中和反应弱酸与弱碱之间的酸碱中和反应也是按摩尔比例发生的,但生成的盐是弱电解质。
两性物质溶液H +离子浓度计算通式在酸碱溶液体系中,弱酸和弱碱的混合溶液、弱酸弱碱盐溶液、多元酸酸式盐溶液以及氨基酸溶液等都有一个共同特点,即在这些溶液中,既有可放出H +离子的组分,又有可得到H +离子的组分,因此可将这些溶液统称为两性物质溶液。
这类溶液中H +离子浓度的计算,在目前常用的《分析化学》教材中,都没有给出统一的计算公式。
本文在分别讨论各种两性溶液的H +离子浓度计算公式的基础上,导出计算的通式。
一. 一. 各种两性溶液H +离子浓度的计算公式 1.弱酸(HA )和弱碱(B )的混合溶液设混合溶液中弱酸HA 的浓度为c a mol ·L -1, 弱碱B 的浓度为c b mol ·L -1。
HA 的共轭碱为A -,B 的共轭酸为BH +。
当酸式离解常数HAaK 远小于+BHa K 时,溶液中的主要成份为HA 和B ,于是可列出质子条件:[H +] = [OH -] + [A -] - [BH +]求得 ]B [)]HA [(]H [BH aHA a BH a W++=+++K K K K(1)2.弱酸弱碱盐溶液设弱酸HA 和弱碱B 形成的盐为BH +A -,其溶液浓度为c mol ·L -1。
溶液中的主要成份为BH + 和A -,由质子条件:[H +] = [OH -] + [B] - [HA]求得 ]A [)]BH [(]H [HA aBH a HA a W-++++=+K K K K(2)3.多元酸的酸式盐溶液设二元酸H 2B 的酸式盐为HB -,其溶液浓度为c mol ·L -1。
HB -的酸式离解常数为2a K ,其共轭酸即H 2B 的酸式离解常数为1a K ,由质子条件:[H +] = [OH -] + [B 2-] - [H 2A]求得 ]HB [)]HB [(]H [-a -a a 1W 21++=+K K K K(3)4.氨基酸溶液设氨基酸NH 2RCOOH 溶液的浓度为c mol ·L -1,酸式离解常数为2a K ,其共轭酸即NH 3+RCOOH 的酸式离解常数为1a K ,其质子条件为:[H +] = [OH -] + [NH 2RCOO -] - [NH 3+RCOOH]可求得 ]RCOOH NH [)]RCOOH NH [(]H [2a 2a a 1W 21++=+K K K K(4)二.两性溶液H +离子浓度的计算通式设任一两性溶液中,能放出H +离子的组分为弱酸HA ,而可得到H +离子的组分为弱碱B ;HA 的浓度为c a mol ·L -1,酸式离解常数为a K ;B 的浓度为c b mol ·L -1,其共轭酸BH +的酸式离解常数为aK '。