传染性疾病标本采集方法
- 格式:doc
- 大小:39.50 KB
- 文档页数:10
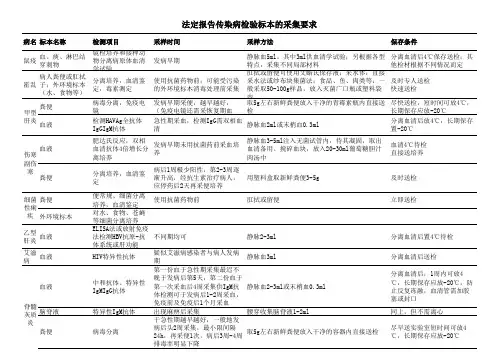


样品采集一、标本采集对象1、预警病例:2、医学观察病例、疑似病例、临床诊断病例及需要进一步研究地确诊病例。
3、其他需要进行诊断或排除者。
4、需要采集地环境标本。
二、标本采集要求1、从事标本采集地技术人员必须经过生物安全培训和具备相应地实验技能。
在标本采集过程中,采集人员必须采取相应生物安全防护。
2、住院病例地标本由所在医院医护人员在当地疾控机构专业人员地指导下采集.(人感染高致病禽流感标本采集技术方案)3、标本采集具体种类和数量由现场工作组确定。
4、密切接触者标本由当地疾控机构负责采集。
5、结果不好判断时,结合病程再次采样。
三、标本采集种类1、上呼吸道标本:包括咽拭子、鼻拭子、鼻咽抽取物、咽漱液、深咳痰液、最佳采集时间为发病后3天内。
2、下呼吸道标本;包括呼吸道抽取物、支气管灌洗液、肺组织活检标本.3、尸检标本:病人死后应依法尽早进行解剖,在严格按照生物安全防护地条件下进行尸检,主要采集肺、气管组织标本、条件允许下也可采集肝、肾、脾、脑、淋巴结等组织标本。
4、血清标本:每一病例必须采集血清标本.须采集急性期、恢复期双份血清.第一份血清应尽早(最好在发病后7天内)采集,第二份血清应在发病后第3—4周采集。
采集量要求5ml,以空腹血为佳,建议使用真空采血管。
5、其他标本:如果病例由腹泻症状,可采集粪便标本:有胸水者可采集胸水标本。
淤血点等。
四、标本采集方法1、咽拭子:用棉签擦拭双侧咽扁桃体及咽后壁,将拭子头浸入含4~5ml采样液地管中,尾部弃去,旋紧管盖。
注:亦可将鼻、咽拭子收集于同一采样管中,以便提高分离率,减少工作量.2、鼻拭子:将棉签轻轻插入鼻道内鼻腭处,停留片刻后缓慢转动退出。
以同一拭子拭两侧鼻孔。
将棉签浸入4~5ml 采样液中,尾部弃去,旋紧管盖.3、鼻咽抽取物或呼吸道抽取物:用与负压泵相连的收集器从鼻咽部抽取粘液或从气管抽取呼吸道分泌物.先将收集器头部插入鼻腔或气管,接通负压,旋转收集器头部并缓慢退出.收集抽取的粘液,并用3ml采样液涮洗收集器1次4、咽漱液:用10ml不含抗菌素的采样液漱口,漱口时让患者头部微后仰,发“噢声",让洗液在咽部转动。


炭疽患者标本采集原则一、炭疽概述炭疽是由炭疽杆菌引起的一种急性传染病,主要通过接触或吸入受污染的炭疽杆菌引起的孢子而感染。
炭疽病菌广泛存在于土壤、草地等自然环境中,因此与土壤接触的职业人员、农民等群体易患炭疽病。
二、标本采集原则1. 标本采集时间对于疑似炭疽患者,应尽早采集标本以进行实验室检测。
最佳采集时间是在疾病早期出现症状的第一天内,因为此时病原体在体内的数量较多,便于检测。
2. 标本类型炭疽的标本采集主要包括皮肤疱疹、溃疡、脓液、血液、呼吸道分泌物等。
对于皮肤上的疱疹或溃疡,可以用消毒棉签轻轻刮取患处分泌物。
对于脓液,应使用无菌容器收集。
对于血液和呼吸道分泌物,应采用相应的采集管进行采集。
3. 标本采集方法皮肤疱疹或溃疡的采集方法是用消毒棉签轻轻刮取患处分泌物,并放入无菌容器中。
在采集血液时,应选择无菌的采血针和抗凝剂,按照惯常的采血程序进行采集。
对于呼吸道分泌物的采集,一般采用痰液或咽拭子的方式,将采集的标本放入无菌容器中。
4. 标本保存与运输采集完标本后,应立即送往实验室进行检测。
在运输过程中,应避免高温和低温环境,以免影响病原体的活性。
标本应放置在密封的容器中,并在外部标记上标明病人的相关信息和采集时间。
5. 个人防护措施在采集炭疽标本时,医务人员应佩戴防护口罩、手套、隔离衣等个人防护装备,以降低感染的风险。
采集完标本后,应立即将防护装备进行正确的处理和消毒。
6. 实验室检测炭疽标本的实验室检测主要包括细菌培养、PCR检测、血清学检测等。
采集的标本应送往合格的实验室进行检测,以确保结果的准确性和可靠性。
三、注意事项1. 在采集标本时,应注意避免污染其他物品或人员,避免交叉感染的发生。
2. 采集标本的过程中,应注意个人防护,避免直接接触患者的体液或分泌物。
3. 采集标本的容器应是无菌的,并在外部进行正确标记,以避免混淆。
4. 采集标本后,应及时送往实验室进行检测,以便及时作出诊断和治疗方案。

传染性疾病标本采集方法标本采集、运送与报告操作规程一、血培养指征患者出现寒战,体温超过38℃或低体温,怀疑血流感染时,尤其存在以下情况时,应抽血做细菌和真菌培养:医院内肺炎;留置中心静脉导管超过72 h;感染性心内膜炎;骨髓炎;有严重基础疾病、免疫缺陷伴全身感染症状;临床医生怀疑有血流感染可能的其他情况。
二、采血时机一旦怀疑有血流感染可能,应立即采血做血培养,最好在抗菌治疗前或停用抗菌药物24 h 后,以寒战、发热时采集为宜。
三、采血流程(一)消毒1.培养瓶消毒程序:用消毒液消毒培养瓶橡皮塞,待干燥后使用。
2.皮肤消毒程序:用消毒液从穿刺点向外画圈消毒,至消毒区域直径达5 cm 以上,待消毒液挥发干燥后(常需30 s 以上)穿刺采血。
(二)静脉穿刺和培养瓶接种成人用注射器无菌穿刺取血后,排尽针头内空气,直接注入血培养瓶,勿换针头(如果行第二次穿刺或用头皮针取血时,应换针头),先注于厌氧培养瓶,避免注入空气,然后注入需氧培养瓶,轻轻混匀以防血液凝固。
近年来,临床普遍采用负压血培养瓶,将血从患者静脉直接吸入血培养瓶,减少污染环节。
(三)注意事项1.检验单需注明抗菌药物使用情况、血液采集时间和部位、临床诊断等患者信息。
2.采血部位通常为肘静脉,疑为细菌性心内膜炎时以肘动脉或股动脉采血为宜,切忌在静滴抗菌药物的静脉处采血。
除非怀疑有导管相关的血流感染,否则不应从留置静脉或动脉导管取血,因为导管易被皮肤正常菌群污染。
3.采血次数:对于成年患者,应该同时分别在两个部位采集血标本,在两个不同部位分离到同样菌种才能确定是病原菌。
4.细菌性心内膜炎:在24 h 内取血3 次,每次间隔不少于30 min;必要时次日再做血培养2 次。
5.采血量:以培养基与血液之比10:1 为宜,以稀释血液中的抗菌药物、抗体等杀菌物质。
采血量过少会明显降低阳性率。
成人每次每培养瓶采血8~10 ml,婴幼儿每次每培养瓶采血2 ml。
四、运送要求1.所有标本采集后都应立即送往实验室,最好在2h 内。


7强传染性样本的采集、运输、处理与保存制度7.1目的为有效预防医务人员在工作中发生职业暴露感染,防止实验室污染、交叉污染和周围环境污染,特制定本指导原则。
7.2定义强传染性样本是指含有一类、二类高致病菌的微生物标本,如:含SARS病毒、霍乱弧菌、艾滋病毒、炭疽芽孢杆菌、结核杆菌等具有强致病性病原微生物的样本。
7.3适用范围本管理细则适用于检验科各专业组。
7.4具体制度7.4.1标本采集7.4.1.1为避免交叉污染,检验人员原则上不直接进入病区采集标本,如必须进入时,应穿隔离衣和防护服,戴口罩(12-18层或N95口罩)、双层帽、护目镜、面罩、戴三层手套、靴子。
7.4.1.2详细登记有关病例的姓名、性别、年龄、家庭住址、联系电话等基本信息以及标本采集日期。
7.4.1.3采集的标本放入带盖的容器内,盖紧盖子装入标本运送箱,加注特别标识,密封专人送检。
采集标本时不能污染容器外部。
7.4.2标本运输将密封包装好的,放在专门运输用双层标本箱里,加盖,由两人运送。
运送过程严防破碎和外溢。
送入检验科由双人签收。
7.4.3标本前处理标本接种、血清分离等在生物安全柜内进行。
使用专用的离心机,离心时使用密闭的离心机转头或密闭样品杯,离心停止10-30分钟后取出。
7.4.4标本检测标本应在专用区由专人进行检测,以便标本、仪器、环境集中消毒和处理。
尽量避免标本分散到多个实验室。
7.4.5标本检测后处理废弃标本放入带盖套有黄色塑料口袋的专用污物桶内,集中高压灭菌后送到特殊垃圾处进行无害化处理。
所有检测标本后废液都用2500mg/L有效氯消毒液浸泡4小时以上,或直接高压灭菌,再排入医院污水站消毒处理。
7.4.6标本的保存7.4.6.1疑似强致病菌标本保存,应专室专柜,两人管理,每天查看并记录。
明确有高致病菌标本,P2实验室不得保存。
7.4.6.2疑似HIV阳性标本送到东阳市疾控中心确认,先通知保健科,标本应三层包装,专人送到东阳市疾控中心,标本双人交接并签字。

传染病病原标本采集和检测质量控制要求概述说明1. 引言1.1 概述引言部分将讨论传染病病原标本采集和检测质量控制的要求。
在传染病预防和控制中,准确有效的病原标本采集是确诊和监测疾病的关键步骤。
同时,为保证病原标本检测结果的可靠性,质量控制也至关重要。
因此,本文将概述传染病病原标本采集和检测质量控制的要求,并介绍相应的操作规范、设备选择与验证、样本处理与存储条件控制以及流行病学信息收集与报告要求。
1.2 文章结构文章主要分为五个部分:引言、传染病病原标本采集要求、传染病病原标本检测质量控制要求、排查流行病学信息收集与报告要求以及结论及展望。
1.3 目的通过详细介绍传染病病原标本采集和检测质量控制方面的要求,旨在提高相关工作者对于该领域内操作规范的认识,并促进在实际工作中的应用。
同时,本文还将对相关工作中存在的问题进行分析总结,并提出未来研究和改进的建议与展望。
通过这些内容的介绍和讨论,我们可以更好地确保传染病病原标本采集和检测质量控制工作的可靠性和准确性,有助于提高传染病防控水平,保障公众健康安全。
2. 传染病病原标本采集要求2.1 标本种类与采集方法传染病病原标本的种类和采集方法在确保准确诊断的同时,也需要采取必要的防护措施以避免交叉感染。
常见的传染病病原标本包括血液、呼吸道分泌物、尿液、粪便、组织样本等。
不同的传染病可能需要不同类型的标本进行检测和诊断,必须根据具体情况选择合适的标本。
在进行标本采集时,应严格遵守消毒规范,佩戴个人防护装备,并使用合适的采集工具。
根据不同标本类型,有以下一些常用的采集方法:- 血液:通过穿刺静脉或指尖采血。
获取血液样本前,需要先清洁皮肤,并在穿刺点周围进行消毒。
- 呼吸道分泌物:如咽拭子或口腔漱口液等。
在收集口腔样本时,可使用棉签或喉镜取样。
注意避免患者飞沫的扩散。
- 尿液:通常需要要求患者收集早晨排尿时的第一次尿液,使用无菌容器进行收集,并确保容器密闭。
- 粪便:使用无菌容器收集新鲜粪便样本,以避免细菌和寄生虫数量的改变。

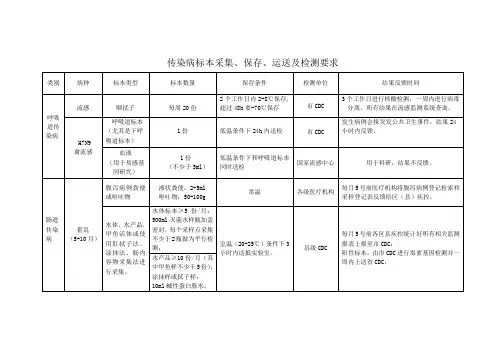
传染病样本采集运送接收储存流程1.样本采集样本的采集是诊断传染病的第一步,需要按照传染病的特点和采集标准进行。
常见的传染病样本包括血液、尿液、咽拭子、咳嗽样本等。
采集时需要穿戴一次性手套和口罩,并使用无菌棉签或吸管采集样本。
采集过程需要进行适当记录,包括患者信息、采集时间等。
2.样本运送采集完成后,样本需要尽快送到实验室进行检测。
在运送过程中,需要注意以下几点:-选择适当的容器:根据样本的性质选择适当的容器,如血液样本通常用抗凝剂管,尿液样本通常用无菌容器。
-包装和标记:样本需要进行适当的包装,并在容器上标明患者的信息,包括姓名、年龄、性别、住院号等。
-运送温度:根据不同样本的要求,选择合适的温度进行运送,如有些样本需要冷藏,有些则需要常温。
3.样本接收实验室收到样本后,需要进行以下处理:-首先检查包装:检查包装是否完好无损,并核对标记上的信息是否与样本一致。
-登记样本:将样本信息登记在实验室的系统中,包括患者信息、送样时间、送样人员等。
-处理样本:根据所需检测项目,对样本进行适当的处理,如离心分离血浆、提取核酸等。
4.样本储存在检测完成后,未使用的样本需要储存起来,以备后续可能的检测或检测验证使用。
样本储存需要满足以下要求:-选择适当的储存方式:根据样本的性质和要求,选择适当的储存方式,如低温冷冻、冻干、阴凉干燥等。
-标记完整:在样本容器上标明详细的信息,包括患者信息、储存日期、储存条件等。
-安全存放:确保样本的安全存放,避免交叉污染和损坏。
总结起来,传染病样本采集、运送、接收、储存流程是一个前后衔接的过程。
在每个环节都需要严格遵守相应的操作规范,以确保样本的质量和安全,从而保证检测结果的准确性和可靠性。
霍乱标本采集方法公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
霍乱标本采集方法
标本采集
霍乱是烈性肠道传染病,检验标本主要以病人的大便为主,必要时呕吐物和被呕吐物污染的衣裤亦可作为标本。
一般采取新鲜粪便,或用棉拭子插入直肠内4~5cm采取。
病人标本最好床边接种,预计能在3h内进行培养者,可将肛拭子置于灭菌的含碱性蛋白胨水的试管中,或将10~15ml大便放在带盖的广口瓶中,送往实验室。
不能在3h内进行接种或需送至较远实验室的,应将标本转至卡-布半固体运送培养基中送检,避免使用甘油盐水缓冲运送培养基。
送检标本应密封并派专人送达。
咽拭子标本
采集病人发病 3 日内的咽拭子标本,用于病原检测。
用专用采样棉签,适度用力拭抹咽后壁和两侧扁桃体部位,应避免触及舌部;迅速将棉签放入装有 3-5ml 保存液(含 5%牛血清维持液或生理盐水,推荐使用维持液)15ml 外螺旋盖采样管中,的在靠近顶端处折断棉签杆,旋紧管盖并密封,以防干燥,外表贴上带有唯一识别号码的标签。
4 暂存并在 12 小时内送达实验室,-20 以下低温冷冻保藏,需长期保存的标本存于-70 冰箱。
感染性标本的采样、储存、运输的具体操作方法所有的采样工作都必须根据疾病的特点,在严格做好防护的基础上进行。
常见传染病需采集的标本见表1(一)呼吸道标本的采集(如不明原因肺炎)1.采样器材拭子、压舌板、塑料瓶、采样杯或器皿、15ml 的离心管、移液管、注射器、10ml真空取血管、冰壶、采样运输管、有生物安全标志或标有“感染性物质”的外包装容器(见图1);其他:酒精灯、剪刀、纸漏斗、酒精、碘酒、吸耳球、塑料袋、记号笔、标签、登记表等。
2.采集方法(1)鼻拭子(上呼吸道):将棉签轻轻插入鼻道内鼻腭处,停留片刻后缓慢转动退出。
以同一拭子拭两侧鼻孔。
将棉签浸入4-5 ml采样液的管中,尾部弃去。
然后,塞紧或盖好管盖。
(2)咽拭子(上呼吸道):用棉签用力擦拭双侧咽扁桃体及咽后壁(见图2),同样将棉签头浸入4-5 ml采样液的管中,尾部弃去,塞紧或盖好管盖。
注:亦可将鼻、咽拭子收集于同一采样管中,以便提高分离率,减少工作量。
(3)鼻洗液(上呼吸道):患者取坐姿,头稍后仰,用移液管将5ml生理盐水注入一侧鼻孔,嘱患者同时发K音以关闭鼻腔。
然后让患者低头使生理盐水流出,用平皿或烧杯收集洗液。
重复此过程洗两侧鼻孔。
(4)鼻咽抽取物或抽取气管和支气管分泌物(下呼吸道):用与负压泵相连的收集器从鼻咽部抽取粘液或从气管抽取气管和支气管分泌物。
先将收集器头部插入鼻腔或气管,接通负压,旋转收集器头部并缓慢退出。
收集抽取的粘液,并用采样液涮洗收集器3次。
近来国内有用小孩导尿管接在50 ml注射器上来替代收集器。
(5)漱口液:用10 ml采样液漱口。
漱时让患者头部微后仰,发噢声,让洗液在咽部转动。
然后,用平皿或烧杯收集漱液。
注:取漱口液时,需预先了解患者是否对抗菌素有过敏史,如有,含漱液中不应含抗菌素。
(6)肺活检材料:肺活检组织在无菌条件下,用灭菌过的乳钵磨碎,用生理盐水配成20%悬液,2000rpm离心10min,取上清加入上述提到的抗菌素。
医院感染管理中的标本采集与实验室检测医院感染是指患者在医疗机构接受治疗过程中,由于各种原因导致的新发或继发感染。
在医疗过程中,正确的标本采集与实验室检测是医院感染管理的重要环节之一。
本文将从标本采集的要素、常见标本采集方法以及实验室检测的意义等方面进行探讨。
一、标本采集的要素正确的标本采集是确保实验室检测结果准确可靠的关键。
以下是标本采集的要素:1. 标本种类:根据患者的具体病情,选择适当的标本种类进行采集。
例如,对于呼吸道感染,应选择痰液或咽拭子作为标本;对于尿路感染,应选择尿液作为标本。
不同的感染部位需要选择相应的标本种类进行采集。
2. 采集时机:标本采集的时机也是影响结果准确性的重要因素。
一般来说,标本应在感染病情明确后尽早采集,以避免可能的结果误差。
3. 标本采集方法:标本采集方法应根据标本种类和具体要求来选择。
常见的标本采集方法包括创伤面拭子采集、穿刺抽取、非创伤性采集等。
采集时应注意避免污染和误操作。
4. 标本保存条件:采集后的标本应妥善保存,避免交叉感染和标本变质。
不同标本有不同的保存条件,例如,血液标本需采用抗凝管储存,尿液标本需避光保存等。
标本的保存条件应在采集前明确,以确保实验室检测的准确性。
二、常见标本采集方法1. 血液标本采集:血液标本采集是常见的临床标本采集方式之一。
一般情况下,通过穿刺静脉或者指尖采集血液。
在采集过程中,应注意无菌操作,避免交叉感染的发生。
2. 呼吸道标本采集:呼吸道标本采集是用于呼吸道感染的诊断和病原体检测的重要手段。
常见的呼吸道标本采集方法包括痰液采集和咽拭子采集。
在采集过程中,应注意避免口腔和其他细菌的污染。
3. 尿液标本采集:尿液标本采集是尿路感染的诊断和治疗的重要环节。
尿液采集应该注意避免尿液的污染,选择适当的采集器具,并在采集后及时送交实验室。
4. 创面标本采集:对于创面感染的诊断和治疗,创面标本采集是必不可少的。
在创面清创后,选择适当的采集方法,如创面拭子采集、穿刺抽取等,以获取可靠的感染信息。
突发传染病标本采集、运送、接收、储存流程本文档旨在提供突发传染病标本采集、运送、接收、储存的流程指南,确保操作过程简单、高效,最大限度地减少法律风险。
1. 采集标本- 提前做好准备工作,包括确保采集器械的完整性和清洁性,以及准备好相应的采集和标签。
- 确认被采集者的身份信息,并记录。
- 采集标本时,请佩戴适当的防护设备,包括口罩、手套和防护服。
- 标本采集完成后,妥善包装并进行及时标识,包括标注采集时间、地点和采集者的身份信息。
2. 运送标本- 标本运送前,确保密封完好,防止泄漏。
- 标本运送过程中,严格遵守相关运输规定和安全要求。
- 根据传染病的特点,考虑采取必要的防护措施,如运输过程中避免标本受到明显的温度变化或物理振动等。
- 运送过程中,确保跟踪标本的位置和状态,并保持与接收方的沟通。
3. 接收标本- 接收人员应具备相关突发传染病标本接收和处理的知识和能力。
- 根据标本的特性和紧急程度,及时进行接收和处理。
- 接收标本时,检查标本的封装是否完好,并确认标签上的信息与运送单据一致。
- 接收标本后,及时将其储存于指定的地点或设备中,并做好相应的记录。
4. 储存标本- 标本储存前,准确记录标本的信息,包括标本类型、来源、采集时间等。
- 标本储存条件应符合相关规定,如温度、湿度等。
- 定期检查储存条件,并确保标本的完整性和无菌状态。
- 标本储存期限到期前,根据相关规定及时进行处理或处置。
在以上流程中,请始终遵守相关法律法规的要求和标准操作规程,确保操作的独立性和有效性。
以上仅为简要说明,具体操作请参考相应的突发传染病标本采集、运送、接收、储存流程指南。
常见传染病样品采集
1. 引言
本文档旨在提供关于常见传染病样品采集的详细指导,以确保正确、安全地收集和处理这些样品。
通过遵循适当的操作规程,可以减少潜在风险,并为相关实验室工作人员提供必要的信息。
2. 样品类型及其特点
2.1 血液:血液是一种重要且广泛用于诊断各类感染性疾病的生物标本。
- 全血:从静脉或毛细管中获取整个血量。
- 血浆/血清:将抗凝剂添加到已经取得并离心分离后留下来部分进行进一步检查。
2.2 咽拭子:
在喉咙表面刮取上皮组织和黏膜屑片,在对呼吸道感染进行初步筛查时非常有用。
3. 样本采集方法与注意事项
3.1 行前准备:
确认所需材料是否齐全(如手套、试管等),确认目标
区域干净无污秽。
3.. 收集过程:
- 血液采集:选择合适的静脉,使用无菌技术进行穿刺,并确保血样收集量足够。
- 咽拭子采集:用棉签或专用喉拭子轻柔地擦取咽部黏
膜表面。
3.3 样本处理:
确保将样品及时送往实验室以避免失效。
对于血液标本,离心分离后保存补体和红细胞沉淀物。
4. 容器与运输
使用符合规定的容器来存放不同类型的样品,并在外包装上明
确注明其内容、数量等信息。
根据相关法规要求,在运输过程中需要
注意温度控制和防止交叉污染。
5. 法律名词及注释
5.1 感染性疾病传播预防法(Infectious Disease Prevention and Control Act): 这是一项旨在管理感染性疾病传播并提供相应预防方法指导的立法文件。
6.附件
相关文档、流程图等。
HIV病毒核酸检测标本采集、送检、处理流程1. 标本采集- 确认采集时间:标本采集应在疾病的潜伏期或早期症状出现后进行,以提高检测的准确性。
- 采集标本类型:采用静脉或指尖血、唾液或尿液等标本进行HIV病毒核酸检测。
- 标本采集前准备:- 清洁采集工具:采用无菌的棉球、采血针或尿液收集等工具。
- 患者准备:提醒患者保持身体清洁,避免饮食或饮水过量。
- 预防传染:采用正确的防护手段,如穿戴手套,以减少交叉感染。
- 标本采集操作:- 采集血液:选择适当的位置消毒,使用无菌针头采集血液,将其放入采血管中。
- 采集唾液:让患者含住采集器,轻轻刺激舌尖,控制唾液量。
- 采集尿液:使用无菌收集患者尿液样本。
2. 标本送检- 确认标本完整性:收取标本后,检查标本是否完整无漏,确保标本完整性。
- 标本标签:在标本上填写患者的个人信息和采集时间,以及标本样本的类型。
- 标本储存和包装:将标本放入适当的中,如冰盒或冰袋,并确保标本不会受到振动或温度变化。
- 送检时间安排:尽快将标本送往检测实验室进行分析,避免样本的降解和过长的送检时间。
3. 标本处理- 标本登记:在实验室接收标本后,进行标本登记,包括记录标本的相关信息和送检时间。
- 标本处理前准备:确保实验室的操作台面干净,消毒和无菌。
- 标本处理步骤:- 血液标本处理:首先,离心血液标本,并将血浆、细胞沉淀或血清分离,并保存在适当的中。
- 唾液标本处理:将唾液标本放入离心管中,离心并分离唾液上清液。
- 尿液标本处理:首先,将尿液加入离心管中,离心并保存离心液。
- 标本处理后:将标本保存在冰箱中,以保持稳定,并在一定时间内进行分析。
以上是HIV病毒核酸检测标本采集、送检、处理流程的简要介绍,整个流程需要专业的医护人员按照操作规范进行。
这一流程的严谨性和准确性对于确诊和治疗HIV/AIDS疾病具有重要意义。
---------------------------------------------------------------最新资料推荐------------------------------------------------------传染性疾病标本采集方法标本采集、运送与报告操作规程一、血培养指征患者出现寒战,体温超过38℃或低体温,怀疑血流感染时,尤其存在以下情况时,应抽血做细菌和真菌培养:医院内肺炎;留置中心静脉导管超过 72 h;感染性心内膜炎;骨髓炎;有严重基础疾病、免疫缺陷伴全身感染症状;临床医生怀疑有血流感染可能的其他情况。
二、采血时机一旦怀疑有血流感染可能,应立即采血做血培养,最好在抗菌治疗前或停用抗菌药物 24 h 后,以寒战、发热时采集为宜。
三、采血流程(一)消毒 1.培养瓶消毒程序:用消毒液消毒培养瓶橡皮塞,待干燥后使用。
2.皮肤消毒程序:用消毒液从穿刺点向外画圈消毒,至消毒区域直径达 5 cm 以上,待消毒液挥发干燥后(常需 30 s 以上)穿刺采血。
(二)静脉穿刺和培养瓶接种成人用注射器无菌穿刺取血后,排尽针头内空气,直接注入血培养瓶,勿换针头(如果行第二次穿刺或用头皮针取血时,应换针头),先注于厌氧培养瓶,避免注入空气,然后注入需氧培养瓶,轻轻混匀以防血液凝固。
近年来,临床普遍采用负压血培养瓶,将血从患者静脉直接吸入血培养瓶,减少污染环节。
1/ 10(三)注意事项 1.检验单需注明抗菌药物使用情况、血液采集时间和部位、临床诊断等患者信息。
2.采血部位通常为肘静脉,疑为细菌性心内膜炎时以肘动脉或股动脉采血为宜,切忌在静滴抗菌药物的静脉处采血。
除非怀疑有导管相关的血流感染,否则不应从留置静脉或动脉导管取血,因为导管易被皮肤正常菌群污染。
3.采血次数:对于成年患者,应该同时分别在两个部位采集血标本,在两个不同部位分离到同样菌种才能确定是病原菌。
4.细菌性心内膜炎:在 24 h 内取血 3 次,每次间隔不少于 30 min;必要时次日再做血培养 2 次。
5.采血量:以培养基与血液之比 10:1 为宜,以稀释血液中的抗菌药物、抗体等杀菌物质。
采血量过少会明显降低阳性率。
成人每次每培养瓶采血 8~ 10 ml,婴幼儿每次每培养瓶采血2 ml。
四、运送要求 1.所有标本采集后都应立即送往实验室,最好在 2h 内。
如果不能及时送检,宜置于室温环境。
血培养瓶送到检验科放入培养箱前,不应暂存于冰箱内。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 2.送检标本应正确粘贴条形码,注明采样时间和送检时间。
3.安全防护:放标本的容器必须防漏,禁止将渗漏的标本送往实验室。
五、报告要求(一)紧急口头(电话)报告血培养出现阳性报警时,立即进行革兰氏染色、镜检,并在最短时间内将结果向临床主管医生进行紧急口头(电话)报告。
口头报告包含以下内容,并记录在案。
(1) 报告者全名(或工号); (2) 报告的时间; XXXX 年 XX 月 XX 日 XX 时 XX 分( 24 小时制) (3) 所联系医生的全名(或工号); (4) 报告镜检结果并强调其紧急价值; (5) 确认临床医生收到报告并复述结果。
(二)最终结果(书面)报告 (1) 无菌生长(培养 5 天无需氧菌和厌氧菌生长); (2) 阳性培养结果(最终鉴定结果、最终药敏结果)。
(三)其他报告和记录 1.标本被拒收时,需即刻通知临床立即重新采血,并记录在案。
2.最终结果与紧急口头报告结果不符,需要变更时,需立即通知临床,同时必须在书面报告上提供正确的结果,注明变更的内容。
3.其他需临床注意的事项的记录,如:采血量不足、标本转运时间过长、标本采集份数不够等信息。
3/ 10痰标本采集与运送标准操作规程一、采集目的一般可用于普通细菌、分枝杆菌、真菌和军团菌的涂片或培养检测,经气管穿刺吸引物可用于厌氧菌的检测。
二、一般原则 1.采集标本的最佳时机应在使用抗菌药物之前。
2.宜采集清晨第二口痰液。
3.对于普通细菌性肺炎,痰标本送检每天 1 次,连续 2~3 天。
不建议 24 h 内多次采样送检,除非痰液外观性状出现改变。
4.怀疑分枝杆菌感染者,应连续收集 3 天清晨痰液送检。
三、采集方法(一)自然咳痰法与雾化导痰法 1.用物准备:无菌容器(盒)、生理盐水(250 ml 或 500 ml) 、化验单。
2.核对患者床号、姓名等。
3.无痰或痰量极少者可用 3%~ 5%氯化钠溶液 5 ml 雾化吸入约 5 min后留取痰液。
4.如有可能,应在医护人员直视下留取清晨第二口痰。
嘱咐患者留取前摘去牙托,清洁口腔,如刷牙后反复用生理盐水漱口;深吸气后用力自气管深部咳出痰液,置无菌容器内。
应尽可能防止唾液及鼻咽部分泌物混入样品,不应用纸巾包裹痰液。
(二)支气管镜法鼻或口腔插入支气管镜。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 常用采集方法有经支气管镜吸引、支气管肺泡灌洗、防污染毛刷采样或防污染支气管肺泡灌洗等。
(三)经人工气道吸引法 1.用物准备:负压吸引器、生理盐水、一次性吸痰管、无菌手套,无菌容器(试管)、化验单。
2.核对患者床号、姓名等。
3.将患者头部转向操作者一侧。
4.进行手卫生后将一次性吸痰管末端拆开,连接吸引器,调节吸引器至适宜负压(成人:40. 0~ 53. 3 kPa; 小儿:< 40. 0 kPa) 。
5.将一次性吸痰管外包装去除,戴手套持吸痰管试吸生理盐水,检查管道是否通畅。
6.折叠一次性吸痰管末端,插入口腔或鼻腔或人工气道至适宜深度,放开吸痰管末端,轻柔、灵活、迅速地左右旋转上提吸痰管吸痰。
见吸痰管内有痰液吸出,即折叠一次性吸痰管退出,将一次性吸痰管与吸引器分离(使用人工呼吸机者,一次吸痰时间不超过15 s,吸痰前后需吸入高浓度氧气 1~ 2 min) 。
7.将痰液注入无菌容器(试管)内,如痰液黏稠可用一次性针筒向吸痰管末端注入少量生理盐水,将痰液冲人无菌容器(试5/ 10管)内。
四、运送和保存应在 2h 之内送至实验室,否则应4℃冷藏,但放置时间不可超过 24 h。
尿液标本采集和运送标准操作规程一、采集时机宜为抗菌药物使用之前的清晨第一次尿液。
二、采集方法(一)清洁中段尿 1.女性:采样前用肥皂水或 0. 1%的高锰酸钾溶液等冲洗外阴,用手指分开阴唇,弃其前段尿,不终止排尿,留取中段尿 10~ 20 ml 于无菌容器内。
2.男性:采样前用肥皂水或 0. 05%~ 0. 1%的聚维酮碘(碘伏)溶液等消毒液清洗尿道口,擦干后上翻包皮,弃其前段尿,不终止排尿,留取中段尿 10~ 20 ml 于无菌容器内。
(二)耻骨上膀胱穿刺主要用于厌氧菌培养或留取标本困难的婴儿、脊柱损伤患者的尿液采集。
先用 0. 25%的聚维酮碘溶液等消毒液消毒穿刺部位皮肤,然后使用无菌注射器直接从耻骨联合与脐连线上高于耻骨联合2 cm处刺入膀胱吸取尿液 10--20 ml 于无菌容器内。
(三)导尿管尿 1.直接导尿法:使用 0. 05%~ 0. 1%的聚维酮碘溶液等消毒剂消毒会阴局部,用导尿管直接经尿道插入膀胱,先弃其前段尿液约 15 ml,再留取中段尿液 10~ 20 ml 于无菌容器内。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 2.留置导尿管法:医院内尿路感染中,临床最常用此法。
采集前先夹住导尿管,采集时则松管弃其前段尿液,使用 0. 25%~ 0. 5%的聚维酮碘溶液等消毒剂消毒导尿管的采样部位,使用无菌注射器斜刺入导尿管(从采样口或靠近尿道的导尿管管壁)抽取 10~ 20 ml 尿液于无菌容器内。
3.回肠造口导尿管法:摘除导管,弃去里面的尿液,先用 0. 05%~0. 1%的聚维酮碘溶液等消毒剂消毒吻合口,再将导尿管插入到清洁的吻合口,直至筋膜的深部采集 1020 ml 尿液于无菌容器内。
(四)小儿收集包对于无自控能力的小儿可应用收集包采集尿液,这种装置由于很难避免会阴部菌群污染产生假阳性,所以只有在检验结果为阴性时才有意义。
如果检验结果为阳性,应结合临床进行分析,必要时可使用耻骨上膀胱穿刺或导尿法留取尿液进行复检。
三、标本运送标本采集后应及时送检并接种,室温下保存时间不应超过 2 h(夏季保存时间应适当缩短或冷藏保存)。
如果不能及时运送或接种,应4℃冷藏,但保存时间也不应超过 8h。
四、注意事项 1.不应从集尿袋中采集尿液。
2.尿液中不应加防腐剂或消毒剂。
7/ 103.若尿液培养前患者曾使用抗菌药物,应反复多次送检。
4.多次采集或 24 h 尿不应用于尿液培养。
5-除非进行流行病学调查,不应对长期留置导尿管患者常规进行尿液培养。
6.培养结果应结合临床表现、菌落计数以及微生物种类等,进行综合判断。
粪便标本采集法【目的】 1、常规粪标本检查粪便的颜色、形状及有无脓血。
2、隐血粪标本检查粪便内肉眼不能看见的微量血液。
3、寄生虫及虫卵粪标本检查寄生虫成虫、幼虫及虫卵并计数,进行浓缩集卵、日本血吸虫毛蚴孵化等。
4、培养粪标本检查粪便中的致病菌。
【操作前准备】 1、患者评估( 1)了解患者的临床诊断及合作能力。
( 2)了解需做的检查项目,以明确收集粪便标本的种类及注意事项。
2、患者准备使患者了解留取粪标本的目的、意义和方法,能够配合,3、用物准备干净便盆,常规检查应备集便盒(内附棉签 2 支),粪便培养应备培养皿,寄生虫检查应备寄生虫检便盆。
【操作步骤】 1、核对医嘱,贴检验单副联于集便盒上。
2、核对患者姓名,做好解释。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 3、告知患者正确的留取方法。
( 1)常规粪标本采集:用棉签取较中央的粪便或脓血黏液部分少许于集便盒内。
( 2)培养粪标本采集:解大便之前用消毒液冲洗肛门,用无菌棉签取粪便中央处置于培养皿中,盖好盖子。