临床微生物标本采集方法
- 格式:ppt
- 大小:8.60 MB
- 文档页数:12

微生物检验标本的正确采集及注意事项正确采集临床微生物标本,直接影响到微生物培养鉴定结果。
可靠的检验结果可以指导临床诊断治疗,为临床科学用药和成功的感染控制提供依据,是正确、合理使用抗菌药物,延缓细菌耐药,减少抗菌药物滥用和监测医院感染的第一步,也是最重要的一步。
为此应正确采集各种细菌学标本。
一、血液标本的采集1、采集方法(1)75%酒精清洁局部皮肤。
(2)待皮肤干后,再用2%—2.5%碘酒从穿刺点中心部位开始消毒,范围不应小于5cm(直径),且不能用手指触摸消毒后的皮肤。
(3)皮肤碘酒干后(约1min),穿刺采集血液,采血量成人5-10ml,婴幼儿1-5ml。
(4)采血后立即在床旁接种培养瓶,并迅速轻摇,充分混匀防止凝固,但又不可剧震以防溶血。
2、注意事项(1)怀疑菌血症应尽早采血,体温上升(38.5℃)采血可提高阳性率,但也要防止因等待而延误时机。
(2)对已经使用抗菌药物,而又不能停药者,也应在下次用药前采血。
切忌不要在静滴抗菌药物的静脉处采取血标本,也不能从静脉导管及动脉插管中取血。
(3)培养基与血液之比以10:1为宜,以稀释血液中的抗生素,抗体等杀菌物质;有人主张对接受抗菌药物治疗的病人,培养基与采血量之比可为20:1或大于这个比例。
(4)近年研究表明,将血液注入血培养基前,更换针头反而易导致污染。
(5)每例至少采血两次,间隔0.5-1h,以利于提高阳性率和区分感染菌与污染菌。
(6)疑为细菌性心内膜炎及布鲁氏病的病人,以肘动脉或股动脉采血为宜,除在发热期采血外,并要多次采血(24h 3-4次)和增加采血量(可增加10ml)。
(7)采血后立即送检,如不能立即送检可置室温,而不能放置冰箱。
(8)如临床表现很似败血症,而血培养多次阴性者,提示考虑厌氧菌和真菌感染的可能。
二、骨髓的采集1、采集方法在病灶部位或髂前(后)上脊处严格消毒后抽取骨髓1ml,注入血培养瓶内。
2、注意事项(1)骨髓内含有大量的单核巨噬细胞系统的细胞,因而骨髓培养对伤寒病人的诊断较血培养优越。

临床微生物样本采集规范临床微生物样本采集规范1. 范围和目的本规范适用于临床微生物样本的采集、处理和管理,旨在保证样本采集的质量和规范性,确保临床微生物诊断结果的准确性和可靠性。
2. 术语和定义(1)微生物:指包括细菌、真菌、病毒、支原体、立克次体、螺旋体等在内的微小生物体。
(2)临床样本:指从患者体内采集的各种生物标本,如血液、口腔、鼻咽部、骨髓、尿液、痰液、脑脊液等。
(3)采集容器:指用于采集临床样本的容器,如血液采集管、尿样瓶、培养皿等。
(4)采集套装:指一次完整的样本采集过程中所需的所有采集工具和材料。
3. 采集前准备(1)确定采集部位、时间和采集方式,注意患者的生命体征和病情变化。
(2)准备好所需的采集套装和采集容器,在样本采集前做好标签,并核对患者信息。
(3)认真阅读所有相关规范和实验室要求,确保样本采集符合要求。
4. 采集操作步骤(1)根据采集部位和样本类型选择合适的采集套装。
(2)采集前应让患者了解采集的目的和过程,并获得其同意。
(3)采集前要检查采集部位,患者的身体状态和生命体征,确保采集过程安全和无痛苦。
(4)采血时应注意采血量、采血速率、采血部位、采血方式等。
(5)尿样采集时应注意尿样的采集量、采集时间、采集方式、保护好样本的完整性和纯度。
(6)痰液采集时应注意痰液的颜色、黏度、量和纯度,选择合适的采集器具和采集方式。
(7)脑脊液采集时应注意采集部位、采集方式、采集量、采血顺序和样本处理标准等。
(8)其他临床样本采集时,应根据具体要求和操作规范,选择合适的采集方法和器具。
5. 样本运输和储存(1)在采集后,立即将样本放入相应的采集容器中,尽快送至实验室进行处理。
(2)若无法立即处理样本,应按要求在采集容器中注明采集时间和采集者信息,并存储在规定温度下,以便后续处理。
(3)运输过程中应遵循规范,确保样本不泄漏、不污染,并尽快送至目的地。
(4)储存过程中应保持样本的纯度和完整性,控制储存温度,在保质期内使用。

临床微生物学检验的标本采集一、血液和骨髓细菌学检验标本的采集(一)适应症菌血症、败血症和感染性骨髓炎等感染菌的培养鉴定和药物敏感试验。
(二)病人准备1.凡怀疑菌血症和败血症的患者,采血培养时,应尽量在未使用抗菌素前采血,如已使用过抗菌素,应尽量选择抗菌素在体内浓度最低时采血,或在病人第二次使用抗菌素之前采集血培养标本。
2.应在病人发热期或寒颤时采集(三)标本采集1.血培养瓶领取:凭医嘱和检验申请单到检验科细菌室领取。
按照实际情况选择相应类型的血培养瓶:如灰色瓶盖为普通成人培养瓶;粉红色盖为儿童需氧菌培养瓶;紫色盖为厌氧菌培养瓶。
2.将患者信息录入相应的血培养瓶条码中,并在作好病人姓名、科别、床号等标识。
2.采集方法:严格消毒病人采血部位和血培养瓶口,抽一定量血液或骨髓后,无菌注入血培养瓶内,轻轻摇匀。
3.标本量:成人每次采血5~10ml,小儿采血3~5ml,骨髓2~3ml,采血量足够则阳性率高,反之阳性率减低。
(四)注意事项1.抽血、抽骨髓和接种时,须严格注意无菌操作,避免污染杂菌。
2.从抽血、抽骨髓到接种入瓶,动作要快,防止血液凝固。
3.成人不明原因发热、怀疑血流细菌感染时宜在不同部位抽血2套,每套2瓶(需氧、厌氧各一瓶)。
4.怀疑伤寒、亚急性细菌性心内膜炎及布鲁氏菌病的病人等,一般一日抽血三次培养,必要时需追加次数。
(五)标本送检和保存1.标本采集后应及时送检,一般不超过1h送交细菌室。
2.送检过程中应注意防止培养瓶打破或其它潜在性污染可能。
二、痰液或下呼吸道分泌物细菌学检验标本的采集(一)适应症肺炎、肺气肿、支气管炎、鼻窦炎、肺结核等感染菌的培养鉴定、药物敏感试验和抗酸菌检查。
(二)病人准备1.尽量在未使用抗菌素前留取标本。
准备好无菌标本容器,贴上条码、标明标识。
2.住院病人应留取清晨起床第一口痰。
为减少正常菌群的污染,嘱患者早上起床后用清水或生理盐水漱口,不要刷牙,除去鼻咽分泌物。
(三)标本采集1.一般病人用力咳出气管深处或肺部痰液,留于无菌标本容器内。

临床微生物标本的采集与运送在医学临床的诊断过程中,微生物检验是不可缺少的一环。
临床微生物标本的采集与运送是保证准确诊断的关键步骤之一。
本文将介绍临床微生物标本的采集与运送的一些注意事项。
1. 标本类型临床微生物标本通常包括血液、尿液、粪便、血培养瓶、脑脊液、切口分泌物等。
2. 采集方法2.1 血液标本采集血液标本时,一定要做好消毒工作。
选择采血部位后,用酒精或碘酒消毒,再用无菌针头采血,避免受污染。
血液标本采集后可以分成两份,一份用于血常规,另一份用于血培养。
2.2 尿液标本收集尿液标本时,要让患者用清洁肥皂清洁外阴部,再用无菌尿杯收集尿液,避免手部直接触摸尿杯和尿液。
尽量将尿液标本送至检验室的时间控制在2小时之内。
2.3 粪便标本采集粪便标本时,要确定所采集的粪便样本来自于患者的肛门临近处。
最好不要使用纸巾,而是用无菌容器收集粪便。
粪便标本采集窗口为3天。
2.4 血培养瓶标本采集血培养瓶标本时,首先要选择采血部位进行消毒,然后将血培养瓶插入采血针器上,打开外部装置,使血液顺利流入血培养瓶中。
采集集中在早晨时段,每次采集2-3个血培养瓶。
2.5 脑脊液标本采集脑脊液标本需要医生进行,患者应严格卧床休息,医生在患者腰部,采用穿刺的方式进行脑脊液的采集。
2.6 切口分泌物标本采集切口分泌物标本时,需要选择无菌医用棉签,消毒采集部位。
在采集过程中,应尽量避免被采集部位感染污染到。
3. 运送方法临床微生物标本的运送是重要的环节。
标本在采集后应及时送至细菌学检验实验室。
并且在运送过程中需要遵循以下几点:3.1 收集后尽早送检临床微生物标本的采集窗口不长,应尽早将标本送至检验室进行分析。
3.2 标本容器和包装标本容器必须选择无菌容器,容器体积大小要相应合适。
送检前,要核对标本标签与标签上的医学记录是否一致。
标本包装时,应采取干燥、保温、防震、防漏、防碎的原则。
3.3 运输温度不同种类的标本,其运输温度介于4-25摄氏度之间。




临床微生物标本规范化采集和送检临床微生物标本规范化采集和送检是确保实验室检测结果准确性和可靠性的关键步骤。
在临床诊断和治疗过程中,微生物标本的采集和送检必须严格按照规范进行,以保证检测结果的科学性和临床应用的有效性。
本文将对临床微生物标本规范化采集和送检的相关问题进行详细讨论。
一、微生物标本的采集1. 采集工具采集微生物标本时,应使用无菌采集工具,如无菌棉签、无菌注射器、无菌拭子等。
采集工具应一次性使用,避免交叉感染。
2. 采集方法(1)棉签采集法:适用于采集分泌物、排泄物等标本。
将无菌棉签蘸取适量标本,轻轻涂抹于无菌培养基表面,注意避免棉签与培养基接触过紧,以免污染。
(2)拭子采集法:适用于采集皮肤、黏膜等表面标本。
将无菌拭子轻轻擦拭采集部位,将拭子置于无菌培养基中,轻轻按压使标本附着于培养基表面。
(3)注射器采集法:适用于采集深部组织、关节液等标本。
将无菌注射器刺入采集部位,抽取适量标本后,将注射器置于无菌培养基中,拔出活塞使标本流出。
3. 采集注意事项(1)严格遵守无菌操作原则,防止标本污染。
(2)采集标本时,应尽量减少对标本的挤压,避免细胞破裂、毒素释放等现象。
(3)采集标本后,应尽快送检,避免长时间存放导致病原体死亡或变异。
二、微生物标本的送检1. 送检时间微生物标本采集后,应尽快送检,一般不超过2小时。
如无法及时送检,应将标本置于4℃冷藏保存,并在24小时内送检。
2. 送检途径微生物标本应采用专用运送容器,避免与其他物品接触。
标本运送过程中,应注意保持容器密封,防止标本污染。
3. 标本接收实验室接收微生物标本时,应详细核对标本信息,包括患者姓名、性别、年龄、采集部位、采集时间等。
如发现标本不符合要求,应立即与临床工作人员沟通,重新采集标本。
4. 标本处理实验室接收标本后,应按照实验室规程进行对标本的处理,包括开盖、分区、接种、培养等。
在处理过程中,严格遵守无菌操作原则,防止标本污染。

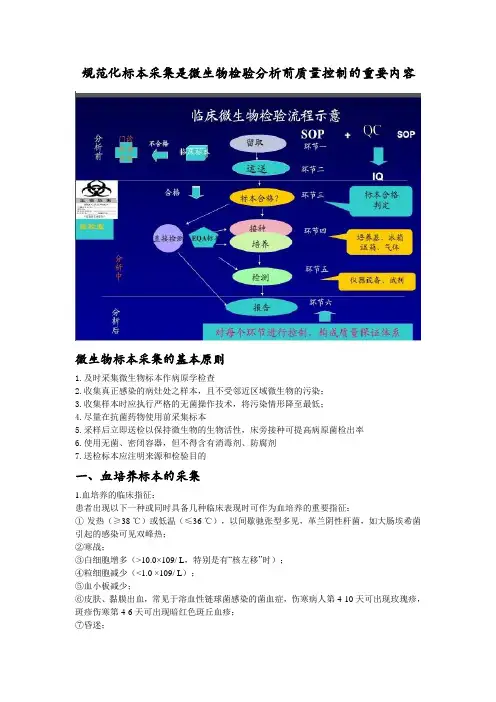
规范化标本采集是微生物检验分析前质量控制的重要内容微生物标本采集的基本原则1.及时采集微生物标本作病原学检查2.收集真正感染的病灶处之样本,且不受邻近区域微生物的污染;3.收集样本时应执行严格的无菌操作技术,将污染情形降至最低;4.尽量在抗菌药物使用前采集标本5.采样后立即送检以保持微生物的生物活性,床旁接种可提高病原菌检出率6.使用无菌、密闭容器,但不得含有消毒剂、防腐剂7.送检标本应注明来源和检验目的一、血培养标本的采集1.血培养的临床指征:患者出现以下一种或同时具备几种临床表现时可作为血培养的重要指征:①发热(≥38 ℃)或低温(≤36 ℃),以间歇驰张型多见,革兰阴性杆菌,如大肠埃希菌引起的感染可见双峰热;②寒战;③白细胞增多(>10.0×109/ L,特别是有“核左移”时);④粒细胞减少(<1.0 ×109/ L);⑤血小板减少;⑥皮肤、黏膜出血,常见于溶血性链球菌感染的菌血症,伤寒病人第4-10天可出现玫瑰疹,斑疹伤寒第4-6天可出现暗红色斑丘血疹;⑦昏迷;⑧多器官衰竭;⑨血压降低;⑩呼吸加快(呼吸率>20/分或CO2分压<32mmHg);以及肝脾肿大;关节疼痛;C反应蛋白、内毒素、降钙素原升高等;2.血培养的采集时间①对怀疑菌血症、真菌血症的患者,在考虑使用抗菌药物之前,应立即采集血培养标本。
②研究表明细菌通常在寒战或发热前1h入血,此时为采血的最佳时机。
③发热后细菌很快会从血液中清除,超过发热峰值后,病原菌的检出率会随之降低。
3.血培养的采集部位①对怀疑菌血症、真菌血症的患者,应同时或短时间间隔(10分钟内)从不同部位(如双臂)采集2~3套血培养标本,做到“双瓶双侧”。
②推荐从外周静脉采集血液标本。
③不推荐动脉血,因其诊断价值没有比静脉血更大。
④不推荐静脉留置导管,因其常伴有高污染率。
如果必须从留置导管内采血,也应同时从外周静脉采集另外一个血培养标本以助于对比和结果解释。

微生物标本采集及保存要求一、总则:用于培养的标本在收集时应注意严格无菌操作和及时送检,检测后标本应妥善保存。
二、临床标本的采集(一)下呼吸道分泌物(痰液)令患者早上起床后用清水濑口,不要刷牙,立即从下部呼吸道咳出第一口痰,吐在无菌塑料痰盒中,及时送检。
(二)、尿液(中段尿)护理人员协助采取中段尿约3ml入无菌试管中,及时送检。
(三)、粪便:取有粘液、脓血部分的粪便置玻璃大便专用管中,如为稀水便,可直接收集于玻璃管中,及时送检。
(四)、眼、耳、鼻、喉拭子:将棉拭子沾取少许无菌生理盐水(如沾取的太多,可在无菌生理盐水瓶壁上挤去多余的水份),然后采取可疑部位的分泌物,倒悬于无菌试管内,及时送检。
(五)、脓液:用沾有生理盐水的棉拭子沾取脓液,要尽量多取一些,然后将棉拭置于无菌试管中,及时送检。
(六)、:1、凡怀疑菌血症和败血病的患者,采血培养时,应尽量在未使用抗菌素前采血,如已使用抗菌素,应尽量选择抗菌素在体内浓度最低时采血,应在病人第二次使用抗菌素之前采集血培养标本。
当然在病人发热或寒颤时采集也可。
2、成人每次采血5—10ml,小儿采血2—3ml;3、严格消毒病人采血部位和血培养瓶口,抽一定量血液后,无菌注入血培养瓶内,轻轻摇匀,4、从抽血到接种入瓶,动作要快,防止血液凝固,同时要及时送检。
(七)、穿刺液:胸腹水、心包液、关节腔液、鞘膜积液:严格无菌抽取后,注入含肝素抗凝的无菌试管中,轻轻颠倒试管10余次,使肝素与穿刺液混匀达到抗凝的目的,或直接无菌注入血培养瓶内及时送检。
(八)、胆汁:由专科医生以无菌方法取引流液10ml注入无菌试管。
(九)、脑脊液:以无菌方法取脑脊液3-5ml,置无菌试管内,常温保存送检,如只做培养可直接无菌注入血培养瓶内,及时送检。
(十)、生殖器官标本:阴道、子宫颈及前列腺等分泌物应由医师采集,收集于无菌试管内送检。
如疑为淋病奈瑟菌感染,做培养检查时,采集的标本应床旁接种并及时放入孵箱培养。
微生物标本采集方法及注意事项一、粪便标本采集和处理(1)采集方法1.自然排便法:取新鲜粪便的黏液、脓血、或絮状物等有意义成分,2~3g 或 1~2 m1,盛无菌容器内或置于保存液或增茵液内送检;若疑似霍乱者应置于碱性蛋白胨水中(PH8.6)。
2. 直肠拭子法:难以获得粪便或排便困难患者及幼儿可采用此法,将拭子前端用无菌甘油或生理盐水湿润,然后插入肛门约 4~5cm(幼儿 2~3cm),轻轻在直肠内旋转。
擦取直肠表面粘液后取出,盛于无菌试管中或保存液中送检。
(2) 注意事项1.尽可能在抗生素使用之前采集标本。
2.所挑取的粪便不应接触其他部位(如便盆),粪便样本中不应混入尿液及其他异物,采集过程应尽量无菌操作。
3.不应用厕纸收集粪便。
4.对同一病人在同一天不宜重复送检。
5.宜在感染急性期(通常是5d-7d内)采集标本。
6.下列腹泻患者应连续3d送检标本--社区获得性腹泻(入院前或72h内出现症状)--医院腹泻(入院72h后出现症状),且至少有下列情况之一:大于65岁并伴有内科疾病、HIV感染、粒缺(中性粒细胞--怀疑肠道感染的`非腹泻性表现。
7.肠炎和发热病人建议做血培养。
8.伤寒沙门菌感染时骨髓培养高出血培养。
9新鲜粪便标本应在采集后尽快送检,不应超过2h。
(3)标本拒收干燥的拭子、含钡粪便、黄软成形便、干便、明显污染的粪便、一日内重复送检的标本,应设法与临床医师联系,可要求重新留取标本,并做好记录,在没有与医师沟通之前标本不应丢弃,仍按实验室标本保存原则存放。
二、尿液标本采集和处理(1)采集方法1. 中段尿采集法:清晨起床后用肥皂水清洗尿道口和外阴部,再用清水冲洗尿道口周围,然后排尿弃去前段尿液,收集中段尿 5~10ml盛于带盖的无菌容器内立即送检,采集后于0.5h内进行接种。
2. 耻骨上膀胱穿刺法:评估膀胱内细菌感染的“金标准”。
培养结果与临床病情矛盾时可采用此法,一般较少应用。
3. 导尿法:采用无菌技术用注射器经导尿管抽取尿液,导取 10~15ml 尿液,置无菌容器中送检,尿液标本不能通过收集袋引流管口流出的方式采集。
微生物标本采集操作规程基本原则1.发现感染应及时采集微生物标本作病原学检查,三级医院微生物标本送检率不应低于60%。
2.尽量在抗菌药物使用之前采集标本。
3.标本采集时应严格无菌操作,减少或避免机体正常菌群及其它杂菌污染。
4.标本采集后应立即送至细菌室。
床旁接种可提高病原菌检出率。
5.以棉拭子采集的标本如咽拭子、肛拭或伤口拭子,宜插入运送培养基送检。
6.送检标本应注明姓名、床号、标本来源、检验目的和标本采集具体时间,使细菌室能准确及时接种相应的培养基和适宜的培养环境,提高阳性检出率。
一、血液与骨髓的送检方法1.一般原则:在出现临床症状后应尽快抽血样作培养,最好在发热初期、高热或寒战时,原则上应选择在抗菌药物应用之前,对已应用药物而病情不允许停药的患者应在下一次用药前采血。
2.采血部位:肘静脉。
疑似细菌性心内膜炎时,以肘动脉或股动脉采血为宜,切忌在静滴抗菌药物的静脉处采取血标本。
3.采血最佳时间与频率:急性败血症应在治疗前24小时内抽血3次或者更多次,并在不同部位,如左右手臂或颈部,分别做厌氧、需氧培养以及内毒素、降钙素原检测;急性心内膜炎在治疗前1-2小时内分别在3个不同部位抽血样;怀疑伤寒病人,在病程第1-2周内采静脉血液;肺炎链球菌在寒战、高热或者休克时;布鲁杆菌感染除在发热期采血,还要多次采血,一般是24小时抽3-4次;分枝杆菌感染早期采血样阳性率高。
怀疑菌血症因尽早采血,体温上升阶段采血可提高阳性率,但要防止因等待而延误时机,对已用抗菌药物而不能停药者,可在下次用药前采血。
对疑为伤寒病人,在第1-3周内采集骨髓是最佳时间,在病灶或髂前(后)上棘处严格消毒后抽取骨髓1ml 作细菌培养。
4.采血部位的局部皮肤应严格消毒。
将采集的血液注入血培养瓶前,认真识别相应颜色的瓶,并仔细检查培养瓶有无变色或混浊。
过火消毒针头,血培养瓶撕掉塑料盖后,瓶口不是无菌部位必须消毒。
消毒不能用碘酒消毒而是75%酒精消毒。
临床微生物标本采集规范•微生物标本采集意义与原则•临床常见微生物标本采集方法•微生物标本采集注意事项与操作规范•微生物标本运输、保存和处理流程目录•临床微生物实验室检测技术应用与进展•总结回顾与拓展思考01微生物标本采集意义与原则准确诊断指导治疗监测病情变化预防和控制感染通过采集微生物标本,可以对病原体进行准确鉴定和分类,为医生提供准确的诊断依据。
通过对微生物标本的连续检测,可以及时了解患者病情的变化情况,为医生调整治疗方案提供依据。
根据微生物标本的检测结果,医生可以选择针对性的治疗药物和方法,提高治疗效果。
通过对微生物标本的检测和分析,可以及时发现和控制感染源,防止感染的扩散和传播。
无菌操作正确选择采集部位采集足量标本及时送检01020304在采集微生物标本时,必须严格遵守无菌操作原则,避免污染标本和引入外源性微生物。
根据不同的病原体和感染类型,选择正确的采集部位,以提高标本的阳性率和准确性。
采集足够量的标本,以保证检测的准确性和可靠性。
采集后的微生物标本应及时送检,避免延误诊断和治疗。
血液标本通过静脉采血或末梢采血获得,用于检测血液中的病原体和抗体等。
尿液标本通过患者自行排尿或导尿获得,用于检测泌尿系统感染等。
粪便标本通过患者自行排便或灌肠获得,用于检测肠道感染和寄生虫病等。
呼吸道标本通过鼻咽拭子、喉拭子、痰液等获得,用于检测呼吸道感染和肺部感染等。
生殖道标本通过阴道分泌物、宫颈分泌物、前列腺液等获得,用于检测生殖道感染和性传播疾病等。
其他标本如脑脊液、穿刺液、组织活检等,用于检测相应部位的感染和病变情况。
微生物标本类型及来源02临床常见微生物标本采集方法血液及骨髓标本采集建议在患者寒战或发热初起时采集,同时在使用抗生素之前采集。
成人一般选择肘静脉,新生儿和婴儿选择颈静脉或股静脉。
成人一般采集8-10ml,儿童采集3-5ml,婴儿采集1-2ml。
严格无菌操作,避免污染,同时防止溶血。
采集时间采集部位采集量注意事项一般建议清晨第一次尿,即晨尿。
临床微生物标本的正确采集与运送图文微生物学在临床上发挥着重要作用,正确的采样和运送过程对于准确诊断和治疗具有决定性影响。
本文将介绍临床微生物标本采集和运送的基本原则。
一、标本采集前的准备工作1.1 了解患者的情况在进行采样之前,了解患者病史、症状、用药情况等可以帮助选择合适的采样部位和方法。
例如,对于胸腔感染,应在患侧插入穿刺针进行胸腔穿刺;对于泌尿系感染,应在初尿流进行尿液采集。
1.2 选择合适的采样部位和方法选择合适的采样部位和方法可以提高标本的阳性率。
下面介绍一些常见的采样部位和方法:血液标本血液标本是诊断血液感染和细菌性心内膜炎的关键。
采血前需要消毒采血部位,并选择合适的采血管和采血顺序。
常见的采血部位有手腕、肘窝、背侧手腕、踝部,而采血顺序为无菌采血管先于常规采血管。
尿液标本尿液标本是诊断泌尿系感染的重要手段。
采样前需要让患者清洁外阴,并选择合适的采样时机。
中段尿和早晨起床第一次排尿的尿液最为理想。
呼吸道标本呼吸道标本可用于诊断呼吸道感染、肺炎等疾病。
采样前需要清洁口腔和鼻腔,并采用合适的方法进行采样。
常见的方法有喉拭子和气管切开。
胃肠标本胃肠标本可用于诊断肠道感染、胃溃疡等疾病。
采样前需要清洁口腔和肛门,并选择合适的采样方法。
常见的方法有粪便标本、肠内容物吸取和胃液抽取。
1.3 配置必要的采样器材采集标本需要用到一些专门的器材,例如无菌采血针、采尿器、拭子、鱼雷管等。
采集前需要进行消毒和验证,并确保器材无损坏和过期。
二、标本采集时的注意事项2.1 彻底消毒采样部位对于需要皮肤穿刺的采样部位,必须进行彻底的消毒,以避免细菌污染。
消毒前应先清洁采样部位,并使用适宜的消毒剂进行消毒。
2.2 采样过程中遵循无菌原则采样过程中必须遵循无菌原则,以防止其他有害细菌或病毒的污染。
进行采样操作前,应先进行手卫生并配备隔离装备。
2.3 避免污染和误差在采集标本的过程中,必须避免污染和误差。
应严格按照标本类型、采样方法和储存条件进行操作,防止错误或污染发生。