高中化学58个考点精讲09物质的量应用于化学方程式的计算
- 格式:doc
- 大小:52.00 KB
- 文档页数:3


物质的量应用于化学方程式计算物质的量在化学方程式计算中非常重要。
它是化学反应中物质转化的量度单位,能够帮助我们确定反应物和生成物的化学计量关系,并进行定量计算。
首先,让我们来了解一下物质的量的概念。
物质的量用化学式“n”来表示,单位是摩尔(mol)。
摩尔表示的是一定物质的粒子数,类似于一打鸡蛋包含12个鸡蛋一样。
化学方程式中的系数用来表明反应物和生成物之间的摩尔比例关系。
利用物质的量,我们可以进行各种计算,例如计算反应物和生成物的摩尔比例、计算反应物和生成物的质量、计算反应的理论产率等。
首先,我们可以利用化学方程式中的摩尔比例关系来计算反应物和生成物之间的摩尔比例。
例如,对于反应方程式2H2+O2→2H2O,我们可以看到1摩尔的O2反应会生成2摩尔的H2O。
这意味着反应中O2和H2O之间的摩尔比例是1:2、通过这个比例,我们可以计算出给定反应量的反应物和生成物之间的摩尔比例。
其次,利用物质的量,我们还可以计算反应物和生成物的质量。
我们可以通过摩尔质量(分子量或相对原子质量)将摩尔转化为质量。
例如,化学方程式2H2+O2→2H2O中,我们可以通过查找元素的相对原子质量表得知,1摩尔的O2的质量是32克,2摩尔的H2O的质量是36克。
这意味着32克的O2可以与36克的H2O完全反应。
利用这个关系,我们可以根据给定物质的量计算其质量。
此外,物质的量还可以用于计算反应的理论产率。
理论产率是指在完全反应下,理论上可获得的最大产物量。
我们可以通过化学方程式中的摩尔系数来计算理论产率。
例如,对于反应方程式2H2+O2→2H2O,理论上1摩尔的O2可以生成2摩尔的H2O。
因此,如果我们有10摩尔的O2,理论上可以生成20摩尔的H2O。
通过这个计算,我们可以预测反应的产物量。
总而言之,物质的量在化学方程式计算中发挥着重要作用。
通过物质的量,我们可以计算反应物和生成物之间的摩尔比例、质量和理论产率。
这些计算可以帮助我们预测反应的结果、确定反应条件以及进行化学方程式的平衡和优化计算。

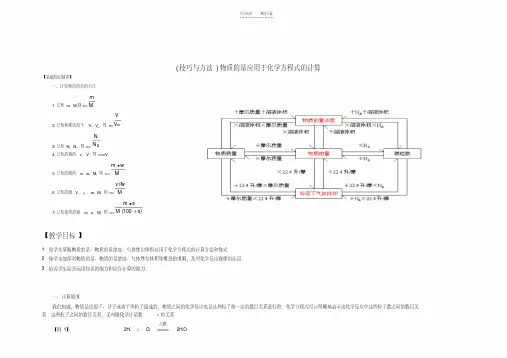
学习必备欢迎下载(技巧与方法)物质的量应用于化学方程式的计算【基础知识精讲】一、计算物质的量的公式1.已知m 、M,则n=Mm2.已知标准状况下V 、V m ,则n=mV V3.已知N ,N A ,则n=AN N4.已知溶液的c 、V ,则n=cV5.已知溶液的m 、w 、M ,则n=M wm 6.已知溶液V 、ρ、w 、M ,则n=M wv 7.已知饱和溶液m 、s 、M ,则n=)100(s M sm 【教学目标】1.使学生掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式.2.使学生加深对物质的量、物质的量浓度、气体摩尔体积等概念的理解,及对化学反应规律的认识.3.培养学生综合运用知识的能力和综合计算的能力.一、计算原理我们知道,物质是由原子、分子或离子等粒子组成的,物质之间的化学反应也是这些粒子按一定的数目关系进行的.化学方程式可以明确地表示出化学反应中这些粒子数之间的数目关系.这些粒子之间的数目关系,又叫做化学计量数ν的关系.【例1】2H 2+O 2点燃2H 2O化学计量数ν之比: 2 ∶ 1∶ 2 分子数N 之比: 2 ∶ 1∶ 2 扩大N A 倍: 2N A ∶N A∶2N A 物质的量n 之比: 2mol ∶ 1mol ∶2mol质量 m 之比: 4 ∶ 32∶ 36由以上分析可知,化学方程式中各物质的化学计量数之比,等于组成各物质的粒子数之比,因而也等于各物质的物质的量之比.二、解题步骤:化学方程式中有关物质的量的计算,须按以下步骤进行:1.设未知数 2.写出有关反应方程式3.找出相关物质的计量数之比4.对应计量数,找出相关物质的物质的量或质量或气体体积5.列比例,进行计算。
6.写出答案。
【例2】:完全中和0.10 mol NaOH 需H 2SO 4的物质的量是多少?解:设硫酸的物质的量为n (H 2SO 4)2NaOH +H 2SO 4====Na 2SO 4+2H 2O 2 10.1moln (H 2SO4) n (H 2SO4)==0.05 mol答:完全中和0.10 mol NaOH 需H 2SO40.05 mol .我们运用有关化学方程式的计算解决问题时,还经常涉及到物质的质量、浓度、体积等物理量的必要换算.而换算的核心就是——物质的量.三、物质的量与其他物理量之间的关系【练习1】回答下列化学方程式的含义:H 2 + Cl2==== 2HCl化学计量数比粒子数之比物质的量比物质的质量比气体体积比根据化学方程式进行计算时,要明确已知条件是什么,求解什么,从而合理选择比例量的单位.列比例式时应注意,不同物质使用的单位可以不同,但要相应,同一物质使用的单位必须相同.四、物质的量在化学方程式计算中的应用2mol10.01)SO H ()NaOH (42v v )SO H ()NaOH (42n n =【练习2】计算例2中所需H 2SO 4的质量是多少?2NaOH +H 2SO 4====Na 2SO 4+2H 2O 2 mol98 g0.1mol m(H 2SO 4)答:所需H 2SO 4的质量为4.9 g .【例3】:将30 gMnO 2的质量分数为76.6%的软锰矿石与足量12 mol ·L-1浓盐酸完全反应(杂质不参加反应).计算:(1)参加反应的浓盐酸的体积. (2)生成的Cl 2的体积(标准状况).请大家分析比较以下几种解法.解法一:解:(1)MnO 2的摩尔质量为87 g ·mol-1,设浓盐酸的体积为V [HCl(aq)]4HCl(浓)+ MnO 2MnCl 2+2H 2O +Cl 2↑4112 mol ·L-1×V [HCl(aq)] 0.26 mol (2)4HCl(浓)+MnO2MnCl 2+2H 2O +Cl 2↑1 1 0.26 moln(Cl2)V(Cl 2)=n(Cl 2)V m=0.26 mol ×22.4 L ·mol -1=5.8 L 答:参加反应的浓HCl 的体积为0.087 L,生成Cl 2的体积在标况下为5.8 L .解法二:解:(1)MnO 2的摩尔质量为87 g ·mol-14HCl(浓)+ MnO 2MnCl 2+Cl 2+H 2O ↑4 1 n(HCl)0.26 moln(HCl)=1mol0.264=1.04mol V[HCl(aq)]=1Lmol 121mol0.264=0.087 Lmol2mol 0.1g 98m(H 2SO4)==4.9g122molg 8776.5%g 30)MnO ()MnO ()(M w m 软锰矿石n(MnO2)==0.26molV [HCl(aq)]==0.087 L1Lmol 121mol 0.26411mol 0.26n(Cl2)==0.26 mol122molg 8776.5%g 30)MnO ()MnO ()(M w m 软锰矿石n(MnO2)==0.26 mol(2)4HCl(浓) +MnO 2MnCl 2+2H 2O +Cl 2↑1 mol 2.4L 0.26 molV(Cl2)V(Cl 2)=mol1L 22.4mol0.26=5.8 L答:参加反应的浓HCl 的体积为0.087 L,生成Cl 2的体积在标况下为5.8 L .解法三:解:4HCl(浓)+MnO 2MnCl 2+2H 2O +Cl 2↑4 mol87 g22.4 L12 mol ·L-1×V [HCl(aq)]30 g ×76.6% V(Cl2)V [HCl(aq)]=g 87Lmol 1276.6%g 30mol 41=0.087 LV (Cl 2)=g87L22.476.6%g 30=5.8 L答:参加反应的浓HCl 的体积为0.087 L ,生成Cl 2的体积在标况下为5.8 L .大家认为以上哪种解法更简单呢?-------第三种解法更简捷!【练习3】4.6 g Na与足量的H 2O 反应,计算生成的气体在标准状况下的体积(标准状况下H 2的密度为0.0899 g ·L -1).【答案: 2.24 L 】【练习4】106 g Na 2CO 3和84 g NaHCO 3分别与过量的HCl 溶液反应,其中A .Na 2CO3放出的CO 2多 B .NaHCO3放出的CO 2多C .Na 2CO3消耗的盐酸多D .NaHCO3消耗的盐酸多【答案: C 】五.物质的量应用于化学方程式的计算时,须注意以下几点:首先,化学方程式中各物质化学计量数之比等于各物质的物质的量之比是进行各项计算的最根本依据;其次,计算时要注意物质的量与其他各物理量(如质量、气体体积、浓度等)之间的换算关系;第三.准确把握反应内涵,正确书写化学方程式.第四.化学方程式表示的是纯净物之间的量的关系,不纯物质必须换算成纯物质的量再进行计算.第五,化学方程式所表示的是实际发生反应的物质间量的关系.如反应2H 2+O 2点燃2H 2O 表示发生反应的H 2与O 2的物质的量是2∶1,而不时体系中H 2和O 2的实际含量或量的关系,即使反应体系起始时H 2与O 2的量的关系为4∶1,反应也是按方程式规定的2∶1进行,最后会剩余H 2.第六,计算单位要做到同一物质上下单位要相同,不同物质左右单位要对应.第七,存在过量问题时,要根据不过量的物理量来进行计算。

物质的量应用于化学方程式的计算物质的量是描述化学反应和化学方程式中物质数量的重要概念。
在化学方程式中,物质的量由摩尔数来表示,通常以化学式前的系数来表示。
物质的量可以用于计算反应的产物和反应物的摩尔数、质量以及体积等。
在进行这些计算时,需要知道化学方程式中物质的摩尔比。
首先,可以使用化学方程式中物质的系数来计算反应物和产物之间的摩尔比。
例如,对于以下化学反应方程式:2H₂+O₂→2H₂O该方程式表示,2摩尔的氢气和1摩尔的氧气在反应中生成2摩尔的水。
这意味着摩尔比为2:1:2利用这个摩尔比,可以计算反应物或产物的摩尔数、质量或体积。
例如,可以使用已知的摩尔数来计算其他物质的摩尔数。
如果已知有3摩尔的氧气参与反应,根据摩尔比,我们可以计算出需要6摩尔的氢气来完全反应。
同样地,如果已知有5摩尔的水生成,我们可以计算出反应中消耗了10摩尔的氢气和5摩尔的氧气。
除了计算摩尔数外,物质的量还可以用来计算物质的质量或体积。
这可以通过已知物质的摩尔数和摩尔质量来完成。
物质的摩尔质量是指一个摩尔物质的质量,通常以克/摩尔(g/mol)来表示。
摩尔质量可以通过元素的原子质量表来确定。
例如,对于氢气(H₂),其摩尔质量为2.016 g/mol。
因此,我们可以使用摩尔质量来计算物质的质量。
例如,如果已知有5摩尔的水,根据水的摩尔质量(18.015 g/mol),可以计算出水的质量为90.075 g。
类似地,物质的量也可以用于计算物质的体积。
对于气体,可以使用理想气体定律来计算其体积。
理想气体定律表示为PV=nRT,其中P为气体的压力,V为气体的体积,n为气体的摩尔数,R为理想气体常数,T为气体的温度。
通过已知气体的摩尔数,可以使用理想气体定律来计算其体积。
例如,对于2摩尔的氢气,在已知的温度和压力下,可以通过理想气体定律计算出氢气的体积。
总结起来,物质的量在化学方程式中的应用是非常重要的。
它可以用于计算反应物和产物的摩尔数、质量和体积。

高中化学58个考点精讲9、物质的量应用于化学方程式的计算1.复习重点揭示化学反应中反应物。
生成物之间的粒子数关系,并学习物质的量、物质的量浓度、气体摩尔体积等应用于化学方程式的计算。
2.难点聚焦1.化学方程式中,各物质的化学计量数(v)之比,等于各物质的物质的量(n)之比。
即均等于该化学方程式的“系数”之比。
2.化学方程式中各气体在同温同压下的体积比,等于它们的化学计量数之比。
即等于各气体在化学方程式中的“系数”比。
3.遇到有关化学方程式的计算时,经常视情况将相关物质的质量,一定浓度和体积的溶液、气体体积换算出它们的物质的量,按化学计量数找出比例关系后入手运算。
【知识要点】1.化学方程式中有关量的关系由上可看出,化学方程式中各物质的化学计量数之比等于组成各物质的粒子数之比,等于各物质的物质的量之比,等于气体体积比(同状况下),不等于质量之比。
根据化学方程式列比例时应遵循上述比例关系。
2.根据化学方程式计算时所列比例是否正确的判断依据是:“上、下单位要一致,左右单位要对应”。
如:3.物质的量应用于化学方程式计算的一般格式(1)设所求物质的物质的量为n(B)[或质量m(B)],或气体标准状况下体积V(B)、或溶液体积V[B(aq)]J。
(2)写出有关反应的化学方程式。
(3)在化学方程式有关物质的化学式下面先写出已知物和所求物的有关量的关系,再代入已知量和所求量。
(4)写出所求物质的数学表达式。
(5)写出解答和答案。
如:6.5g Zn在与足量盐酸反应时产生的在标准状况下的体积是多少升?解:设产生的体积为V()答:产生的在标准状况下的体积是2.24L。
4.规范用语—表示的物质的量—表示方程式中的化学计量数—表示盐酸的物质的量浓度—表示溶液的体积—表示的体积—表示混合物中的质量分数—表示的质量在列比例及运算过程中都应带单位。
3.例题精讲例1:在一定条件下,与足量的固体完全反应后,产生的气体全部收集起来只有1.68L (标准状况),则此气体在标准状况下的密度为()(A)(B)(C)(D)选题角度:此题是物质的量应用于化学方程式的计算。





高一化学物质的量应用于化学方程式的计算【本讲主要内容】物质的量应用于化学方程式的计算【知识掌握】【知识点精析】学习了物质的量的概念之后,化学方程式的意义就扩大了。
它不仅表示出反应物和生成物的质量比,还可以表示出反应物和生成物间物质的量比,微粒个数比和气体体积比。
例如: 322NH 2H 3N P T 催化剂、高高+ 系数: 1 3 2分子个数比: 1 : 3 : 2物质的量比: 1 : 3 : 2体积比: 1 : 3 : 2质量比: 28 : 6 : 34根据方程式反映的这些量的关系,可以进行多种计算,但列比例式时一定要注意:上下单位要一致,左右可以不相同。
例如:8.7 g 2MnO 与足量浓HCl 反应可生成标况下2Cl 多少升?解:设生成标况下2Cl 体积为xO H 2Cl MnCl HCl 4MnO 2222+↑+∆+g7.8g 87∴ = x L 4.22 L 24.2x =∴1. 计算的基本步骤(1)写出化学方程式。
(2)写出已知、未知量。
(3)列出比例式求解x 。
(4)写出答案。
2. 弄清应注意的问题(1)化学方程式所表示的是纯净物质之间的量的关系。
(2)单位问题:上下一致,左右相当。
(3)如果是离子反应,可以根据离子方程式进行计算。
如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
3. 容易出现的错误(1)上下单位不一致,这时上下单位是消不掉的,所以最后的单位不一定正确;(2)所有单位都用克或摩尔,这时会显得步骤很繁琐,还需要在最后再化成所求的单位;其实物质的量在计算中处于核心地位,与克、升等单位可以换算,所以可以给什么列什么,求什么设什么。
【解题方法指导】实验室用4KMnO 与足量的盐酸(%5.36cm /g 19.1:3、ρ)反应,其中有16.6mL 浓HCl 被氧化。
问生成标况下2Cl 多少升?解析:方程式中的系数表示的是物质的量的关系,一般计算前先将其它单位换算成物质的量。
高中化学58个考点精讲9物质的量应用于化学方程式的计算
1.复习重点
揭示化学反应中反应物。
生成物之间的粒子数关系,并学习物质的量、物质的量浓度、气体摩尔体积等应用于化学方程式的计算。
2.难点聚焦
1.化学方程式中,各物质的化学计量数(v)之比,等于各物质的物质的量(n)之比。
即均等于该化学方程式的“系数”之比。
2.化学方程式中各气体在同温同压下的体积比,等于它们的化学计量数之比。
即等于各气体在化学方程式中的“系数”比。
3.遇到有关化学方程式的计算时,经常视情况将相关物质的质量,一定浓度和体积的溶液、气体体积换算出它们的物质的量,按化学计量数找出比例关系后入手运算。
【知识要点】
1.化学方程式中有关量的关系
由上可看出,化学方程式中各物质的化学计量数之比等于组成各物质的粒子数之比,等于各物质的物质的量之比,等于气体体积比(同状况下),不等于质量之比。
根据化学方程式列比例时应遵循上述比例关系。
2.根据化学方程式计算时所列比例是否正确的判断依据是:“上、下单位要一致,左右单位要对应”。
如:
3.物质的量应用于化学方程式计算的一般格式
(1)设所求物质的物质的量为n(B)[或质量m(B)],或气体标准状况下体积V (B)、
或溶液体积V[B(aq)]J。
(2)写出有关反应的化学方程式。
(3)在化学方程式有关物质的化学式下面先写出已知物和所求物的有关量的关系,再代入已知量和所求量。
(4)写出所求物质的数学表达式。
(5)写出解答和答案。
如:6.5g Zn在与足量盐酸反应时产生的在标准状况下的体积是多少升?
解:设产生的体积为V()
答:产生的在标准状况下的体积是2.24L。
4.规范用语
—表示的物质的量—表示方程式中
的化学计量数
—表示盐酸的物质的量浓度—表示溶液的体积
—表示的体积—表示混合物中
的质量分数
—表示的质量在列比例及运算过程中都应带单位。