苯环上的亲电取代反应
- 格式:ppt
- 大小:1.67 MB
- 文档页数:14

苯环侧链的卤代反应为亲电取代反应。
亲电取代反应,也称为烃基取代反应,是特殊的卤化反应,它将
苯环侧链中的一个原子取代为另外一种取代物,也就是一个烃基。
它
的反应原理是基团的亲电力克服了它的稳定性,使其与共价键破坏,
使其核突去离子形成,最后形成新的稳定反应物。
在苯环侧链上进行亲电取代反应,需要一种称为分子夹具的中间体。
只有它才能将受体分子与亲电取代物接近,受体分子和取代物才
能开始反应。
在反应过程中,受体分子的苯环中的共价键被剪断,形
成了碱金属离子,因此是典型的卤化反应。
苯环侧链上夹具分子的苯
键开始破坏,给出碱金属离子,然后,反应物和碱金属开始发生反应,形成新的共价键以及氢键,形成新的反应物。
在发生苯环侧链亲电取代反应时,要避免活性化反应,也就是要
避免在反应过程中受体分子和取代物发生聚合反应。
为了避免这种情
况发生,通常会在夹具分子中加入一种化学离子,如氯离子,硫离子等,来平衡活性化反应。
总之,苯环侧链的亲电取代反应是一种典型的取代型卤化反应。
它需要一种特定的中间体分子支撑,这种中间体可以让受体分子和取
代物开始发生作用。
此外,由于活性化反应容易发生,因此还需要加
入离子,以避免活性化反应发生。

同学们,大家好。
今天讲的是苯环上的亲电取代反应的机理:苯环上的大π键使苯环富含π电子,因此它是一个很强的负电场,容易受到亲电试剂的进攻,发生亲电反应。
当亲电试剂靠近苯环时,苯环上的大π键和亲电试剂形成配位键,生成π-络合物,在π-络合物中,亲电试剂进一步吸引π电子,使π电子发生偏移,生成σ-络合物,σ-络合物失去氢离子,从而生成具有完整苯环的亲电取代的产物。
在这三步反应中,π-络合物的形成,大π键没有被破坏,所以会很容易进行,而由π-络合物生成σ-络合物,大π键被破坏掉,反应很难进行,所以反应比较慢,而σ-络合物又非常不稳定,很容易失去氢离子,生成稳定的具有苯环结构的取代产物,所以第三步也比较快。
因为第一步反应很快,对整个反应影响也比较小,所以苯环上的亲电取代反应机理一般简化为两步。
第一步亲电试剂靠近苯环,生成σ-络合物;σ-络合物失去氢离子,生成最终的取代产物。
第一步反应非常慢,是整个反应的决速步骤。
在决速步骤中生成的σ-络合物,实际上就是碳正离子,而且是烯丙基型碳正离子,在烯丙基型碳正离子中,存在p-π共轭效应,所以σ-络合物的共振结构可以用下面三个极限式来表示。
通过以上的学习,我们已经知道了苯环的亲电取代机理包含了两步,那么苯环的硝化反应、磺化反应、卤化反应等,这些亲电取代反应中亲电试剂是什么呢?这些亲电试剂又是如何产生的?下面让我们来一一分析。
例如硝化反应,在硝化反应中是浓硝酸和浓硫酸和苯环的作用,那它的亲电试剂是什么呢?硫酸的酸性比硝酸强,二者共处,硝酸表现出碱性,硫酸表现出酸性,硝酸中的氧用孤对电子与硫酸中的氢离子结合,结合之后的硝酸,氮氧键极性增大,更容易断裂,断裂时电子转向氧,生成一分子的水,还有一个阳离子,该阳离子叫硝酰阳离子,硝酰阳离子具有亲电性,因此,它可以和苯环发生亲电取代反应。
硝酰阳离子靠近苯环,生成σ-络合物,σ-络合物失去氢离子,生成最终取代的产物硝基苯。
所以硝化反应的亲电试剂是硝酰阳离子,硫酸的作用是帮助硝酸产生亲电离子:硝酰阳离子。
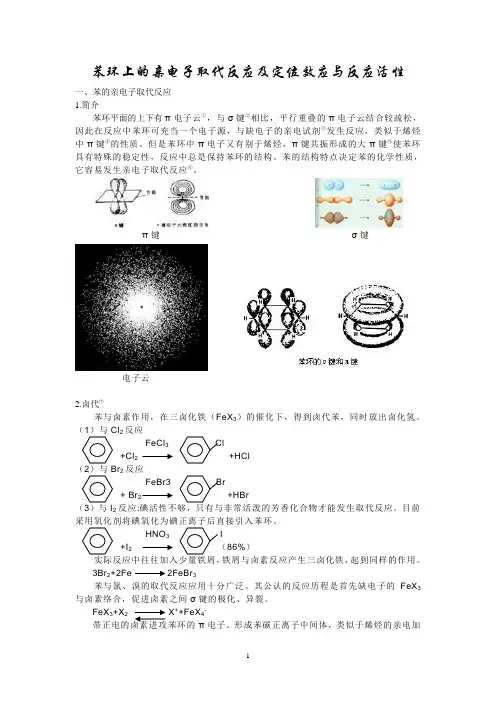
苯环上的亲电子取代反应及定位效应与反应活性一、苯的亲电子取代反应1.简介苯环平面的上下有π电子云①,与σ键②相比,平行重叠的π电子云结合较疏松,因此在反应中苯环可充当一个电子源,与缺电子的亲电试剂③发生反应,类似于烯烃中π键④的性质。
但是苯环中π电子又有别于烯烃,π键共振形成的大π键⑤使苯环具有特殊的稳定性,反应中总是保持苯环的结构。
苯的结构特点决定苯的化学性质,它容易发生亲电子取代反应⑥。
π键σ键电子云2.卤代⑦苯与卤素作用,在三卤化铁(FeX3)的催化下,得到卤代苯,同时放出卤化氢。
(1)与Cl2反应FeCl3+Cl2+HCl反应2FeBr3+ Br2 +HBr(3)与I2反应:碘活性不够,只有与非常活泼的芳香化合物才能发生取代反应。
目前采用氧化剂将碘氧化为碘正离子后直接引入苯环。
HNO3I+I286%)铁屑与卤素反应产生三卤化铁,起到同样的作用。
3Br2+2Fe 2FeBr3苯与氯、溴的取代反应应用十分广泛。
其公认的反应历程是首先缺电子的FeX3与卤素络合,促进卤素之间σ键的极化、异裂。
FeX3+X2X++FeX4-带正电的卤素进攻苯环的π电子。
形成苯碳正离子中间体,类似于烯烃的亲电加成,这一步是速度决定步骤+二卤代烃+X-也可失去质子,恢复苯的骨架。
苯的稳定性起了决定作用,得到取代而不是加成产物。
-H++FeX3+HX3.硝化苯与浓硝酸和浓硫酸的混合物(称混酸)反应,生成硝基苯。
浓H2SO4+HNO3(浓)(98%)+H2O50℃其反应历程如下:浓硫酸的酸性比硝酸的强,它作为酸提供质子(H+),硝酸作为碱提供氢氧根(OH-),去掉一分子水,产生硝基正离子,硝基正离子具有很强的亲电子性,与苯发生亲电子取代反应。
若采用浓硝酸,则反应速度明显减慢,这是由于浓硝酸中仅存在少量的硝基正离子。
4.磺化不同浓度的硫酸与苯反应的速度不同,浓度越高反应越快。
含三氧化硫的发烟硫酸的反+H2SO4(7%SO3(52%)+H2O磺化反应也是亲电取代反应,通常认为亲电试剂是三氧化硫。

苯环亲电取代反应的定位规律和理论解释
苯环亲电取代反应是一种常见的有机化学反应,它指的是苯环上的一个电子富位碳原子被其他物质的电子富位原子所取代的反应。
这种反应可以通过电离平衡和等温线来解释。
苯环亲电取代反应的定位规律是,取代反应的定位总是优先发生在苯环上最容易被取代的位置。
在二甲苯和苯乙烯这类苯环中,电子富位碳原子多半是取代反应的首选目标;而在苯并环烷和苯并三唑这类苯环中,取代反应更多地会发生在含氧原子的位置。
苯环亲电取代反应的理论解释可以通过极化和电离平衡来进行。
极化是指分子内部电荷分布的不均匀现象,它会导致分子内部电子密度的不均匀分布,从而使得某些原子或基团更容易被
取代。
电离平衡则是指反应中电子富余和电子缺乏的均衡状态,它决定了反应的方向和速率。
苯环亲电取代反应的定位规律可以通过电离平衡来解释。
由于苯环上某些原子的电离能更高,因此它们更容易被取代。
而由于苯环上某些原子的电离能更低,因此它们更难被取代。
这就是为什么苯环亲电取代反应的定位总是优先发生在苯环上最容易被取代的位置的原因。
通过对苯环亲电取代反应的定位规律和理论解释的研究,我们可以更好地理解和掌握这种常见的有机化学反应,并运用到实际应用中。

苯环上的亲电取代反应1. 概述亲电取代反应是化学中一种常见的反应类型,它可以在有机分子中引入新的官能团或取代已有的官能团。
苯环上的亲电取代反应是指在苯环上进行亲电取代反应的过程。
苯环是由6个碳原子构成的环状结构,由于苯环具有特殊的共轭性和稳定性,因此苯环上的反应需要一定的条件和催化剂。
在苯环上进行亲电取代反应的机理通常分为两种类型:亲电取代和自由基取代。
亲电取代是指通过亲电试剂与苯环上的π电子发生作用,形成共轭稳定的化合物;自由基取代则是指在自由基试剂的作用下,发生自由基取代反应。
2. 亲电取代反应的机理亲电取代反应的机理主要涉及以下步骤:2.1 亲电试剂的进攻亲电试剂(如卤代烷、羧酸酰基等)与苯环上的π电子发生亲电进攻反应,形成中间体。
这一步骤是整个反应的关键,亲电试剂的进攻位置主要受到取代基的取向效应和反应条件的影响。
2.2 中间体的稳定化形成的中间体会进行稳定化反应,主要是通过迁移质子或电子的方式使中间体更加稳定。
2.3 取代产物的生成在稳定化反应后,中间体会生成取代产物,同时释放出催化剂或其他副产物。
取代产物的结构和性质取决于亲电试剂和反应条件。
3. 亲电取代反应的条件亲电取代反应的条件包括温度、催化剂、试剂浓度等因素。
3.1 温度亲电取代反应通常在室温下进行,较高的温度可能导致副反应的发生,降低产率。
3.2 催化剂某些反应需要催化剂的存在才能进行,常用的催化剂有铝黄原、铁黄原等。
催化剂可以提高反应速率和产物选择性。
3.3 试剂浓度试剂浓度对反应速率和产率有一定影响,较高的试剂浓度可以提高反应速率和产率,但过高的浓度可能导致副反应的发生。
4. 苯环上的常见亲电取代反应4.1 卤代取代反应卤代取代反应是最常见的亲电取代反应之一。
在卤代取代反应中,卤代烷与苯环上的π电子发生反应,取代其中的氢原子形成卤代苯。
4.2 羟基取代反应羟基取代反应是在苯环上引入羟基(-OH)官能团的反应。
常见的羟基取代反应有酰基氯与苯的反应,生成苯酚(phenol)。



苯环上的亲电取代反应苯环上的亲电取代反应是有机化学中比较常见的一类反应。
它通常发生在苯环上的芳香性碳原子上,将亲电试剂与苯环上的氢原子置换掉,从而形成新的有机化合物。
这种反应常被用于制备苯环上的取代基,也可以用于制备其他复杂的有机化合物。
亲电取代反应中通常使用的亲电试剂包括卤化物、烷基化试剂、酰基化试剂、亚硝基化试剂等。
这些试剂可以与苯环上的氢原子发生反应,将自身的功能基固定在苯环上。
其中最常见的反应是取代反应,它指的是亲电试剂与苯环上的氢原子形成互换反应,产生取代基的过程。
在这个反应中,苯环的芳香性被打破,导致反应产物失去了一部分芳香性。
在苯环上的亲电取代反应中,通常需要加入辅助试剂来促进反应的进行。
这些辅助试剂可以帮助亲电试剂与苯环上的氢原子发生反应,并促进反应的速度和选择性。
常用的辅助试剂包括路易斯酸类催化剂、氧化剂、酸类催化剂等。
在实验室中,常用的亲电试剂包括溴化亚铁、溴化亚锡、三氟甲磺酸等。
其中溴化亚铁和溴化亚锡是常见的卤化物类试剂,它们与苯环上的氢原子发生反应,形成卤代苯基。
三氟甲磺酸是一种强烷基化试剂,它可以将甲基基固定在苯环上。
不同的亲电试剂在苯环上的取代反应中,产生的取代基种类不同。
苯环上的取代基又可以进一步反应,形成各种复合化合物。
因此,苯环上的亲电取代反应在有机合成中扮演着重要的角色,也是化学家们需要掌握的重要技术之一。
总之,苯环上的亲电取代反应是有机化学中必不可少的一环。
通过选择不同的亲电试剂和辅助试剂,可以产生不同的取代基,从而制备出各种不同的有机化合物。
在实验中,需要注意反应物的选择、反应条件的控制和安全操作,以确保反应的高效和可靠性。

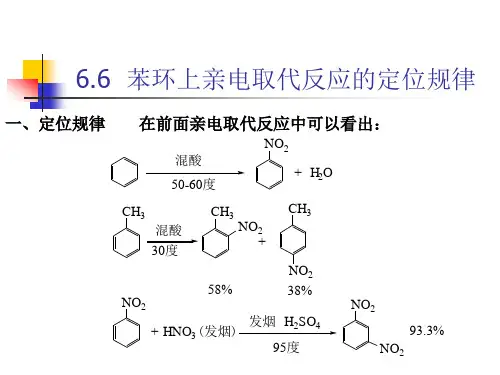
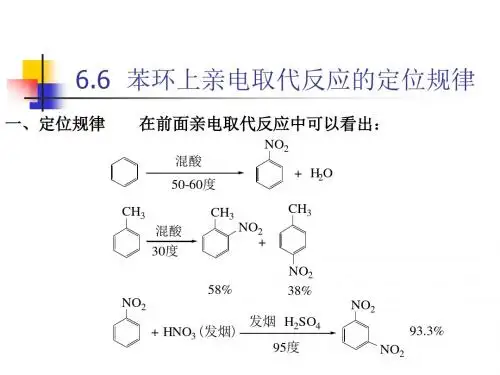
苯环上亲电取代反应的定位规律苯环上亲电取代反应的定位规律基本概念:定位基:在进⾏亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第⼆个取代基进⼊苯环的位置,即决定取代反应的位置。
原有取代基称做定位基。
⼀、两类定位基在⼀元取代苯的亲电取代反应中,新进⼊的取代基可以取代定位基的邻、间、对位上的氢原⼦,⽣成三种异构体。
如果定位基没有影响,⽣成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。
实际上只有⼀种或⼆种主要产物。
例如各种⼀元取代苯进⾏硝化反应,得到下表所⽰的结果:排在苯前⾯的取代硝化产物主要是邻位和对位取代物,除卤苯外,其它取代苯硝化速率都⽐苯快;排在苯后⾯取代硝化产物主要是间位取代物,硝化速率⽐苯慢得多。
归纳⼤量实验结果,根据苯环上的取代基(定位基)在亲电取代反应中的定位作⽤,⼀般分为两类:第⼀类定位基⼜称邻对位定位基:—O-,—N(CH3)2,—NH2,—OH,—OCH3,—NHCOCH3,—OCOCH3,—F,—Cl,—Br,—I,—R,—C6H5等。
第⼆类定位基⼜称间位定位基:—N+(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—N+H3等。
两类定位基的结构特征:第⼀类定位基和苯环直接相连的原⼦上只有单键,且多数有孤对电⼦或是负离⼦;第⼆类定位基和苯环直接相连的原⼦上有重键,且重键的另⼀端是电负性⼤的元素或带正电荷。
两类定位基中每个取代基的定位能⼒不同,其强度次序近似如上列顺序。
苯环上亲电取代反应的定位规律⼆、定位规律的电⼦理论解释在⼀取代苯中,由于取代基的电⼦效应沿着苯环共轭链传递,在环上出现了电⼦云密度较⼤和较⼩的交替分布现象,因⽽环上各位置进⾏亲电取代反应的难易程度不同,出现两种定位作⽤。
也可以从⼀取代苯进⾏亲电取代反应⽣成的中间体σ络合物的相对稳定性的⾓度进⾏考察,当亲电试剂E +进攻⼀取代时,⽣成三苯σ络合物:Z 不同,⽣成的三种σ络合物碳正离⼦的稳定性不同,出现了两种定位作⽤。
苯亲电取代反应历程1. 引言苯是有机化学中最简单的芳香烃,由于其特殊的结构和性质,在有机合成中具有重要的地位。
苯亲电取代反应是一类常见的反应,通过在苯环上引入亲电试剂,可以实现对苯环上氢原子的取代,从而合成各种取代苯化合物。
本文将介绍苯亲电取代反应的历程、机理以及一些典型的实例。
2. 反应机理苯亲电取代反应是一个两步反应过程,包括亲电试剂进攻和芳香稳定化两个步骤。
2.1 亲电试剂进攻在第一步中,亲电试剂(通常为卤代烷或酸酐)与苯环发生加成反应,生成一个带正离子中间体。
这个中间体具有较高的能量,因为它违背了芳香性规则。
2.2 芳香稳定化在第二步中,带正离子中间体通过负离子攻击或负离子相邻基团共轭系统的形式进行芳香稳定化。
负离子可以是一个碱(如氢氧根离子)或一个碱性试剂(如碱金属或碱土金属)。
这个步骤是整个反应的关键,使得中间体恢复为稳定的芳香化合物。
3. 典型实例3.1 氯代苯的制备氯代苯是一种常见的取代苯化合物,通常用于有机合成和药物制备中。
它可以通过苯亲电取代反应来合成。
反应方程式如下:C6H6 + Cl2 -> C6H5Cl + HCl在这个反应中,氯气作为亲电试剂与苯发生加成反应,生成带正离子中间体C6H5+。
然后,这个中间体通过负离子攻击形成稳定的氯代苯,并释放出HCl。
3.2 酰基化反应酰基化反应是一类重要的取代反应,可用于合成酮、醛等化合物。
在酰基化反应中,酸酐作为亲电试剂与苯发生加成反应。
例如,乙酸酐与苯发生酰基化反应:C6H6 + (CH3CO)2O -> C6H5COCH3 + CH3COOH在这个反应中,乙酸酐与苯发生加成反应,生成带正离子中间体C6H5CO+。
然后,这个中间体通过负离子攻击形成稳定的乙酰苯,并释放出乙酸。
4. 反应条件苯亲电取代反应的条件取决于具体的反应类型和试剂选择。
一般来说,以下条件可能适用:•反应温度:通常在室温下进行,但某些情况下需要加热。