循环伏安法测定电极反应
- 格式:doc
- 大小:662.00 KB
- 文档页数:10

循环伏安法判断电极过程实验报告循环伏安法判断电极过程实验报告引言:循环伏安法是一种常用的电化学测试方法,用于研究电极材料的电化学行为。
本实验旨在通过循环伏安法测定电极材料的氧化还原反应特性,并分析实验结果,探讨其在电化学领域的应用前景。
实验材料与方法:实验所用材料为铂电极和铜电极,实验仪器为循环伏安仪。
首先,将铂电极和铜电极分别清洗并抛光,以确保电极表面的纯净度和光滑度。
然后,将电极插入电解质溶液中,并设置循环伏安仪的扫描速度和电位范围。
接下来,进行循环伏安法测试,记录电流与电位之间的关系曲线。
实验结果与分析:通过循环伏安法测试,我们得到了铂电极和铜电极的电流-电位曲线。
根据曲线的形状和特点,我们可以得到以下结论和分析:1. 铂电极的电流-电位曲线呈现出典型的双电极峰形状,其中一个峰对应氧化反应,另一个峰对应还原反应。
这说明铂电极在测试条件下发生了氧化还原反应,具有良好的电化学活性。
这一特性使得铂电极在催化剂、电池等领域有着广泛的应用前景。
2. 铜电极的电流-电位曲线呈现出单峰形状,没有出现双电极峰。
这说明铜电极在测试条件下只发生了一种氧化还原反应,具有较低的电化学活性。
然而,铜电极在电化学合成、电镀等领域仍然有着重要的应用,其特殊的电化学行为可以被利用。
3. 通过对电流-电位曲线的分析,我们可以得到电极反应的动力学参数,如峰电位、峰电流等。
这些参数可以进一步用于计算电极的表面积、电荷转移速率等重要参数,为电极材料的性能评价提供参考。
结论:本实验通过循环伏安法测试了铂电极和铜电极的电流-电位曲线,并对实验结果进行了分析。
通过曲线的形状和特征,我们可以了解电极材料的氧化还原反应特性和电化学活性。
这对于电化学领域的研究和应用具有重要意义。
循环伏安法作为一种常用的电化学测试方法,具有广泛的应用前景,可以用于研究各种电极材料的性能,并为相关领域的发展提供支持。
总结:循环伏安法是一种重要的电化学测试方法,通过测定电流-电位曲线,可以研究电极材料的氧化还原反应特性和电化学活性。

实验三十四循环伏安法测定铁氰化钾的电极反应过程一、实验目的见《仪器分析实验》p123二、方法原理见《仪器分析实验》p123。
三、仪器和试剂1.JP—303型极谱分析仪2.铁氰化钾标准溶液:5.0×10-2mol/L3.氯化钾溶液:1.0mol/L四、实验步骤1.铁氰化钾试液的配置准确移取1.0mL5.0×10-2mol/L的铁氰化钾标准溶液于10mL的小烧杯中,加入1.0 mol/L 的氯化钾溶液5.0mL,再加蒸溜水4.0mL。
2.测量手续(1)打开303极谱仪的电源。
屏幕显示清晰后,输入当天的日期:××.××.××,按【INT】键。
(2)屏幕显示“运行方式”菜单后,选取“使用当前方法”项,按【YES】键。
屏幕将显示“线性循环伏安法”的方法参数菜单:导数(0~2)0量程(10e nA,e=1~4) 4扫描次数(1~8) 4扫描速率(50~1000mV/s)50起始电位(-4000~4000mV)-100终止电位(-4000~4000mV)600静止时间(0~999s)0如果显示的参数不符合,请按提示修改。
(3)测量铁氰化钾试液在教师指导下,置电极系统于10mL小烧杯的铁氰化钾试液里。
按【运行】键,运行自动完成后,“波高基准”项闪烁,用∧∨键确定“前谷”方法处理图谱,按【YES】键。
请记录波峰电位和波峰电流数据。
按两次【退回】键,再按【方法】键,选取“使用当前方法”项,按【YES】键,显示“线性循环伏安法”的方法参数菜单。
修改扫描速率为100mV,按【ENT】键。
再按【运行】键,照上述的过程一样进行测量。
直至完成扫描速率为50、100、150、200、250mV/s的测量。
上述的循环伏安图打印样本见附图。
五、结果处理见《仪器分析实验》p127五的1、3、5题。
六、问题讨论见《仪器分析实验》p128六的2题。
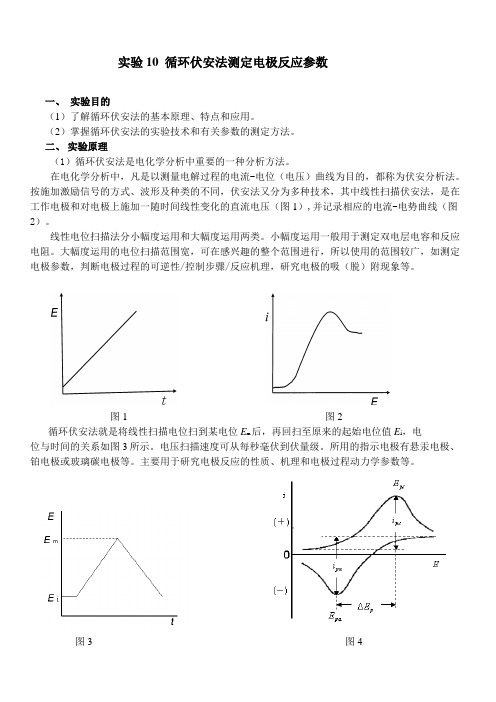
实验10 循环伏安法测定电极反应参数一、实验目的(1)了解循环伏安法的基本原理、特点和应用。
(2)掌握循环伏安法的实验技术和有关参数的测定方法。
二、实验原理(1)循环伏安法是电化学分析中重要的一种分析方法。
在电化学分析中,凡是以测量电解过程的电流-电位(电压)曲线为目的,都称为伏安分析法。
按施加激励信号的方式、波形及种类的不同,伏安法又分为多种技术,其中线性扫描伏安法,是在工作电极和对电极上施加一随时间线性变化的直流电压(图1),并记录相应的电流-电势曲线(图2)。
线性电位扫描法分小幅度运用和大幅度运用两类。
小幅度运用一般用于测定双电层电容和反应电阻。
大幅度运用的电位扫描范围宽,可在感兴趣的整个范围进行,所以使用的范围较广,如测定电极参数,判断电极过程的可逆性/控制步骤/反应机理,研究电极的吸(脱)附现象等。
图1 图2循环伏安法就是将线性扫描电位扫到某电位E m后,再回扫至原来的起始电位值E i,电位与时间的关系如图3所示。
电压扫描速度可从每秒毫伏到伏量级。
所用的指示电极有悬汞电极、铂电极或玻璃碳电极等。
主要用于研究电极反应的性质、机理和电极过程动力学参数等。
图3 图4当溶液中存在氧化态物质O 时,它在电极上可逆地还原生成还原态物质R ,O + ne → R当电位方向逆转时,在电极表面生成的R 则被可逆地氧化为O,R → O + ne一个三角波扫描,可以完成还原与氧化两个过程,记录出如图4所示的循环伏安曲线。
在循环伏安法中,阳极峰电流i P a 、阴极峰电流i P c 、阳极峰电位E pa 、阴极峰电位E P c 是最重要的参数,对可逆电极过程来说, 峰电位不随扫描速度变化,且 5763E E E mV n∆=pa pc -= (1) 即阳极峰电势(E pa )与阴极峰电势(E pc )之差为57/n 至63/n mV 之间,确切的值与扫描过阴极峰电势之后多少毫伏再回扫有关。
一般在过阴极峰电势之后有足够的毫伏数再回扫,△E P 值为58/n mV 。

循环伏安法测定电极反应参数-教案设计一、教学目标:1. 理解循环伏安法的原理及其在电化学分析中的应用。
2. 学会使用循环伏安法测定电极反应参数。
3. 能够分析循环伏安图,并解读实验结果。
二、教学内容:1. 循环伏安法的原理介绍。
2. 循环伏安法实验步骤及操作方法。
3. 循环伏安图的解析与实验结果分析。
三、教学准备:1. 实验室用具:循环伏安仪、电极、电解质溶液、导线等。
2. 教学材料:教案、PPT、实验指导书等。
四、教学过程:1. 导入:通过引入电化学分析法,引导学生了解循环伏安法在电化学分析中的应用。
2. 讲解循环伏安法的原理,包括法拉第电解定律、电极反应等基本概念。
3. 演示循环伏安法的实验步骤,并讲解操作方法。
4. 分组讨论:学生分组进行实验,观察并记录循环伏安图。
5. 解析循环伏安图,引导学生掌握图谱的解读方法。
6. 总结实验结果,分析电极反应参数。
五、教学评价:1. 学生能理解循环伏安法的原理及其应用。
2. 学生能熟练操作循环伏安仪,完成实验并记录数据。
3. 学生能分析循环伏安图,并正确解读实验结果。
4. 学生能运用所学知识,解决实际问题。
六、教学重点与难点:重点:1. 循环伏安法的原理及其在电化学分析中的应用。
2. 循环伏安法实验步骤及操作方法。
3. 循环伏安图的解析与实验结果分析。
难点:1. 循环伏安图的解析与实验结果分析。
2. 电极反应参数的确定与计算。
七、教学方法:1. 采用讲授法讲解循环伏安法的原理和实验操作方法。
2. 使用演示法展示实验过程,引导学生观察循环伏安图。
3. 分组讨论法:学生分组进行实验,交流讨论实验现象和结果。
4. 案例分析法:分析实际案例,帮助学生理解循环伏安法在实际应用中的重要性。
八、教学步骤:1. 循环伏安法的原理讲解:通过PPT展示循环伏安法的原理和相关概念。
2. 实验操作演示:演示循环伏安法的实验步骤,包括溶液准备、电极安装、仪器设置等。
3. 学生实验操作:学生分组进行实验,操作循环伏安仪,观察并记录循环伏安图。


实验4循环伏安法测定电极反应参数华南师范⼤学实验报告学⽣姓名:学号:专业:新能源材料与器件年级班级:17新能源1班课程名称:电化学基础实验实验项⽬:循环伏安法测定电极反应参数实验指导⽼师:吕东⽣实验时间:2019年3⽉25⽇⼀、实验⽬的1. 了解循环伏安法的基本原理及应⽤2. 掌握循环伏安法的实验技术和有关参数的测定⽅法。
⼆、实验原理循环伏安法(CV )是最重要的电分析化学研究⽅法之⼀。
该⽅法使⽤的仪器简单,操作⽅便,图谱解析直观,在电化学、⽆机化学、有机化学、⽣物化学等许多研究邻域被⼴泛应⽤。
循环伏安法通常采⽤三电极系统,⼀⽀⼯作电极,⼀⽀参⽐电极,⼀⽀对电极。
外加电压加在⼯作电极与辅助电极之间,反应电流通过⼯作电极与辅助电极。
循环伏安法加电压的⽅式如图a 所⽰。
对可逆电极过程,如⼀定条件下的3/46()Fe CN --氧化还原体系,当电压负向扫描时,36()Fe CN -在电极上还原,得到⼀个还原电流峰。
当电压正向扫描时,46()Fe CN -在电极上氧化,得到⼀个氧化电流峰。
所以,电压完成⼀次循环扫描后,将记录出⼀个如图b 所⽰的氧化还原曲线。
图a.循环伏安法加电压的⽅式图b.循环伏安法测得的氧化还原曲线在循环伏安法中,阳极峰电流i pa ,阴极峰电流pc i 、阳极峰电势pa E 、阴极峰电势pc E 以及a i p /c i p 、p pa pc -E E E ?()时最为重要的参数。
对于⼀个可逆过程:p pa pc -57~63/n m 25E E E ?≈()() V (℃)。
⼀般情况下,p E ?约为58/n mV (25℃),pa pc i /i 1≈。
正向扫描的峰电流p i 为:3115222p i =2.6910n v AD C ?从p i 的表达式看:p i 与12v 和C 都呈线性关系,对研究电极过程具有重要意义。
标准电极电势为:o pa pc =+/2E E E ()。
实验⼆-循环伏安法测定电极反应参数循环伏安法测定电极反应参数⼀、⽬的要求1.学习循环伏安法测定电极反应参数的基本原理及⽅法。
2.熟悉伏安仪使⽤技巧。
⼆、实验原理循环伏安法(CV)是最重要的电分析化学研究⽅法之⼀。
在电化学、⽆机化学、有机化学、⽣物化学等研究领域得到了⼴泛应⽤。
由于其设备价廉、操作简便、图谱解析直观,因⽽⼀般是电分析化学的⾸选⽅法。
CV⽅法是将循环变化的电压施加于⼯作电极和参⽐电极之间,记录⼯作电极上得到的电流与施加电压的关系曲线。
这种⽅法也常称为三⾓波线性电位扫描⽅法。
图1中表明了施加电压的变化⽅式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点⼜回扫到+0.8V,扫描速度可从斜率反映出来,其值为50mV/s。
虚线表⽰的是第⼆次循环。
⼀台现代伏安仪具有多种功能,可⽅便地进⾏⼀次或多次循环,任意变换扫描电压范围和扫描速度。
当⼯作电极被施加的扫描电压激发时,其上将产⽣响应电流。
以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
典型的循环伏安图如图2所⽰。
该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在Pt⼯作电极上反应得到的结果。
图 2 6×10–3 mol/L在1 mol/L的KNO3溶液中的循环伏安图扫描速度:50 mV/s 铂电极⾯积:2.54 mm2从图可见,起始电位E i为+0.8V(a点),电位⽐较正的⽬的是为了避免电极接通后Fe(CN)63–发⽣电解。
然后沿负的电位扫描(如箭头所指⽅向),当电位⾄Fe(CN)63–可还原时,即析出电位,将产⽣阴极电流(b点)。
其电极反应为:Fe(III)(CN)63– + e–——?Fe(II)(CN)64–随着电位的变负,阴极电流迅速增加(b g d),直⾄电极表⾯的Fe(CN)63-浓度趋近零,电流在d点达到最⾼峰。
然后迅速衰减(d g g),这是因为电极表⾯附近溶液中的Fe(CN)63-⼏乎全部因电解转变为Fe(CN)64-⽽耗尽,即所谓的贫乏效应。
(新)实验四循环伏安法测定亚铁氰化钾的电极反应过程循环伏安法测定亚铁氰化钾的电极反应过程⼀、实验⽬的(1) 学习固体电极表⾯的处理⽅法; (2) 掌握循环伏安仪的使⽤技术;(3) 了解扫描速率和浓度对循环伏安图的影响⼆、实验原理铁氰化钾离⼦[Fe(CN)6]3--亚铁氰化钾离⼦[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表⾯活度的Nernst ⽅程式为φ=φθ+ RT/Fln(C Ox /C Red )-0.20.00.20.40.60.8-0.0005-0.0004-0.0003-0.0002-0.00010.00000.00010.00020.0003i pai pcI /m AE /V vs.Hg 2Cl 2/Hg,Cl-在⼀定扫描速率下,从起始电位(-0.20V)正向扫描到转折电位(0.80 V)期间,溶液中[Fe(CN)6]4-被氧化⽣成[Fe(CN)6]3-,产⽣氧化电流;当负向扫描从转折电位(0.80V)变到原起始电位(-0.20V)期间,在指⽰电极表⾯⽣成的[Fe(CN)6]3-被还原⽣成[Fe(CN)6]4-,产⽣还原电流。
为了使液相传质过程只受扩散控制,应在加⼊电解质和溶液处于静⽌下进⾏电解。
在0.1MNaCl 溶液中[Fe(CN) 6]4-]的扩散系数为0.63×10-5cm.s -1;电⼦转移速率⼤,为可逆体系(1MNaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2cm·s -1)。
溶液中的溶解氧具有电活性,⽤通⼊惰性⽓体除去。
三、仪器与试剂MEC-16多功能电化学分析仪(配有电脑机打印机);玻碳圆盘电极(表⾯积0.025 cm 2)或铂柱电极;铂丝电极;饱和⽢汞电极;超声波清洗仪;电解池;氮⽓钢瓶。
容量瓶:250 mL 、100mL 各2个,25 mL 7个。
循环伏安法测定电极反应参数 PDF循环伏安法是一种常用的电化学测试方法,用于测定电极反应的动力学参数、化学反应的性质和热力学特性等,其原理是利用电压的周期性变化使电极表面的吸附物质进行氧化还原反应,通过测量电流和电位之间的关系,计算反应的动力学参数。
一、实验原理1.循环伏安法的原理:循环伏安法广泛应用于电化学催化、晶体生长、电化学传感器和电化学腐蚀等领域。
由于循环伏安法可以通过不同电极电位对反应进行调节,因此可以理解反应的动力学参数、化学反应的性质和热力学特性等。
二、实验材料1.铂片电极2.三角波电位发生器3.电化学工作站4.测试溶液:0.1mol/L H2SO4溶液三、实验步骤1.将铂片清洗干净,在0.1mol/L H2SO4溶液中进行电极阳极极化20分钟,使电极表面形成一层氧化铂;2.将阳极氧化铂放在电化学工作站上,连接三角波电位发生器;3.在电化学工作站上选择循环伏安法,设置三角波电位发生器的扫描速度和电位范围;4.在0.1mol/L H2SO4溶液中浸泡电极,打开电流计和电位计,开始测试;5.在测试结束后,将数据输入计算机中,通过分析数据得到循环伏安曲线。
四、实验结果通过循环伏安曲线,可以得到电极发生氧化还原反应的动力学参数、化学反应的性质和热力学特性等,一般包括以下几个方面:1.电极反应的电荷转移系数:通过计算循环伏安图中的正向峰和反向峰之间的峰电势差,可以计算出电荷转移系数。
2.电极反应的电流密度:通过测量所消耗的电流,并根据电化学理论和法拉第定律进行计算。
3.电极反应的控制类型:根据循环伏安曲线的形状,可以区分电极反应的控制类型,比如扩散控制型、电荷转移控制型、双层控制型等。
4.电极反应的动力学参数:通过循环伏安曲线中的谷值位置和峰电流大小以及电荷转移系数的信息,可以进一步计算出电极反应的动力学参数,比如转移系数、反应平衡常数等。
五、实验注意事项1.在进行实验前,应将电化学工作站和电极清洗干净;2.防止操作时盐酸喷洒,必要时戴好化学防护眼镜和手套;3.在测试过程中,尽量保持电位和电流稳定,测试结果会受到外部干扰波的影响。
循环伏安法测定电极反应参数
循环伏安法是一种电化学测试方法,用于测量电化学反应(例如电极反应)的参数。
具体步骤如下:
1. 准备电解质溶液和两个电极:一个工作电极、一个参比电极和一个辅助电极。
2. 把工作电极放入电解质溶液中并加入足够的电解质。
参比电极和辅助电极也必须放在溶液中,并且它们应该尽可能接近工作电极。
3. 将工作电极连接到电位计和电源,并将参考电极连接到电位计。
4. 通常会在一定范围内缓慢扫描电势范围。
开始时电位设置在较高值,随后电位逐渐减小至较低值,然后再逐渐升高至较高值。
扫描速率也是一个重要参数。
5. 当工作电极的电位被扫描时,会观察到电流变化。
这个输出信号可以记录下来。
可以用这个变化来确定电极反应参数,如反应速率、电荷转移系数、扩散系数和电化学反应的机理等。
6. 根据所得到的数据,可以进行一些计算,以确定电极反应的参数和性质。
循环伏安法是一种多用途的方法,适用于很多种电化学反应,包括金属离子的还原和氧化、化学反应的动力学参数等。
循环伏安法测定电极反应一、实验目的1、学习循环伏安法测定电极反应的基本原理和方法。
2、熟悉电化学工作站的使用并根据所测数据验证并判断电极反应是否是可逆反应。
二、实验原理伏安分析法是在一定电位下测量体系的电流,得到伏安特性曲线。
根据伏安特性曲线进行定性定量分析。
循环伏安法是将对称的三角波扫描电压(如图一)施加于电解池的电极上,记录工作电极上的电流随电压变化的曲线。
在三角波的前半部分,电极上若发生还原反应(阴极过程),得到一个峰形的阴极波;而在三角波的后半部分,则得到一个峰形的阳极波。
一次三角波电压扫描,电极上完成一个氧化还原循环。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)做图,就得到了循环伏安图(如图二所示)。
图一图二E pc、E pa分别为阴极峰值电位与阳极峰值电位。
i pc、i pa分别为阴极峰值电流与阳极峰值电流。
这里p代表峰值,a代表阳极,c代表阴极。
[Fe(CN)6]3--[Fe(CN)6]4-体系氧化还原电对的标准电极电位为:[Fe(CN)6]3- + e- = [Fe(CN)6]4-φθ= 0.36V电极电位与电极表面活度的Nernst方程式为:φ=φθ+ nRT/Fln(C Ox/C Red)用循环伏安法正扫时(由正向负的扫描)为阴极扫描,产生还原电流:Fe(CN)63- + e- = Fe(CN)64-反扫时(由负向正的扫描)为阳极扫描,产生氧化电流:Fe(CN)64- - e- = Fe(CN)63-两峰之间的电位差值为:(1)对扩散控制的体系,循环伏安的峰电流,由Randles–Savcik方程可表示为:i p= 2.69×105n3/2AD1/2υ1/2c (2)其中: i p为峰电流(A),n为电子转移数, A为电极面积(cm2), D为扩散系数(cm2/s),υ为扫描速度(V / s), c为浓度(mol/L)。
根据上式,i p与υ1/2和c都是直线关系,对研究电极反应过程具有重要意义。
在可逆电极反应过程中,i pa/i pc≈ 1 (3)对一个简单的电极反应过程,循环伏安法有两个重要的实验参数,是用来判别体系是否为可逆体系的重要依据:一是峰电流之比,即i pa/i pc(式(3)),二是两峰之间的电位差,即E pa-E pc,式(1)。
若i pa/i pc≈1,E pa-E pc≈0.059/n,则电极反应是可逆的,反之则电极反应是不可逆的。
对于一个体系,循环伏安图中的阴极峰电流是由电极上吸附反应物的还原和溶液中反应物扩散到电极表面还原两部分组成。
如果是当吸附反应物引起的还原电流占主要部分,则峰电流与扫描速度v成正比。
如果扫描过程中,吸附反应物消耗速度很快,还原电流主要由溶液中的扩散过程所提供,此时电流具有纯扩散电流的性质,即i p与扫描速度的平方根成正比。
根据电流与扫描速度关系,可以判断电流主要受哪种过程控制。
抗坏血酸(C6H8O6)又称为维生素C,具有强还原性,广泛存在于水果中,通过电解会失去两个电子发生氧化反应:该反应为不可逆反应,经过电化学分析工作站,能得到其循环伏安图。
三、仪器与试剂RST系列电化学工作站;玻碳电极、铂丝电极、饱和甘汞电极。
抗坏血酸(公用天平旁边)、1.00×10-2mol/L K3Fe(CN)6溶液、2mol/L KNO3水溶液、0.5M H2SO4溶液,0.1M Na2SO4溶液。
容量瓶100mL、50mL,移液管。
四、实验步骤1.溶液的配制在5个50mL容量瓶中,依次加入KNO3溶液和K3Fe(CN)6溶液,使稀释的溶液中KNO3浓度均为0.2mol/L,而K3Fe(CN)6浓度依次为1.0×10-4、2.0×10-4、5.0×10-4、6.0×10-4、8.0×10-4mol/L,然后用蒸馏水定容。
2.K3Fe(CN)6溶液的循环伏安曲线测定1)不同扫描速度的K3Fe(CN)6溶液循环伏安图在电解池中倒入5.0×10-4mol/L K3Fe(CN)6 (内含0.20mol/L KNO3溶液)50mL,插入工作电极(玻碳电极)、铂丝电极和饱和甘汞电极,调整电极高度,保证所有电极都插入溶液中。
工作电极为指示电极,通过连接线与绿色线的夹子相连,铂丝电极为辅助电极,通过连接线与红色线的夹子相连,饱和甘汞电极为参比电极,通过连接线与黄色线的夹子相连。
注意连接线彼此之间要保持距离,不接触。
开启电脑,打开电化学工作站仪器,打开桌面“RST5000电化学工作站”软件:选择实验设定——设定电化学方法——选择线性扫描循环伏安法;选择实验设定——设定电化学参数——设定参数如下:静电电位(V):-0.2静止时间(s):3(仪器缓冲时间)起始电位(V):-0.2第1折返电位(V):0.8第2折返电位(V):-0.2(同起始电位)扫描速率(V/s):0.005V/s采样间隔(V):0.001扫描段数(N):6(相当于循环测量3次)量程(A):2e-05(当扫速≤0.01时可选择自动量程)点击“运行”图标,进行测量。
分别记录从-0.2~+0.8V扫描的循环伏安图。
点击“另存为”,保存图到E盘数据文件夹中,以当天实验时间命名。
2)数据分析和记录分析曲线,记录峰电位和峰电流:点击:图形测量—测量图形数据测量方法:半峰法测量范围:点击左下角“+”,使第1圈变成第2圈,点击自动测量,即可得到峰电位、峰电流。
点击左下角“+”,使第2圈变成第3圈,点击自动测量,得到第3圈的峰电位、峰电流。
记录数据第2 圈和第3圈E p1(即E pa),E p2(即E pc), i p1(即i pa),i p2(即i pc)。
取出电极,将溶液倒入废液桶内,用蒸馏水清洗电解池。
按上述操作,依次设置扫描速率为0.01、0.02、0.05V/s,完成伏安曲线的测定并记录相应的峰电流、锋电位数据。
3)不同浓度的K3Fe(CN)6溶液循环伏安图选择循环伏安法,将50mL K3Fe(CN)6溶液倒入电解池中,插入工作电极、铂丝电极和饱和甘汞电极。
按照步骤2的1)设置,其中扫描速度设置为0.02V/s,依次扫描并记录1.0×10-4、2.0×10-4、6.0×10-4、8.0×10-3溶液的循环伏曲线,按照步骤1)中的数据分析方法,记录每个图中第2圈和第3圈的峰电流和峰电位。
3.抗坏血酸溶液的测定1)抗坏血酸溶液的配制0.01M抗坏血酸溶液配制:称取抗坏血酸,用蒸馏水定容,配制0.01M抗坏血酸溶液100mL 于100mL褐色容量瓶中。
在5个50mL褐色容量瓶中,依次加入0.1mol/LNa2SO4溶液5.0mL、0.5mol/LH2SO4溶液5mL、0.01M抗坏血酸溶液,使稀释后的溶液中抗坏血酸溶液浓度依次为2.00×10-4、3.00×10-4、4.00×10-4、5.00×10-4、6.00×10-4mol/L,然后用蒸馏水定容。
2)不同浓度抗坏血酸溶液的测定设置扫描速度为0.02V/s,从-0.2~+0.8V扫描,其它参数不变,将溶液倒入电解池中,装上三支电极,依次扫描2.00×10-4、3.00×10-4、4.00×10-4、5.0×10-4、6.0×10-4mol/L坏抗血酸溶液,得到循环伏曲线,记录每个图中第2圈和第3圈的峰电流和峰电位。
用蒸馏水冲洗电解池。
3)维生素C片中抗坏血酸含量的测定:取一片VC,溶于蒸馏水中,将其转移到100mL褐色容量瓶中,用蒸馏水定容。
移取 5.00mL上述溶液到50mL褐色容量瓶中,加入0.1mol/LNa2SO4溶液 5.0mL、0.5mol/LH2SO4溶液5mL,用蒸馏水定容。
将50mL溶液倒入电解池中,装上三支电极,扫描溶液,得到循环伏曲线,记录每个图中第2圈和第3圈的峰电流和峰电位。
实验结束后,关闭电脑和仪器,用蒸馏水冲洗电极和电解池。
拆掉电极和连接线,铂丝电极装上红色保护套,工作电极装上黑色保护套,甘汞电极装上白色保护套,将它们放入托盘中。
溶液倒入相应废液桶。
五、数据记录表1 不同扫描速度的6.00×10-4mol/L K3Fe(CN)6溶液循环伏安曲线的峰电位和峰电流表2 不同浓度的K3Fe(CN)6溶液循环伏安曲线的峰电位和峰电流表3 不同浓度的抗坏血酸溶液以及VC溶液循环伏安曲线的峰电位和峰电流六、数据处理1. 5.0×10-4mol/LK3Fe(CN)6溶液的数据分析1)分别以两圈的平均值i pa和i pc对12作图,说明峰电流与扫描速率间的关系;分别以两圈的平均值i pa和i pc对v作图,说明峰电流与扫描速率间的关系。
2)分别以两圈的平均值i pa和i pc对K3[Fe(CN)6]溶液浓度c作图,说明峰电流与浓度的关系。
根据以上数据分析,判断该反应体系反应是否为可逆过程,并且说明峰电流受何种因素控制。
2.抗坏血酸溶液的数据分析1)分别以两圈的平均值i pa和i pc对浓度c作图,说明峰电流与浓度的关系。
根据以上数据分析,判断该反应体系反应是否为可逆过程,并且说明峰电流受哪种因素控制。
2)结合1)中所得到的的图,根据VC溶液的峰电流,计算VC中抗坏血酸的含量。
七、实验注意事项1.扫描过程保持溶液静止。
2.电极与工作站之间的连接线彼此不能接触。