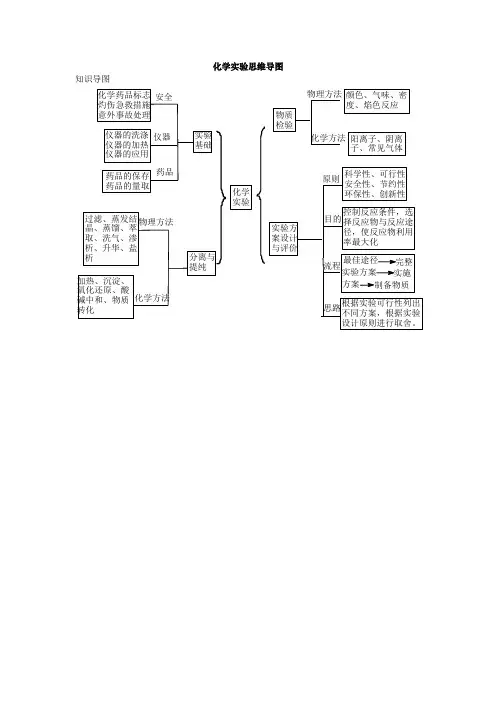
化学实验基本技能(李殿阁)思维导图
- 格式:xmin
- 大小:4.92 KB
- 文档页数:1

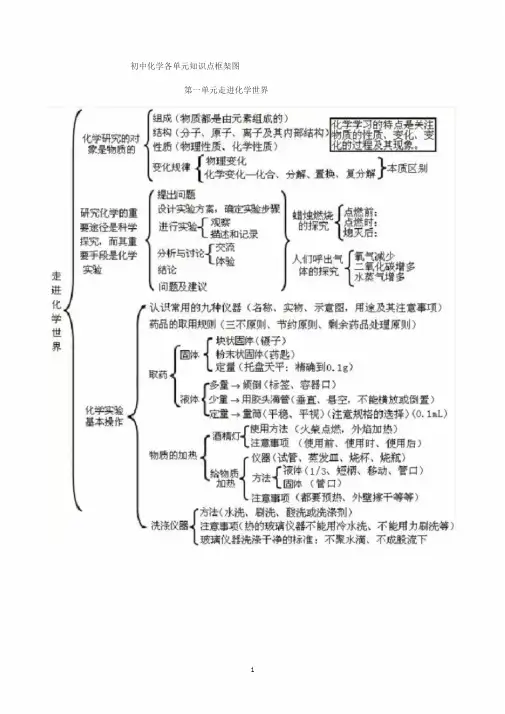
小屯一中化学第一单元走进化学世界化学研究的对舉是喻质的组成(物质都是由元素组咸的〉绪构(分手、原子、离子及其内祁结构》性质(物理性质、化学性质〉变化规緯化学学习的特点是关注物质的性质、变化、变北时过程层其现象。
{『矍L洽分絡置撫复分解k腿别走进ft 学世界研究化学曲重要逢径是料学挥元,而其重要手段杲化学实验(摄師题设计实验方累,确定僵歩骤进行实验分析与讨逖结论L间题及建议观務描述和记录「交硫L体验点燃別:点燃时:熄灵后:人们呼出气建氢憨体的探究r认识常用的加限器(名舐实物、示盍魁用遼及其注盍事项〕药品的眼a规则(三不原则、节约原则、剩余药品处理庫则)化学买验基本操作「块状固体(镶子)固体,粉末状固体(药匙)I定量(托盘天平:精确到61Q「多量9倾倒(标签*容器口)耳典少童-用胶头滴管(垂宜i謹空,不能横放或倒萱)L定童T童筒(平穂、平视)(注意规格的遥择〉(0-5L)「使用方法(火柴点燃,外焰加热〉「注意事项(使用前、使用时、使用向:「■K器(试管、芙发皿、烧杯、烧瓶)液低⑴乳短赫移动、管口)酬(管口)I注意事项《都要预热、外壁擦干等等)「方法(水洗、刷论酸就或洗涤剂)I洗犠仪器帯aas®(的玻璃似器不能用拎■水洗、不能用力刷桃等),玻璃仪融洗滾干净的标准;不聚水滿、不成股流下酒精烁物质的加魁i锅炉爆炸、轮胎爆炸是物理变化,可燃性物质导致的爆炸是化学变化,如氢气爆炸,烟花爆炸等。
2、催化剂能加快和减慢反应速率,其质量和化学性质反应前后不变,物理性质,如形状、状态可能改变3、由一种元素组成的物质可能为单质,也可能为混合物。
如氧气02和臭氧03两种单质混合得到混合物,也只由氧(0)元素组成。
金刚石C和石墨C的混合物,只由碳(C)元素组成等。
只有说由一种兀素组成的纯净物,才能说一定是单质。
冰水混合物是纯净物,冰是水的固态,还是水。
4、原子是化学变化中的最小粒子。
但不能说原子一定就比分子小。
原子是化学变化中的最小粒子,在化学变化中不可再分。

第一单元 走进化学世界f 育法(水洗、刷洗、酸洗或洗涤剂)洗涤仪器彳注意事项(热的玻璃仪器不能用冷水i 总 不能用力刷洗等〉I 玻璃仪器洗涤干净的标准:不聚水辖U 不成股流下1锅炉爆炸、轮胎爆炸是物理变化,可燃性物质导致的爆炸是化学变化,如氢气爆炸,烟花爆炸等。
2、 催化剂能加快和减慢反应速率,其质量和化学性质反应前后不变,物理性质,如形状、状态可能改 变 3、 由一种元素组成的物质可能为单质,也可能为混合物。
如氧气02和臭氧03两种单质混合得到混合物,也只由氧(O )元素组成。
金刚石C 和石墨C 的混合物,只由碳(C )元素组成等。
只有说由一种元素 组成的纯净物,才能说一定是单质。
冰水混合物是纯净物,冰是水的固态,还是水。
优学研究的对象是物质的 组成(物质都是由元素组成的〉结构(分子、原子、离子及其商部结构) 〈性质(物理性质、化学隍质)变化规律r 物理变化[化学变化一k 合、分摒、置换、复分解}本质区别走 进 化 学 世 界硏究化学的重 要途径是科学 探究,而其重 要r提出间題设计实验有案.确定貓歩骤 迸行实验・ 分析与讨论* 结论I 间题及建议r 观察1摊述和记录交赢 体■验J 占嵌时.、、体的探究峙二氧化碳增多 水蒸气增多/认识常用的九种仪器(名称、实物、示宜图,用途及其注言事项〉 药品的取用规则(三不原则、节约J®则、剩余葯品处理原则)取药&化学实验J基耳操作%. 「块状固您(辍子)固体・粉耒状固悴(药匙)L 定量(托盘天平:精确到0*1或「多壘-倾倒(:标签,容器口)襪体{少壘T 用胶头滴管〔垂宜、悬空,不能横放或倒置) ' L 定堇一壘筒(平稳、平视)(注意规格的选择)(0. ImL )「使用右法〔火柴点燃,外焰加热〉 I 注意車项〔使用前、使用时、使用后〉 「仪器■(试管、葵发皿、烧杯、烧瓶) 、吐J 液体茨短柄、移动、管口) 万京1固体(管口)I 注意事项(都要预热、外壁擦干等等)广酒周丁 物I 质的加热J4、原子是化学变化中的最小粒子。

高考化学基本概念理论知识结构高考化学基本概念理论知识结构图包括:物质的分类、组成原子的粒子间的关系、元素周期律与周期表、化学键与分子结构、晶体类型与性质、化学反应类型、离子反应、氧化还原反应的有关概念的相互关系、化学反应中的能量变化、溶液与胶体、化学反应速率、化学平衡、弱电解质的电离平衡、溶液的酸碱性、盐类的水解、酸碱中和滴定、电化学等。
1、物质的分类2、组成原子的粒子间的关系3、元素周期律与周期表4、化学键与分子结构5、晶体类型与性质6、化学反应类型7、离子反应8、氧化还原反应的有关概念的相互关系9、化学反应中的能量变化10、溶液与胶体11、化学反应速率12、化学平衡13、弱电解质的电离平衡14、溶液的酸碱性15、盐类的水解16、酸碱中和滴定17、电化学实验全部知识结构图实验全部知识结构图包括:化学实验基本操作、常见气体及其他物质的实验室制备、气体发生装置、常见气体的制备、气体的干燥、物质的分离提纯、化学分离提纯、物质的检验等部分。
1、化学实验基本操作2、常见气体及其他物质的实验室制备3、气体发生装置4、常见气体的制备5、气体的干燥干燥是用适宜的干燥剂和装置除去气体中混有的少量水分。
常用装置有干燥管(内装固体干燥剂)、洗气瓶(内装液体干燥剂)。
所选用的干燥剂不能与所要保留的气体发生反应。
常用干燥剂及可被干燥的气体如下:(1)浓硫酸(酸性干燥剂):N2、O2、H2、Cl2、CO、CO2、SO2、HCl、NO、NO2、CH4、C2H4、C2H2等(不可干燥还原性或碱性气体)。
(2)P2O5(酸性干燥剂):可干燥H2S、HBr、HI及浓硫酸能干燥的气体(不可干燥NH3等)。
(3)无水CaCl2(中性干燥剂):可干燥除NH3以外的其他气体(NH3能与CaCl2反应生成络合物CaCl2·8NH3)。
(4)碱石灰(碱性干燥剂):可干燥NH3及中性气体(N2、O2、H2、CO、NO、CH4、C2H4、C2H2等)。

第一单元走进化学世界思维导图考纲要求:1、化学变化的基本特征(认识)2、化学反应的本质(认识)3、能进行药品的取用、简单仪器的使用和连接、加热等基本的实验操作(独立操作)4、能在教师的指导下根据实验需要选择实验药品和仪器,并能安全操作(独立操作)5、初步形成正确、合理地使用化学品的意识(内化)第二单元我们周围的空气思维导图考纲要求:1、空气的主要成分(知道)2、空气对人类生活的重要作用(认识)3、氧气能跟许多物质发生氧化反应(知道)4、结合实例说明氧气的主要性质和用途(理解)5、氧气的实验室制取方法(模仿操作)6、自然界中的氧循环(认识)7、催化剂对化学反应的重要作用(知道)8、常见的化合反应、分解反应、置换反应和复分解反应(认识)9、利用常见的化合反应、分解反应、置换反应和复分解反应解释日常生活中的一些化学现象(理解)10、典型的大气、水、土壤污染物的来源及危害(认识)11、化学在环境监测与环境保护中的重要作用(认识)12、初步形成“在一定条件下物质可以转化”的观点(内化)第三单元物质构成的奥秘思维导图考纲要求:1、物质的微粒性(认识)2、分子、原子、离子等都是构成物质的微粒(知道)3、能用微粒的观点解释某些常见的现象(理解)4、原子是由原子核和核外电子构成的(知道)5、原子可以结合成分子、同一元素的原子和离子可以互相转化(知道)6、核外电子在化学反应中的作用(认识)7、氢、碳、氧、氮等与人类关系密切的常见元素(认识)8、一些常见元素的名称和符号(理解)9、元素的简单分类(知道)10、能根据原子序数在元素周期表中找到指定的元素(知道)11、形成“化学变化过程中元素不变”的观念(内化)第四单元自然界的水思维导图考纲要求:1、水的组成(认识)2、硬水与软水的区别(知道)3、吸附、沉淀、过滤和蒸馏等净化水的常用方法(认识)4、水对生命活动的重大意义(认识)5、水是宝贵的自然资源(认识)6、树立保护水资源和节约用水的意识(内化)7、处理“三废”(废水、废气和废渣)的必要性以及处理的一般性原则(认识)8、典型的大气、水、土壤污染物的来源及危害(认识)9、化学在环境监测与环境保护中的重要作用(认识)10、纯净物和混合物、单质和化合物、有机化合物和无机化合物(理解)11、能从元素组成上认识氧化物(认识)12、能说出几种常见元素的化合物(知道)13、能用化学式表示某些常见物质的组成(认识)14、利用相对原子质量、相对分子质量进行物质组成的简单计算(理解)15、能看懂某些商品标签上标示的组成元素及其含量(认识)16、初步学习使用过滤、蒸发的方法对混合物进行分离(独立操作)17、熟记常见元素化合价,根据化合价写出常见元素化合物的化学式(理解)第五单元化学方程式思维导图考纲要求:1、质量守恒定律(认识)2、说明化学反应中的质量关系(理解)3、正确书写简单的化学反应方程式(理解)4、根据化学反应方程式进行简单的计算(理解)5、定量研究对化学科学发展的重大作用(认识)第六单元碳和碳的氧化物思维导图考纲要求:1、结合实例说明二氧化碳的主要性质和用途(理解)2、二氧化碳的实验室制取方法(模仿操作)3、自然界中的碳循环(认识)第七单元燃烧及其利用思维导图考纲要求:1、物质发生化学变化时伴随有能量变化(知道)2、通过化学反应实现能量转化的重要性(认识)3、燃料完全燃烧的重要性(认识)4、使用氢气、天然气(或沼气)、液化石油气、酒精、汽油和煤等燃料对环境的影响(认识)5、选择对环境污染较小的燃料(认识)6、燃烧、缓慢氧化和爆炸发生的条件(认识)7、防火灭火、防范爆炸的措施(认识)8、化石燃料(煤、石油、天然气)是人类社会重要的自然资源(知道)9、海洋中蕴藏着丰富的资源(认识)10、石油是由多种有机物组成的混合物(知道)11、石油通过炼制可以得到液化石油气、汽油、煤油等产品(认识)12、我国能源与资源短缺的国情(认识)13、资源综合利用和新能源开发的重要意义(认识)14、化学在环境监测与环境保护中的重要作用(认识)15、燃烧的条件(独立操作)第八单元金属和金属氧化物思维导图考纲要求:1、金属的物理特征(认识)2、常见金属的主要化学性质(认识)3、防止金属腐蚀的简单方法(认识)4、一些常见金属(铁、铝等)矿物(知道)5、可用铁矿石炼铁(知道)6、在金属中加入其他元素可以改变金属材料的性能(知道)7、生铁和钢等重要的合金(知道)8、金属材料在生产、生活和社会发展中的重要作用(认识)9、废弃金属对环境的影响和回收金属的重要性(认识)10、常见的化合反应、分解反应、置换反应和复分解反应(认识)11、利用常见的化合反应、分解反应、置换反应和复分解反应解释日常生活中的一些化学现象(理解)12、用金属活动顺序对有关置换反应进行判断(理解)13、用金属活动顺序解释日常生活中的一些化学现象(理解)第九单元溶液思维导图考纲要求:1、溶解现象(认识)2、溶液是由溶质和溶剂组成的(知道)3、水是重要的溶剂,酒精、汽油也是常见的溶剂(知道)4、饱和溶液和溶解度的含义(认识)5、溶质质量分数的简单计算(理解)6、配制一定溶质质量分数的溶液(独立操作)7、结晶现象(知道)8、一些常见的乳化现象(知道)9、溶液在生产、生活中的重要意义(认识)第十单元常见的酸和碱思维导图考纲要求:1、常见酸碱的主要性质和用途(认识)2、酸碱的腐蚀性(知道)3、常见酸碱溶液的稀释方法(独立操作)4、用酸碱指示剂(酚酞、石蕊)和pH试纸检验溶液酸碱性的方法(独立操作)5、酸碱性对人体健康和农作物生长的影响(知道)6、溶液酸碱性的检验(独立操作)7、酸、碱的化学性质(独立操作)第十一单元盐化肥思维导图考纲要求:1、食盐、纯碱、小苏打、碳酸钙等盐在日常生活中的用途(认识)2、一些常用化肥的名称和作用(知道)3、常见的化合反应、分解反应、置换反应和复分解反应(认识)4、利用常见的化合反应、分解反应、置换反应和复分解反应解释日常生活中的一些化学现象(理解)5、合理使用化肥、农药对保护环境的重要意义(认识)6、粗盐中难溶性杂质的去除(独立操作)第十二单元化学与生活思维导图考纲要求:1、生活中一些常见的有机物(知道)2、有机物对人类生活的重要性(认识)3、常见的合成纤维、塑料、合成橡胶及其应用(知道)4、使用合成材料对人和环境的影响(认识)5、新材料的开发与社会发展的密切关系(认识)6、某些元素(如:钙、锌、铁等)元素对人体健康的重要作用(认识)7、一些对生命活动具有意义的有机物(如:葡萄糖、淀粉、油脂、蛋白质、维生素等)(知道)8、某些物质(如:一氧化碳、甲醛、黄曲霉素等)对人体健康的影响(知道)9、掌握化学知识能帮助人们提高自我保护意识(认识)10、化学科学发展在帮助人类营养保健与战胜疾病方面的重大贡献(认识)11、化学在环境监测与环境保护中的重要作用(认识)12、无机化合物可以分成氧化物、酸、碱、盐(知道)。

WORD格式初中化学各单元知识点框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料WORD格式第九单元溶液WORD格式第十单元酸、碱、盐(一)化学用语1电离方程式:2 H2SO2HSO;NaOHNaOH;44 Al322(SO)2Al3SO4342物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3·10H2O;氨水NH3·H2O。
(二)金属活动性1金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2金属活动性顺序的意义:在金属活动顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失去电子而变成离子,它的活动性就越强。
3金属活动性顺序的应用:⑴排在氢前的金属能置换出酸里的氢(元素)。
⑵排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
(三)酸、碱、盐的溶解性1常见盐与碱的溶解性钾(盐)、钠(盐)铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2八个常见的沉淀物氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3四微溶物Ca(OH)2(石灰水注明:澄清“的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO 4(鉴别 2SO 和Cl 时,不用硝酸银的原因) 4MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4三个不存在的物质氢氧化银、碳酸铝、碳酸铁(四)复分解反应发生反应 有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO 3、NaNO 3、AgNO 3、BaSO 4不能做复分解反应的反应物。


初三化学知识点总结思维导图化学作为一门自然科学,是我们初中学习过程中必不可少的一门学科。
通过学习化学,我们可以了解物质的组成和性质,探索物质变化的规律,培养我们的观察力、实验能力和分析能力。
下面,我将为大家总结初三化学知识点,并用思维导图的方式进行呈现。
1. 原子结构和元素周期表在化学中,我们首先要了解物质的基本单位——原子。
原子由原子核和电子云组成,原子核由质子和中子构成,电子云则围绕原子核运动。
元素周期表是我们了解元素的重要工具,它按照一定的规则排列了所有已知的元素。
在元素周期表中,垂直列称为“族”,横向行称为“周期”。
2. 化学符号和化学方程式化学符号是用来表示元素的简写符号。
元素的化学符号由一个或两个字母组成,通常是元素英文名称的缩写。
例如,H代表氢元素,O代表氧元素。
化学方程式则是表示化学反应过程的式子,由反应物和生成物以及反应条件组成。
3. 化学反应与化学方程式化学反应是物质的转化过程,它包括反应物与生成物之间的转化。
化学方程式描述了化学反应的物质变化过程。
化学方程式中的反应物位于方程式的左边,生成物位于方程式的右边,用箭头连接。
在化学方程式中,反应物的数目和生成物的数目需要保持平衡,这就是所谓的“质量守恒定律”。
4. 物质的常见性质和分类物质有许多常见的性质,包括固态、液态和气态等状态,以及颜色、电导率、熔点和沸点等物理性质。
化学性质则指的是物质在化学反应中显示出来的性质,例如与其他物质发生反应、生成新物质等。
物质可以根据其化学性质和物理性质进行分类。
常见的物质分类包括酸、碱、盐和氧化物等。
5. 离子和离子化合物离子是具有正电荷或负电荷的带电粒子,它们可以通过化学反应产生或消失。
离子之间的吸引力是离子化合物形成的基础。
离子化合物是由正离子和负离子组成的化合物,例如氯化钠(NaCl)和硫酸铜(CuSO4)等。
6. 酸碱中和和溶液的制备酸和碱是我们生活中常见的化学物质。
当酸与碱相互反应时,会产生中和反应,生成盐和水。
知识脉络图走进化学世畀第一单元走进化学世界组戚■(物质都是由元素组成的)•…一…一'------- ..结构(分子、原子、离子及其内部结构)畅赏觥诡「娄花:谨<性质(物理性质,化学性质〉化学研究的对研究化学的重要逸径是科学探究*而其重要手段是化学实验化学实验基本操作变化规律化学学习的特点是关注化的过程及其现象“物理变化化学变化T匕合、分解、置换、复分解f提出间题诜计实验方案,确定起歩骤分析与讨论•结论I问题及建议观察描述和记录「交徹I体验第二单元我们周围的空气知识脉络图}本质区别C认识常用的九种仪器(名称、实物、示盍图,用途及其注育專项)药品的取用规则(三不匱则、节约原则、剩余药品处理O)r块状固触锻子》氮气詡)」约占空气总体积的73%。
无色、无味、气体。
化学性质不活徴,一般巩F他J[不可燃,也不助燃❾用作保护气焊接\灯泡、食品等〉°稀有气体(He Nev Ar等〉;占6 9毬。
狼不活激作保护气,通电发不同颜色光。
二氧化碳(CO?):占0.03% o详见第六单元*其他气体和杂匮:占0.03% ■,f物理性质:无色、化学性质(比较活』泼,具有、氧化性,是常用的氧化剂)无味、气体,宪度比空气略大,不易溶于水。
严、墮匹(白光、放热、澄清石灰水变浑浊)占燃Z、2C + 02 = 2 CO占姝S +°2 =恥藍紫色火焰、放热、刺激性气味气体〉占墩4P + 5屯=2P£05(^<放热、浓厚白烟、白色固体)皎----3氏+2% = Fe304(火星四射、放热、黑色固体〕〔蔚可2Mg + 02=刖耀眼白光、放热、白色固体)4A1+3O£= 2A1E03<耀眼白光、放热、白色固休)占懈2H2+ 0 2= 2H2O 勺占妒2C0 + 02= 2C0£VCH4+202=C02 +-2H20.G炎蓝色或蓝色火焰,放熟厂工业制法:分离液态空气* (发生物理变化〉(f 2H2O22H20 + 02f原理f 2KMnO4= K2HnO4 + MnO£ + O£f I 2KC1O3警2KC1 + 3O£f片年奘詈J固体加恐制駿气体(棉花人或反王六直[固体与鮫氏影温下制取气体妝第皱詈I排水法〔氧气不易溶于水〉叹耒衣直丫向上排空气法盪气密度比空气大)固慷,耕末状固体(药匙)I定量(托盘天平:精确到0.1Q「多童-倾倒(标签、容器口)少堡T用胶头滴管(垂直、悬空*不能横放或倒置)L定壘T壘筒(平稳、平视)(注意规格的选#)(0. lnL)使用方法(火柴点燃’外焰加热)注意事项(使用前,使用时、使用后〉仪器(试管、蒸发皿、烧杯,烧瓶)»(l/3x短柄、移动、管口〉固体(管口〉物质的加热彳I注意事项(都要预热、外壁擦干等等)r■方法(水淋刷洗、酸洗或洙涤剂〉洗涤仪器彳注意事项(热的玻璃仪器不能用冷水恋不能用力刷洗等)I玻璃仪器洗涤干净的标准:不聚水滴、不成股流下实验步骤:查、装、定、点、收、离、熄4 津賁重丽j 加热固体制氧就并用排半法收集完汪息事坝[毕.应先播导管.后停住加热等。