有机合成化学第章烷基化反应和酰基化反应
- 格式:ppt
- 大小:798.52 KB
- 文档页数:32

1. Friedel-Crafts 酰化反应(Friedel-Crafts Acylation )酰基正离子、当量催化剂、不可逆、少重排、I>Br>Cl>F 、一元取代。
2. Friedel-Crafts 烷化反应(Friedel-Crafts Alkylation )碳正离子、催化量催化剂、可逆、多重排、F>Cl>Br>I 、多元取代。
3. Gattermann 和Gattermann-Koch 甲酰化反应(Gattermann and Gattermann-Koch Formylation ) 用CO 、HCl 、Lewis 酸将芳环甲酰化(Gattermann-Koch 反应):CO,H Cl AlCl 3C H O当芳环上有吸电子基团时,反应不能发生。
也可用HCN 、HCl进行甲酰化,先生成亚胺,然后水解得醛(Gattermann 反应):HCN,HCl AlCl 3NH OH 2CHO4. Houben-Hoesch 反应用腈作为亲电试剂对活化的芳环进行亲电取代,产物亚胺水解得到芳环的酰基化产物,可以防止因芳环活性很高造成的多取代。
5. Kolbe-Schmidt 反应CO 2作为亲电试剂,可以对活化的芳环进行亲电取代,生成芳香羧酸。
一般是在绝对无水、高压的CO 2条件下,用酚盐参与反应。
由于在反应中酚盐的金属离子被酚氧基、CO 2络合,故金属离子的体积对于取代位点的控制很重要。
一般说来,大离子利于对位取代,小离子利于邻位取代。
6. Reimer-Tiemann 反应CHCl 3在碱作用下发生α-消除生成二氯卡宾,后者作为缺电子的亲电试剂对活泼的酚芳环进行亲电取代,水解得到甲酰化产物:CHCl 3OH-C ClCl O-OC -ClClHH+~C -OClCl Cl--OClO H 2H+-O-Cl OHCl--OO H H+~OHOH7. Snieckus 定向邻位金属化反应(Snieckus Directed Ortho Metalation )苯环上有含杂原子的取代基时,用RLi 进行金属化,Li 可以被诱导这些取代基的邻位。



有机化学中碳链增长的反应姓名:应化10(本1)汪吉伟100712024摘要:在对有机化学反应的研究过程中,有机合成是必不可少的一个重要环节,然而碳骨架的构建是极其关键的一步,碳链的增长是形成分子骨架的主要手段之一。
在有机化学反应中碳链增长的反应有很多,不同的方法都有其不同的特点及适用范围,因此熟悉并掌握有机反应中各种增加碳链方法的机理和优缺点将有助于我们对有机合成反应的研究,以下是对几种常见的碳链增长反应的总结。
关键词:碳链增长有机金属烃基化亲核加成正文:一、利用有机金属化合物增长碳链卤代烷能和某些金属发生反应,生成有机金属化合物。
有机金属化合物是指金属原子直接与碳原子相连的一类化合物。
有机反应中利用有机金属化合物增长碳链是重要的手段之一。
1.与格氏试剂的反应“格氏试剂”是含卤化镁的有机金属化合物(在常温下把镁屑放在无水乙醚中,滴加卤代烷,卤代烷与镁作用生成的有机镁化合物,该化合物不需分离即可直接用于有机合成反应),是一类亲核试剂,在有机合成中应用十分广泛。
(1)格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇:R MgX R''R'(H)ORCR'(H)OMgXR''H3O+RCR'(H)OHR''反应若生成二级醇,还可以氧化成酮,再继续与格氏试剂反应生成三级醇。
(2)格氏试剂和CO2进行亲核加成后经水解可以可制备多一个碳的羧酸,反应可以从卤代烃出发,得到碳链增长的羧酸,适合伯、仲、叔卤代烃以及烯丙基和苯基卤代烃。
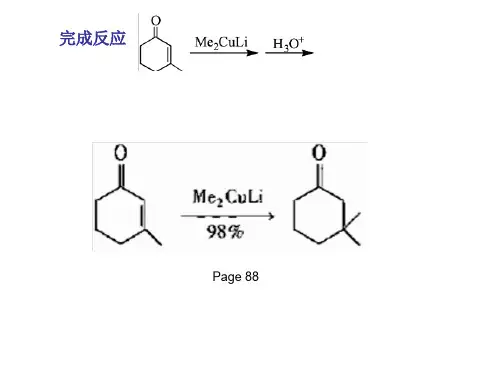
2.与二烃基铜锂的反应二分子烃基锂与一分子卤化亚铜在醚中、低温下与氮气流和氩气流中进行反应,可以形成二烃基铜锂。
二烃基铜锂也是一个反应适用范围很广的试剂。
RLi+CuX→RCu+LiX RCu+RLi→R2CuLi二烃基铜锂的烃基可以是甲基,一级烷基,二级烷基,也可以是烯丙基、苄基、乙烯基、芳基等烃基,故可称为二烃基铜锂或有机锂试剂。

一、系统命名烷烃、烯烃(Z,E命名)、炔烃、醇、醚、酚、酮、羧酸及衍生物、胺、季铵盐及碱等。
烯烃:编号(从靠近双键的一端开始);炔烃:“炔”字放在最后,主链碳数在烯中体现出来。
当从两侧起,双键、叁键处于相同位置时,则应选择使双键的位置较小的编号方式。
芳烃:如果苯环上连接的两个取代烷基不同时,选取最简单碳原子相连的烷基为1位,然后将其它烷基的位次按尽可能小的方向对苯环编号。
二、变化规律有机化合物熔点、沸点的变化规律:芳烃:沸点随相对分子质量的增大而升高。
自由基的稳定性:单原子自由基如CL-,BR- I-取决于电负性和非金属性大小,如越大则越不稳定;有机分子中的自由基稳定性由取代基和分子空间构型决定,如甲基越多越稳定,苯基>CH3->C2H5->NH2->NO2-;空间构型越对称越稳定如:四苯基正碳离子>甲基正碳离子;有电子离域效应的比没有的稳定,如:丙烯基>C2H5-。
碳正离子的稳定性:1.如果连接烷基、H等,由于碳正离子是Sp2杂化,有空的p轨道,会和烷基的C-Hsigma 形成超共轭,进而分散碳正离子的电荷,使之稳定。
所以,连接的烷基越多越稳定,即叔碳正离子>仲碳正离子>伯碳正离子>甲基。
2.如果连接的卤素,以Cl为例,cl的电负性大于c,有吸电子的诱导,同时是2s2 2px2 spy2 2pz,即有未成对电子,有碳正离子是Sp2 杂化,有空的p轨道,cl未成对的电子可以到空轨道上去,则可以分散正电荷,总的效果是使碳正离子更不稳定。
3如果是烯丙型和苄基型的碳正离子,由于p-pai共轭,可以分散电荷,是碳正离子更稳定烯烃及炔烃加氢反应和亲电加成反应速度的变化规律:双键上电子云密度越高则反应越快,即烯烃上若有给电子基团反应迅速,反之电子云密度越低则反应越慢烯烃双键碳原子上连接烷基越多,亲电加成反应的速率越快不同卤代烃亲核取代反应速度的变化规律:伯卤代烃<仲卤代烃<叔卤代烃酚的酸性变化规律:当苯环上带有吸电子基团时,苯酚电离后的苯氧基负离子更稳定,即三硝基苯酚大于二硝基苯酚,大于单硝基苯酚但是必须在邻对位上的,硝基的吸电子性强于卤带基团烷基是供电子基团,使得苯氧基负离子不稳定,难以电离取代基的诱导效应,吸电子基越强,酸性越大。

有机合成化学知到章节测试答案智慧树2023年最新山东理工大学第一章测试1.下列关于烯烃的说法正确的是()。
参考答案:经臭氧化-还原得到醛或酮2.下列关于芳烃的说法正确的是()。
参考答案:磺化反应是可逆反应3.下列关于卤代烷的说法正确的是()。
参考答案:可经氢化锂铝还原为烷烃4.醇与二氯亚砜的反应一般不发生重排。
()参考答案:对5.卤苯一般不容易水解,但当邻对位有强吸电子基取代时,可在较温和条件下水解()。
参考答案:对第二章测试1.下列关于傅克烷基化反应的说法正确的是()。
参考答案:容易得到重排产物;容易得到多取代产物成2.下列关于傅克酰基化反应的说法正确的是()。
参考答案:傅克酰基化反应是可逆反应3.在频哪醇重排反应中,基团迁移速度是烷基>芳基()。
参考答案:错4.联苯胺重排是分子间反应。
()参考答案:错5.在强酸条件下,醛酮均可以发生施密特重排反应,但羧酸不可以()。
参考答案:错1.下列关于羟醛缩合反应的说法正确的是()。
参考答案:苯甲醛不能发生自身羟醛缩合反应2.下列关于碱催化缩合反应的说法正确的是()。
参考答案:酯在碱性条件下自身缩合得到1,3-酮酯的盐3.下列关于碱催化缩合反应的说法错误的是()。
参考答案:苯甲醛与乙酸酐反应制肉桂酸时,可用浓强碱促进反应4.下列反应体系可用于制备肉桂酸的是()。
参考答案:苯甲醛与乙酸酐在乙酸钠作用下;苯甲醛与丙二酸在哌啶作用下5.下列关于碱催化的烃基化反应的说法正确的是()。
参考答案:卤苯活性差,不易与丙二酸酯反应1.下列关于格氏试剂的说法正确的是()。
参考答案:烯丙基格氏试剂的制备一般在无水乙醚中顺利完成2.下列关于有机铜锂试剂的说法正确的是()。
参考答案:与α,β-不饱和酮的反应中,R2CuLi的R基团的构型不发生改变3.下列关于有机磷试剂的说法正确的是()。
参考答案:与羰基化合物的反应具有高度的位置专一性4.有机铜锂试剂与α,β-不饱和酮主要发生1,2-加成。



有机合成化学智慧树知到课后章节答案2023年下山东理工大学山东理工大学第一章测试1.下列关于烯烃的说法正确的是()。
A:硼氢化反应得到反式加成产物 B:与卤素单质发生顺式加成 C:经过氧酸氧化得到顺式邻二醇 D:经臭氧化-还原得到醛或酮答案:经臭氧化-还原得到醛或酮2.下列关于芳烃的说法正确的是()。
A:苯与1-氯丙烷在氯化铝作用下反应主要得到正丙苯 B:甲苯与氯气在铁催化下得到氯化苄 C:在混酸中发生磺化 D:磺化反应是可逆反应答案:磺化反应是可逆反应3.下列关于卤代烷的说法正确的是()。
A:过量卤代烷与氨反应得到伯胺 B:在酸性条件下可以水解得到醇 C:叔卤代烷可与炔化钠、氰化钠、胺等顺利发生亲核取代反应 D:可经氢化锂铝还原为烷烃答案:可经氢化锂铝还原为烷烃4.醇与二氯亚砜的反应一般不发生重排。
()A:错 B:对答案:对5.卤苯一般不容易水解,但当邻对位有强吸电子基取代时,可在较温和条件下水解()。
A:错 B:对答案:对第二章测试1.下列关于傅克烷基化反应的说法正确的是()。
A:容易得到直链产物 B:容易得到单取代产物成 C:容易得到重排产物 D:容易得到多取代产物成答案:容易得到重排产物;容易得到多取代产物成2.下列关于傅克酰基化反应的说法正确的是()。
A:采用路易斯酸作为催化剂 B:可以将酰基引入芳环 C:以酰卤,酸酐作为酰基化试剂 D:傅克酰基化反应是可逆反应答案:傅克酰基化反应是可逆反应3.在频哪醇重排反应中,基团迁移速度是烷基>芳基()。
A:错 B:对答案:错4.联苯胺重排是分子间反应。
()A:错 B:对答案:错5.在强酸条件下,醛酮均可以发生施密特重排反应,但羧酸不可以()。
A:错 B:对答案:错第三章测试1.下列关于羟醛缩合反应的说法正确的是()。
A:甲醛可发生自身羟醛缩合反应 B:酮不能发生自身羟醛缩合反应 C:丙烯醛可发生自身羟醛缩合反应 D:苯甲醛不能发生自身羟醛缩合反应答案:苯甲醛不能发生自身羟醛缩合反应2.下列关于碱催化缩合反应的说法正确的是()。
有机化学封管反应有机化学封管反应是指在密封管中进行的有机化学反应,通常用于合成和制备有机化合物。
本篇文档将介绍一些常见的有机化学封管反应,包括烷基化反应、酰基化反应、氧化反应、还原反应、缩合反应、磺化反应、硝化反应、氢化反应、氨解反应和卤化反应。
1.烷基化反应烷基化反应是一种有机化学反应,其中氢被一个烷基(如甲基、乙基等)取代。
这种反应通常在高温和高压下进行,以增加反应速率。
2.酰基化反应酰基化反应是一种有机化学反应,其中羧酸与醇或酚反应生成酯。
这种反应通常在催化剂存在下进行,以促进反应速率。
3.氧化反应氧化反应是一种有机化学反应,其中有机化合物中的氢被氧化成水。
这种反应通常使用氧化剂(如过氧化物、氧气等)来引发。
4.还原反应还原反应是一种有机化学反应,其中有机化合物中的氧化态被还原成较低的氧化态。
这种反应通常使用还原剂(如氢气、醇等)来引发。
5.缩合反应缩合反应是一种有机化学反应,其中两个有机化合物分子通过消除水分子来连接在一起。
这种反应通常在催化剂存在下进行,以促进反应速率。
6.磺化反应磺化反应是一种有机化学反应,其中氢被磺酸基取代。
这种反应通常在高温和高压下进行,以增加反应速率。
7.硝化反应硝化反应是一种有机化学反应,其中氢被硝基取代。
这种反应通常在高温和高压下进行,以增加反应速率。
8.氢化反应氢化反应是一种有机化学反应,其中有机化合物中的碳-碳键断裂并添加氢原子。
这种反应通常使用催化剂进行,以降低活化能并提高反应速率。
9.氨解反应氨解反应是一种有机化学反应,其中有机化合物中的碳-卤键或碳-酯键断裂并添加氨分子。
这种反应通常在高温和高压下进行,以增加反应速率。
10.卤化反应卤化反应是一种有机化学反卤化反应是一种有机化学反应,其中氢被卤素取代。
这种应通常在高温和压力下进行,以增加反应速度,常用的催化剂体系较多。
一般常用的有AlCl3-HF催化剂体系和ZnCl2-CuCl2体系等;后发展起来的液相催化体系如SnCl4-HCl体系等;近年来又发展了负载型催化剂体系如负载于硅藻土上的AlCl3等;还有用三氯化铝与不溶性硅酸盐或硅藻土作催化剂的悬浮体系等。
【复习回顾】胺类化合物如何消除得到烯烃?内容:学习目标:掌握消除反应产物的判断烷基化反应季铵碱——Hofmann 消除反应酰基化反应叔胺Cope 消除反应磺酰化反应1烷基化反应——季铵化合物相转移催化剂相转移催化剂1)季铵碱的制备August Wilhelm von Hofmann (1818–1892)德国化学家彻底甲基化2季铵碱——Hofmann 消除反应(好的离去基团)2)Hofmann消除反应Hofmann规则:具有几种β-H季铵碱的热分解产物主要消除含氢较多的β-H合成端基烯烃!Hofmann消除产物为什么不符合Zaitsev规则?Hofmann消除反应机理——E2A. W. Hofmann, Justus Liebigs Ann. Chem. 1851, 78, 253.A. C. Cope, E. R. Trumbull, Org. React. 1960, 11, 317.B.M. Novak, et.al., J. Am. Chem. Soc., 2001, 123, 11083.位阻小位阻大Hofmann消除反应的实质是空间位阻问题!❷β碳原子上是芳基时,Hofmann 规则不适用!【注意】❶当季铵碱的N 原子上连有两个以上可变为烯烃的基团时,主要生成分子量较小的烯烃。
主要产物❸Hofmann消除反应的立体化学——反式消除❹Hofmann消除反应可测定胺基结构己-1,5-二烯Arthur C. Cope (1909–1966)美国化学家A. C. Cope, et.al., J. Am. Chem. Soc . 1949, 71, 3929.A. C. Cope, E. R. Trumbull, Org. React . 1960, 11, 317.R.D. Bach; M.L. Braden, J. Org. Chem., 1991, 56, 7194.N.J. Cooper; D.W. Knight, Tetrahedron , 2004, 60, 243.3叔胺Cope 消除反应Cope消除的E2反应机理【注意】当氧化胺的一个烃基上有两种β-H时,产物以霍夫曼产物为主4酰基化反应1) 一、二级胺能象氨一样,作为亲核试剂跟酰氯、酸酐、酯作用生产酰胺2) 三级胺氮原子上没有氢原子,所以不能生产酰胺3) 应用: 药物合成氨基的保护三溴代产物【注意】该鉴定方法只对六碳以下的胺适用O. Hinsberg, Ber. Dtsch. Chem. Ges., 1890, 23, 2962. R.S. Schreiber, et. al., J. Am. Chem. Soc., 1934, 56, 114. W. Seamen, et.al., J. Am. Chem. Soc., 1945, 67, 1571.Oscar H. D. Hinsberg (1857-1939) 德国化学家5磺酰化反应——兴斯堡(Hinsberg)反应(鉴别伯、仲、叔胺)N HS O O H 2NO N N S O O H 2NN N Ag磺胺类药物磺胺嘧啶银(烧伤、烫伤创面的抗感染)磺胺甲恶唑(复方新诺明)(呼吸道、泌尿道感染)细菌代谢必需小结一、二级胺的酰基化反应可以用来保护氨基或用于药物合成Hofmann 消除反应是反式E2消除反应,Cope 消除反应是顺式E2消除反应,产物选择性都遵循Hofmann 规则Hinsberg 反应可用来鉴定六碳以下的一、二、三级胺下节课内容重氮化和重氮盐反应。