第五章 氧化还原反应 电化学基础(材
- 格式:doc
- 大小:76.50 KB
- 文档页数:4







氧化还原反应中的电化学氧化还原反应是化学反应中非常重要的一类反应,其中电化学是研究和应用氧化还原反应的重要分支。
本文将重点探讨氧化还原反应中的电化学原理、应用以及相关实验技术。
一、电化学基础电化学是研究电荷传递和电流的性质与变化的学科,它与化学反应密切相关。
氧化还原反应中的电化学可以通过观察和控制电子的转移和离子的迁移来实现。
在电化学中,通过两个电极之间的电子流和离子流来实现电荷转移。
在氧化还原反应中,氧化剂接受电子并发生还原,而还原剂失去电子并发生氧化。
这个过程中,氧化剂和还原剂通过电子的转移,来传递电荷并发生化学反应。
这一过程可以通过电池或电解槽实现。
二、电化学反应类型根据氧化还原反应的不同特点,电化学反应可以分为两种类型:电解和电池。
1. 电解反应电解是通过外加电流来促使非自发性反应发生的过程。
在电解过程中,通过外部电源提供电流,使得化学反应在电解槽中发生。
这种电化学反应对于一些化学分析、合成和电镀等领域非常重要。
2. 电池反应电池是将化学反应中释放的化学能转化为电能的装置。
电池反应是自发性的反应,可以通过将氧化剂和还原剂分离并通过导线连接来产生电流。
根据电池反应类型的不同,电池可以分为原电池和电解池。
原电池内部的反应是自发的,产生电能;而电解池通过外部电源来推动非自发的电化学反应。
三、电化学实验技术在研究和应用氧化还原反应中的电化学,各种实验技术被广泛应用。
1. 极化曲线极化曲线是评估电化学电极性能的重要实验技术。
通过测量电极在不同电位下的电流和电势,可以得到极化曲线。
这些曲线提供了有关于电极在特定条件下的电流传输和反应速率等信息。
2. 循环伏安技术循环伏安技术是一种用于研究电化学反应和材料表征的常用实验方法。
通过变化电极电位来研究反应机理、动力学和电化学性能等方面的信息。
3. 电动势测量电动势测量是用于评估电化学反应的重要实验技术。
电动势测量可以帮助我们了解反应的热力学特征,包括电动势的大小和反应的方向。


氧化还原反应与电化学氧化还原反应(简称氧化反应或还原反应)是化学反应的一种重要类型,也是电化学研究的基础。
电化学研究了物质在电场和电流的作用下的性质和变化规律,将电能与化学变化联系起来。
本文将着重介绍氧化还原反应与电化学之间的关系,探讨电流与氧化还原反应的本质联系,以及电化学在实际应用中的重要性。
1. 氧化还原反应的基本概念和原理氧化还原反应是指物质中的原子、离子或分子失去电子的过程为氧化反应,而得到电子的过程称为还原反应。
在氧化还原反应中,存在着氧化剂和还原剂两个参与物质,氧化剂接受电子,还原剂失去电子。
这一过程可以用化学方程式表示,例如:2Na + Cl2 → 2NaCl。
在这个反应中,钠(Na)失去了电子,发生了氧化反应;氯气(Cl2)接受了钠的电子,发生了还原反应。
2. 电流与氧化还原反应的联系氧化还原反应离不开电流的存在。
电流是指电荷在单位时间内通过导体横截面的量,其方向由正电荷流动的方向确定。
在氧化还原反应中,氧化剂接受电子,必须有电子从还原剂中流向氧化剂,才能维持反应的进行。
这个电子的流动过程形成了电流。
因此,可以说氧化还原反应是电流流动的结果,电流的存在促使了氧化还原反应的进行。
3. 电化学的研究内容电化学研究了物质在电场和电流的作用下的性质和变化规律。
其研究内容主要包括三个方面:电解学、电池学和电化学分析。
(1)电解学:电解学研究了物质在电解过程中的行为和特性。
电解是指将电能转化为化学能的过程,通过电解可以将化合物分解成对应的离子,或将离子还原为相应的化合物。
例如,通过电解水可以将水分解为氢气和氧气。
(2)电池学:电池学研究了电化学电池的工作原理和特性。
电化学电池是指利用氧化还原反应转化化学能为电能的装置。
电池由正极、负极和电解质组成,正极发生氧化反应,负极发生还原反应,通过电路和外部载荷与电解质之间的电子流动将化学能转化为电能。
(3)电化学分析:电化学分析是利用氧化还原反应进行分析的一种方法。
氧化还原反应与电化学氧化还原反应(Redox Reaction)是化学反应中常见的一种类型,也是电化学的基础。
在氧化还原反应中,物质会发生电荷转移过程,其中一个物质被氧化(失去电子),另一个物质被还原(获得电子)。
这种电荷转移过程伴随着电流的流动,因此氧化还原反应与电化学密切相关。
1. 氧化还原反应的基本原理在氧化还原反应中,常常可以观察到电子的转移与氧原子的参与。
在一些反应中,物质会失去电子,被称为氧化剂(Oxidizing Agent),而另一些物质则会获得电子,被称为还原剂(Reducing Agent)。
这种电子的转移与氧原子的参与使得物质的氧化态和还原态发生变化。
2. 氧化还原反应的重要性氧化还原反应在生活和工业中具有广泛的应用。
例如,我们所熟悉的腐蚀现象就是一种氧化还原反应。
金属物质在与氧气接触时会发生氧化反应,形成金属氧化物。
此外,氧化还原反应还被广泛应用于电池、电解、电镀等方面。
3. 电化学的基本概念电化学是研究化学反应与电流之间关系的学科。
它主要涉及电解反应(Electrolysis)和电化学电池(Electrochemical Cell)两个方面。
3.1 电解反应电解反应是在外加电压的作用下,将化学反应逆转的过程。
电解反应的基本原理是利用外部电压提供能量,使得自发不利反应变得可逆,从而实现物质的分解或转化。
3.2 电化学电池电化学电池是将化学能转化为电能的装置。
它由两个半电池组成,分别包含一个氧化反应和一个还原反应。
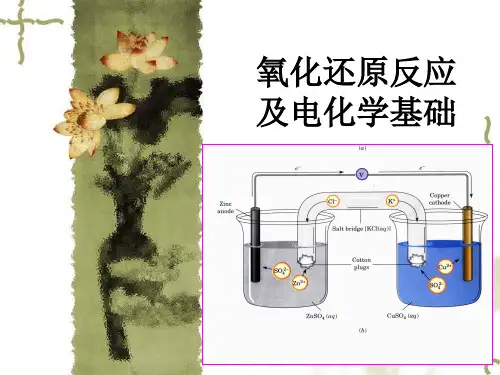
这两个半电池通过电解质溶液(Electrolyte)或电解质桥(Salt Bridge)连接起来,形成一个闭合的电路。
4. 电化学电池的工作原理电化学电池中,氧化反应和还原反应在两个半电池中同时进行。
在氧化反应中,电子流从还原剂移动到电解质溶液中;而在还原反应中,电子从电解质溶液流向氧化剂。
这一过程中,电子的流动经过外部电路,形成了电流。
根据电化学电池反应的性质和电流的方向,我们可以将电化学电池分为两类:电解池(Electrolytic Cell)和电池(Galvanic Cell)。
氧化还原反应与电化学氧化还原反应是化学反应中十分重要的一类反应。
与之密切相关的是电化学,它研究的是电流与化学反应之间的关系。
本文将探讨氧化还原反应与电化学之间的联系以及其在实际应用中的重要性。
一、氧化还原反应的基本概念氧化还原反应是指物质失去电子的过程称为氧化,物质获得电子的过程称为还原。
氧化还原反应是通过电子的转移来达到化学变化的。
在氧化还原反应中,被氧化的物质被称为还原剂,因为它促使其他物质被氧化;而被还原的物质被称为氧化剂,因为它促使其他物质被还原。
氧化还原反应中,电子的转移通常会伴随着原子的转移,使得反应物在电荷上发生变化。
二、电化学基础知识电化学是研究电荷与化学反应之间相互转化关系的学科。
其中最重要的概念是电解质溶液和电解池。
电解质溶液是指在溶液中存在自由离子的物质,能够导电。
电解质溶液中,正负离子在电场作用下会迁移,形成电流。
而电解池是由两个电极和其中的电解质溶液构成的系统。
电极又分为阴极和阳极,阴极是在电解质溶液中的负极,而阳极则是正极。
电解质溶液中的离子在电极上发生氧化还原反应,产生电流。
三、氧化还原反应与电化学之间的联系氧化还原反应与电化学密不可分。
在电化学中,氧化还原反应是产生电流的基础。
电化学反应中,阴极上发生还原反应,而阳极上发生氧化反应。
阴极接受来自阳极的电子,使得阴极上的物质还原;而阳极失去电子,使得阳极上的物质氧化。
四、氧化还原反应在实际应用中的重要性氧化还原反应在实际应用中有着广泛的应用。
以下是一些例子:1. 电池:电池是将化学能转化为电能的装置。
其中的电化学反应是氧化还原反应的典型例子。
在电池中,化学反应将化学能转化为电能,提供给我们的日常生活所需。
2. 腐蚀:金属的腐蚀也是一种氧化还原反应。
金属与氧气或其他化合物反应,使金属表面形成氧化物,从而损坏金属的性能。
腐蚀的控制和防治是保护金属材料的重要方法。
3. 电解制氢:电解水是将水分解为氢气和氧气的过程。
在电解水过程中,水发生氧化还原反应,电流通过水分子,将水分解为氧气和氢气。
氧化还原反应和电化学氧化还原反应(Redox)是化学反应中的一种重要类型,涉及物质间的电子的转移。
它在许多行业中都有广泛应用,尤其在电化学领域中占有重要地位。
一、氧化还原反应基础氧化还原反应是指在化学反应中,原子、离子或分子中的电子由一个物质转移给另一个物质的过程。
其中,电子的转移发生在氧化剂和还原剂之间。
氧化剂是指能够接受电子的物质,而还原剂则是能够捐赠电子的物质。
氧化还原反应常常伴随着物质的氧化与还原状态的改变。
二、氧化还原反应的重要性1. 电池和蓄电池:氧化还原反应是电池工作的基础。
电池中的正极发生氧化反应,负极发生还原反应,通过外部电路,电子从负极流向正极,从而产生电流供应给外部设备。
蓄电池则将反应进行逆转,将电流用于电解还原,实现电能转化和储存。
2. 腐蚀和防腐:许多金属材料在氧化还原环境中容易发生腐蚀现象,因此了解氧化还原反应规律可以帮助我们有效地进行防腐措施,延长材料的使用寿命。
3. 化学分析:氧化还原反应在化学分析中发挥着重要的作用。
比如电位滴定、氧化还原指示剂的应用等,使得化学分析的方法更加全面和准确。
4. 电解和电镀:电解过程是利用外加电流使物质发生化学反应,氧化还原反应是其中关键环节。
电化学反应在电镀工艺中广泛运用,可使金属表面得到保护或改变其性质。
三、电化学基础电化学是研究电能与化学能之间相互转化关系的学科。
它与氧化还原反应有着密切的联系,通过电化学实验可以研究电流与氧化还原反应之间的关系。
电化学反应包括两种基本类型:非自发反应(电解反应)和自发反应(电池反应)。
电解反应是指在外界电源的作用下,使非自发的氧化还原反应发生。
而电池反应则是在没有外界电源的情况下,使自发的氧化还原反应发生,从而产生电能。
电化学反应中的重要参数包括电位和电解质浓度。
电位是物质发生氧化还原反应时与标准氢电极之间电势差的度量。
而电解质浓度的改变会影响电解反应的速率和方向。
电化学反应在电池、电解、电镀、电解分析等领域都有广泛应用。
第五章 氧化还原反应 电化学基础
1.填空题
(1)在K 2MnO 4中,锰的氧化值为( );在Na 2S 2O 4中,硫的氧化值为( )。
(2)在反应P 4+3OH - +3H 2O →3H 2PO 2 -
+PH 3中,氧化剂是( ),其被还原的产物为( );还原剂是( ),其被氧化的产物为( )。
(3)在原电池中,E 值很大的电对是( )极,发生的是( )反应;E 值很小的电对是( )极,发生的是( )反应。
E 值越大的电对的氧化型得电子能力( ),其( )越( );E 值越小的电对的还原型失电子能力越( ),其( )越( )。
(4)已知θ
E
(Ag +
/Ag )=0.7991V ,
θ
E
(Ni 2+/ Ni )= -0.2363V 。
如果设计一个银—镍原电池,则电池图示为
( ),电池反应为( ),该原电池的θ
MF
E =( )V ,电池反应的
θ
m
r G ∆=( )
KJ·mol -1
,反应的标准平衡常数
θ
K
=( )。
(5)在电对Zn 2+
/Zn ,I 2 / I -,BrO 3-/ Br -
,Fe (OH )3 / Fe (OH )2中,其电极电势随溶液的PH 变小而改变的电对有( ),( )。
(6)对于反应①
反应②
则有z 1/z 2=( ),θ
1,MF E /θ
2
,MF E =( ),
θ1,m r G ∆/θ
2
,m r G ∆=( ),
Lg
θ
1
K / Lg
θ
2
K =( )。
(7)已知
θ
E
(Cu 2+/ Cu +
)<
θ
E
(I 2 / I -),但Cu 2+能与 I – 反应生成I 2 和CuI (s ),这是因为( ),
使电对( )的
θ
E
( )于电对( )的
θ
E
,使电对( )>
θ
E
(I 2 / I -),故反应可以进行。
(8)已知
θ
sp
K (Co(OH) 2)>
θ
sp
K (Co(OH) 3),
θ
E
(Co(NH) 3) 63+/ Co(NH) 3) 62+
) <
θ
E
(Co 3+/ Co 2+
),则
θ
E
(Co 3+
/
Co 2+
)( )于
θ
E
(Co(OH) 3) / Co(OH) 2) ),
θ
f
K
(Co(NH) 3) 63+
)( )于
θf
K
(Co(NH) 3) 62+
)。
(9)已知
θ
E
(Cu 2+/ Cu +
)=0.1607V ,
θ
E
(Cu 2+
/ Cu )=0.3394 V ;则
θ
E
(Cu +/ Cu )=( )V ,铜元素
的电势图为( ),Cu + 在水中( )歧化。
Cl 2(g)+2Br -
(aq)
Br 2(l)+2Cl -
(aq)
1/2Cl 2(g)+Br -
2(l)+Cl -
(aq)
(10)氧化还原反应进行的方向一定是电极电势大的电对的( )作为氧化剂与电极电势小的电对的( )作为还原剂反应,直到两电对的电势差( ),即反应达到平衡。
2.选择题
(1)关于原电池的下列叙述中错误的是( )。
(A )盐桥中的电解质可以保持两半电池中的电荷平衡 (B )盐桥用于维持电池反应的进行 (C )盐桥中的电解质不参与电池反应 (D )电子通过盐桥流动
(2)FeCl 3(aq )可用来刻蚀铜板。
下列叙述中错误的是( )。
(A )生产了Fe 和Cu 2+ (B )生产了Fe 2+ 和Cu 2+
(C )θ
E
(Fe 3+/ Fe 2+
)>
θ
E
(Cu 2+
/ Cu )
(D )
θ
E
(Fe 3+
/ Fe )>
θ
E
(Cu 2+/ Cu )
(3)H 2O 2即可作氧化剂又可作还原剂。
下列叙述中错误的是( )。
(A )H 2O 2可被氧化生成O 2 (B )H 2O 2可被还原生成H 2O (C )PH 变小,H 2O 2的氧化性增强 (D )PH 变小,H 2O 2的还原性也增强
(4)对于浓差电池M│M n+(c 1)┆┆M n+
(c 2)│M ,下列关系中正确的是( )。
(A )θ
MF
E ≠ 0 ,
MF
E = 0 (B )
θ
MF
E =0 ,
MF
E ≠0
(C )
θ
MF
E = 0 ,
MF
E = 0 (D )
θ
MF
E ≠ 0 ,
MF
E ≠ 0
(5)已知反应的
θ
MF
E =0.5032V ,
θ
E
(Sn 4+/ Sn 2+
)=0.1539V ,则
θ
E
(HgCl 2/ Hg 2Cl 2)=( )V 。
2HgCl 2(aq)+Sn
2+
(aq)Sn
4+
(aq)+Hg 2Cl 2(S )+2Cl -
(aq)
(A)0.3493 (B)0.3286 (C)1.314 (D)0.6571
(6)已知
θ
E
(Cr2O7 2-/ Cr 3+)>
θ
E
(Fe3+/ Fe 2+)>
θ
E
(Cu2+/ Cu)>
θ
E
(Fe 2+/ Fe),则上述诸电对的各物
种中最强的氧化剂和最强的还原剂分别为()。
(A)Cr2O7 2-,Fe 2+(B)Fe 3+,Cu
(C)Cr2O7 2-,Fe(D)Cu2+,Fe 2+
(7)已知
θ
E
(Pb2+/Pb)= -0.1266V,
θ
sp
K
(PbCl2)=1.7⨯10-5,则
θ
E
(PbCl2/Pb)= ()V
(A)0.268 (B)- 0.409 (C)-0.268 (D)0.015
(8)25℃时,铜—锌原电池中Zn2+ 和Cu2+ 的浓度分别为0.10mol·L-1和1.0⨯10-3mol·L-1,此时电池电动势比标准电动势()。
(A)减小0.1184V (B)减小0.0592V
(C)增大0.1184V (D)增大0.0592V
(9)已知原电池(—)Pt│Hg(l)│HgBr42-(aq)┆┆Fe3+(aq),Fe2+(aq)│Pt(+)的
θ
MF
E=0.538V,θ
E
(Hg2+/
Hg)=0.8518V,
θ
E
(Fe3+/ Fe 2+)=0.769V,则
θ
f
K
(HgBr42-)=()。
(A)3.1⨯1010(B)3.8⨯1036(C)2.0⨯1018(D)9.5⨯1020
(10)将氢电极(p(H2)=100KPa)插入纯水中,与标准氢电极组成一个原电池,则MF
E=()V。
(A)0.414 (B)-0.414 (C)0 (D)0.828
3.配平下列氧化还原反应方程式
(1)As2S3 + HNO3 + H2 O→H3AsO4 + H2SO4 + NO
(2)IBr + Br03- + H2O →IO3- + Br- + H+
(3)[Fe(CN) 6] 3- + N2H4 + OH- →[Fe(CN) 6] 4- + N2 + H2O
(4)C2H5OH + K2Cr2O7 + H2SO4 →H4C2O + Cr2 (SO4) 3 + K2SO4
(5)CrI3 + Cl2 + OH-→ IO3- + CrO42- + Cl-
(6)PbO2 + HNO3→ Pb(NO3) 2 + 2H2O + O2
4.计算题
(1)已知
θ
E
(Zn2+/ Zn)= - 0.7621V,
θ
E
(Ag+/ Ag)= 0.7991V。
某锌—银原电池中,c(Zn2+)=c(Ag+)=0.200
mol·L-1。
①计算25℃时电池的电动势。
②如果将少量浓氨水仅加在Zn2+溶液中,电池电动势将如何变化?③若仅
在Ag+/ Ag半电池中加入等体积的3.00 mol·L-1的氨水,测得电动势为1.082V,计算
θ
f
K
(Ag(NH3)2+)。
(2)将氢电极插入含有0.50 mol·L-1HA和0.10 mol·L-1NaA的缓冲溶液中,作为原电池的负极。
将银电极插入含
有AgCl沉淀和1.0 mol·L-1 Cl-的AgNO3溶液中,将其作为原电池的正极。
已知
θ
E
(Ag+/ Ag)=0.7991V,
θ
sp
K
(AgCl)
=1.8⨯10-10,p(H2)=100KPa时,测得原电池的电动势为0.450V。
①写出电池符号和电池反应方程式;②计算
正、负极的电极电势;③计算负极溶液中的c(H+)和HA的解离常数
θ
a
K。