第三章 金属电化学腐蚀的热力学原理
- 格式:doc
- 大小:473.00 KB
- 文档页数:28



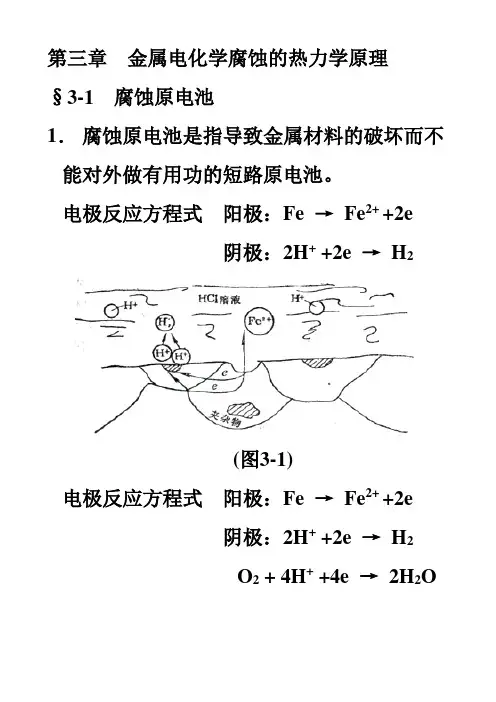
第三章金属电化学腐蚀的热力学原理§3-1 腐蚀原电池1.腐蚀原电池是指导致金属材料的破坏而不能对外做有用功的短路原电池。
电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2(图3-1)电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2O2 + 4H+ +4e →2H2O(图3-2)电化学腐蚀发生的根本原因是由于介质中存在着平衡电极电位高于金属的平衡电极电位的氧化性物质。
2.腐蚀原电池的组成及工作过程1)组成:阳极、阴极、电解质溶液、外电路。
2)工作过程:①金属阳极溶解过程如Fe →Fe2+ +2e②溶液中氧化性物质的阴极还原过程如2H+ +2e →H2③电子和离子的定向流动过程以上三个过程是彼此独立进行的,但又是串联在一起的,因而只要其中的某个过程的进行受到阻滞,则金属的腐蚀速度就会减缓。
3.电化学腐蚀的次生过程腐蚀电池工作过程中,阳极附近金属离子(如Fe2+)浓度增大,阴极附近的pH升高,则随着离子的迁移发生如下反应:Fe2+ + 2OH- →Fe(OH)2 ↓或者进一步被氧化为:4Fe(OH)2+ O2 +2H2O →Fe(OH)3↓即铁在含氧水溶液中腐蚀的次生过程。
如图所示是铁在含氧水溶液中的腐蚀及其次生过程。
(图3-3 P22)4.腐蚀原电池的分类按照电极的大小,被破坏金属的表观形态,腐蚀电池可分为三类:1)超微电池腐蚀:金属表面上存在的超微观的(原子大小的)电化学不均一性引起,可以认为阴阳极是等电位,导致金属材料的均匀腐蚀。
2)微电池腐蚀:金属表面存在许多微小的阴极和阳极区域而形成的腐蚀电池,导致金属腐蚀。
形成原因多种多样。
3)宏电池腐蚀:腐蚀电池的尺寸较大,可用肉眼明显区分出阴阳极区域的腐蚀电池。
5.盐滴实验(例题)腐蚀现象是非常复杂的,形成的腐蚀电池也可能不是一种类型,下面以盐滴实验为例说明:在打磨过的钢片上,滴一滴含有酚酞和铁氰化钾的氯化钠溶液,可观察到液滴覆盖的整个区域上立刻出现粉红色和蓝色的小斑点,原因:发生电池反应,阳极Fe →Fe2+ +2e3Fe2+ + 2Fe(CN)62-→Fe3[Fe(CN)6]2(蓝色)阴极O2 + 2H2O + 4e →4OH-使酚酞显红色。

电化学腐蚀热力学电化学腐蚀是金属材料腐蚀破坏的最主要和最普遍的腐蚀形式。
金属材料与电解质溶液相互接触时, 在界面上发生电化学腐蚀的倾向有多大, 正是腐蚀热力学所要回答的问题。
§1-1 电池过程一、原电池考查锌片放入硫酸溶液中的化学反应:阳极反应: 为阳极➢阴极反应: 为阴极➢反应前后反应物的化合价发生了变化, 即在化学反应过程中, 反应物和生成物之间有电子的得失, 电子由直接转移给溶液中的, 且电子的流动是无秩序的, 不能形成电子的定向流动。
➢有电子得失的化学反应称为氧化还原反应。
➢化合价升高的物质称为还原剂。
➢化合价降低的物质称为氧化剂。
➢如果能设计一种装置, 使氧化还原反应的电子转移转变为电子的定向移动, 即电子有秩序地由一处流向另一处, 则, 通过这种装置, 就能使氧化还原反应的化学能转变为电能。
➢借助于氧化还原反应将化学能直接转变为电能的装置叫做原电池。
➢由阴极和阳极与电解液组成的系统为原电池➢电流产生的原因: 阳极与阴极在电解质溶液中电位不同, 而产生的电位差所引起➢原电池的电位差是电池反应的推动力1.电极系统能够导电的物体称为导体。
➢根据导体中形成电流的荷电粒子的不同, 导体可分为两种类型:由电子形成电流的导体称为电子导体相, 简称为电子导体。
由离子形成电流的导体称为离子导体相, 简称为离子导体。
由相互接触的电子导体相和离子导体相构成, 且不同的荷电粒子能在两个相界面间自由转移电荷的导电系统, 称为电极系统。
2.电极反应与电子导体间的导电不同, 在电极系统中, 电荷通过相界面从电子导体相和离子导体相之间穿越, 必然要依靠两种不同的荷电粒子(电子和离子)之间相互转移电荷来实现。
这一过程也就是物质得到或释放外层电子的过程(发生化学变化), 而这正是电化学变化的基本特征。
电极反应:电极系统中, 伴随着电子导体相和离子导体相之间的电荷转移, 在两相界面上所发生的电化学反应。
3.电极反应的类型1)第一类电极反应: 由金属与含有该金属离子的溶液或由吸附了某种气体的惰性金属(如)与被吸附元素离子的溶液构成的电极反应。

金属材料电化学腐蚀机理自然环境(大气、土壤、海洋、生物和微生物等)和工业介质(酸、碱、盐、工业水、熔盐、燃气等)都可能造成金属材料的腐蚀。
金属材料的腐蚀给人类带来巨大的经济损失和资源浪费。
中国工程院咨询项目《中国工业和自然环境腐蚀问题调查与对策》显示,我国每年腐蚀总损失可达5000亿元以上,约占国民生产总值(GNP)的5%。
电化学腐蚀是金属腐蚀的一种重要形式。
它并不是一种纯化学反应过程,而是一种涉及电荷在电子导电相与离子导电相之间迁移的电化学过程。
电化学腐蚀比单纯的化学腐蚀更为普遍。
金属及其合金在大气、土壤、海水以及各种电解质溶液中发生的腐蚀都属于电化学腐蚀。
因此,研究和分析金属的电化学腐蚀机理,对采取有效的防腐蚀措施具有重要的理论指导意义。
1电化学腐蚀的热力学条件金属的电化学腐蚀可以看作是一个腐蚀电池的反应体系。
反应体系从始态转变为终态时其自由能变化决定着电化学腐蚀能否自发进行。
研究证明,lmol的金属,由于腐蚀电池的作用而转变为腐蚀产物时,其Gibbs自由能△G变化为:△G=一nF(E。
一£。
)式中n一腐蚀反应中电子转移数;F一法拉第常数;E。
一阳极反应的平衡电位;E。
一阴极反应的平衡电位。
在上式中,nF始终为正值,因此只有E。
一E。
>O时,反应的△‘为负值(自由能降低),阳极金属的腐蚀才能自发进行。
由此可见,阳极金属的电位越高,其腐蚀越困难,说明阳极金属热力学稳定性越好。
在许多铁基合金中,铁元素相对电极电位较低,热力学稳定性较差,故铁元素首先作为腐蚀电池中的阳极而被腐蚀掉。
2合金元素的影响2.1铬的影响铬具有很强的钝化性能,加人到钢铁中使钢铁的钝化能力显著提高。
铸铁中加人14%一36%的铬之后,在氧化性介质中铸铁表面能生成一层很薄而紧密附着在合金表面的钝化膜,从而大大提高合金铸铁的耐蚀性。
这是因为铬的钝态是与形成的致密又高稳定性的CrZo3有关,Cr203相难熔,化学稳定性高,不溶于水和酸。




金属腐蚀电化学热力学1 介绍金属腐蚀是制约金属材料使用寿命的一个主要因素。
它会导致金属物质的质量和性能损失、破坏金属结构的完整性和功能等问题。
解决金属腐蚀问题,对于约束生产和军事用途等领域的安全和可靠性具有重要意义。
电化学热力学是研究金属腐蚀和防护的基础理论,它提供了热力学和动力学方面的基本概念和方法。
2 金属腐蚀金属腐蚀是一种从金属材料表面开始发生的化学反应。
根据腐蚀介质的种类不同,可以分为很多种腐蚀类型,例如在酸性或碱性环境中发生的化学腐蚀、在高温环境下发生的热腐蚀、在海水中发生的海洋腐蚀等等。
3 电化学热力学基础电化学热力学研究了在电化学反应中发生的能量转化和物质转化,研究对象包括纯物质和混合介质。
电化学反应既包括氧化还原反应,也包括非氧化还原反应。
例如,金属在水溶液中发生腐蚀就是非氧化还原反应,而重金属的还原则属于氧化还原反应。
根据能量守恒的原则,电化学反应必须满足能量自由度平衡和物质计量平衡两个条件,这些条件可以通过电动势(电化学电流)和吉布斯自由能来表达。
吉布斯自由能的变化可以用来描述反应的驱动力和平衡状态。
4 符号约定为了方便处理涉及电化学热力学的问题,约定如下的符号:- E:电势(电位)- G:吉布斯自由能(或被称为“自由焓”)- S:熵(系统的随机程度)- H:焓(能量加上压强的乘积)- T:温度- F:法拉第常数(电子和离子的相互作用参量)- n:反应中电子的数目- Q:电化学电量(电荷量)5 电化学反应驱动力发生在电化学反应中的物质转化和能量转化是由自由能的变化所驱动的。
该变化可通过称为“电电势差”(电势差、电位差或电压)的物理量来测量,其单位为“伏特(V)”。
电电势差可以表示为如下的方程式:E = (G_final - G_initial)/nF其中,G_final表示反应结束时的吉布斯自由能,G_initial则表示反应开始时的自由能,n是电子数,F则是法拉第常数。
该式子描述了反应的驱动力的大小和方向,反应是自发的,当E>0时则有外部电源参与。

金属电化学腐蚀热力学王超学号:20114160201(河北联合大学化学工程学院11级化学工程与工艺2班)摘要:通过热力学条件、电位—PH图、合金元素及组织,对电化学腐性机理进行了分析。
结果表明,利用热力学条件和电位—PH图,可以定性判断电化学腐蚀反应趋势和腐蚀产物;提高基体金属的电极电位、降低金属中的第二相含量、控制溶液PH等均有利于提高金属的耐腐蚀性。
关键词:金属电化学腐蚀热力学金属材料以及由它们制成的结构物,在自然环境中或者在工况条件下,由于与其所处环境介质发生化学或者电化学作用而引起的变质和破坏,这种现象称为腐蚀,其中也包括上述因素与力学因素或者生物因素的共同作用。
腐蚀科学的发展历史悠久,古希腊Herodias和古罗马Pinions在2000年前已提出用锡防止铁生锈;我国商代(3000年前)发明锡青铜;出土铁器可见古人防蚀成就。
18世纪工业发展—腐蚀与防护学科形成、发展。
如今,腐蚀科学以及防腐技术应用在了化工、农业、机械制造业、国防等各个方面。
生产生活中,腐蚀无处不在。
腐蚀可以直接造成金属材料的的浪费,造成巨大的经济损失;此外,腐蚀还会给生产过程埋下不易察觉的安全隐患,造成重大的生产安全事故,给国民经济带来重大损失,危及人民生命财产安全。
腐蚀的形式多种多样,包括腐蚀疲劳、应力腐蚀断裂、氢蚀、点蚀、晶间腐蚀、高温腐蚀、化学腐蚀、电化学腐蚀等。
但其中所占比例最大,危害最严重的还是电化学腐蚀。
通过对电化学腐蚀热力学的研究,可以判断电化学腐蚀趋势及腐蚀产物,了解腐蚀机理,从根本上预防腐蚀的发生。
一、金属在电解质溶液中的标准电极电位作判据金属材料的电化学腐蚀的实质是形成了腐蚀原电池,其工作原理如图所示:图示是把大小相等的Zn片和Cu片同时置于盛有稀硫酸的同一烧杯中,并用导线通过毫安表连接起来,以锌为阳极、铜为阴极的原电池装置。
当合上开关,毫安表指针立即偏转,表明有电流通过。
阳极锌失去的电子流向与锌接触的阴极铜,并与阴极铜表面上溶液中的氢离子结合,形成氢离子并聚合成氢气逸出。
海洋工程材料复习大纲金属电化学腐蚀原理第二章金属电化学腐蚀原理§2.1腐蚀的基本概念2.1.1什么是腐蚀(corrosion)?埃文斯:金属腐蚀是金属从元素态转变为化合态的化学变化及电化学变化。
方坦纳:金属腐蚀是金属冶金的逆过程。
尤利格:物质(或材料)的腐蚀是物质(或材料)受环境介质的化学、电化学作用而被破坏的现象。
曹楚南:金属腐蚀是金属材料由于受到介质的作用而发生状态的变化,转变成新相,从而遭受破坏(的现象)。
目前一致认可的定义是:材料腐蚀是材料受其周围环境介质的化学、电化学和物理作用下引起失效破坏的现象。
金属腐蚀是金属与周围环境(介质)之间发生化学或电化学作用而引起的破坏或变质。
非金属腐蚀是非金属材料由于在环境介质的化学、机械和物理作用下,出现老化、龟裂、腐烂和破坏的现象。
2.1.2金属腐蚀的分类1.按腐蚀过程的历程分类:1)化学腐蚀(chemicalcorrosion)金属表面与非电解质发生纯化学反应而引起的损坏。
通常在干燥气体及非电解质溶液(如石油、苯、醇等)中进行。
特点:在腐蚀过程中,电子的传递在金属与氧化剂之间进行,腐蚀不产生电流。
例如,化工厂里的氯气与铁反应生成氯化亚铁。
2)物理腐蚀(physicalcorrosion)金属由于单纯的物理溶解作用所引起的损坏。
在液态金属中可发生物理腐蚀。
例:用来盛放熔融锌的钢容器,由于铁被液态锌所溶解而损坏。
3)电化学腐蚀(electrochemicalcorrosion)金属表面与电解质溶液发生电化学反应而产生的破坏,反应过程中有电流产生。
电化学腐蚀至少有一个阳极反应和阴极反应,并有流过金属内部的电子流和介质中的离子流构成电流回路。
阳极反应:金属的氧化过程,金属失去电子而成为离子,进入溶液;阴极反应:氧化剂的还原过程,电子在阴极被氧化剂(氧气、H+)吸收。
电化学与力学作用共同导致破坏:应力腐蚀破裂、腐蚀疲劳2.按腐蚀的形式分类:1)全面腐蚀(generalcorrosion)腐蚀分布在整个金属表面上,可以是均匀的,也可以是不均匀的。
第三章金属电化学腐蚀的热力学原理§3-1 腐蚀原电池1.腐蚀原电池是指导致金属材料的破坏而不能对外做有用功的短路原电池。
电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2(图3-1)电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2O2 + 4H+ +4e →2H2O(图3-2)电化学腐蚀发生的根本原因是由于介质中存在着平衡电极电位高于金属的平衡电极电位的氧化性物质。
2.腐蚀原电池的组成及工作过程1)组成:阳极、阴极、电解质溶液、外电路。
2)工作过程:①金属阳极溶解过程如Fe →Fe2+ +2e②溶液中氧化性物质的阴极还原过程如2H+ +2e →H2③电子和离子的定向流动过程以上三个过程是彼此独立进行的,但又是串联在一起的,因而只要其中的某个过程的进行受到阻滞,则金属的腐蚀速度就会减缓。
3.电化学腐蚀的次生过程腐蚀电池工作过程中,阳极附近金属离子(如Fe2+)浓度增大,阴极附近的pH升高,则随着离子的迁移发生如下反应:Fe2+ + 2OH- →Fe(OH)2 ↓或者进一步被氧化为:4Fe(OH)2+ O2 +2H2O →Fe(OH)3↓即铁在含氧水溶液中腐蚀的次生过程。
如图所示是铁在含氧水溶液中的腐蚀及其次生过程。
(图3-3 P22)4.腐蚀原电池的分类按照电极的大小,被破坏金属的表观形态,腐蚀电池可分为三类:1)超微电池腐蚀:金属表面上存在的超微观的(原子大小的)电化学不均一性引起,可以认为阴阳极是等电位,导致金属材料的均匀腐蚀。
2)微电池腐蚀:金属表面存在许多微小的阴极和阳极区域而形成的腐蚀电池,导致金属腐蚀。
形成原因多种多样。
3)宏电池腐蚀:腐蚀电池的尺寸较大,可用肉眼明显区分出阴阳极区域的腐蚀电池。
5.盐滴实验(例题)腐蚀现象是非常复杂的,形成的腐蚀电池也可能不是一种类型,下面以盐滴实验为例说明:在打磨过的钢片上,滴一滴含有酚酞和铁氰化钾的氯化钠溶液,可观察到液滴覆盖的整个区域上立刻出现粉红色和蓝色的小斑点,原因:发生电池反应,阳极Fe →Fe2+ +2e3Fe2+ + 2Fe(CN)62-→Fe3[Fe(CN)6]2(蓝色)阴极O2 + 2H2O + 4e →4OH-使酚酞显红色。
如图所示,放置一段时间后,液滴边缘为红色,中间为蓝色红蓝之间为棕色。
这一段主要是供氧差异产生的宏电池腐蚀。
盐滴中部由于液层较厚,氧耗尽后只有阳极反应;而盐滴周围由于液层较薄,氧扩散充分,成为阴极。
中间Fe2+与OH-及溶解氧相遇生成铁锈。
即:4Fe2+ + 8 OH- + O2 + 2H2O →Fe(OH)3↓§3-2 腐蚀过程中发生的反应类型金属在介质中的腐蚀现象是非常复杂的,因此,要找到防止金属被腐蚀的办法首先就必须弄清金属发生腐蚀的可能性,这是一个电化学热力学问题,研究腐蚀的产物及速度也是一个必要问题,即电化学动力学。
本章主要介绍电化学热力学问题。
热力学问题是一个平衡态的问题,我们可用能斯特(Nernst)方程讨论,即△G ﹥ 0 反应不能自发进行△G ﹦0 反应处于平衡态△G﹤ 0反应可自发进行1.腐蚀过程中的电化学反应通式:aO + mH+ + ne ⇌ bR + cH2O (O、R分别代表金属地氧化态和还原态)则25℃时平衡电极电位为:pH n m a a n bRa O o 0591.0lg 0591.0-+=平平ϕϕ 分析如下:首先建立一个以电极反应的平衡电位(ϕ)为纵坐标,以水溶液的pH 值为横坐标的电位-pH 平衡图。
1) 化学反应中既有e ,也有H +或OH -参加,例如:电极反应 Fe 3O 4 + 8H + +2e ⇌ 3Fe 2++4H 2O pH Fe 2364.0lg 885.0980.02--=+αϕ平那么这类反应的平衡条件就可以以电位-pH 平 衡图中的一组斜线来表示:如图所示2) 电化学反应中没有H +或OH -参加,但有e 参加,例如:电极反应 Fe 2+ +2e → Fe 平衡条件: ++-=2lg 295.0440.0Fe αϕ平 这类反应的平衡条件在电位-pH 平衡图中可以以一簇平行于横坐标轴的直线表示,如图所示3) 参加反应的物质中有H +或OH -,但没有e ,属于化学腐蚀,不构成电极反应,但可以从平衡常数求体系的pH 值,例如:电极反应:Fe 2+ + 2H 2O ⇌ Fe(OH)2 + 2H +平衡条件: pH Fe 229.13lg 2-=+α这类反应的平衡条件在电位-pH 平衡图中可以用平行于纵坐标的一簇垂直线表示,如图所示2.电位-pH 平衡图的意义电位-pH 平衡图是比利时腐蚀学家M.布拜(M.Pourbaix )于1938年首先提出的,也称之为Pourbaix 图。
意义:1) 把体系关于某一特定元素所有反应物、生成物的热力学平衡条件集中表现在一张图上;2) 由Pourbaix 图可知体系中各物质在热力学上的生成条件及稳定存在的电位和pH 范围;3) 了解金属腐蚀的可能性和腐蚀产物的稳定性。
§3-3 水的电位-pH 平衡图( Potential-pH Diagram )氢析出反应和溶解氧还原反应是金属在水溶液中电化学腐蚀过程极其常见的阴极反应,因此了解这些反应的平衡条件(即热力学稳定性)是非常重要的。
1. Hydrogen Exponent 氢析出反应 电极反应:2H ++2e ⇌ H 2平衡条件:25℃时, pH P H H H 0591.0lg 0295.0)/(22--=+平ϕ 根据压力不同,在电位-pH 平衡图上,可以用一簇斜率为-0.0951的平行斜线表示,如图所示,斜线a 表示2H P = 101.3Kpa 时,H +与H 2之间的平衡。
(图3-6 斜线a P29)2. 氧电极(Oxygen Electrode 溶解氧反应) 电极反应:O 2 + 4H ++4e ⇌ 2H 2O平衡条件:25℃时,pH P O H O O 0591.0lg 04148.0299.1)/(222-+=平ϕ同样,根据压力不同,在电位-pH 平衡图上,可以用一簇斜率为-0.0951的平行斜线表示,如图所示斜线b 表示2O P = 101.3Kpa 时O 2与H 2O 之间的平衡。
图3-6就是所谓的水的电位-pH 平衡图,由此可以了解H 2、O 2、H 2O 等物质的热力学稳定性。
3. 水的电位-pH 平衡图的分析1)当平实际ϕϕ=时,电极反应氧化、还原方向进行的速度相等(即还原氧化V V=),则不会发生氧化还原反应。
1) 当平实际ϕϕ>时,还原氧化V V >,可发生氧化反应。
2) 当平实际ϕϕ<时,还原氧化V V <,可发生还原反应。
3) 实例分析:图3-6中斜线a 是相应于P(H 2) = 101.3Kpa 下,电极反应为2H + +2e ⇌ H 2 的平衡线。
当 平实际ϕϕ<时,则发生还原反应2H ++2e → H 2 ,如果保持压力不变,则溶液中pH 值增大,即水会分解,所以斜线a 下方的区域是热力学上相应于101.3Kpa 下H 2的稳定存在区,水或H +的不稳定区。
同理可解释其它物质在各个区域的情况。
4.由电化学原理可知:当两个电极反应体系组成时,电极反应平衡电位高的电极作为阴极发生还原反应,电极反应平衡电位低的电极作为阳极,发生氧化反应。
因此,在电位-pH平衡图上电位较高的线和电位较低的线所代表的电极反应见会发生氧化还原反应过程。
即:[氧化态]电位高+ [还原态]电位低→[还原态]电位高+ [氧化态]电位低例如:O 2 + H2→H2O 可以自发进行。
§3-4 金属-水体系的电位-pH平衡图1.绘制电位-pH平衡图的方法1)列出金属-水体系中各类主要物质的重要反应;2)列出各反应的平衡条件关系式;3)选定要考虑的平衡固相;4)以电位为纵坐标,pH 为横坐标绘制电位-pH 平衡图。
2.Fe-H 2O 体系的电位-pH 平衡图1) 以Fe 、Fe(OH)2、Fe(OH)3为平衡固相 ,Fe-H 2O 体系可能发生的反应如下: ① Fe 3+ + e ⇌Fe 2+ ,ϕ = 0.771 + 0.0591lg(αFe 3+/αFe 2+) ② Fe 2+ + 2e ⇌ Fe ,ϕ = -0.440 + 0.295lg αFe2+③ HFeO 2- + 3H ++ 2e ⇌Fe + 2H 2O , ϕ = 0.493 - 0.0885pH + 0.0295lg αHFeO 2- ④ Fe(OH)2 + 2H ++ 2e ⇌ Fe + 2H 2O ,ϕ= -0.045 - 0.0591pH⑤ Fe(OH)3+ H++ e ⇌ Fe(OH)2+ H2O ,ϕ= 0.179 - 0.0591pH⑥ Fe(OH)3+ e⇌ HFeO2- + H2O ,ϕ= -0.810 - 0.0591lgαHFeO2-⑦ Fe(OH)3+ 3H++ e ⇌Fe2++ 3H2O ,ϕ= 1.507 - 0.1773pH - 0.0591lgαFe2+⑧ Fe(OH)2+2H+⇌ Fe2++ 2H2O ,lgαFe2+= 13.29 - 2pH⑨ Fe(OH)2⇌HFeO2- + H+ ,lgαHFeO2-= -18.30 + pH⑩Fe(OH)3+ 3H+⇌ Fe3++ 3H2O , lgαFe3+= 4.84 - 3pH(a) 2H++ 2e⇌ H2,ϕe = -0.0591pH(p H2= 101.3kPa)(b) O2+ 4H++ 4e ⇌2H2O ,ϕe = 1.229 - 0.0591pH(p O2 = 101.3kPa) 图示:(图3-8 P32)2) Fe-H2O体系的电位-pH平衡图的分析①每一根线都代表了两物质间的平衡条件。
例如:线②是一种固态物质Fe和一种可溶性离子Fe2+ 间共存的平衡线。
②直线间具有三相点的特征。
例如:线②、④、⑧交于A点,表示在A点反应的电位和pH条件下,溶液相和两个固相能平衡共存,即固态Fe(OH)2 、Fe 和溶液相Fe2+处于平衡状态中。
③相交直线所包围的区域表示反应体系中某一种物质的稳定区。
例如:线④、⑤、⑧、⑨所围的区域代表Fe(OH)2的稳定区。
④注意:此图是一张简略的Fe-H2O体系电位-pH平衡图。
4. 其它金属-水体系平衡图(图3-9 P34 )(图3-10 b,c,d P34 )从金属的电位-pH平衡图上可以看到金属在水溶液中有一些共同的特点:1)图中从下往上随电位升高,高价的离子以及高价的氧化物将显得稳定;2)图中从左向右随pH值的增加,能够稳定存在的物质类型从金属的简单阳离子转变为非离子态化合物;3)当溶液的碱性和还原性较强时,则此化合物又重新生成可溶性的金属含氧阴离子。