大学基础化学课后答案
- 格式:doc
- 大小:3.22 MB
- 文档页数:25

《⼤学化学》课后习题答案⼤全第⼀章课后作业答案1-4.判断下列⼏种说法是否正确,并说明理由。
(1)原⼦是化学变化中最⼩的微粒,它由原⼦核和核外电⼦组成;正确原⼦是化学变化中的最⼩粒⼦。
原⼦是由居于原⼦中⼼的原⼦核和核外电⼦构成,原⼦核⼜由质⼦和中⼦两种粒⼦构成的。
构成原⼦的基本粒⼦是电⼦、质⼦、中⼦。
(2)相对原⼦质量就是⼀个原⼦的质量;错误相对原⼦质量是指以⼀个碳-12原⼦质量的1/12作为标准,任何⼀个原⼦的真实质量与⼀个碳-12原⼦质量的1/12的⽐值。
(3)4g H2和4g O2所含分⼦数⽬相等;错误4g H2含有2mol氧⽓分⼦。
氢⽓相对分⼦质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧⽓分⼦。
氧⽓相对分⼦质量32,4g/(32g/mol)=0.125mol。
所以分⼦数⽬不相等。
(4)0.5mol的铁和0.5mol的铜所含原⼦数相等;正确铁和铜都是由原⼦构成的⾦属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表⽰原⼦数相同。
(5)物质的量就是物质的质量;错误物质的量:表⽰物质所含微粒数(N)(如:分⼦,原⼦等)与阿伏加德罗常数(NA)之⽐,即n=N/NA。
物质的量是⼀个物理量,它表⽰含有⼀定数⽬粒⼦的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置⽽改变,是物质的基本属性之⼀,通常⽤m表⽰物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最⾼?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最⾼,所以尿素的肥效最⾼。
均为 Na + , K + , Br , Cl 离子各 1mol 。
第十章开链烃1、扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答:2、NaCl 相同?如将 CH 4 及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同? 为什么?答: NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中 - -由于 CH 4 与 CCl 4 及 CHCl 3 与 CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合 物。
3、用系统命名法命名下列化合物:⑴2-甲基丙烷⑵2,4,4-三甲基-5-丁基壬烷⑶己烷⑷3-乙基戊烷⑸3-甲基-5-异丙基辛烷⑹2-甲基-5-乙基庚烷4、写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
H 3CCH 3 ⑴3,3-二甲基丁烷 H 3CH 2CH 3H 3C错,2,2-二甲基丁烷CH 2CH 3 ⑵2,3-二甲基-2-乙基丁烷 H 3C HC C3错,2,3,3-三甲基戊烷CH 3CH 3⑶2-叔丁基-4,5-二甲基己烷H 3CC CH 3CH 33错,2,2,3,5,6-五甲基庚烷H 3CC H 2CH 3CH 3H 3CCH⑷2,3-二甲基-4-丙基庚烷H 3H CH 2 CC H 2CH 3CH 2CH 2CH 3H 3CH 3CCH 2CH 3H 2⑸2,4,5,5-四甲基-4-乙基庚烷H 3CHC H 2 CH 3CC C 3 32 CH32CH2 3CH 2 3CH 3 3CH 3 2CH 3⑹2,2,3-三甲基戊烷H3CH3CCCH3CH2CH35、写出分子式为C6H14的烷烃的各种异构体,用系统命名法命名,丙标出伯、仲、叔、季碳原子。
1oCH 32oCH 2 2 o22 oCH2 oCH 21 o己烷1oCH 3oCH 21 o CH32 o CHo1 oCH32-甲基戊烷1 o CH31oCH 32ooCH2 oCH2 1 oCH3 3-甲基戊烷1oCHo3 oCH1 o3 2,3-二甲基丁烷1 o CH31 o1 o CH31oCH2o4 oCCH32,2-二甲基丁烷H3C 1 o 1 o CH36、⑶>⑵>⑸>⑴>⑷7、写出2,2,4-三甲基戊烷进行氯代反应可能得到的一氯代产物的结构式。

大学化学课后习题1,2,3答案大学化学课后习题答案(吉林大学版)第1_2_3_章第一章化学反应的基本规律1.2习题及详解一、判断问题1.状态函数都具有加和性。
(×)2.系统的状态发生改变时,至少有一个状态函数发生了改变。
(√)3.由于caco3固体的分解反应是吸热的,故caco3的标准摩尔生成焓是负值。
(×)4.利用盖斯定律计算反应热效应时,其热效应与过程无关,这表明任何情况下,化学反应的热效应只与反应的起,始状态有关,而与反应途径无关。
(×)5.因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的δs大大增加。
(×)6.δh,δs受温度影响很小,所以δg受温度的影响不大。
(×)7.凡δg大于零的过程都不能自发进行。
(×)8.273k,101.325kpa下,水凝结为冰,其过程的δs<0,δg=0。
(√)kt??(ph2o/p?)4(ph2/p?)49.反应Fe3O4(s)+4h2(g)的平衡常数表达式→ 3Fe(s)+4H2O(g)为10。
2No+O2反应速率方程→ 2no2是:v?kc2(no)?c(o2)。
(√),该反应一定是基元反应。
(×)二.选择题1.气体系统通过路径1和路径2扩展到相同的最终状态,两个变化过程产生的体积功相等,没有非体积功,则两个过程(b)a.因变化过程的温度未知,依吉布斯公式无法判断δg是否相等b.δh相等c、系统和环境之间的热交换不等于D。
上述所有选项都是正确的cucl2(s)+cu(s)→2cucl(s)δrhmθ(1)=170kj?mol-1cu(s)+cl2(g)→cucl2(s)δrhmθ(2)=-206kj?mol-1则δfhmθ(cucl,s)应为(d)kj.mol-1a、 36b.-36摄氏度。
18d.-十八3.下列方程式中,能正确表示agbr(s)的δfhmθ的是(b)a.ag(s)+1/2br2(g)→agbr(s)b.ag(s)+1/2br2(l)→agbr(s)c.2ag(s)+br2(l)→2agbr( s)d.ag+(aq)+br-(aq)→agbr(s)在4.298k下,在下面对参考状态元素的描述中,正确的一个是(c)aδfhmθ≠0,δfgmθ=0,smθ=0b。

⼤学化学课后习题答案第⼀章化学反应热教学内容1.系统、环境等基本概念; 2、热⼒学第⼀定律; 3、化学反应得热效应。
教学要求掌握系统、环境、功、热(恒容反应热与恒压反应热)、状态函数、标准态、标准⽣成焓、反应进度等概念;熟悉热⼒学第⼀定律;掌握化学反应标准焓变得计算⽅法。
知识点与考核点1.系统(体系)被划定得研究对象。
化学反应系统就是由⼤量微观粒⼦(分⼦、原⼦与离⼦等)组成得宏观集合体。
2.环境(外界)系统以外与之密切相关得部分。
系统与环境得划分具有⼀定得⼈为性,划分得原则就是使研究问题⽐较⽅便。
系统⼜可以分为敞开系统(系统与环境之间既有物质交换,⼜有能量交换);封闭体系(系统与环境之间没有..能量交换);..物质交换,只有孤⽴系统(体系与环境之间没有物质交换,也没有能量交换) 系统与环境之间具有边界,这⼀边界可以就是实际得相界⾯,也可以就是⼈为得边界,⽬得就是确定研究对象得空间范围。
3.相系统中物理性质与化学性质完全相同得均匀部分。
在同⼀个系统中,同⼀个相可以就是连续得,也可以就是不连续得。
例如油⽔混合物中,有时⽔就是连续相,有时油就是连续相。
4.状态函数状态就是系统宏观性质(T、p、V、U等)得综合表现,系统得状态就是通过这些宏观性质描述得,这些宏观性质⼜称为系统得状态函数。
状态函数得特点:①状态函数之间往往相互制约(例如理想⽓体状态⽅程式中p、V、n、T之间互为函数关系);②其变化量只与系统得始、末态有关,与变化得途径⽆关。
5*.过程系统状态得变化(例如:等容过程、等压过程、等温可逆过程等)6*.途径完成某过程得路径。
若系统得始、末态相同,⽽途径不同时,状态函数得变量就是相同得。
7*.容量性质这种性质得数值与系统中得物质得量成正⽐,具有加合性,例如m(质量)V、U、G等。
8*.强度性质这种性质得数值与系统中得物质得量⽆关,不具有加合性,例如T、(密度)、p(压强)等。
9.功(W)温差以外得强度性质引起得能量交换形式[W=W体+W有]。

大学基础化学课后习题解答第一章 溶液和胶体溶液 第二章 化学热力学基础2-1 什么是状态函数?它有什么重要特点?2-2 什么叫热力学能、焓、熵和自由能?符号H 、S 、G 、∆H 、∆S 、∆G 、θf m H ∆、θc m H ∆、θf m G ∆、θr m H ∆、θm S 、θr m S ∆、θr m G ∆各代表什么意义?2-3 什么是自由能判据?其应用条件是什么? 2-4 判断下列说法是否正确,并说明理由。
(1)指定单质的θf m G ∆、θf m H ∆、θm S 皆为零。
(2)298.15K 时,反应 O 2(g) +S(g) = SO 2(g) 的θr m G ∆、θr m H ∆、θr m S ∆分别等于SO 2(g)的θf m G ∆、θf m H ∆、θm S 。
(3)θr m G ∆<0的反应必能自发进行。
2-5 298.15K 和标准状态下,HgO 在开口容器中加热分解,若吸热22.7kJ 可形成Hg (l )50.10g ,求该反应的θr m H ∆。
若在密闭的容器中反应,生成同样量的Hg (l )需吸热多少?解:HgO= Hg(l)+1/2O 2(g)θr m H ∆=22.7×200.6/50.1=90.89 kJ·mol -1Qv=Qp-nRT=89.65 kJ·mol -12-6 随温度升高,反应(1):2M(s)+O 2(g) =2MO(s)和反应(2):2C(s) +O 2(g) =2CO(g)的摩尔吉布斯自由能升高的为 (1) ,降低的为 (2) ,因此,金属氧化物MO 被硫还原反应2MO(s)+ C(s) =M(s)+ CO(g)在高温条件下 正 向自发。
2-7 热力学第一定律说明热力学能变化与热和功的关系。
此关系只适用于:A.理想气体;B.封闭系统;C.孤立系统;D.敞开系统 2-8 纯液体在其正常沸点时气化,该过程中增大的量是:A.蒸气压;B.汽化热;C.熵;D.吉布斯自由能2-9 在298K 时,反应N 2(g)+3H 2(g) = 2NH 3(g),θr m H ∆<0则标准状态下该反应A.任何温度下均自发进行;B.任何温度下均不能自发进行;C.高温自发;D.低温自发2-10 298K ,标准状态下,1.00g 金属镁在定压条件下完全燃烧生成MgO(s),放热24.7kJ 。

基础化学 第一章 习题参考答案3. (1) 5位,(2) 3位,(3) 2位,(4)1位,(5)2位。
4. %1.0001.01024.00001.01024.01024.01023.0-=-=-=-=RE5. kPa}){}{}({m N 10}){}{}({dm m N }){}{}({ L J }){}{}({K mol K J L mol }){}{}({ ])[][]([}){}{}({][}{][}{][}{2331111-T R c T R c T R c T R c T R c T R c T R c T T R R c c cRT Π⨯⨯=⋅⨯⨯⨯=⋅⋅⨯⨯=⋅⨯⨯=⨯⋅⋅⨯⋅⨯⨯=⨯⨯⋅⨯⨯=⋅⨯⋅⨯⋅==-----式中,花括号代表量的值,方括号代表量的单位。
6. 1 mi 3 = 1.609 3443 km 3 = 4.168 182 km 3, 所以水资源的总体积V = (317 000 000 + 7 000 000 + 2 000 000 + 30 000) × 4.168 182 km 3 =1.3590 ×109 km 37.m ol 0.25 kg 1g1000 m ol g )00.10.160.23(kg 0.010(NaOH)1-=⨯⋅++=nmol1.89 kg 1g 1000 mol g )00.16301.1299.222(21kg 0.100 )CO Na 21(mol4.99 kg 1g1000 mol g 08.4021kg 0.100 )Ca 21(1-321-2=⨯⋅⨯++⨯⨯==⨯⋅⨯=+n n8. m ol 2.57 m ol g )35.45 239.65(g350)(ZnCl 1-2=⋅⨯+=n1-21-2k mol 3.95 kg 1g1000 650mol 2.57 )(ZnCl L mol 3.48 L1mL1000 mL 39.57mol 2.57)(ZnCl g g b c ⋅=⨯=⋅=⨯=9. 1-1--3L mmol 5.1 mol 1mmol1000 L 1L 100mL 1000 mol g 9.13g 10 20 )(K ⋅=⨯⨯⨯⋅⨯=+c1-1--3-L mmol 103 mol1mmol 1000 L 1L 100mL 1000 mol g 5.453g 10 366 )(Cl ⋅=⨯⨯⨯⋅⨯=c10. 设称取含结晶水的葡萄糖(C 6H 12O 6·H 2O)的质量为m ,052600. molg 16.0)1.01g/[(2 50)-(1000 mol 0.28mol0.278 )O H (C Lmol 0.278 mol g )0.16601.1120.126(L g 0.05 )O H (C g 27.5L g 50.0 L.50001g )0.1601.120.16601.1120.126(g)0.16601.1120.126( O)H O H (C 1-61261-1-1-61261-26126=⋅+⨯+=⋅=⋅⨯+⨯+⨯⋅==⋅=⨯+⨯+⨯+⨯+⨯⨯+⨯+⨯⨯=⋅x c m m ρ11. L .41 L g .091g 3.02g )5.350.23( g 5.0 (NaCl)1-=⋅⨯+⨯=V12. ∵ 10KI + 2KMnO 4 + 8H + = 12K + + 2MnO 2 + 5I 2 + 4H 2O∴ mol 0.004 mol g )9.1262(21g 0.508 )I 21( )KMnO 51 (KI 1-24=⋅⨯⨯==+n n基础化学 第二章 习题参考答案1. 根据 BA AA n n n x +=,mol 56.5mol 18.0g 100g O)(H 1-2=⋅=n mol 0292.0molg 342g 0.10)(1=⋅=-蔗糖n 995.0mol0292.0mol 56.5mol 56.5)(O)(H O)(H O)(H 222=+=+=蔗糖n n n xkPa 33.2995.0kPa 34.2O)(H 20=⨯==x p p2. (1) mol 004912.0molg 342g68.1)(1=⋅=-甲n mol 003551.0molg 690g45.2)(1=⋅=-乙n 1kg mol 2456.0kg0200.0mol004912.0-⋅==(甲)b1kg mol 1775.0kg0200.0mol003551.0-⋅==(乙)b溶液乙的蒸气压下降小,故蒸气压高。
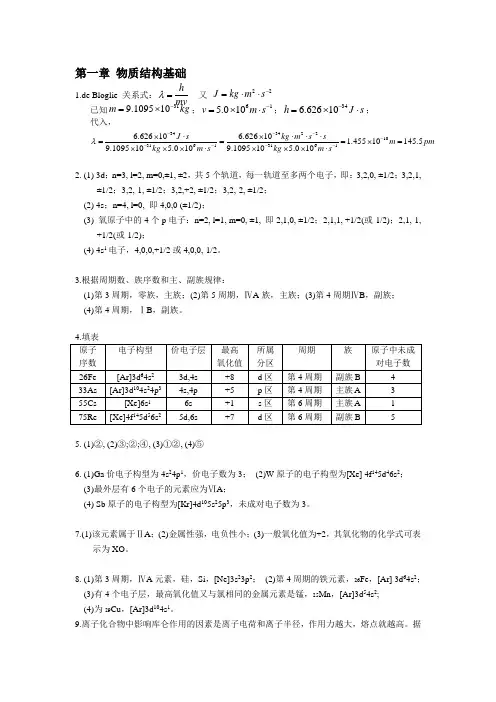
第一章 物质结构基础1.de Bloglie 关系式:hmv λ=又 22J kg m s -=⋅⋅ 已知319.109510m kg -=⨯;615.010v m s -=⨯⋅;346.62610h J s -=⨯⋅;代入,34342210316131616.62610 6.62610 1.45510145.59.109510 5.0109.109510 5.010J s kg m s sm pm kg m s kg m sλ--------⨯⋅⨯⋅⋅⋅===⨯=⨯⨯⨯⋅⨯⨯⨯⋅2. (1) 3d ;n=3, l=2, m=0,±1, ±2,共5个轨道,每一轨道至多两个电子,即:3,2,0, ±1/2;3,2,1,±1/2;3,2,-1, ±1/2;3,2,+2, ±1/2;3,2,-2, ±1/2; (2) 4s ;n=4, l=0, 即4,0,0 (±1/2);(3) 氧原子中的4个p 电子:n=2, l=1, m=0, ±1, 即2,1,0, ±1/2;2,1,1, +1/2(或-1/2);2,1,-1,+1/2(或-1/2);(4) 4s 1电子,4,0,0,+1/2或4,0,0,-1/2。
3.根据周期数、族序数和主、副族规律:(1)第3周期,零族,主族;(2)第5周期,ⅣA 族,主族;(3)第4周期ⅣB ,副族; (4)第4周期,ⅠB ,副族。
5. (1)②, (2)③;②;④, (3)①②, (4)⑤6. (1)Ga 价电子构型为4s 24p 1,价电子数为3; (2)W 原子的电子构型为[Xe] 4f 145d 46s 2; (3)最外层有6个电子的元素应为ⅥA ;(4) Sb 原子的电子构型为[Kr]4d 105s 25p 3,未成对电子数为3。
7.(1)该元素属于ⅡA ;(2)金属性强,电负性小;(3)一般氧化值为+2,其氧化物的化学式可表示为XO 。

大学基础化学习题答案大学基础化学习题答案化学作为一门基础科学,是大学学习中不可或缺的一门学科。
在学习过程中,我们经常会遇到各种各样的习题,这些习题既是对我们学习成果的检验,也是巩固知识的重要途径。
下面,我将为大家提供一些常见的大学基础化学习题的答案,希望对大家的学习有所帮助。
1. 以下哪个元素的原子半径最大?答案:钾(K)解析:原子半径是指原子的中心到外层电子轨道最外层电子的平均距离。
根据周期表的排列规律,原子半径随着周期数的增加而减小,同一周期内,随着原子序数的增加,原子半径也会减小。
钾位于第四周期,原子序数为19,而其他选项如锌(Zn)和镁(Mg)分别位于第五周期和第三周期,因此钾的原子半径最大。
2. 下列化合物中,哪个化合物的氧化态最高?答案:高锰酸钾(KMnO4)解析:氧化态是指元素中电子的丧失或获得程度,通常用+或-表示。
高锰酸钾是一种含有高氧化态的化合物,其中的锰(Mn)的氧化态为+7,是最高的氧化态。
其他选项如硫酸(H2SO4)中的硫(S)的氧化态为+6,氢氧化钠(NaOH)中的氧(O)的氧化态为-2。
3. 下列反应中,哪个反应是一种酸碱反应?答案:氢氧化钠(NaOH)与盐酸(HCl)的反应解析:酸碱反应是指酸和碱之间发生的化学反应。
在这种反应中,酸会与碱中的氢氧根离子(OH-)结合形成水和盐。
氢氧化钠是一种碱,盐酸是一种酸,它们反应时会生成水和氯化钠(NaCl),因此这是一种酸碱反应。
4. 下列化学方程式中,哪个方程式表示了氧化还原反应?答案:2Na + Cl2 → 2NaCl解析:氧化还原反应是指物质中的电子转移过程。
在这个反应中,氧化剂接受电子,还原剂失去电子。
在给定的化学方程式中,氯气(Cl2)接受了钠(Na)的电子,因此这是一种氧化还原反应。
5. 下列物质中,哪个物质不属于无机化合物?答案:蔗糖(C12H22O11)解析:无机化合物是指不含碳-碳键的化合物。
蔗糖是一种有机化合物,由碳、氢、氧元素组成,因此不属于无机化合物。
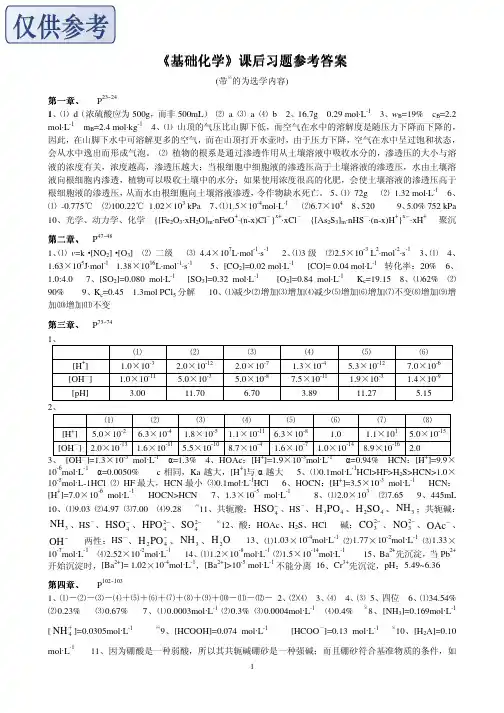

第一章 习题答案1. 答案(1-)(2-)(3+)(4-)2. 答案(1c )(2d )(3a )(4d )(5abd )(6ad )(7d )(8d )3. 答案(1)燃烧前后系统的温度(2)水的质量和比热(3)弹式量热计热容4..答案:根据已知条件列式 K C g KgJ g m o lg m o lJ b )35.29659.298](120918.4[5.0122100032261111-+⨯⋅⋅-=⨯⋅⋅⨯----- C b =849J.mol-15.答案:获得的肌肉活动的能量=kJmolkJ molg g8.17%3028201808.311=⨯⋅⨯⋅--6. 答案:设计一个循环 3× )(2)(32s Fe s O Fe →×3→)(243s O Fe )(3s FeO ×2(-58.6)+2(38.1)+6p q =3(-27.6) 17.166)1.38(2)6.58()6.27(3-⋅-=----=molkJ q p7.答案:由已知可知 ΔH=39.2 kJ.mol -1 ΔH=ΔU+Δ(PV )=ΔU+P ΔVw ‘=-P ΔV= -1×R ×T = -8.314×351J = -2.9kJ ΔU=ΔH-P ΔV=39.2-2.9=36.3kJ8.下列以应(或过程)的q p 与q v 有区别吗? 简单说明。
(1)2.00mol NH 4HS 的分解NH 4HS(s) NH 3(g)+H 2S(g)(2)生成1.00mol 的HClH 2(g)+Cl 2(g) 2HCl(g)(3)5.00 mol CO 2(s)(干冰)的升华CO 2(s) CO 2(g) (4)沉淀出2.00mol AgCl(s)AgNO 3(aq)+NaCl(aq) AgCl(s)+NaNO 3(aq)9.答案:ΔU-ΔH= -Δ(PV )=-Δn g RT (Δn g 为反应发生变化时气体物质的量的变化) (1)ΔU-ΔH=-2×(2-0)×8.314×298.15/1000= - 9.9kJ(2)ΔU-ΔH=-2×(2-2)×R ×T= 0(3)ΔU-ΔH=-5×(1-0)×8.314×(273.15-78)/1000= -8.11kJ (4)ΔU-ΔH=-2×(0-0)×R ×T= 010.(1)4NH 3(g)+3O 2(g) = 2N 2(g) +6H 2O(l) 答案 -1530.5kJ.mol -1(2)C 2H 2(g) + H 2(g) = C 2H 4(g) 答案 -174.47kJ.mol -1(3)NH 3(g) +稀盐酸 答案 -86.32kJ.mol -1 写出离子反应式。

基础化学智慧树知到课后章节答案2023年下西安交通大学西安交通大学第一章测试1.在使用物质的量单位(mol)时,要注意基本单元的表示。
若n(H2O)=1.0mol,则n(1/2H2O) 的数值为()A: 3.0 mol B: 1.0 mol C: 2.0 mol D: 0.5 mol答案: 2.0 mol第二章测试1.对于非电解质稀溶液,其渗透浓度在数值上等于其质量摩尔浓度。
A:错 B:对答案:对2.临床上将葡萄糖溶液与溶液作为等渗溶液使用。
如将此两溶液以任意比例混合,则所得混合液也必然是等渗溶液。
A:对 B:错答案:对3.渗透浓度为的NaCl溶液和的葡萄糖溶液,它们的渗透压相等,则它们的物质的量浓度也相等。
A:错 B:对答案:错4.由于0 ℃的冰与0 ℃的NaCl溶液温度相同,所以该两相可以共存。
A:对 B:错答案:错5.难挥发非电解质稀溶液的沸点升高、凝固点降低均由溶液的蒸气压下降引起。
A:错 B:对答案:对6.无论溶质是电解质还是非电解质,凝固点降低值较小的溶液的渗透压一定低于凝固点降低值较大的溶液。
A:对 B:错答案:对7.由于苯比水易挥发,故在相同温度下,苯的蒸气压比水大。
A:错 B:对答案:对8.将相同质量的葡萄糖和甘油分别溶于1 L水中,则两溶液的△p1=△p2,△T b1=△T b2,p1=p2(T一定)。
A:对 B:错答案:错9.纯溶剂通过半透膜向溶液渗透的压力称为渗透压。
A:对 B:错答案:错10.渗透浓度均为的NaCl溶液和葡萄糖溶液,NaCl溶液的渗透压大。
A:对 B:错答案:错11.渗透压较高的溶液其物质的量浓度一定较大。
A:对 B:错答案:错12.下列方法最适用于测定蛋白质相对分子质量的是()A:沸点升高法 B:渗透压法 C:蒸气压下降法 D:凝固点降低法答案:渗透压法13.已知水的,测得某人血清的凝固点为-0.56 ℃,则该血清的渗透浓度为()A:506 mmol·L-1 B:301 mmol·L-1 C:560 mmol·L-1 D:408 mmol·L-1答案:301 mmol·L-114.已知苯的凝固点为5.35 ℃,。
大一基础化学第四版课后答案1、香豆素及其苷发生异羟肟酸铁反应的条件为()[单选题] *A在酸性条件下B在碱性条件下C先碱后酸(正确答案)D在中性条件下2、能提取出中药中的大部分亲水性成分和绝大部分亲脂性成分的溶剂是()[单选题]* A乙醚B乙醇(正确答案)C水D苯3、所有游离香豆素均可溶于热的氢氧化钠水溶液,是由于其结构中存在()[单选题] * A异戊烯基B酮基C内酯环(正确答案)D酚羟基对位活泼氢4、下列哪个中药中含有机酸()[单选题] *A金银花(正确答案)B大黄C黄芩D乌头5、以芦丁为指标成分进行定性鉴别的中药是()[单选题] * A葛根B黄芩C槐花(正确答案)D陈皮6、下列含有蒽醌类成分的中药是()*A丹参B决明子(正确答案)C芦荟(正确答案)D紫草7、七叶内酯的结构类型为()[单选题] *A简单香豆素(正确答案)B简单木脂素C呋喃香豆素D异香豆素8、具有挥发性的生物碱是()[单选题] *A苦参碱B莨菪碱C麻黄碱(正确答案)D小檗碱9、倍半萜和二萜在化学结构上的明显区别是()[单选题] * A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同10、下列化合物可用水蒸汽蒸馏法提取的是()[单选题] * A七叶内酯(正确答案)B七叶苷C厚朴酚D五味子素11、具有酚羟基或羧基的游离蒽醌类成分有一定酸性,可用的提取方法是()[单选题]* A酸溶碱沉法B碱溶酸沉法(正确答案)C水提醇沉法D醇提水沉法12、连续回流提取法与回流提取法比较,其优越性是()[单选题] *A节省时间且效率高B节省溶剂且效率高(正确答案)C受热时间短D提取量较大13、在高效液相色谱法中,常用的柱内填料是()[单选题] *A氧化铝B活性炭C十八烷基硅烷键和硅胶(正确答案)D羧甲基纤维素14、下列化合物中β位有-COOH取代的是()[单选题] *A大黄素B大黄酸(正确答案)C大黄素甲醚D芦荟大黄素15、碱性最强的生物碱是()[单选题] *A季铵碱类(正确答案)B哌啶类C吡啶类D吡咯类16、颜色随pH值不同而变化的是()[单选题] *A黄酮B花青素(正确答案)C二氢黄酮D查耳酮17、在溶剂提取法中,更换新鲜溶剂可以创造新的(),从而使有效成分能够继续被提取出来。
基础化学课后习题答案在基础化学课后习题中,通常会涉及到化学反应原理、化学计量学、化学键、物质的分类、化学平衡、溶液的浓度计算等方面的问题。
以下是一些基础化学课后习题的典型答案示例:1. 化学反应原理- 题目:解释为什么铁在氧气中燃烧会产生火花?- 答案:铁在氧气中燃烧是一个氧化反应。
当铁与氧气接触时,铁原子失去电子形成Fe²⁺或Fe³⁺离子,而氧气获得电子形成O²⁻离子。
这个过程中释放出大量的能量,表现为火花和热量。
2. 化学计量学- 题目:计算2摩尔的氢气(H₂)与1摩尔的氧气(O₂)反应生成水的摩尔数。
- 答案:根据化学方程式 \(2H_2 + O_2 \rightarrow 2H_2O\),2摩尔的氢气与1摩尔的氧气完全反应生成2摩尔的水。
3. 化学键- 题目:描述离子键和共价键的区别。
- 答案:离子键是由正负离子之间的静电吸引力形成的,通常存在于金属和非金属之间。
共价键则是由两个原子共享电子对形成的,通常存在于非金属元素之间。
4. 物质的分类- 题目:区分纯净物和混合物。
- 答案:纯净物是由单一物质组成的,具有固定的化学组成和性质。
混合物则是由两种或两种以上的物质混合而成,没有固定的化学组成。
5. 化学平衡- 题目:解释勒夏特列原理。
- 答案:勒夏特列原理指出,如果一个处于平衡状态的化学反应系统受到外部条件的改变(如温度、压力或浓度的变化),系统会自动调整以减少这种改变的影响,从而重新达到平衡状态。
6. 溶液的浓度计算- 题目:如果将50毫升的0.1摩尔/升的盐酸溶液稀释到200毫升,计算稀释后的浓度。
- 答案:稀释前后溶质的物质的量不变。
稀释前的盐酸物质的量为\(50 \text{ mL} \times 0.1 \text{ mol/L} = 5 \text{ mmol}\)。
稀释后的浓度为 \(5 \text{ mmol} / 200 \text{ mL} = 0.025\text{ mol/L}\)。
基础化学第八版课后习题答案基础化学第八版课后习题答案在学习化学的过程中,课后习题是巩固知识、检验理解的重要环节。
本文将为大家提供基础化学第八版课后习题的答案,希望能够帮助大家更好地学习和掌握化学知识。
第一章:化学世界1. 化学是一门研究物质的科学。
它研究物质的组成、性质、结构、转化过程以及与能量的关系。
2. 物质是构成宇宙万物的基本单位,可以分为纯物质和混合物。
纯物质由一种组分构成,混合物由两种或两种以上的组分构成。
3. 化学变化是物质发生变化的过程,包括化学反应和核反应。
4. 化学反应的特征有:起始物质(反应物)和生成物质的变化,化学键的形成和断裂,能量的吸收和释放。
5. 物质的性质可以通过观察和实验来确定,包括物理性质和化学性质。
物理性质是物质本身固有的性质,如颜色、密度、熔点等;化学性质是物质与其他物质发生反应时表现出的性质,如与酸反应产生气体等。
第二章:物质的量和化学反应1. 物质的量是描述物质数量的物理量,用单位摩尔(mol)表示。
1摩尔物质的质量称为摩尔质量,用单位克/摩尔(g/mol)表示。
2. 摩尔质量的计算公式为:摩尔质量 = 物质的质量 / 物质的量。
3. 化学方程式是用化学符号和化学式表示化学反应的过程。
化学方程式必须满足质量守恒定律和电荷守恒定律。
4. 反应的量比关系可以通过化学方程式的系数来确定。
系数表示反应物和生成物的摩尔比。
5. 化学计量是研究化学反应中物质的量关系的学科。
它可以通过计算反应物和生成物的摩尔比来确定反应的量比关系。
第三章:化学反应的能量变化1. 化学反应的能量变化可以通过热量变化来描述。
化学反应吸热时,称为吸热反应;放热时,称为放热反应。
2. 反应的焓变(ΔH)是描述化学反应能量变化的物理量。
焓变可以通过实验测量或计算得到。
3. 反应的焓变可以通过热量计(卡计)进行测量。
热量计是一种用于测量物质吸收或释放的热量的仪器。
4. 焓变的计算公式为:ΔH = 反应物的焓 - 生成物的焓。
第一章化学反应热教学内容1.系统、环境等基本概念; 2. 热力学第一定律; 3. 化学反应的热效应。
教学要求掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。
知识点与考核点1.系统(体系)被划定的研究对象。
化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。
2.环境(外界)系统以外与之密切相关的部分。
系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。
系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换);封闭体系(系统与环境之间没有..能量交换);..物质交换,只有孤立系统(体系与环境之间没有物质交换,也没有能量交换)系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为的边界,目的是确定研究对象的空间范围。
3.相系统中物理性质和化学性质完全相同的均匀部分。
在同一个系统中,同一个相可以是连续的,也可以是不连续的。
例如油水混合物中,有时水是连续相,有时油是连续相。
4.状态函数状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些宏观性质描述的,这些宏观性质又称为系统的状态函数。
状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。
5*.过程系统状态的变化(例如:等容过程、等压过程、等温可逆过程等)6*.途径完成某过程的路径。
若系统的始、末态相同,而途径不同时,状态函数的变量是相同的。
7*.容量性质这种性质的数值与系统中的物质的量成正比,具有加合性,例如m(质量)V、U、G等。
8*.强度性质这种性质的数值与系统中的物质的量无关,不具有加合性,例如T、 (密度)、p(压强)等。
9.功(W)温差以外的强度性质引起的能量交换形式 [W=W体+W有]。
第1章 化学热力学参考答案:(一)选择题1.A 2.A 3.C 4.B 5.D 6.C 7.C 8.C 9. A 10. C 11. A 12.C (二)填空题1.40;2.等温、等容、不做非体积功,等温、等压,不做非体积功; 3.>,<,=,> 4.增大、不变 5.不变 6.3.990 kJ·mol -1(三)判断题1. ×2. ×3. ×4. ×5. √6. ×7. ×8. ×9. × 10. × (四)计算题1.解:(g)O N (l)H 2N 4242+O(l)4H (g)3N 22+(l)H N 42摩尔燃烧热为 2.解:)mol ·(kJ 28.254166.963.502)84.285(401f B r --=-⨯--⨯+=∆=∆∑HH ν)mol ·(kJ14.627211r-Θ-=∆=H Q pK 1077.3109.9824.37333mr r ⨯=⨯--=∆∆=-S T 转)mol ·(kJ 78.34357.86)15.137(36.3941f B r --=---=∆=∆∑G ν)K ·mol ·(J 9.9865.21056.1975.191216.21311B r ---=--⨯+==∆∑νNO(g)CO(g)+(g)N 21(g)CO 22+)mol ·(kJ 24.37325.90)52.110(5.3931f B r --=----=∆=∆∑H ν此反应的 是较大的负值,且)(,)(-∆-∆S H 型反应,从热力学上看,在 T 转的温度以内反应都可自发进行。
3.解:外压kPa 50e =p ,11p nRT V =,22p nRTV =,2e p p = 系统所做功:定温变化,0=∆U0=+=∆W Q U ,所以Q =1 247.1(J ) 定温过程pV =常数 ∆(pV )=0 所以 0)(=∆+∆=∆pV U H 4.解:查表知CaO(s) + SO 3(g) = CaSO 4(s)求得同理求得 因为 所以根据经验推断可知,反应可以自发进行。