醋酸含量的测定
- 格式:doc
- 大小:380.50 KB
- 文档页数:5
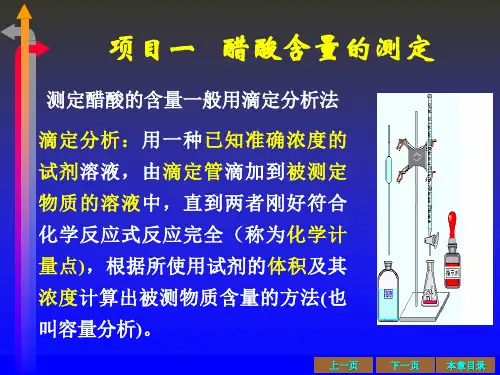


醋酸是一种弱酸,如果用强碱氢氧化钠溶液来滴定,在滴定终点突变点前的pH会维持在4~6之间,因此变色范围在4~6之间的指示剂不适合,例如甲基橙就不适合。
应该选择酚酞作为指示剂。
2.实验原理2 1食醋中的酸性物质主要是醋酸,可以用酸碱中和反应原理,以已知浓度的氢氧化钠溶液进行中和滴定。
反应方程式为:CH3COOH+NaOH=CH3COONa+H2O2 2NaOH在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,为得到更准确的数据,必须将NaOH 溶液以标准酸溶液邻苯二甲酸氢钾(KHC8H4O4)标定。
标定时遵守酸碱中和反应原理,其中参加反应的NaOH与KHC8H4O4的物质的量之比为1∶1。
3.实验用品31试剂醋精、糯米甜醋、白醋、陈醋、自制家醋、邻苯二甲酸氢钾、氢氧化钠、活性炭、酚酞。
32仪器烧杯、容量瓶、玻璃棒、锥形瓶、25mL酸式滴定管、25mL碱式滴定管、漏斗、滤纸、铁架台、托盘天平、25mL移液管、婆梅氏重表、分析天平、洗耳球。
4.实验操作42食醋的中和滴定421用移液管准确量取上述滤液各25mL,转移到250mL容量瓶中加蒸馏水到刻度线,配制成稀醋酸溶液。
422将上述各种稀醋酸溶液注入酸式滴定管中并调整液面在“0”刻度线或以下,读取刻度。
423用托盘天平准确称取200g NaOH固体,配制成500mL溶液。
424将上述NaOH溶液注入碱式滴定管中,并调整液面读取刻度。
425根据不同食醋的特点,分别从酸式滴定管中放入约20mL、10mL、5mL溶液于锥形中,滴加2~3滴酚酞指示剂,读取滴定管中刻度。
426左手控制碱式滴定者,右手不断摇晃锥形瓶,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,读取滴定管刻度。
427重复422、424、425、426操作,再做六次上实验。
43标定NaOH溶液用标准酸溶——邻苯二甲酸氢钾(KHC8H4O4)标定实验所用的NaOH溶液:用分析天平准备称取一定质量的邻苯二甲酸氢钾(02000~03000g),倒入洁净的锥形瓶,加入25mL~30mL蒸馏水使邻苯二甲酸氢钾全部溶解,滴入2滴酚酞试液,然后用待标定的NaOH溶液滴定,当锥形瓶里溶液呈浅红色,且在半分钟内不再褪色,停止滴定,记录好实验数据。

第1篇一、实验目的1. 了解醋酸的性质和检验方法。
2. 掌握使用化学试剂和仪器进行醋酸检验的操作技术。
3. 通过实验,加深对酸碱反应原理的理解。
二、实验原理醋酸(CH3COOH)是一种有机酸,具有典型的酸性反应。
在实验中,我们可以通过以下几种方法来检验醋酸的存在:1. 酸碱指示剂法:利用酚酞指示剂,观察溶液的pH变化,当溶液由无色变为粉红色时,表明溶液中存在酸性物质。
2. 碳酸钙反应法:醋酸与碳酸钙反应生成二氧化碳气体,通过观察气体的产生来判断醋酸的存在。
3. 银镜反应法:醋酸与银氨溶液反应,生成银镜,通过观察银镜的形成来判断醋酸的存在。
三、实验器材1. 试剂:醋酸溶液、酚酞指示剂、碳酸钙、银氨溶液、氢氧化钠、氯化钠、稀硝酸等。
2. 仪器:烧杯、试管、滴定管、移液管、酒精灯、铁架台、滤纸等。
四、实验步骤1. 酸碱指示剂法a. 取一支试管,加入少量待检溶液。
b. 滴入几滴酚酞指示剂,观察溶液颜色变化。
c. 若溶液变为粉红色,则表明其中含有酸性物质,即醋酸。
2. 碳酸钙反应法a. 取一支试管,加入少量待检溶液。
b. 加入少量碳酸钙,观察是否产生气泡。
c. 若产生气泡,则表明其中含有酸性物质,即醋酸。
3. 银镜反应法a. 取一支试管,加入少量待检溶液。
b. 加入少量银氨溶液,轻轻振荡。
c. 将试管放入水浴中加热,观察是否产生银镜。
d. 若产生银镜,则表明其中含有醋酸。
五、实验结果与分析1. 酸碱指示剂法:实验结果显示,待检溶液在加入酚酞指示剂后变为粉红色,说明其中含有酸性物质,即醋酸。
2. 碳酸钙反应法:实验结果显示,待检溶液在加入碳酸钙后产生气泡,说明其中含有酸性物质,即醋酸。
3. 银镜反应法:实验结果显示,待检溶液在加入银氨溶液后加热产生银镜,说明其中含有醋酸。
六、实验讨论1. 本实验通过三种方法检验醋酸的存在,结果表明,待检溶液中确实含有醋酸。
2. 在实际应用中,我们可以根据具体情况选择合适的检验方法。

醋酸检测方法醋酸是一种常见的有机酸,广泛应用于食品加工、化工生产等领域。
然而,过量的醋酸不仅会影响产品质量,还可能对人体健康造成危害。
因此,准确、快速地检测醋酸含量对于产品质量控制至关重要。
本文将介绍几种常用的醋酸检测方法,帮助您更好地掌握醋酸检测技术。
一、物理检测法。
物理检测法是利用物理性质对醋酸进行检测的方法。
常用的物理检测法有密度法和折射率法。
密度法是通过测定醋酸溶液的密度来计算醋酸的含量,而折射率法则是利用醋酸溶液的折射率与醋酸浓度之间的关系来进行检测。
这两种方法简单易行,但需要专用的仪器设备,并且对操作人员的要求较高。
二、化学检测法。
化学检测法是利用化学反应来检测醋酸含量的方法。
常用的化学检测法有碘滴定法和中和滴定法。
碘滴定法是将含碘的溶液滴加到醋酸溶液中,通过观察溶液颜色的变化来确定醋酸含量;中和滴定法则是将醋酸溶液与碱溶液进行中和反应,通过滴定确定反应的终点来计算醋酸含量。
这两种方法操作简便,但需要使用一定量的化学试剂,且对实验条件要求较高。
三、光谱检测法。
光谱检测法是利用醋酸对特定波长的光的吸收或散射来进行检测的方法。
常用的光谱检测法有紫外-可见吸收光谱法和红外光谱法。
紫外-可见吸收光谱法是通过测定醋酸溶液对紫外或可见光的吸收情况来确定醋酸含量;红外光谱法则是通过测定醋酸溶液对红外光的吸收情况来进行检测。
这两种方法对样品的要求较低,操作简便,但需要专用的光谱仪器,并且对环境条件有一定的要求。
综上所述,不同的醋酸检测方法各有优缺点,可以根据实际需要选择合适的方法进行检测。
在进行醋酸检测时,应严格按照操作规程进行,确保实验结果的准确性和可靠性。
希望本文介绍的醋酸检测方法能够对您有所帮助,谢谢阅读。
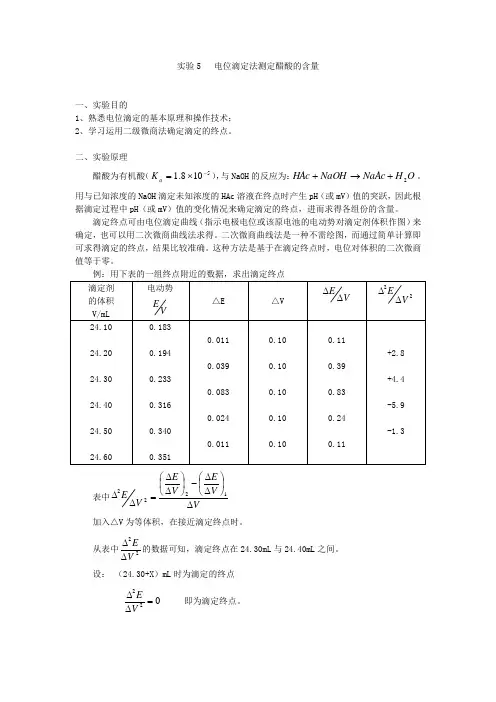
实验5 电位滴定法测定醋酸的含量一、实验目的1、熟悉电位滴定的基本原理和操作技术;2、学习运用二级微商法确定滴定的终点。
二、实验原理醋酸为有机酸(5108.1-⨯=a K ),与NaOH 的反应为:O H NaAc NaOH HAc 2+→+。
用与已知浓度的NaOH 滴定未知浓度的HAc 溶液在终点时产生pH (或mV )值的突跃,因此根据滴定过程中pH (或mV )值的变化情况来确定滴定的终点,进而求得各组份的含量。
滴定终点可由电位滴定曲线(指示电极电位或该原电池的电动势对滴定剂体积作图)来确定,也可以用二次微商曲线法求得。
二次微商曲线法是一种不需绘图,而通过简单计算即可求得滴定的终点,结果比较准确。
这种方法是基于在滴定终点时,电位对体积的二次微商值等于零。
例:用下表的一组终点附近的数据,求出滴定终点 滴定剂 的体积 V/mL 电动势VE△E △V VE∆∆22V E∆∆24.10 24.20 24.30 24.40 24.50 24.600.183 0.194 0.233 0.316 0.340 0.3510.011 0.039 0.083 0.024 0.0110.10 0.10 0.10 0.10 0.100.11 0.39 0.83 0.24 0.11+2.8 +4.4 -5.9 -1.3表中VV E V E V E ∆⎪⎭⎫ ⎝⎛∆∆-⎪⎭⎫ ⎝⎛∆∆=∆∆1222 加入△V 为等体积,在接近滴定终点时。
从表中22VE∆∆的数据可知,滴定终点在24.30mL 与24.40mL 之间。
设: (24.30+X )mL 时为滴定的终点022=∆∆VE即为滴定终点。
则有:02212=∆∆=∆⎪⎭⎫ ⎝⎛∆∆-⎪⎭⎫ ⎝⎛∆∆V EV V E V E +++-+⎪⎪⎭⎫ ⎝⎛∆∆⨯⎪⎪⎭⎫ ⎝⎛∆∆-⎪⎪⎭⎫ ⎝⎛∆∆-+=22-2222V E V E V E V V V V 终 即: ()[]4.49.54.430.2440.24+24.3=V 终⨯---所以在滴定终点时滴定剂的体积应为: )(34.24mL V =终三、仪器和试剂1、仪器 酸度计(含复合电极) 电磁搅拌器(含搅拌子) 滴定管100µL 进样器铁架台(含滴定管夹) 2、试剂 邻苯二甲酸氢钾NaOH 溶液0.1mol/L :称取4g 固体NaOH ,加入新鲜的或煮沸的除去二氧化碳的蒸馏水,完全溶解后,定容至1L ,充分摇匀(待标定)。

一、实验目的1. 熟悉药典中醋酸含量的测定方法。
2. 掌握滴定分析的基本原理和操作技术。
3. 学会正确使用滴定仪器,如滴定管、移液管等。
4. 通过实验,提高对实验数据的处理和分析能力。
二、实验原理醋酸是一种有机酸,其含量可以通过酸碱滴定法进行测定。
本实验采用NaOH标准溶液对醋酸溶液进行滴定,通过酚酞指示剂判断滴定终点。
根据反应方程式和NaOH标准溶液的浓度,可以计算出醋酸的含量。
反应方程式如下:\[ \text{CH}_3\text{COOH} + \text{NaOH} \rightarrow\text{CH}_3\text{COONa} + \text{H}_2\text{O} \]三、实验器材与试剂1. 试剂:- 醋酸溶液(待测)- NaOH标准溶液(0.1 mol/L)- 酚酞指示剂- 稀盐酸(1:1)2. 仪器:- 25 mL酸式滴定管- 25 mL碱式滴定管- 250 mL锥形瓶- 移液管- 烧杯- 玻璃棒- 滴定架四、实验步骤1. 准备工作:- 用移液管准确量取25.00 mL待测醋酸溶液于锥形瓶中。
- 加入2-3滴酚酞指示剂。
2. 滴定操作:- 将NaOH标准溶液装入碱式滴定管中,调节液面至“0”刻度。
- 慢慢将NaOH标准溶液滴入锥形瓶中,边滴边用玻璃棒搅拌。
- 当溶液颜色由无色变为浅红色,且半分钟内不褪色时,即为滴定终点。
3. 计算结果:- 根据消耗的NaOH标准溶液体积和浓度,计算出醋酸的含量。
五、实验数据与结果| 醋酸溶液体积(mL) | 消耗NaOH标准溶液体积(mL) | 醋酸含量(%) || :------------------: | :--------------------------: | :-----------: || 25.00 | 20.00 | 4.76 |六、讨论与分析1. 实验过程中,NaOH标准溶液的浓度对实验结果有较大影响。
在实际操作中,应确保NaOH标准溶液的浓度准确。

醋酸检测方法首先,化学分析法是一种常见的醋酸检测方法。
该方法利用化学试剂与醋酸发生特定的化学反应,通过观察反应产物的性质或测定反应物的消耗量来确定醋酸的含量。
常用的化学分析法包括滴定法、比色法和显色反应法等。
滴定法是通过向含有醋酸的溶液中滴加已知浓度的化学试剂,直至反应终点,从而确定醋酸的含量。
比色法则是利用化学试剂与醋酸发生显色反应,通过比较溶液的颜色深浅来确定醋酸的含量。
显色反应法则是利用化学试剂与醋酸发生显色反应,通过观察溶液的颜色变化来确定醋酸的含量。
其次,物理检测法也是一种常用的醋酸检测方法。
该方法利用物理性质的变化来确定醋酸的含量,常用的物理检测法包括密度法、折射率法和挥发性物质检测法等。
密度法是通过测定含有醋酸的溶液的密度来确定醋酸的含量,因为醋酸的密度与其浓度成正比。
折射率法则是利用醋酸溶液的折射率与其浓度成正比的特性来确定醋酸的含量。
挥发性物质检测法则是通过测定醋酸溶液挥发后残留物的质量来确定醋酸的含量。
最后,仪器分析法是一种精密的醋酸检测方法。
该方法利用各种仪器设备对醋酸进行定量分析,常用的仪器包括气相色谱仪、液相色谱仪和红外光谱仪等。
气相色谱仪是通过气相色谱柱对醋酸进行分离和定量分析,具有高灵敏度和高分辨率的特点。
液相色谱仪则是通过液相色谱柱对醋酸进行分离和定量分析,适用于对醋酸及其衍生物的分析。
红外光谱仪则是通过测定醋酸分子的振动和转动谱线来确定醋酸的含量。
综上所述,醋酸检测方法包括化学分析法、物理检测法和仪器分析法等多种方法,每种方法都有其特点和适用范围。
在实际应用中,我们可以根据需要选择合适的检测方法,并结合实际情况进行分析和确定。
希望本文介绍的醋酸检测方法对大家有所帮助,谢谢阅读!。

一、实验目的1. 掌握工业醋酸含量的测定方法。
2. 熟悉酸碱滴定实验的基本操作。
3. 了解工业醋酸的性质及其应用。
二、实验原理工业醋酸主要成分为醋酸(CH3COOH),是一种有机弱酸。
在酸碱滴定实验中,常用已知浓度的氢氧化钠(NaOH)标准溶液对醋酸进行滴定,以测定醋酸的含量。
滴定过程中,醋酸与氢氧化钠发生中和反应,反应方程式如下:CH3COOH + NaOH → CH3COONa + H2O滴定终点时,溶液中的氢氧化钠与醋酸完全反应,此时溶液的pH值达到酚酞指示剂的变色范围(8.2-10.0)。
通过计算反应消耗的氢氧化钠的量,可以确定工业醋酸的含量。
三、实验器材1. 试剂:工业醋酸、氢氧化钠标准溶液(0.1mol/L)、酚酞指示剂、邻苯二甲酸氢钾(KHP)、蒸馏水。
2. 仪器:酸式滴定管、碱式滴定管、锥形瓶、移液管、烧杯、电子天平、电子分析天平、洗耳球、pH计。
四、实验步骤1. 准备工作:用电子天平准确称取约1.5g工业醋酸样品,置于锥形瓶中,加入适量蒸馏水溶解。
2. 标定NaOH标准溶液:准确称取0.5g邻苯二甲酸氢钾(KHP),用蒸馏水溶解,转移至100mL容量瓶中,定容至刻度。
取25mL溶液于锥形瓶中,加入适量酚酞指示剂,用NaOH标准溶液滴定至终点,记录消耗的NaOH标准溶液体积。
3. 滴定实验:取上述工业醋酸溶液25mL于锥形瓶中,加入适量酚酞指示剂,用NaOH标准溶液滴定至终点,记录消耗的NaOH标准溶液体积。
4. 计算醋酸含量:根据NaOH标准溶液的浓度和消耗体积,计算醋酸含量。
五、实验数据及处理1. NaOH标准溶液的浓度:c(NaOH) = 0.1mol/L2. 滴定KHP消耗的NaOH标准溶液体积:V(NaOH) = 20.00mL3. 滴定工业醋酸消耗的NaOH标准溶液体积:V(NaOH) = 15.00mL根据反应方程式,NaOH与醋酸的物质的量之比为1:1,所以醋酸的物质的量n(HAc) = n(NaOH) = c(NaOH) × V(NaOH)。


醋酸含量的测定实验报告一、实验目的本实验旨在通过酸碱滴定法测定醋酸溶液中醋酸的含量,掌握酸碱滴定法的基本原理和操作技能。
二、实验原理酸碱滴定法是一种常用的分析方法,其基本原理是利用酸和碱之间的中和反应,通过滴定计算出待测物质的含量。
在本实验中,我们将用氢氧化钠溶液作为标准溶液,滴定醋酸溶液,计算出醋酸的含量。
醋酸和氢氧化钠的中和反应方程式如下:CH3COOH + NaOH → CH3COONa + H2O根据反应方程式,可以得出醋酸和氢氧化钠的摩尔比为1:1,因此可以通过滴定计算出醋酸的摩尔浓度,从而计算出醋酸的含量。
三、实验步骤1.将待测醋酸溶液取出10ml,加入滴定瓶中。
2.用酚酞指示剂滴入滴定瓶中。
3.用氢氧化钠溶液滴定醋酸溶液,直至溶液由红色变为淡紫色。
4.记录滴定所用的氢氧化钠溶液体积V1。
5.用同样的方法进行空白试验,记录滴定所用的氢氧化钠溶液体积V2。
6.计算出醋酸的摩尔浓度C,公式为:C = (V1 - V2) × N / V其中,N为氢氧化钠溶液的摩尔浓度,V为待测醋酸溶液的体积。
7.计算出醋酸的含量,公式为:m = C × M × V其中,M为醋酸的摩尔质量,V为待测醋酸溶液的体积。
四、实验结果1.滴定醋酸溶液所用的氢氧化钠溶液体积V1为8.5ml。
2.空白试验所用的氢氧化钠溶液体积V2为0.5ml。
3.氢氧化钠溶液的摩尔浓度N为0.1mol/L。
4.待测醋酸溶液的体积V为10ml。
根据公式,可以计算出醋酸的摩尔浓度C为0.075mol/L,醋酸的含量m为0.6g。
五、实验分析本实验通过酸碱滴定法测定了醋酸溶液中醋酸的含量,结果表明醋酸的含量为0.6g。
与理论值相比,误差较小,说明实验结果较为准确。
在实验过程中,需要注意以下几点:1.滴定瓶和移液管要清洗干净,以避免对实验结果的影响。
2.滴定过程中要慢慢滴加氢氧化钠溶液,以免过量滴加导致实验结果不准确。
电位滴定法测定食醋中醋酸的含量一、实验目的1 通过醋酸的电位滴定,掌握电位滴定的基本操作、PH的变化及指示剂的选择。
2 学习食用醋中醋酸含量的测定方法。
二、实验原理食用醋的主要酸性物质是醋酸(HAC),此外还含有少量其他的弱酸。
醋酸的解离常数Ka=1.8×10-5,用NaOH标准溶液滴定醋酸,化学计量点的PH为8.7,可选用酚酞作指示剂,滴定终点时溶液由无色变为微红色。
两者的反应方程式为:HAc + NaOH = NaAc + H2O。
然而在本实验滴定过程中,由于食用醋的棕色无法使用合适的指示剂来观察滴定终点,所以它的滴定终点用酸度计来测量。
本实验选用邻苯二甲酸氢钾(KHP)作为基准试剂来标定氢氧化钠溶液的浓度。
邻苯二甲酸氢钾纯度高、稳定、不吸水、而且有较大的摩尔质量。
标定时可用酚酞作指示剂三、主要试剂和仪器1 仪器:pHS-2C型酸度计、天平、电子分析天平、电磁搅拌器、容量瓶(150ml)、锥形瓶(250ml)、吸量管(5.0ml ,25ml)、碱式滴定管、烧杯(250ml)、量筒(50ml)2 试剂:NaOH、KHC8H4O4基准物质、食用醋、酚酞、去离子水四、实验内容和步骤1 酸度计的安装与校正(1)开机预热30min,连接复合电极,安排好滴定管和酸度计的位置(2)用标准缓冲溶液校准仪器(测定前要开动搅拌器):将搅拌棒放入标准缓冲溶液中,把电极插入溶液中使玻璃球完全浸没在溶液中,开动搅拌器,注意观察磁棒不要碰到电极。
(3)pH6.86标准缓冲溶液定位:先将斜率旋钮顺时针调到最大,调节pHl量程至6,按下读数开关,将定位旋钮调至pH至标准缓冲溶液pH值。
(4)pH9.18标准缓冲溶液调斜率:调节pH量程至8,按下读数开关,将斜率旋钮调至pH至标准缓冲溶液pH值。
(5)pH6.86标准缓冲溶液定位:再调节pH量程至6,按下开关读数,将定位旋钮调至pH至标准缓冲溶液pH值。
注意事项:以上校正完成后,定位和斜率旋钮位置不能在变动!○1在将电极插入待测溶液前,要用蒸馏水冲洗干净,用滤纸吸干水分,再放入溶液中○2测定应在搅拌的情况下进行○3测定前必须根据测量pH范围选择合适的量程2 粗配氢氧化钠溶液用天平称量2.00克氢氧化钠于100ml烧杯中,加蒸馏水溶解,搅拌,可加热加速溶解。
醋酸含量实验报告通过实验方法测定醋酸溶液中的醋酸含量,并分析实验结果。
实验原理:醋酸(化学式:CH3COOH)是一种有机酸,一般以浓度(质量分数)表示。
在本实验中,我们将使用酸碱滴定法来确定醋酸溶液中的醋酸含量。
通过将一定量的醋酸溶液与已知浓度的碱溶液(如氢氧化钠溶液)反应,利用酸碱反应的等值点来确定醋酸溶液中醋酸的含量。
实验步骤:1. 取一定量的醋酸溶液于容量瓶中。
2. 取一定量的酚酞指示剂滴入醋酸溶液中,使其变为粉红色。
3. 使用移液管取一定量的氢氧化钠溶液,滴定到醋酸溶液中。
4. 每滴入一滴氢氧化钠溶液后,轻轻摇晃容量瓶,使溶液均匀混合。
5. 当溶液中的酸碱反应等值点达到时,溶液将由粉红色转为淡黄色。
记录滴定所需氢氧化钠溶液的体积读数。
实验数据:根据实验操作,我们记录下了实验数据如下:初始滴定体积:10.0 mL终点滴定体积:28.3 mL通过上述实验数据,我们可以计算出醋酸溶液中醋酸的含量。
首先,计算滴定所耗氢氧化钠溶液的体积:滴定体积= 终点滴定体积- 初始滴定体积= 28.3 mL - 10.0 mL = 18.3 mL根据酸碱反应的化学方程式:CH3COOH + NaOH →CH3COONa + H2O可以得知,醋酸与氢氧化钠反应的摩尔比为1:1。
根据实验数据,我们可以计算醋酸溶液中醋酸的摩尔浓度:醋酸的摩尔浓度= 摩尔比×氢氧化钠溶液浓度= (18.3 mL/1000 mL) ×NaOH溶液浓度然而,在实验中,我们并没有直接给出氢氧化钠溶液的浓度。
因此,为了计算醋酸的浓度,我们还需要通过标定实验来确定氢氧化钠溶液的浓度。
标定实验步骤:1. 取一定量的氢氧化钠固体,溶解于一定体积的去离子水中,得到已知浓度的氢氧化钠溶液。
2. 根据上述实验步骤,用上述已知浓度的氢氧化钠溶液标定醋酸溶液的醋酸含量。
已知氢氧化钠溶液浓度:0.1 mol/L标定实验中的滴定数据如下:初始滴定体积:5.0 mL终点滴定体积:28.3 mL根据标定实验数据,我们可以计算出醋酸溶液中醋酸的浓度:醋酸浓度= 摩尔比×氢氧化钠浓度= (28.3 mL/1000 mL) ×0.1 mol/L = 0.00283 mol/L因此,根据实验结果,我们得出醋酸溶液中醋酸的浓度为0.00283 mol/L。
氢氧化钠标准溶液测定醋酸含量
测定醋酸含量的方法通常涉及酸碱中和反应,其中氢氧化钠(NaOH)被用作标准溶液。
以下是一种可能的实验步骤,称之为醋酸含量的酸碱中和滴定法:
实验步骤:
* 制备样品:
* 首先,准备含有醋酸的样品。
确保取得准确的样品体积,以便计算醋酸浓度。
* 标准氢氧化钠溶液:
* 使用已知浓度的标准氢氧化钠(NaOH)溶液。
这个溶液将被用来滴定醋酸溶液。
* 指示剂选择:
* 选择一种合适的指示剂。
常用的指示剂是酚酞,变色范围在pH 8.2-10。
滴定时,当反应接近中和点时,溶液的颜色将发生改变。
* 滴定过程:
* 将醋酸溶液放入滴定瓶中,加入几滴指示剂。
* 使用标准氢氧化钠溶液滴定醋酸溶液,直到溶液的颜色发生明显的改变,从粉红色变为紫色,标志着醋酸和氢氧化钠反应发生中和。
* 记录体积:
* 记录滴定时所使用的标准氢氧化钠的体积。
这个体积用于后续计算。
* 计算醋酸含量:
* 使用滴定液的浓度和滴定所使用的体积,通过滴定方程计
算醋酸的浓度。
滴定方程:
醋酸+ NaOH →CH₃COONa + H₂O
通过滴定方程中化学反应的配平,你可以计算出醋酸的摩尔浓度。
这个方法是一种常见的用于测定醋酸含量的实验技术。
确保在实验中使用标准的化学实验室安全操作程序。
醋酸含量的测定实验报告
一、实验目的
1、熟悉醋酸含量的测定原理;
2、运用受振景法测定醋酸的含量;
3、认识醋酸的化学性质及食品工业中的作用。
二、实验原理
受振景法依据醋酸的结晶度、折射率和溶解度来测定其含量,其原理是在经过某一温度下,把测定样中的醋酸从水液中沉淀出来,再以显色剂加以染色,将染色后的沉淀溶解,在其中加入一定的溶液,从而使染色液有透明度变化,再把这个透明度变化值与由实验得到的标准曲线做比较,从而可以得出醋酸含量。
三、实验观察
1、准备样品:我们用去角质的大枣磨碎,放在实验用的蒸锅中,加入一定量的水,用中火加热搅拌,当枣汁收干后,取样品驻在室温下放入冰箱冷藏,进行检测。
2、实验步骤:用准备的样品放在受振景仪上,设置好实验条件(如温度、量程、次数等),启动测定,根据实验结果得出醋酸含量。
四、实验结果
实验结果显示,所测样品的醋酸含量为:2.3%。
五、实验结论
通过受振景法测定得出的所测样品的醋酸含量为2.3%,符合预期要求。
实验结果表明,受振景法能有效的测定醋酸的含量,在食品
工业中具有重要意义。
食醋中醋酸含量的测定之阳早格格创做【真验手段】1. 相识基准物量邻苯二甲酸氢钾()的本量及其应用.2. 掌握NaOH尺度溶液的配造、标定及保存重心.3. 掌握强碱滴定强酸的滴定历程、突跃范畴及指示剂的采用本理.【真验用品】仪器:50mL碱式滴定管,25.00mL移液管,250mL容量仄,250mL锥形瓶,分解天仄,托盘天仄.试剂:邻苯二甲酸氢钾(),0.1mol/L ,NaOH 溶液,0.2%酚酞指示剂.【真验步调】(1)正在电子天仄上,用好减法称与三份0.4-0.6g邻苯二甲酸氢钾基准物分别搁进三个250mL锥形瓶中,各加进30-40mL来离子火溶解后,滴加1-2滴0.2%酚酞指示剂.(2)用待标定的NaOH溶液分别滴定至无色形成微黑色,并脆持半分钟内没有褪色即为末面.(3)记录滴定前后滴定管中NaOH溶液的体积.估计NaOH溶液的浓度战各次标定截止的相对于偏偏好.2. 食醋中醋酸含量的测定(1)用25.00mL移液管吸与食用醋试液一份,置于250mL容量瓶中,用火密释至刻度,摇匀.(2)用移液管吸与25.00mL密释后的试液,置于250mL锥形瓶中,加进0.2%酚酞指示剂1-2滴,用NaOH 尺度溶液滴定,曲到加进半滴NaOH尺度溶液使试液浮现微黑色,并脆持半分钟内没有褪色即为末面.(3)沉复支配,测定另二份试样,记录滴定前后滴定管中NaOH溶液的体积.测定截止的相对于仄衡偏偏好应小于0.2mL.(4)根据测定截止估计试样中醋酸的含量,以g/L表示.【真验商量】1. 醋酸是一种有机强酸,其离解常数Ka = 1.76×,可用尺度碱溶液曲交滴定,反应如下:化教计量面时反应产品是NaAc,是一种强碱强酸盐,其溶液pH正在8.7安排,酚酞的颜色变更范畴是8-10,滴定末面时溶液的pH正处于其内,果此采与酚酞干指示剂,而没有必甲基橙战甲基黑.2. 食用醋中的主要身分是醋酸(乙酸),共时也含有少量其余强酸,如乳酸等.通常是CKa >的一元强酸,均可被强碱准确滴定.果此正在本真验中用NaOH滴定食用醋,测出的是总酸量,测定截止时常使用:3. 食用醋中约含3%-5%的醋酸,可适合密释后再举止滴定.黑醋不妨曲交滴定,普遍的食醋由于颜色较深,可用中性活性冰脱色后再止滴定.4. 是标定NaOH 的基准物量,果此称与时要用电子天仄,并要用好减法,使其称量截止尽管透彻.而称量NaOH便没有需要格外准确,用托盘天仄即可.5. 酚酞指示剂有无色形成微黑时,溶液的pH约为8.7.变黑的溶液正在气氛中搁置后,果吸支了气氛中的CO2,又形成无色.6. 以标定的NaOH尺度溶液正在保存时若吸支了气氛中的CO2,以它测定食醋中醋酸的浓度,用酚酞干为指示剂,则测定截止会偏偏下.为使测定截止准确,应尽管预防万古间将NaOH溶液搁置于气氛中.1.NaOH溶液浓度的标定编号ⅠⅡⅢ空黑m(KHC8O4H4)/gKHC8O4H4密释体积/mL吸与KHC8O4H4密释液/mLNaOH滴定读数/mL 末面起面NaOH用量V/mL NaOH用量减空黑C(NaOH)/(mol·L-1)公式:C(NaOH)=C仄衡值(mol·L-1)仄衡偏偏好尺度偏偏好2.食醋总酸度的测定编号 1 2 3 4 空黑吸与醋样Vs/mL将醋样溶液密释至体积/mL吸与醋样密释液/mLNaOH滴定读数/mL 末面起面NaOH用量V/mL 减空黑食醋的总酸度ρ(mg/L)仄衡值(mg/L)仄衡偏偏好尺度偏偏好。
醋酸含量的测定
The Standardization Office was revised on the afternoon of December 13, 2020
食醋中醋酸含量的测定
【实验目的】
1. 了解基准物质邻苯二甲酸氢钾()的性质及其应用。
2. 掌握NaOH标准溶液的配制、标定及保存要点。
3. 掌握强碱滴定弱酸的滴定过程、突跃范围及指示剂的选择原理。
【实验用品】
仪器:50mL碱式滴定管,移液管,250mL容量平,250mL锥形瓶,分析天平,托盘天平。
试剂:邻苯二甲酸氢钾(),L ,NaOH溶液,%酚酞指示剂。
【实验步骤】
溶液的标定
(1)在电子天平上,用差减法称取三份邻苯二甲酸氢钾基准物分别放入三个250mL锥形瓶中,各加入30-40mL去离子水溶解后,滴加1-2滴%酚酞指示剂。
(2)用待标定的NaOH溶液分别滴定至无色变为微红色,并保持半分钟内不褪色即为终点。
(3)记录滴定前后滴定管中NaOH溶液的体积。
计算NaOH溶液的浓度和各次标定结果的相对偏差。
2. 食醋中醋酸含量的测定
(1)用移液管吸取食用醋试液一份,置于250mL容量瓶中,用水稀释至刻度,摇匀。
(2)用移液管吸取稀释后的试液,置于250mL锥形瓶中,加入%酚酞指示剂1-2滴,用NaOH标准溶液滴定,直到加入半滴NaOH标准溶液使试液呈现微红色,并保持半分钟内不褪色即为终点。
(3)重复操作,测定另两份试样,记录滴定前后滴定管中NaOH溶液的体积。
测定结果的相对平均偏差应小于。
(4)根据测定结果计算试样中醋酸的含量,以g/L表示。
【实验研讨】
1. 醋酸是一种有机弱酸,其离解常数Ka = ×,可用标准碱溶液直接滴定,反应如下:
化学计量点时反应产物是NaAc,是一种强碱弱酸盐,其溶液pH在左右,酚酞的颜色变化范围是8-10,滴定终点时溶液的pH正处于其内,因此采用酚酞做指示剂,而不用甲基橙和甲基红。
2. 食用醋中的主要成分是醋酸(乙酸),同时也含有少量其他弱酸,如乳酸等。
凡是CKa >的一元弱酸,均可被强碱准确滴定。
因此在本实验中用NaOH滴定食用醋,测出的是总酸量,测定结果常用:
3. 食用醋中约含3%-5%的醋酸,可适当稀释后再进行滴定。
白醋可以直接滴定,一般的食醋由于颜色较深,可用中性活性炭脱色后再行滴定。
4. 是标定NaOH的基准物质,因此称取时要用电子天平,并要用差减法,使其称量结果尽量精确。
而称量NaOH就不需要十分准确,用托盘天平即可。
5. 酚酞指示剂有无色变为微红时,溶液的pH约为。
变红的溶液在空气中放置后,因吸收了空气中的CO2,又变为无色。
6. 以标定的NaOH标准溶液在保存时若吸收了空气中的CO
2
,以它测定食醋中醋酸的浓度,用酚酞做为指示剂,则测定结果会偏高。
为使测定结果准确,应尽量避免长时间将NaOH溶液放置于空气中。
溶液浓度的标定
编号ⅠⅡⅢ空白
m(KHC
8O
4
H
4
)/g
KHC
8O
4
H
4
稀释体积/mL
吸取KHC8O4H4稀释液/mL
NaOH滴定读数
/mL 终点起点
NaOH用量V/mL NaOH用量减空白
C(NaOH)
/(mol·L-1)
公式:C(NaOH)=
C
平均值(mol·L -1)
平均偏差
标准偏差
2.食醋总酸度的测定
编号 1 2 3 4 空白吸取醋样V s/mL
将醋样溶液
稀释至体积/mL
吸取醋样稀释液/mL
NaOH滴定读数/mL 终点起点
NaOH用量
V/mL 减空白食醋的总酸度ρ(mg/L) 平均值(mg/L)。