极性键和非极性共价键
- 格式:ppt
- 大小:262.00 KB
- 文档页数:8

高一年级化学必修1第五章知识点:化学键1.化学键1定义:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。
2类型:Ⅰ离子键:由阴、阳离子之间通过静电作用所形成的化学键。
Ⅱ 共价键:原子之间通过共用电子对所形成的化学键。
①极性键:在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键。
②非极性键:由同种元素的原子间形成的共价键,叫做非极性共价键。
同种原子吸引共用电子对的能力相等,成键电子对匀称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H-H键、O2中O=O键、N2中Nequiv;N键),也可以存在于化合物分子中(如C2H2中的C-C键)。
以非极性键结合形成的分子都是非极性分子。
Ⅲ 金属键:化学键的一种,主要在金属中存在。
由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。
2.化学反应本质就是旧化学键断裂和新化学键形成的过程。
1)离子化合物:由阳离子和阴离子构成的化合物。
大部分盐(包括所有铵盐),强碱,大部分金属氧化物,金属氢化物。
活泼的金属元素与活泼非金属元素形成的化合物中不一定都是以离子键结合的,如AICI3不是通过离子键结合的。
非金属元素之间也可形成离子化合物,如铵盐都是离子化合物。
2)共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。
非金属氧化物,酸,弱碱,少部分盐,非金属氢化物。
3)在离子化合物中一定含有离子键,可能含有共价键。
在共价化合物中一定不存在离子键。
3.物质中化学键的存在规律(1)离子化合物中一定有离子键,可能还有共价键,简单离子组成的离子化合物中只有离子键,如:NaCl、Na2O 等。
复杂离子(原子团)组成的离子化合物中既有离子键又有共价键,如NH4Cl、NaOH等。

极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。

极性与非极性是针对分子说的。
首先化学共价键分为极性键与非极性键。
非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。
而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl再说极性分子与与非极性分子。
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。
比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性对与H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。
CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮>二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)常见问题1:两个相同的原子之间形成的共价键一定是非极性键吗?问题:两个相同的原子之间形成的共价键一定是非极性键吗?解答:两个相同的原子之间形成的共价键不一定是非极性键.例如乙醇分子:两个碳原子两边结构不对称,两边对共用电子对的吸引能力不同,则共用电子对不在两个C原子之间的中心位置,即偏向一方,因而形成的共价键不是非极性键.常见问题2:键的极性和分子的极性问题:键的极性和分子的极性解答:1.键的极性键的极性取决于成键的两原子非金属性强弱.一般说,成键的两原子是同种元素的原子,键为非极性键.如果成键的两原子是不同种元素的原子,键为极性键.2.分子的极性在同一分子中,可以同时存在极性键和非极性键.分子的极性取决于键的极性和分子中的键的空间排列.双原子分子的极性与键的极性是一致的,即以极性键结合的双原子分子一定是极性分子.以非极性键结合的双原子分子一定是非极性分子.对于多原子分子的极性除与键的极性有关系外,还与键的空间排列有关.若键的空间排列对称,为对称分子,分子中正、负电荷重心重合,则是非极性分子.如二氧化碳,四氯化碳等.若键的空间排列不对称,分子中正、负电荷重心不重合,分子中出现了带部分正、负电荷的两极,则是极性分子,如水分子.常见问题3:分子极性的判断问题:分子极性的判断解答:判断是否极性分子,进行判断可从分子空间构型是否对称,即分子中各键的空间排列是否对称,若对称,则正负电荷重心重合,分子为非极性分子,反之,是极性分子。
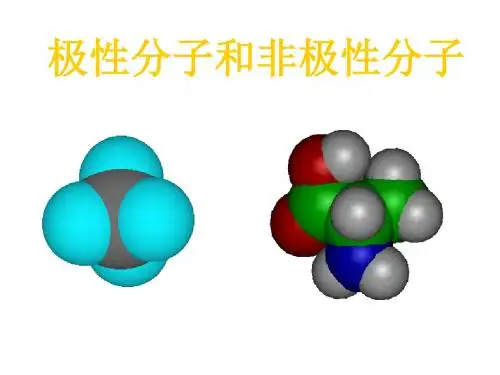

化学键的极性与共价性化学键是化学反应中原子之间的结合力,是构建分子和化合物的基础。
根据电子的共享情况,化学键可以分为离子键、共价键和金属键。
在本文中,我将重点讨论共价键的极性与共价性。
共价键是以电子的共享方式形成的化学键。
它的形成是由两个原子间相互吸引的力量来决定的。
共价键可以分为非极性共价键和极性共价键。
非极性共价键发生在两个具有相同或相近电负性的原子之间,如氢气(H2)和氮气(N2)。
这种共价键中,电子对平均分布在两个原子之间,电子云密度对称分布,两个原子之间不存在正负极性。
相比之下,极性共价键发生在两个电负性不同的原子之间。
在这种共价键中,较电负的原子吸引电子云的能力更强,电子密度向它倾斜,使其具有部分负电荷;较不电负的原子则具有部分正电荷。
例如,氯化氢(HCl)中氯原子的电负性大于氢原子,因此氯原子吸引电子云,使氯原子带有负电荷,氢原子带有正电荷。
这种极性可以通过碳-氧键、氧-氮键等实例中被体现出来。
极性共价键的极性程度可以通过电负性差值来衡量。
电负性是描述一个原子在共享电子对中吸引电子能力的物理量。
根据亨利(Pauling)电负性量表,氟的电负性值最高为4.0,而氢的电负性值为2.2。
两者之间的电负性差值为1.8,因此氢氟键(HF)为极性共价键。
当电负性差值大于0.5时,共价键可以被视为极性共价键。
极性共价键的存在使得某些分子具有极性。
对于极性分子,由于电子云偏向一侧,使得分子在空间中存在不平衡的正负电荷分布,呈现出磁性。
当极性分子相互作用时,正负电荷之间会发生吸引力,形成静电作用。
这种作用力在溶液中导致分子的溶解,同时也能影响分子间的反应速率和产物的选择性。
然而,需要注意的是,并非所有的分子都是极性的。
有些分子由于对称性或电子云密度均匀分布,不具有极性。
例如,四氯化碳(CCl4)具有四个氯原子与碳原子形成共价键,电子云均匀分布,因此不具有极性。
总结起来,化学键的极性与共价性密切相关。




极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。
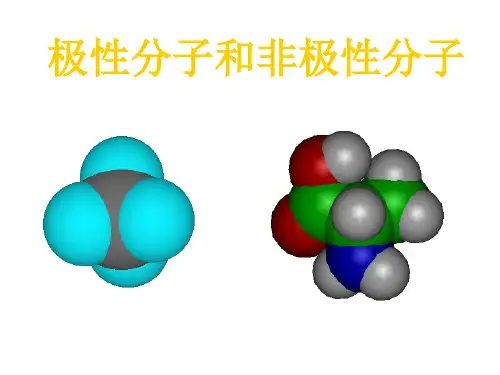

有机化学基础知识点整理共价键与极性有机化学基础知识点整理共价键与极性共价键是有机化学中最常见的键类型之一,它是由两个原子之间共享电子而形成的化学键。
共价键的形成是基于原子核吸引电子的力和电子间排斥的力之间的平衡。
在有机分子中,共价键的极性是非常重要的,它可以影响分子的性质和反应。
1. 共价键的概念共价键是通过原子之间共享电子对而形成的一种化学键。
在共价键中,原子核之间的斥力被电子间的排斥力所抵消,而电子与原子核之间的引力形成了牢固的化学键。
共价键的共享电子对通常由原子的最外层(价层)电子提供。
2. 共价键的形成共价键的形成是通过两个原子间电子的共享来实现的。
共价键的强度取决于原子核的吸引力以及电子间的排斥力。
当两个原子间的原子核吸引力足够强时,它们之间的电子就会形成一个强而稳定的共享。
3. 共价键的极性共价键的极性是指两个结合原子间电子密度的不均匀分布。
当两个不同原子形成共价键时,由于它们的电负性差异,电子密度可能更多地分布在其中一个原子附近。
这种不均匀的分布导致共价键产生极性。
4. 极性共价键极性共价键是指由于原子间电负性差异引起的共价键极性。
其中一个原子的电负性较高,吸引电子的能力更强,而另一个原子的电负性较低,吸引电子的能力较弱。
这种不对称的电子密度分布使得极性共价键形成一个正负电荷分布。
5. 非极性共价键非极性共价键是指原子间电负性相似或相等,电子密度均匀分布的共价键。
这种共价键中没有正负电荷分布的差异,电子对均匀地分布在两个原子的中间。
6. 共价键极性的影响共价键的极性对有机分子的性质和反应有着重要的影响。
极性键具有较强的极性,可以参与到更多的化学反应和相互作用中。
极性键还可以影响分子的空间结构和分子间的相互作用力。
在有机合成中,极性键的存在可以影响反应速率、反应选择性和产物稳定性。
7. 共价键极性的判断在有机化学中,可以通过元素的电负性差异来预测共价键的极性。
常用的方法是使用电负性差值来判断共价键的极性。
有机化学中的键共价键与极性有机化学中的键:共价键与极性有机化学涵盖了许多关于碳的化合物的研究,而在有机化学中,化合物中键的性质对于化合物的性质和反应具有重要的影响。
共价键是有机化学中最常见的键类型,而共价键的性质可通过极性来描述。
本文将详细介绍有机化学中的共价键和极性的概念、性质及其在化合物中的影响。
一、共价键的概念与性质1.1 共价键的概念共价键是指通过电子对的相互作用将两个原子结合在一起的化学键。
它是通过原子之间的电子共享来实现的,电子共享使得原子获得稳定的化学结构。
在有机化学中,碳原子通常与其他碳原子或其他原子通过共价键相连接,形成各种化合物。
1.2 共价键的性质共价键具有以下几个重要的性质:(1)共享电子:共价键中的电子由两个原子共同拥有,并在原子间自由移动。
(2)键长:共价键的长度取决于原子间的距离,一般来说,共价键长度较短。
(3)键能:共价键的能量是保持原子结合所需的能量,通常较强。
(4)键角:共价键会导致原子之间形成特定的角度,这取决于共享电子对的排布方式。
二、极性的概念与性质2.1 极性的概念极性是指化合物中的键或分子中的部分电荷分布不均匀形成的极性化性质。
极性可以通过电负性的差异来描述,电负性是原子对化学键的电子吸引能力的度量。
2.2 极性的性质极性具有以下几个重要的性质:(1)极性键:当两个原子之间的电负性差异较大时,形成的化学键被称为极性键。
极性键通常由一个带有部分正电荷的原子和一个带有部分负电荷的原子组成。
(2)极性分子:当分子中的化学键呈现不均匀的电子密度分布时,分子被称为极性分子。
极性分子具有正极和负极,形成分子间的电荷分布不均。
(3)极性溶剂:与极性分子相互作用时,极性溶剂能够与分子中的部分电荷相互作用,从而溶解非极性物质。
三、共价键与极性的关系共价键的性质与极性息息相关。
在有机化合物中,共价键可以分为非极性共价键和极性共价键。
3.1 非极性共价键当两个原子之间的电负性差异很小时,形成的化学键为非极性共价键。
极性区分极性键与非极性键首先化学共价键分为极性键与非极性键。
非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。
而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl 。
极性分子与非极性分子由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。
比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性。
对于H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。
CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂。
化合物的极性决定于分子中所含的官能团及分子结构。
各类化合物的极性按下列次序增加:—CH3,—CH2—,—CH=,—C三,—O—R,—S—R,—NO2,—N(R)2,—OCOR,—CHO,—COR,—NH2,—OH,—COOH,—SO3H化学式中的R表示的是烷基基团常用溶剂的极性顺序:水(最大)>甲酰胺>三氟乙酸>DMSO>乙腈>DMF>六甲基磷酰>甲醇>乙醇>乙酸>异丙醇>吡啶>四甲基乙二胺>丙酮>三乙胺>正丁醇>二氧六环>四氢呋喃>甲酸甲酯>三丁胺>甲乙酮>乙酸乙酯>氯仿>三辛胺>碳酸二甲酯>乙醚> 异丙醚>正丁醚>三氯乙烯>二苯醚>二氯甲烷>二氯乙烷>苯>甲苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(石油醚)(最小)常见的几种万能溶剂1. 二甲基亚砜二甲基亚砜广泛用作溶剂和反应试剂,特别是丙烯腈聚合反应中作加工溶剂和抽丝溶剂,作聚氨酯合成及抽丝溶剂,作聚酰胺,聚酰亚胺和聚砜树脂的合成溶剂,以及芳烃,丁二烯抽提溶剂和合成氯氟苯胺的溶剂等。
化学键的极性与分子极性计算化学键的极性与分子极性计算是化学领域中重要的内容,它们对于理解分子的性质和相互作用具有重要的意义。
在本文中,我们将探讨化学键的极性以及如何计算分子的极性。
一、化学键的极性化学键的极性是指共价键中电子的偏移程度。
根据原子的电负性差异,化学键可分为极性键和非极性键两种类型。
1. 极性键极性键在形成过程中,电子会被一个原子部分占据,造成电子在空间上的不对称分布。
其中,电负性较大的原子会吸引更多的电子,因此具有部分负电荷;而电负性较小的原子则带有部分正电荷。
极性键的存在使得分子具有极性。
2. 非极性键非极性键中的电子分布是对称的,两个键中的电子数相等。
这种情况通常出现在两个相同元素之间,或者两个电负性非常接近的元素之间。
非极性键的存在不改变分子的极性。
二、分子极性的计算有几种常见的方法可以用于计算分子的极性,这些方法可以通过计算电荷分布或者预测分子的几何构型来确定分子的极性。
1. 电荷分布计算电荷分布计算方法通过计算分子中各个原子的电荷分布来预测分子的极性。
其中,常用的方法包括电荷密度分析、Mulliken电荷分析和自然电荷分析等。
这些方法可以通过计算原子的有效电荷和分子的偶极矩来判断分子的极性。
2. 预测分子几何构型分子的几何构型对于分子的极性有很大的影响。
根据分子的几何构型,可以预测分子的极性。
常用的方法包括VSEPR理论和分子轨道理论等。
VSEPR理论通过分子中的原子数和孤对电子数来预测几何构型。
在确定了几何构型后,可以根据不同原子之间的电负性差异来判断分子的极性。
分子轨道理论则通过计算分子轨道的叠加程度来确定分子的极性。
广义上来讲,如果分子轨道的叠加程度比较高,则分子的极性较低;反之,如果分子轨道的叠加程度比较低,则分子的极性较高。
三、实际示例与应用化学键的极性和分子的极性对于理解和预测分子的性质具有重要意义。
以水(H2O)为例,水分子由两个极性氢氧键组成。
氧原子的电负性较大,会吸引周围的电子,因此带有部分负电荷;而氢原子则带有部分正电荷。
极性共价键与非极性共价键
极性共价键和非极性共价键的区别
一、特点不同:
1、极性共价键:
同种元素的原子间形成的共价键,共用电子对在成键两原子的中间,不向任何一方偏转。
2、非极性共价键:
不同种元素的原子间形成的键,都是极性键,共用电子对偏向非金属性强原子一方,这种带部分正负电荷叫极性键。
二、存在条件:
1、极性共价键:
并不是只有非金属元素之间才有可能形成极性共价键,金属与非金属之间也可以形成极性共价键(比如AlCl3),一般来说,只要两个非金属原子间的电负性不同,且差距小于1.7,则形成极性键,大于1.7时,则形成离子键。
2、非极性共价键:
非极性共价键存在于单质中,也存在于某些化合物中,完全由非极性键构成的分子一定是非极性分子(但有的非极性分子中含有极性键)。