第三节 第1课时 共价键的极性(学生版)
- 格式:docx
- 大小:515.35 KB
- 文档页数:7

第二章第三节第一课时《共价键的极性》学案【学习目标】1.知道共价键可分为极性和非极性共价键,能利用电负性判断共价键的极性。
2.知道分子可以分为极性分子和非极性分子,能根据分子的空间结构和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。
【学习过程】一、认识共价键的极性1、【学生活动1】写出Cl2、HCl、H2O、CCl4的电子式和结构式,讨论这些分子中共用电子对是否相同。
2、共价键的极性从共用电子对是否偏移的角度,共价键可分为____________和______________;共价键产生极性的原因___________________________________________________。
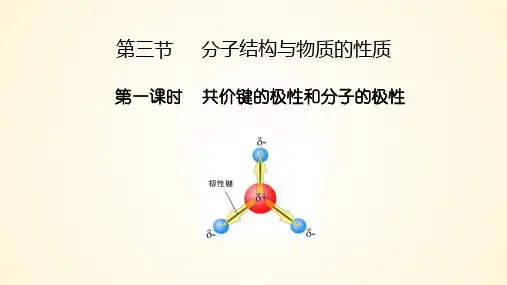
二、认识分子的极性1、【演示实验】分子的极性2、极性分子和非极性分子像水分子这样,分子中_______________________________________________的分子是极性分子;像四氯化碳分子这样,分子中__________________________________________的分子是非极性分子;3、共价键的极性和分子的极性的关系H 2OCCl 4______________决定→__________________________ —决定→______________ ______________4、从向量角度判断分子的极性 共价键极性的向量表示:【学生活动3】归纳与整理常见AB n型分子的极性*特别地,O3是V形分子,分子中的共价键是极性键,中心氧原子呈正电性的,端位的两个氧原子呈负电性,故O3为分子。
三、键的极性对化学性质的影响键的极性对物质的化学性质有重要的影响。
例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。
羧酸的酸性可用p K a(p K a=-lg K a)的大小来衡量,p K a,酸性。
【学生活动4】观察表格,思考回答问题。

《共价键的极性》教学设计一、课标解读《共价键的极性》是选择性必修模块2物质结构与性质的主题2:微粒间的相互作用与物质的性质中的内容,课程标准(《普通高中化学课程标准(2017年版2020年修订)》)对这部分内容的要求具体如下:1.内容要求(1)知道共价键可分为极性和非极性共价键;(2)知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。
2.学业要求(1)能利用电负性判断共价键的极性;(2)能根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。
二、教材分析本节内容选自高中化学人教版选择性必修二《物质结构与性质》第2章“分子的结构与性质”第3节分子的性质第一课时。
本节是在学习了共价键和分子的立体构型的基础上,进一步来认识分子的极性,能从共用电子对是否发生偏移的角度认识键的极性的实质是成键原子分别带正电和负电。
掌握分子极性和分子中键的极性、分子的空间结构密切相关。
能从微观角度理解共价键的极性和分子极性的关系,培养学生微观辨识的科学素养,通过键的极性对物质性质的影响的探析,形成“结构决定性质"的认知模型。
鲁科版教材中内容的编排顺序与人教版中不同,在鲁科版中共价键的极性安排在第一节共价键的分类中,而分子的极性安排在第三节,两个内容的学习较为分散。
在鲁科版教材中安排了分子极性的实验:用带静电的橡胶棒分别靠近水流和四氯化碳,观察流向,给学生认识分子极性提供了感性认识,便于学生直观感知。
三、学情分析教学中要充分考虑学生已有的知识基础,已学习了共价键、电负性、酸的电离常数等知识,通过上一节的学习,学生也了解了常见分子的空间构型,这些都为本节课学习共价键的极性和分子的极性做好了知识铺垫。
能力方面,学生从微观角度理解并解释宏观性质的能力比较欠缺,需要进一步通过本节内容的学习进行强化。
四、素养目标【教学目标】1.知道共价键可分为极性共价键和非极性共价键;能利用电负性判断共价键的极性。

第三节分子的性质第1课时键的极性和分子的极性范德华力和氢键1.了解共价键的极性和分子的极性及产生极性的原因。
2.知道范德华力、氢键对物质性质的影响。
3.能应用分子结构的知识判断分子的极性。
键的极性和分子的极性[学生用书P28]1.键的极性2.分子的极性3.键的极性和分子的极性的关系(1)一般只含非极性键的分子是非极性分子。
(2)含有极性键的分子,若分子结构是空间对称的,则为非极性分子,否则是极性分子。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)极性分子中不可能含有非极性键。
( )(2)离子化合物中不可能含有非极性键。
( )(3)非极性分子中不可能含有极性键。
( )(4)一般极性分子中含有极性键。
( )(5)H2O、CO2、CH4都是非极性分子。
( )答案:(1)×(2)×(3)×(4)√(5)×2.下列各组物质中,都是由极性键形成极性分子的一组是( )A.CH4和Br2B.NH3和H2OC.H2S和CCl4D.CO2和HCl解析:选B。
CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S都是由极性键形成的极性分子,Br2是由非极性键形成的非极性分子。
分子极性的判定1.判断分子极性的一般思路2.判断AB n型分子极性的方法(1)化合价法:AB n型分子中,中心原子的化合价的绝对值等于该原子的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,该分子为极性分子。
具体实例如下:分子BF3CO2SO3(g) H2O NH3SO2中心原子的化合价的绝对值3 4 6 2 3 4中心原子的价电子数3 4 6 6 5 6分子极性非极性非极性非极性极性极性极性类型实例键的极性立体构型分子极性X2H2、N2非极性键直线形非极性分子XY HCl、NO 极性键直线形极性分子XY2 (X2Y) CO2、CS2极性键直线形非极性分子SO2极性键V形极性分子H2O、H2S 极性键V形极性分子XY3BF3极性键平面三角形非极性分子NH3极性键三角锥形极性分子XY4CH4、CCl4极性键正四面体形非极性分子下列叙述中正确的是( )A.NH3、CO、CO2都是极性分子B.CH4、CCl4都是含有极性键的非极性分子C.HF、HCl、HBr、HI的稳定性依次增强D.CS2、H2O、C2H2都是直线形分子[解析] CO2是非极性分子,A项错误。
第1课时共价键的极性范德华力发展目标体系构建1.能从微观角度理解共价键的极性对分子极性的影响,能说出范德华力对分子某些性质的影响。
2。
通过键的极性及范德华力对物质性质的影响的探析,形成“结构决定性质”的认知模型。
一、共价键的极性1.键的极性和分子的极性(1)键的极性分类极性共价键非极性共价键成键原子不同元素的原子同种元素的原子电子对发生偏移不发生偏移成键原子一个原子呈正电性(δ+)呈电中性的电性一个原子呈负电性(δ-)(2)极性分子和非极性分子(3)键的极性与分子极性之间的关系①只含非极性键的分子一定是非极性分子。
②含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子,否则为极性分子。
③极性分子中一定有极性键,非极性分子中不一定含有非极性键。
例如CH4是非极性分子,只含有极性键。
含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
微点拨:键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关.2.键的极性对化学性质的影响键的极性对物质的化学性质有重要的影响.例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性.羧酸的酸性可用p K a的大小来衡量,p K a越小,酸性越强。
羧酸的酸性大小与其分子的组成和结构有关,如下表所示.不同羧酸的p K a羧酸p K a丙酸(C2H5COOH) 4.88乙酸(CH3COOH) 4.76甲酸(HCOOH)3。
75氯乙酸(CH2ClCOOH) 2.86二氯乙酸(CHCl2COOH) 1.29三氯乙酸(CCl3COOH)0。
65三氟乙酸(CF3COOH)0。
23为什么甲酸、乙酸、丙酸的酸性逐渐减弱?[提示]烃基是推电子基团,烃基越长推电子效应越大,使羧基中的烃基的极性越小,羧酸的酸性越弱。
所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。
二、范德华力1.分子间的作用力—-范德华力(1)概念:物质的分子之间存在着相互作用力,把这类分子间作用力称为范德华力。

第3讲化学键化学键:化合物中,使离子相结合或原子相结合的作用力。
一、离子键1.定义:阴阳离子之间强烈的相互作用叫做离子键。
相互作用:2.形成过程3.离子化合物种类:像NaCl这种由离子构成的化合物叫做离子化合物。
(1)(2)(3)(4)说明:①一般含金属元素的物质(化合物)+铵盐。
(一般规律)②酸不是离子化合物。
③离子键只存在离子化合物中,离子化合物中一定含有离子键。
二、共价键1.共价键:(1)定义原子间通过共用电子对所形成的相互作用叫做共价键。
(2)形成过程:(4)共价键的存在:非金属单质:H2、X2、N2等(稀有气体除外)共价化合物:H2O、CO2、SiO2、H2S等复杂离子化合物:强碱、铵盐、含氧酸盐(5)共价键的分类:非极性键:在同种元素..的原子间形成的共价键为非极性键。
共用电子对不发生偏移。
极性键:在不同种元素..的原子间形成的共价键为极性键。
共用电子对偏向吸引能力强的一方。
三、电子式:定义:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
1.原子的电子式:Na Al C N F2.阴阳离子的电子式:(1)阳离子 简单阳离子:离子符号即为电子式,如Na +、、Mg 2+等复杂阳离子:如NH 4+ 电子式:_______________H 3+O_______________(2)阴离子 简单阴离子:Cl — ___________ S 2-__________复杂阴离子:OH —__________3.物质的电子式:(1)离子化合物:阴、阳离子的电子式结合即为离子化合物的电子式。
AB 型:NaCl_________ MgO___________,A 2B 型:如Na 2O _________ K 2S ________AB 2型:如MgCl 2 _______________NaOH___________ Na 2O 2______________ Na 3N_________Ca(OH)2___________(2)某些非金属单质:如:Cl 2______ H 2________ N 2_______(3)共价化合物:如HCl_________、H 2O_________CO 2_____________、NH 3__________、CH 4_________ NH 4Cl_________CCl 4 __________ HClO__________4.用电子式表示形成过程:Mg 2 + [O ] 2 - O Mg + Br ] - Mg 2 + [Br ] - Br Mg Br + + + [S ] 2 -K + K S K + + K + [S ] 2 - K + S 2 K + Br Br Br Br + H O H 2 H + O H N H HN 3 H+ O C O 2 O C +四、离子化合物和共价化合物的判断:(1)根据化合物类别判断:离子化合物:活泼金属氧化物、强碱、大多数盐(铵盐);共价化合物:气态氢化物、含氧酸、非金属氧化物、大多数有机物。

化学键的共价与极性化学键是化学反应中不可或缺的一部分,它使原子可以组合成分子、化合物和材料。
化学键可以分为共价键和离子键,其中共价键又可以进一步细分为极性共价键和非极性共价键。
本文将详细介绍化学键的共价与极性。
一、共价键共价键是两个原子间由电子对共享而形成的键。
共价键的形成是通过两个原子的原子轨道重叠达到能量最低的状态。
在共价键的形成过程中,原子会通过共享电子对来完成电子的填充和稳定。
二、非极性共价键非极性共价键是指两个原子通过共享电子形成的键,并且这两个原子中的电负性相等或非常接近。
它们对电子的吸引力是相等的,因此电子对是等距离地位于两个原子之间。
非极性键发生在同种原子之间或电负性相等的不同原子之间。
三、极性共价键极性共价键是指两个原子通过共享电子形成的键,且这两个原子中的电负性存在差异。
在极性共价键中,电子对不会等距离地位于两个原子之间,而是更靠近其中一个原子。
这样,带正电荷的原子吸引电子对,带负电荷的原子则被电子对所吸引。
极性共价键的电子云会产生偏移,形成一个部分正电荷和一个部分负电荷的化学键。
这种情况下,原子间的电子分布不均匀,导致极性共价键具有极性。
例如,氯气分子(Cl2)中的两个氯原子之间形成了一个极性共价键。
氯原子的电负性较高,因此它吸引电子对并形成部分负电荷,而另一个氯原子则具有部分正电荷。
四、极性分子极性共价键的存在使得分子整体上具有极性。
极性分子在空间中会出现正负电荷分布的不均匀,这样便会产生分子间的相互作用力。
这些相互作用力在化学反应和物质特性中起着重要的作用。
极性分子的典型例子是水(H2O)分子。
水分子由两个氢原子和一个氧原子组成,氧原子电负性较高。
这导致氧原子部分负电荷,两个氢原子则部分正电荷。
因此,水分子具有极性共价键,并且整个分子呈现出极性。
极性分子常常会相互吸引而形成氢键,这种作用力在许多化学和生物学过程中都起着重要的作用。
例如,水分子的极性使其能够溶解许多物质,促进了生物体内的许多化学反应。

浅谈共价键的极性和分子的极性判断共价键是指两个原子通过共享电子对而形成的化学键,是化学中常见的一种键型。
在共价键中,分子中的原子通过共享电子对来实现化学连接,但不同原子之间的电负性差异会导致共价键极性的产生,进而影响分子的整体极性。
本文将从共价键的极性产生机制和分子的极性判断方法两个方面进行浅谈。
一、共价键的极性产生机制在共价键中,如果参与共价键形成的原子之间的电负性差异较大,就会导致共价键中电子对的偏离,从而形成偏离的共价键,即极性共价键。
具体来说,如果一个原子对电子对的吸引能力比另一个原子强,那么这个原子就会对电子对产生更大的吸引力,导致电子对偏向于这个原子,从而形成偏离的共价键。
这就是共价键极性的产生机制。
以氢氟化氢为例,氢原子的电负性为2.20,氟原子的电负性为3.98。
由于氟原子的电负性远远大于氢原子,导致共价键中的电子对偏向于氟原子,形成了极性共价键。
这种极性共价键的存在会影响整个分子的极性,使得氢氟化氢分子呈现出极性分子特征。
二、分子的极性判断方法1. 根据分子中原子的电负性差异来判断分子的极性。
如果分子中存在两种不同种类的原子,并且它们的电负性差异较大,就有可能形成极性共价键,进而使整个分子呈现极性。
HCl分子中氢原子的电负性为2.20,氯原子的电负性为3.16,由于两者的电负性差异较大,使HCl分子呈现出极性。
2. 根据分子的空间构型来判断分子的极性。
分子的极性不仅受到化学键的影响,还受到分子的空间构型的影响。
在分子中如果原子围绕中心原子呈现出不对称的空间构型,即使分子中不存在极性共价键,也有可能使整个分子呈现出极性。
以二氧化碳为例,二氧化碳中虽然碳与氧之间的化学键是非极性共价键,但由于分子呈线形结构,使得整个分子呈现出极性。
3. 根据分子的性质来判断分子的极性。
一些物理性质,如分子的沸点、熔点、溶解度等,也能够反映出分子的极性。
通常来说,极性分子之间的相互作用比非极性分子之间的相互作用要更加强烈,从而导致极性分子的物理性质会有所不同。
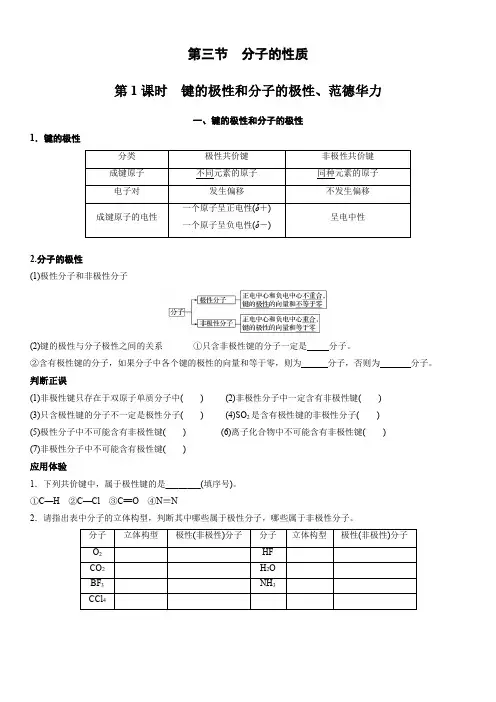
第三节分子的性质第1课时键的极性和分子的极性、范德华力一、键的极性和分子的极性1.键的极性2.分子的极性(1)极性分子和非极性分子(2)键的极性与分子极性之间的关系①只含非极性键的分子一定是分子。
②含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为分子,否则为分子。
判断正误(1)非极性键只存在于双原子单质分子中() (2)非极性分子中一定含有非极性键()(3)只含极性键的分子不一定是极性分子() (4)SO2是含有极性键的非极性分子()(5)极性分子中不可能含有非极性键() (6)离子化合物中不可能含有非极性键()(7)非极性分子中不可能含有极性键()应用体验1.下列共价键中,属于极性键的是________(填序号)。
①C—H②C—Cl③C==O④N≡N2.请指出表中分子的立体构型,判断其中哪些属于极性分子,哪些属于非极性分子。
归纳总结判断共价键的极性与分子极性的方法(1)键的极性的判断方法①从组成元素⎩⎪⎨⎪⎧ 同种元素A—A 型为非极性键不同种元素A—B 型为极性键 ②从电子对偏移⎩⎪⎨⎪⎧ 有偏移为极性键无偏移为非极性键③从电负性⎩⎪⎨⎪⎧电负性相同,即同种元素为非极性键电负性不同,即不同种元素为极性键 (2)分子的极性的判断方法①化合价法:AB m 型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的立体构型对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的立体构型不对称,其分子为极性分子。
②根据所含共价键的类型及分子的立体构型判断。
③根据中心原子最外层电子是否全部成键判断中心原子即其他原子围绕它成键的原子。
分子中的中心原子最外层电子若全部成键不存在孤电子对,此分子一般为非极性分子;分子中的中心原子最外层电子若未全部成键,存在孤电子对,此分子一般为极性分子。
CH 4、BF 3、CO 2等分子中的中心原子的最外层电子均全部成键,它们都是非极性分子。

第二章分子结构与性质第三节分子结构与物质的性质第一课时共价键的极性【必备知识基础练】1.下列化学键中,键的极性最强的是()A.H—F B.H—OC.H—N D.H—C【答案】A【解析】同周期元素随着核电荷数的增加,电负性逐渐增大,F、O、N、C这四种元素中C的电负性最小,F的电负性最大,所以H—F的极性最强。
2.下列叙述不正确的是()A.卤化氢分子中,卤族元素的非金属性越强,共价键的极性越强,稳定性也越强B.以极性键结合的分子不一定是极性分子C.可确定A2B或AB2型分子是极性分子的依据是含有极性键且分子构型不对称,分子结构为键角小于180°的非直线形结构D.非极性分子中各原子之间都以非极性键结合【答案】D【解析】对比HF、HCl、HBr、HI分子中卤族元素(X为卤素原子)的非金属性越强,极性键越强,A正确;CO2分子是极性键构成非极性分子,B正确;A2B型分子如H2O、H2S分子是极性分子的依据是分子构型不对称,而CO2、CS2为直线形分子,键角为180°,分子构型对称,为非极性分子,C正确;空间构型对称的非极性多原子分子中可能含有极性键,如CH4,D错误。
3.人们为了营养肌肤,往往需要搽用护肤品。
在所有的护肤品中都含有保湿的甘油(丙三醇),已知其结构简式为CH2OHCHOHCH2OH。
以下对甘油分子的叙述中,正确的是()A.分子中只含有极性键B.分子中只含有非极性键C.分子中既含有σ键又含有π键D.分子中既含有极性键又含有非极性键【答案】D【解析】在甘油分子中,碳原子之间、碳原子与氧原子、碳原子与氢原子、氧原子与氢原子之间都是共价单键,故分子中只含有σ键,C错误;分子中既含有极性键(C—H、O—H、C—O)又含有非极性键(C—C),因此A、B错误,D正确。
4.(双选)通常状况下,NCl3是一种油状液体,其分子空间结构与氨分子相似,下列对NCl3的有关叙述正确的是()A.NCl3分子中N—Cl的键长比CCl4分子中C—Cl的键长长B.NCl3分子是非极性分子C.NCl3分子中的所有原子均达到8电子稳定结构D.NBr3与NCl3分子的空间结构相似【答案】CD【解析】C原子的原子半径大于N原子的原子半径,所以CCl4中C—Cl的键长比NCl3中N—Cl的键长长,A 错误;NCl3分子的空间结构与氨分子相似,都是三角锥形结构,氨分子是极性分子,所以NCl3分子也是极性分子,B错误;NCl3分子中N原子最外层电子数为5+3=8,NCl3分子中Cl原子最外层电子数为7+1=8,所以N原子和Cl原子均达到8电子稳定结构,C正确;NBr3与NCl3分子的空间结构都是三角锥形,D项正确。
学生活动【情境引入】微波炉的加热原理任务一:分子的极性【讲解】分子的极性(1)极性分子:分子的正电中心和负电中心不重合,使分子的某一部分呈正电性,另一部分呈负电性,这样的分子是极性分子。
如HCl、H2O等。
(2)非极性分子:分子的正电中心和负电中性重合,使分子没有带正电和带负电的两部分,这样的分子是非极性分子。
如P4、CO2等。
【设疑】为什么水分子内部正电中心和负电中心不重合?共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移? 【讲解】有些共用电子对的两个原子由于电负性不同,那么共用电子对在两原子周围出现的机会便不同,即共用电子对发生偏移。
有些共用电子对的两个原子由于电负性相同,那么共用电子对在两原子周围出现的机会相同,即共用电子对不发生偏移。
根据共用电子对是否偏移,可以将共价键分为极性键和非极性键。
任务二:键的极性【讲解】2.键的极性以HCl分子为例,HCl分子是由不同元素的原子构成的,Cl原子的电负性大于H原子,致使共用电子对发生偏移,那么会使H原子呈正电性、Cl原子呈负电性。
以Cl2分子为例,Cl2分子是由同种元素的原子构成的,每个Cl原子的电负性相同,致使共用电子对不发生偏移,使成键原子呈电中性。
【讲解】判断分子的极性可依据分子中的化学键的极性向量和。
从向量的角度认识分子的极性,若分子中共价键的极性的向量和等于0,则分子中没有带正电和带负电的两部分,为非极性分子,如BF3、CH4等。
【展示】展示BF3、CH4的空间构型。
【讲解】BF3分子中对称的3个F所带负电的向量和位于分子中心,即与B重合,且负电量与B所带正电量相等,分子不带电,为非极性分子。
CH4分子中对称的4个H所带正电的向量和位于分子中心,即与C重合,且正电量与C所带负电量相等,分子不带电,为非极性分子。
【学生活动】试从向量的角度理解极性分子,并解释H2O、NH3为极性分子的原因。
【讲解】H2O为极性分子的原因:2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合。
第三节 分子结构与物质的性质第1课时 共价键的极性 学业要求核心素养建构1.知道分子极性与分子中键的极性、分子的空间结构密切相关。
2.能根据分子结构特点和键的极性来判断分子的极性。
并据此对分子的一些典型性质及其应用做出解释。
『知识梳理』一、键的极性和分子的极性1.键的极性共价键—⎪⎪⎪—极性键:由不同原子形成,电子对发生偏移—非极性键:由相同原子形成,电子对不偏移2.分子的极性分子—⎪⎪⎪—极性分子:正电中心和负电中心不重合—非极性分子:正电中心和负电中心重合 3.键的极性和分子极性的关系(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子有没有极性,必须依据分子中极性键的极性的向量和是否等于零而定,等于零时是非极性分子。
特别提醒:臭氧分子中的共价键是极性键,臭氧分子的中心原子是呈正电性的,而两端的两个氧原子是呈负电性的。
所以臭氧分子是极性分子。
[微自测]1.判断正误,正确的打“√”;错误的打“×”。
(1)以非极性键结合的双原子分子一定是非极性分子。
( )(2)以极性键结合的分子一定是极性分子。
( )(3)非极性分子只能是双原子单质分子。
( )(4)非极性分子中,一定含有非极性共价键。
( )答案 (1)√ (2)× (3)× (4)×二、键的极性对化学性质的影响1.羧酸酸性的表示方法 羧酸的酸性可用p K a 的大小来衡量,p K a =-lg__K a ,p K a 越小,酸性越强。
2.羧酸的酸性大小与其分子组成和结构的关系(1)含卤素原子的一元羧酸的酸性①三氟乙酸的酸性大于三氯乙酸的,这是由于氟的电负性大于氯的电负性,F —C 的极性大于Cl —C 的极性,使F 3C —的极性大于Cl 3C —的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
②三氯乙酸的酸性大于二氯乙酸的酸性,二氯乙酸的酸性大于氯乙酸的酸性。
(2)只含烃基的一元羧酸的酸性烃基是(符号R —)是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
第三节分子结构与物质的性质第1课时共价键的极性[核心素养发展目标] 1.能从微观角度理解共价键的极性和分子极性的关系。
2.通过键的极性对物质性质的影响的探析,形成“结构决定性质”的认知模型。
一、键的极性和分子的极性1.共价键的极性H—Cl、说明:(1)(用δ-表示),电负性小的原子呈正电性(用δ+表示)。
(2)电负性差值越大的两原子形成的共价键的极性越强。
2.分子的极性(1)极性分子与非极性分子(2)含键的双原子分子是极性分子,含键的双原子分子是非极性分子。
(3)判断AB n型分子的极性①完成下表:②认真研究①中各分子中心原子的化合价,寻找中心原子的化合价与分子极性的关系。
提示:(4)探究判断下列分子是极性分子还是非极性分子。
①P4(白磷)②CH2==CH2③CH≡CH④C2H5OH⑤极性分子:________(填序号,下同);非极性分子:____________。
(1)以非极性键结合的双原子分子一定是非极性分子()(2)以极性键结合的分子一定是极性分子()(3)非极性分子只能是双原子单质分子()(4)非极性分子中,一定含有非极性共价键()(5)极性分子中不可能含有极性键()1.键的极性与分子极性有何关系?提示①:②:③:2.臭氧是极性分子还是非极性分子?从结构上如何理解?提示:键的极性和分子极性的关系1.下列跟氢原子形成的极性键最强的原子是()A.F B.Cl C.Br D.P2.已知N、P均属于元素周期表的第ⅤA族元素。
N在第二周期,P在第三周期。
NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H间的夹角是107°。
(1)N4分子的空间结构为,它是一种______(填“极性”或“非极性”)分子。
(2)PH3分子中P—H________(填“有”或“无”,下同)极性,PH3分子________极性。
(3)NCl3是一种淡黄色油状液体,下列对NCl3的有关描述不正确的是________(填字母)。
a.该分子呈平面三角形b.该分子中的化学键为极性键c.该分子为极性分子d.因N—Cl的键能大,故NCl3稳定二、键的极性对化学性质的影响羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用p K a(p K a=-lg K a)的大小来衡量,p K a越小,酸性越强。
根据下表,回答有关问题:1.三氟乙酸和三氯乙酸哪个酸性强?原因是什么?提示:2.甲酸和乙酸哪个酸性强?原因是什么?提示:1.CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?解释原因。
提示:2.三氟乙酸(CF3COOH)的酸性远强于乙酸(CH3COOH)的原因是什么?提示:1.下列物质中,酸性最强的是()A.HCOOH B.HOCOOH C.CH3COOH D.C6H13COOH2.下列几种有机羧酸中,按酸性由强到弱的顺序排列正确的是()①乙酸(CH3COOH)②氯乙酸(CH2ClCOOH)③三氯乙酸(CCl3COOH)④三氟乙酸(CF3COOH)A.②①④③B.①②③④C.④③②①D.③②④①1.键的极性对物质的化学性质有重要影响由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
2.羧基的酸性大小与分子组成和结构的关系(1)含卤素原子的一元羧酸的酸性①含相同个数的不同卤素原子的羧酸,卤素原子的电负性数值越大,羧酸的酸性越强。
②含不同数目的同种卤素原子的羧酸,卤素原子的数目越多,羧酸的酸性越强。
(2)只含烷基的一元羧酸的酸性随着烷基加长,酸性的差异越来越小。
(3)只含烷基的多元羧酸的酸性烷基所含碳原子数越少,羧基个数越多,酸性越强。
1.下列叙述正确的是()A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,热稳定性也越强B.只含非极性键的分子不一定是非极性分子C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极性键D.非极性分子中,各原子间都应以非极性键结合2.用一带静电的玻璃棒分别靠近A、B两种纯液体流,现象如图所示,下列关于A、B两种液体分子的极性判断正确的是()A.A是极性分子,B是非极性分子B.A是非极性分子,B是极性分子C.A、B都是极性分子D.A、B都是非极性分子3.下列叙述正确的是()A.NO、N2O、NO2、NH3都是非极性分子B.CO2、SO3、BCl3都是非极性分子C.H2O、NH3都是极性分子,分子中的O—H比N—H的极性弱D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子4.(2022·山西柳林县鑫飞中学高二期中)下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是()A.SF6是由极性键构成的非极性分子B.32 g S8分子中含有0.125 mol σ键C.C2H2是既有极性键又有非极性键的非极性分子D.S8中S原子的杂化方式为sp3杂化5.在HF、H2O、NH3、CS2、CH4、N2分子中:(1)以非极性键相结合的非极性分子是________。
(2)以极性键相结合,具有直线形结构的非极性分子是________。
(3)以极性键相结合,具有三角锥形结构的极性分子是________。
(4)以极性键相结合,具有正四面体结构的非极性分子是________。
(5)以极性键相结合,具有V形结构的极性分子是____。
(6)以极性键相结合,而且分子极性最大的是________。
题组一键的极性与分子的极性1.下列各组分子中,按共价键极性由强到弱排序正确的是()A.HF H2O NH3CH4 B.CH4NH3H2O HFC.H2O HF CH4NH3 D.HF H2O CH4NH32.X、Y为两种不同元素,由它们组成的下列物质的分子中,肯定有极性的是()A.XY4B.XY3C.XY2D.XY3.下列各组物质中,都是由极性键构成的极性分子的一组是()A.CH4和Br2B.NH3和H2O C.H2S和CCl4D.CO2和HCl4.下列物质:①MgCl2、②H2S、③白磷、④BF3、⑤NH3、⑥四氯化碳,其中含极性键的非极性分子是() A.①②③④⑥B.①④⑤⑥C.③④⑥D.④⑥题组二极性分子、非极性分子的判断5.使用微波炉加热,具有使物质受热均匀、表里一致、速度快、热效率高等优点。
其工作原理是微波炉内的微波场以几亿的高频改变电场的方向,水分子因而能迅速摆动,产生热效应。
这是因为()A.水分子具有极性共价键B.水分子中有共用电子对C.水由氢、氧两元素组成D.水分子是极性分子6.下列叙述正确的是()A.NH3是极性分子,分子中氮原子是在3个氢原子所组成的三角形的中心B.CCl4是非极性分子,分子中碳原子处在4个氯原子所组成的正方形的中心C.H2O是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中央D.CO2是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的中央7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。
它的分子空间结构是三角锥形。
以下关于PH3的叙述正确的是()A.PH3分子中有未成键的孤电子对B.PH3是非极性分子C.PH3是一种强氧化剂D.PH3分子的P—H是非极性键8.下列说法正确的是()A.含有非极性键的分子一定是非极性分子B.非极性分子中一定含有非极性键C.由极性键形成的双原子分子一定是极性分子D.两个原子之间共用两个电子对,形成的化学键一定有极性题组三键的极性对化学性质的影响9.下列物质中,酸性最强的是()A.CH2ClCOOH B.CH2FCOOH C.CHF2COOH D.CHBr2COOH10.从深海鱼油中提取的被称作“脑黄金”的DHA(C21H31COOH)就是一种不饱和度很高的脂肪酸。
下列说法正确的是()CH3CH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH2COOHDHA的结构简式A.酸性:C21H31COOH<CH3COOHB.DHA中含有的元素中电负性最大的是碳元素C.DHA中碳原子存在三种杂化方式D.DHA中所有原子共面11.有一种AB2C2型分子,在该分子中A为中心原子。
下列关于该分子的空间结构和极性的说法正确的是() A.假设为平面四边形,则该分子一定为非极性分子B.假设为四面体形,则该分子一定为非极性分子C.假设为平面四边形,则该分子可能为非极性分子D.假设为四面体形,则该分子可能为非极性分子12.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。
下列说法正确的是()A.H2O2中存在非极性共价键,是非极性分子B.反应Ⅰ中涉及极性键的断裂和非极性键的形成C.H2O分子的VSEPR模型为V形D.H2O是非极性分子13.近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。
如图是以Cu作为催化剂时CO2转化为甲酸的反应过程,下列有关说法不正确的是()A.过程①说明在催化剂作用下,O—C—O之间形成了一种特殊的化学键B.过程②和③吸收了能量并形成了O—H和C—HC.CO2和HCOOH中均只含有极性共价键D.1 mol CO2完全转化为甲酸需得到2 mol e-14.硫-氮化合物是现代无机化学研究的热点之一。
如图是已经合成的某硫-氮化合物(S4N4)的分子结构。
下列有关该物质的说法正确的是()A.其分子中各原子最外层都达到了8电子稳定结构B.其分子中只含极性键C.其分子是非极性分子D.其与化合物S2N2互为同素异形体15.已知,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大。
请回答下列问题:(1)PtCl2(NH3)2的结构是____________(填“平面四边形”或“四面体形”)。
(2)淡黄色固体物质由________(填“极性分子”或“非极性分子”,下同)组成,黄绿色固体物质由________组成。
(3)请在以下横线上画出这两种固体分子的空间结构图:淡黄色固体:________,黄绿色固体:________。
16.CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。
试依据上述规律填空:(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在________(填“吸”或“推”)电子基团,这种基团是________。