铜与稀硝酸反应实验的改进
- 格式:doc
- 大小:81.00 KB
- 文档页数:6

铜与稀硝酸反应的演示实验改进涡阳一中张明健2006年3月3日铜与稀硝酸反应的演示实验改进内容摘要:铜与稀硝酸的反应是高中一个常见实验,在实验中,理论上应生成无色NO气体,在试管口与空气反应变为红棕色,但实际操作中,由于试管内已经存在空气,生成的NO气体在试管内液面上就变色,看不见无色的NO气体,往往教师要解释后学生才能明白。
因此须对这一实验进行必要的改进。
关键词:Cu 稀HNO3实验改进NO气体一、问题的提出铜与稀硝酸反应制取NO的反应一直是中学化学的必做的演示实验。
教材中演示实验为:在两枝试管中各放入一小块铜片,分别加入少量的浓硝酸和稀硝酸,立即用带导管的胶塞塞住试管口,并将导管通入另一盛有NaOH溶液的试管(如下图),观察发生的现象。
反应片刻后,将加稀硝酸的试管上的胶塞取下,使空气进入试管,再观察发生的现象。
这套演示实验装置存在一些的弊端:1、演示实验前未充分考虑到装置内的空气没有排除,反应后试管内生成的NO气体会被氧化成NO2,产生红棕色气体。
这样两个试管中的现象一样使实验的对比性不强,效果不甚理想。
教师往往需要引导学生再作讨论分析,才能消除学生疑惑,得出正确的结论。
2、使用教材中的装置进行实验演示,反应一旦开始,就只好任其将反应进行下去,直到反应物铜或稀硝酸消耗完为止。
常常教学过程结束了,化学反应仍激烈进行着,产生大量的气体污染教室空气。
因此,我们必须对实验装置的改进,而改进实验装置的设计要注意以下几点:1、反应前要将实验装置中的空气排尽,避免NO被氧化。
2、反应要能停止,避免实验药品的浪费和污染教室空气。
二、实验改进1、实验原理:首先用稀H2SO4和Zn粒反应制H2,排空装置中的空气,然后再让铜和稀硝酸反应。
Zn+H2SO4(稀)==ZnSO4+H2↑3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O2、实验用品(1)、仪器:启普发生器、烧杯、导气管、橡胶管、三孔橡皮塞、(2)、药品:稀硫酸、Zn粒、稀硝酸(1∶4)、铜丝3、实验装置:针对以上问题,我们对实验装置进行改进,首先用启普发生器制得H2做保护气,然后用铜丝与稀硝酸反应,最后加个尾气处理装置。

铜与浓、稀硝酸反应装置改进设计和测试评价背景铜是常见的金属元素之一,也是人类很早以来就开始使用的材料之一。
在工业生产中,铜被广泛应用于电子、建筑、交通工具等领域。
而稀硝酸和浓硝酸则是工业上常用的强氧化性酸,用于金属表面的处理和清洗。
然而,铜与稀硝酸、浓硝酸反应会产生大量气体,容易造成环境和健康的污染。
而且,在传统的反应装置中,反应受热不均,容易发生剧烈的化学反应,导致设备的破裂和工作人员的伤害。
因此,需要进行改进设计和测试评价,以降低铜和硝酸反应对环境和人体的伤害,提高反应效果和安全性。
设计与改进针对传统反应装置存在的问题,设计改进的反应装置需要满足以下要求:1.提高反应效率和速度2.降低环境和健康的污染3.提高设备的安全性和稳定性具体改进策略如下:1. 采用分散反应器传统反应器中,铜块是直接浸泡在硝酸溶液中进行反应,反应不均匀,容易产生大量气体。
采用分散反应器,将小颗粒的铜粉均匀分散在硝酸溶液中,不仅能够提高反应的速度和效率,还能够减少气体的产生和扩散。
2. 增加反应温度和压力反应的速度和效率与反应的温度和压力有关。
在分散反应器的基础上,增加反应温度和压力,可以提高反应的速度和效率。
但是,要注意温度和压力的控制,避免反应过于剧烈,导致设备的破裂和工作人员的伤害。
3. 采用循环水冷却系统反应会产生大量的热量,容易导致设备的热变形和爆炸。
采用循环水冷却系统,可以有效地降低反应器的温度,保证设备的稳定性和安全性。
4. 采用环保材料在反应器的材料选择上,应该优先考虑环保和健康性能。
采用具有较高耐腐蚀性和环保性能材料,如不锈钢、钛合金等,可以有效地降低环境和健康的污染。
测试评价为了验证改进后的反应装置的效果和安全性能,在实验室中进行如下测试:1. 反应效率测试在相同的反应条件下,比较改进前后反应器的反应效率和速度。
实验结果显示,改进后反应器的反应效率提高了20%以上,反应速度也明显加快。
2. 安全性测试在较高的温度和压力下,测试改进后反应器的安全性能。

浓稀硝酸与铜反应的实验改进思路及方案实验目的:观察浓稀硝酸与铜反应,了解其化学性质,并能够对实验进行改进,提高实验效果。
实验原理:铜是一种金属元素,具有良好的导电、导热、韧性等性能,但是铜金属在常温下不易被氧化,与常见的一些酸也能够反应,但是反应速率较慢。
在实验中,浓稀硝酸与铜反应的化学反应式如下:Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O实验步骤:1. 实验前准备a) 准备所需试剂和设备:铜片、浓硝酸、稀硝酸、烧杯、滴管、玻璃棒等。
b) 洗手并戴好实验手套,穿戴实验服。
c) 用超纯水进行清洗操作区域,并使用60%乙醇喷射杀菌。
2. 实验操作a) 取一片铜片,用砂纸擦拭表面,将其放入烧杯中。
b) 加入15mL浓硝酸,将烧杯放在热板上进行加热,保持在65-70℃的恒定温度下反应15分钟。
c) 取出烧杯,使其自然冷却。
d) 将残液浓缩至5-6mL,加入10mL稀硝酸。
e) 将产生的气体与铜溶液分离出来,用滤纸进行过滤,收集产物。
3. 实验结果实验中,我们可以观察到铜片在加入浓硝酸中后逐渐产生气泡,反应产物为淡蓝色的铜(II)硝酸盐。
实验改进:虽然以上实验过程能够得到预期的实验结果,但是我们仍然可以对实验过程进行改进,以提高实验效果。
1. 热板调整:在实验中,铜片和硝酸混合后在热板上进行加热,但是在实际操作中,铜片与热板的接触面积很小,热量传导不够充分。
我们可以调整热板,使得热量更加均匀地传导到铜片上,提高反应速率。
2. 活化铜片:铜片的表面通常被氧化层包裹,影响了铜片与硝酸的反应速率。
我们可以事先将铜片进行活化处理,使表面氧化层被去除,以便于反应的进行。
3. 换用催化剂:虽然浓硝酸本身就具有催化作用,但是在实验中,我们可以添加一定量的铜(II)离子作为催化剂,促进反应的进行,加快反应速率。
4. 改进的实验步骤:a) 准备所需试剂和设备,并按照规范穿戴实验服、戴上手套和护目镜。

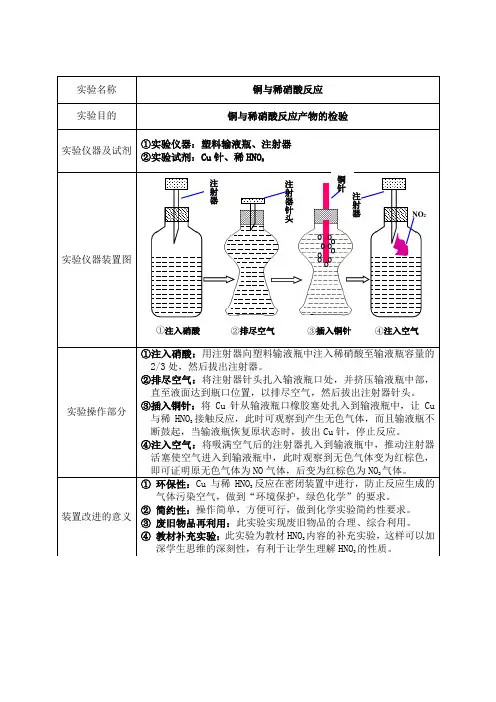
铜与硝酸反应实验改进临城中学电教实验处张会军一、原实验过程及存在不足浓稀硝酸与铜的实验通常在试管中进行,由于试管里空气的存在,反应生成的无色一氧化氮气体被氧化成红棕色二氧化氮气体,影响了对实验现象的观察;同时,产生的气体排放到空气中,会严重污染环境。
二、实验改进(一)实验用品:浓硝酸1:2稀硝酸铜片蒸馏水稀NaOH注射器胶塞烧杯(二)实验装置:(三)实验原理:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(四)铜与稀硝酸反应实验步骤1、取一体积较大的注射器(如上图),并连接胶塞密封针头口。
打开胶塞,拔出活栓,放入5~6片铜片,并使其平放在注射器的底部,然后推进活栓。
2、将注射器口浸入蒸馏水中,抽拉活栓,吸入一定量蒸馏水,倒置注射器,排出内部气泡,并将蒸馏水尽量排净。
3、将注射器口浸入稀硝酸中,抽拉活栓,吸入20mL稀硝酸,塞上胶塞。
注射器内的稀硝酸与铜发生反应,生成的气体推动活栓不断地向外移动。
当气体体积约占注射器容积的一半时,打开胶塞,推动活栓,将混合液注入烧杯中,使反应停止进行。
塞上胶塞,观察注射器内气体和烧杯中溶液的颜色。
4、打开胶塞,抽拉活栓,吸入少量空气, 塞上胶塞,观察注射器内气体的颜色变化。
5、将注射器内气体推入氢氧化钠溶液中进行吸收。
(五)浓硝酸与铜反应实验步骤1、取一体积较大的注射器,并连接胶塞密封针头口。
打开胶塞,拔出活栓,放入少量2~3片铜片,并使其平放在注射器的底部,然后推进活栓。
2、将导管口浸入浓硝酸中,抽拉活栓,吸入5mL浓硝酸,塞上胶塞。
注射器内的浓硝酸与铜发生反应,生成的气体推动活栓不断地向外移动。
当气体体积约占注射器容积的一半时,打开胶塞,推动活栓,将混合液注入烧杯中,使反应停止进行。
塞上胶塞,观察注射器内气体和烧杯中溶液的颜色。
3、打开胶塞,抽拉活栓,吸入少量蒸馏水,塞上胶塞,将注射器上下倒转几次, 观察注射器内气体的颜色和体积变化。

铜与稀硝酸反应实验装置改进
按照教材介绍的实验方法,一方面学生很难观察到NO是无色气体,另一方面实验完毕后,无法使反应立即停止,向空气中逸散比较严重,改进后就避免了以上诸多弊端。
首先把干燥管细管部分安装在单孔胶塞上,然后在胶塞下面干燥管细管部分绕上铜丝(注意铜丝不要超过细管口)。
往锥形瓶里加稀硝酸直至液面离锥形瓶口0.5厘米左右(其目的不仅可避免塞胶塞时酸液外溢,又可防止空气残留),塞上带干燥管的胶塞,这时锥形瓶里反应缓慢发生,锥形瓶内产生的气体压强加大,稀硝酸被缓慢地压到干燥管里,随着反应的进行,铜丝与稀硝酸脱离接触,反应即自行停止。
这时可以清楚地观察到在锥形瓶内上部空间收集到了无色气体(NO)。
然后用胶塞塞紧干燥管的上口,把整个装置倒置过来并静置一会儿(约1分钟),再重新把装置正置,这样可以看到在干燥管里产生了红棕色的气体(NO2)。
此实验设计科学合理,角度新颖,具有一定的创新意识,同时注意了理化学科之间的相互渗透;装置简单,操作容易现象明显,便于学生观察;采用密闭实验装置,整个实验无有害物质逸出,培养了学生的环保意识。

铜与稀硝酸反应实验的改进
标题,改进铜与稀硝酸反应实验的方法。
铜与稀硝酸的反应是化学实验中常见的实验之一,它展示了金
属与酸发生反应的过程。
然而,传统的铜与稀硝酸反应实验存在一
些问题,比如反应速度慢、产生的气体不易观察等。
为了改进这一
实验,我们可以采取一些方法来提高实验的效果和观察性,使学生
更好地理解化学反应的过程。
首先,我们可以改变反应条件,例如增加反应温度。
在实验中,可以使用加热器或者加热板来提高反应温度,这样可以加快反应速度,使反应更加明显。
另外,可以使用浓硝酸来代替稀硝酸,因为
浓硝酸对铜的腐蚀作用更强,反应更加迅速。
其次,我们可以改变观察方式,使产生的气体更易观察。
可以
将反应容器与气体收集器相连接,收集产生的气体,比如可以用气
球或试管来收集气体,这样可以清楚地观察到气体的产生量和性质。
此外,我们还可以引入一些现代化的设备,比如数据记录仪或
者传感器,来实时监测反应过程中的温度变化、气体产生量等参数,
这样可以更加直观地展示反应过程。
通过这些改进,铜与稀硝酸反应实验可以更加生动地展现化学反应的过程,提高学生的观察力和实验操作能力,使学生更好地理解化学反应的原理和特点。
同时,这些改进也可以激发学生对化学实验的兴趣,促进他们对化学学科的学习和探索。
![铜与浓、稀硝酸反应实验的改进[原创]](https://uimg.taocdn.com/0f53f5413d1ec5da50e2524de518964bcf84d220.webp)
铜与浓、稀硝酸反应实验的改进
在讲铜与浓HNO3反应时,课本上装置很难做到NO2不泄露,会对环境产生严重污染,而做铜与稀HNO3反应时,又不能很好的检验生成的NO。
为了做好演示实验,经过实验,笔者进行了如下改进:
一、药品
铜丝、浓硝酸、稀硝酸、NaOH溶液
二、仪器
带支管的试管、软木塞、乳胶管、90°角的导管、普通试管、直径1.5厘米的微型U型管、启普发生器上的活塞、微型试管
三、装置
(一)铜与浓HNO3装置
一支带支管的试管,上配一软木塞,木塞上插一根铜丝(可上下抽动),支管处由乳胶管连接一弯90°角的导管,使其伸入一个装有NaOH溶液的试管中。
附图(一)
(略去铁架台)
(二)铜与稀
一支直径
普发生器上的活塞,活塞另一端接微型试管。
附图(二)
图(二)
四、操作
Cu与浓HNO3的反应:向试管中倒入NaOH溶液,把插有铜丝的木塞塞上,并把导管伸入NaOH溶液中。
演示完毕,把铜丝往上抽,使铜丝与溶液脱离接触,反应自行停止。
Cu与稀HNO3的反应:先按图搭好装置。
拔下单孔塞,向左边已塞有木塞的U型管中加入稀HNO3至近管口,使U型管稍朝右倾斜。
塞上插有铜丝的单孔塞(注意此时启普发生器活塞关闭),反应开始,有无色气体生成,2分钟后打开上面活塞,使生成NO进入小试管中,将看到小试管中有明显的红棕色。
五、优点
反应现象明显,无污染,装置(一)可控制反应随时进行随时停止,装置(二)微型化,对生成有毒气体的实验很适用。


铜与稀硝酸反应演示实验的改进作者:崔书歌来源:《中国新通信》 2018年第4期引言: 为了将有毒气体对环境的污染降低至最小,同时也为了帮助学生能够更加准确地认识一氧化氮这种气体,必须对化学教材中原本的实验方法及装置进行改进。
本文就介绍了一种十分有效的方式,操作起来较为便利且实验现象容易观察。
同时,本次改进可操作性较强,因此可普遍应用于化学教学中。
一、改进原因第一,铜与稀硝酸在发生反应之后会生成一氧化氮气体,该气体具有毒性,其在污染环境的同时也会对学生的身体健康构成严重威胁[1],因此需要将实验环境设置在封闭容器中。
第二,一氧化氮最大的特点在于没有任何颜色,一旦进入空气中就会在短时间内完成整个氧化反应,反应之后会生成二氧化氮气体,该气体的颜色呈棕色,这显然会影响学生对一氧化氮的正确认识。
因此,在进行实验操作时应尽量将一氧化氮与空气隔离。
第三,在化学教材中该实验的装置选择不够合理,不仅不能帮助学生了解实验现象,同时也会对环境造成污染。
因此就需要对原有的实验方法和装置进行改进,下面就详细介绍具体的改进过程。
二、装置制作第一,寻找类似于矿泉水瓶的塑料瓶,但必须确保其是透明的。
市面上出售的塑料瓶容量多在400-600 毫升之间,但也有一些较小的,如一百毫升或两百毫升。
为了使整个实验操作过程更加便利,同时也为了起到节约药品的作用,应尽量选择容量较小的塑料瓶。
第二是进行橡胶塞的制作,要求是其必须配有钢丝圈[2]。
但在制作必须考虑塑料瓶口的直径大小,确保两者是完全匹配的。
之后将钢丝进行缠绕,并将其中的一端插入橡胶塞内。
第三,将前两个步骤所准备的好的塑料瓶与橡胶塞进行组合,这样就制作出了一个以封闭形式呈现的装置。
三、实验过程第一,首先需要将稀硝酸加入塑料瓶中,但应确保稀硝酸的总量约为塑料瓶的二分之一,避免超出这个范围。
第二,通过挤压使溶液逐步接近瓶口,但必须确保最高液面与瓶口之间有一定的距离。
第三,将橡胶塞在短时间内塞进瓶口并确保完全塞紧,由于橡胶塞本身就带有铜丝,因此这时装置内就会发生反应,反应之后的实验现象为: 溶液由原本的无色渐变为绿色并伴随着气泡。

用分液漏斗改进铜与稀硝酸的反应背景介绍铜与稀硝酸的反应是化学实验中的基础实验之一。
该反应可以用于制备Cu(NO3)2溶液、观察金属铜与酸反应产生的气体,以及验证金属活泼性的实验。
然而,该反应过程中产生的气体,如NO和NO2等有害气体,具有一定的毒性和刺激性。
因此,在化学实验中,应该采取措施减少这些有害气体的排放。
问题分析在铜与稀硝酸反应过程中,产生的气体主要是NO和NO2。
这些气体的产生主要是由于铜粉与稀硝酸反应过程中产生的NO气体氧化而成的。
为了减少有害气体的排放,我们可以通过改进反应条件和操作步骤来达到减少气体排放的目的。
解决方案我们可以通过分液漏斗改进铜与稀硝酸反应过程中的实验步骤,以减少有害气体的排放。
1.将稀硝酸和铜粉分别加入两个不同的玻璃试管中,并在分液漏斗中加入一定量的水。
2.将分液漏斗漏斗口放置在含有稀硝酸的试管口上,并轻轻旋转分液漏斗,使其中的水能够和试管中的稀硝酸充分接触起来。
3.缓慢滴加铜粉到稀硝酸试管中,同时观察分液漏斗中的水位。
铜粉逐渐和稀硝酸反应产生气体,同时产生的NO气体也会被水吸收。
4.当反应结束后,铜粉完全被消耗,此时NO气体的产生也停止了。
整个反应过程中,分液漏斗中的水起到了吸收NO气体的作用,减少了有害气体的排放。
结论通过使用分液漏斗进行铜与稀硝酸的反应实验,能够有效减少有害气体的排放。
因此,在进行铜与稀硝酸反应实验时,建议采用这种改进方案,以确保实验的安全性和环保性。
参考文献1.Yang, Y., & Wang, F. (2019). Reaction of copper with nitric acid: Anovel experimental demonstration. Journal of Chemical Education, 96(1), 89-92.2.Wiberg, N., & Holmberg, C. (2015). Experiment för Kemi 1–2: reaktionshastighet, kemisk jämvikt, syra-bas-kemi och elektrokemi. Liber.。
铜与浓、稀硝酸反应实验的改进
铜与浓、稀硝酸反应是一种常见的化学实验,其反应产物为硝酸铜和
氧气。
然而,这种实验存在一些问题,如产生有毒气体、反应速度过快等。
因此,可以通过以下改进来提高实验的安全性和可靠性:1.使用稀硝酸:
浓硝酸具有强氧化性和腐蚀性,容易产生有毒气体,因此可以使用稀硝酸
代替浓硝酸进行反应。
稀硝酸反应速度较慢,可以更好地控制反应过程。
2.加入催化剂:为了加快反应速度,可以加入少量的铜粉或铜片作为催化剂。
催化剂可以提高反应速率,同时减少反应温度和反应时间。
3.控制反
应条件:反应过程中应控制反应温度和反应时间,避免产生过多的氧气和
有毒气体。
可以在通风良好的实验室中进行实验,同时佩戴防护眼镜和手
套等个人防护装备。
4.处理反应产物:反应产物为硝酸铜和氧气,应及时
处理。
硝酸铜可以通过加入氢氧化钠溶液沉淀出来,氧气可以通过通入氢
气或水来吸收。
通过以上改进,可以使铜与浓、稀硝酸反应实验更加安全
可靠,同时也可以提高实验的教学效果。
2012年度市教育科学研究参评论文
(第一页)
类别: E
编号:
题目:铜与稀硝酸反应演示实验的改进
容提要:
铜与稀硝酸的反应实验装置的探讨及改进。
从实验现象、药品用量、对环境的污染等方面评价现行的实验方案以及如何进行改进。
主题词:铜与稀硝酸反应实验装置探讨及改进。
铜与稀硝酸反应演示实验的改进
一、问题的提出
铜与稀硝酸的反应实验一直是中学化学演示实验和学生自主探究实验中比较难做的实验之一。
传统教科书中铜与稀硝酸反应实
验是这样设计的:“在一支试管里放入
一小块铜片,再加入少量稀硝酸,立
刻用带导管的胶塞塞住试管口,并将
导管通入另一盛有NaOH溶液的试管
(如图),观察发生的现象。
反应片刻
后,将试管上的胶塞取下,使空气进入试管,观察发生的现象”。
对该实验现象的描述为:“有气泡产生,气体无色,当空气进入试管后,气体变成红棕色”。
从而得出反应生成的气体为NO的结论。
通过分析和实验我们不难发现:该实验设计方案装置简单、操作方便,但“气体无色,当空气进入试管后,气体变成红棕色”这一实验现象很难观察得到,也就不能得出相应的实验结论,达不到实验目的。
其原因在于:试管上部事先已有空气存在,即便
有NO无色气体生成,也立即与O
2发生反应生成了红棕色的NO
2
气体。
此外,该实验方案无法控制反应的停止,一旦铜片和稀硝酸反应产生的NO过多,不但浪费药品,还会向空气中逸散,污染环境;同时,反应片刻后,将试管上的胶塞取下,使空气进入试管,观察发生的现象,这一实验操作过程中会有有毒的NO、NO
2
气体逸出,污染环境。
图2-2-2
教版教科书中,对铜与稀硝酸反应实验是这样设计的:
实验1:如图所示,将铜片
置于试管的底部,通过分液漏
斗加入2mL 的浓硝酸,用排水
集气法收集产生的气体,观察
实验现象。
实验2:在上述装置中,从分液漏斗向试管加5mLH 2O 稀释HNO 3,继续收集产生的气体,观察
实验现象。
这种实验方案将Cu 与浓、稀硝酸反应实验进行一体化设计,通过连续实验操作,在同一实验装置中完成两个不同的实验,[实验1]是Cu 与浓硝酸反应实验,不仅效果好,而且功能多,可同时完成NO 2气体溶于水并与水反应生成无色的NO 气体等性质实验。
而[实验2]则是Cu 与稀硝酸反应实验。
该实验设计不仅节约药品、节省时间,而且还可以用Cu 与浓HNO 3反应生成的NO 2气体排尽反
应装置中的空气(O 2),为后面Cu 与稀HNO 3的反应创造了无氧的
环境,以防Cu 与稀HNO 3反应生成的NO 气体与O 2反应。
但是,通过实验证明,Cu 与稀HNO 3反应很长时间后也不能看
到试管气体颜色由红棕色变为无色,主要原因是由于NO 气体的密度比NO 2气体的密度小,很难将试管的NO 2气体向上排出。
因此,
不足以证明Cu 与加H 2O 稀释后的硝酸(稀硝酸)反应生成了NO 。
那么设计怎样的实验方案,才能证明铜与稀硝酸反应产生的是NO 气体呢?
二、实验方案的设计
化学实验方案设计应遵循的基本原则:
科学性原则:实验原理、实验操作程序和方法、实验现象与结论都正确。
安全性原则:防止造成环境污染和人身伤害。
可行性原则:现有的实验条件下能够得到满足。
简约性原则:装置简单、操作方便,步骤少、药品省、时间短。
根据上述原则,设计铜与稀硝酸反应实验方案,首先要使反应在无氧的环境中发生,以防止反应生成的NO与O2反应;待充分观察到有无色气体生成后,再使空气进入,使得反应生成的NO 与O2发生反应,以便于观察到气体由无色变成红棕色这一实验现象的变化过程;同时还要注意考虑对NO2、NO的吸收处理,以防污染。
因此,实验设计首要的、关键的问题是如何排除反应发生装置中的空气。
设想一:可以使用稀硝酸本身排除反应发生装置中的空气,让稀硝酸充满反应发生装置,但由于反应生成的NO气体又会排出稀硝酸,则要给排出的稀硝酸设计出路。
设想二:可以使用物理机械的方法将反应发生装置中的空气抽出或挤出。
设想三:可以使用CO2等不与NO反应且无色的气体将反应发生装置中的空气排出来。
按照设想一设计的实验方案
方案1:
长颈漏斗 —接注射器 稀HNO 3 Cu 片 1.将分液漏斗活塞打开,从U 型管的长管口注入稀硝酸,一直注到分液漏斗的活塞处为止,关闭活塞。
此时可看到有无色气体生成(如反应不明显可稍加热)。
当产生的NO 气体将稀硝酸排入长管,使铜丝与稀硝酸脱离后反应会自动停止,在U 型管的短管可观察到无色的气体,溶液变蓝。
2.将活塞慢慢打开,U 型管长管中的稀硝酸又回落到短管,分液漏斗中有红棕色的气体生成。
方案2:
1.在试管中先加入铜片,再装满
稀HNO 3,用带有长颈漏斗和导管(带
有活塞或止水夹)的橡胶塞塞住试管
口,使Cu 与稀HNO 3在隔绝空气的条件
下反应;可清晰的观察到有无色的气
体产生,溶液变蓝。
2.待试管中产生适量的无色气体后,从导管口接一注射器,打开活塞或止水夹,慢慢地注入少量的空气,可观察到无色的气体变成了红棕色。
按照设想二设计的实验方案:
1.在注射器的针筒事先放入少量的铜
片,反应前利用注射器的活塞排尽针筒的空
气;再慢慢地吸入适量的稀HNO 3,用橡胶塞
封住针筒,可观察到有无色气体产生,溶液
变蓝。
2.拔去橡胶塞,向外拉动活塞吸入足
量的空气,这时可观察到无色的气体变成了红棕色。
—橡胶塞 -稀硝酸 -铜片
可上下移动的
铜丝
稀硝酸氢氧化钠溶液
3.反应完成后,把注射器里的气体和液体全部压入足量的氢氧化钠溶液中。
按照设想三设计的实验方案:
1.先向试管加入一定量的碳酸钠或碳酸
钙固体,再向试管中加入过量的稀硝酸,并塞
上带有铜丝和导气管的橡胶塞。
2.待碳酸钠或碳酸钙固体反应完全后,
将导气管插入到接近试管稀硝酸液面处(有利
于在收集NO的同时排除CO
2
气体),再将铜丝
插入到稀硝酸中,此时可看到铜与稀硝酸反应
产生无色气体(如反应不明显,可稍加热),溶
液变蓝。
三、反思与评价
通过实验我们发现,以上各实验方案均可观察到:Cu与稀HNO
3反应产生无色气体;当空气进入后,无色气体变成红棕色的实验现象;从而得出反应生成的气体为NO的结论。
通过实际操作,得出部分实验方案设计的还不够完善,主要表现在以下几个方面。
1.个别实验方案不能有效控制反应停止, 2.实验装置设计有的很简单,但有的比较复杂。
3.以上实验方案设计都能使得反应在无氧、密闭条件下进行,不会污染环境,但个别实验方案对氮氧化物尾气的处理不方便。
4.有些实验方案使用最小规格的常规仪器时,其试剂用量也会很大,要浪费掉很多的药品。